
6 курс / Нефрология / Ацетатный_и_бикарбонатный_диализ_Лебедо
.pdf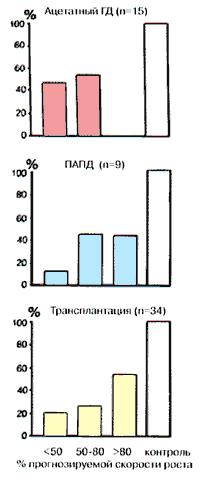
Рис. 81. Относительные скорости роста детей с ХПН, получающих различные виды диализного лечения. Данные из Fernell et al, 1984.
Fernell et al (1984) сравнивали скорость роста в трёх группах детей: получающих лечение гемодиализом, находящихся на постоянном амбулаторном перитонеальном диализе и перенесших трансплантацию почки (рис. 81). В группе детей, находящихся на гемодиализе, отмечалась наиболее низкая скорость роста и более высокая степень ацидоза и уремии, чем у детей из двух других групп. Скорость роста в группе детей, находящихся на постоянном амбулаторном перитонеальном диализе была сравнима со скоростью роста у детей, перенесших трансплантацию почки. Клиника почечной остеодистрофии в группе детей, получающих постоянный амбулаторный перитонеальный диализ, заметно улучшилась по сравнению с группой, в которой проводилось лечение гемодиализом (Rahman et al, 1987). Авторы объяснили это тем, что при лечении постоянным амбулаторным перитонеальным диализом у больных достигалась более адекватная коррекция кислотно-основного состояния и постоянно контролировалась концентрация фосфата и кальция в плазме.
Пока ещё трудно полностью оценить долговременные преимущества коррекции ацидоза, так как при анализе приходится учитывать различные факторы. Трудности обычно вызывает не выявление отклонений от нормы, а количественная оценка этих отклонений.
Резюме
Используемые сегодня методы лечения почечной недостаточности в различной степени позволяют обеспечить коррекцию кислотно-основного состояния больных. Бикарбонат является почти идеальным буфером при всех видах диализного лечения, так как с его помощью достигается наиболее физиологичная кислотно-основная коррекция и почти отсутствуют побочные эффекты. Необходимость в использовании на гемодиализе бикарбонатного буфера становится очевидной в случае, когда стандартное диализное лечение приобретает более эффективные формы: возрастают скорости потоков
71
диализирующего раствора и крови, увеличивается поверхность и проницаемость мембраны диализатора. Бикарбонат является наиболее предпочтительным буфером для гемодиафильтрации, где он может входить в состав как диализирующего, так и замещающего растворов. Для одной из форм гемодиафильтрации - биофильтрации - применяется безбуферный диализирующий раствор, а готовый раствор бикарбоната вводится непосредственно в кровь больного. Это облегчает дозирование буфера, поступающего в организм, и позволяет полностью исключить применение ацетата. У больных, получающих лечение гемофильтрацией, обычно удаётся достичь более высоких уровней бикарбоната плазмы, чем на гемодиализе, что не зависит от вида используемого буфера. Гемофильтрация, обеспечивая большую стабильность гемодинамики по сравнению с другими видами диализного лечения, уменьшает потребность в бикарбонатном буфере. Коррекция кислотно-основного состояния у больных, находящихся на постоянном амбулаторном перитонеальном диализе, осуществляется более легко, чем при других формах диализного лечения. Главным образом это обусловлено низкой скоростью транспорта растворенных веществ через биологическую мембрану организма. В настоящее время на перитонеальном диализе в качестве буфера широко используется лактат, который пришёл на смену ацетату. Клинические исследования по применению бикарбонатного буфера на перитонеальном диализе, вероятно, продемонстрируют более полную кислотно-основную коррекцию и уменьшение патологического воздействия лактатного буфера на ткани брюшины и на иммунную систему. Однако для широкого распространения бикарбонатных перитонеальных растворов необходимо решить все технические проблемы использования бикарбоната на перитонеальном диализе.
Средние уровни бикарбоната в плазме имеют большее значение для постоянных форм диализа, чем для интермиттирующих форм, поскольку в последнем случае амплитуда колебаний вокруг средней величины может быть значительной. Различия в кислотноосновной коррекции при различных методах лечения почечной недостаточности могут иметь долговременные последствия, полноценно оценить которые пока еще достаточно сложно.
72

10. Практическое руководство по применению бикарбоната
При использовании на гемодиализе бикарбонатного буфера особого внимания заслуживают два практических вопроса. Во-первых, для предупреждения преципитации карбоната кальция при смешивании бикарбонатного диализирующего раствора в аппарате "искусственная почка" необходимо соблюдать определённые химические условия. Вовторых, чтобы избежать бактериального роста, необходимо поддерживать на высоком уровне микробиологическое качество диализирующего раствора и проводящих магистралей.
Профилактика преципитации карбоната кальция
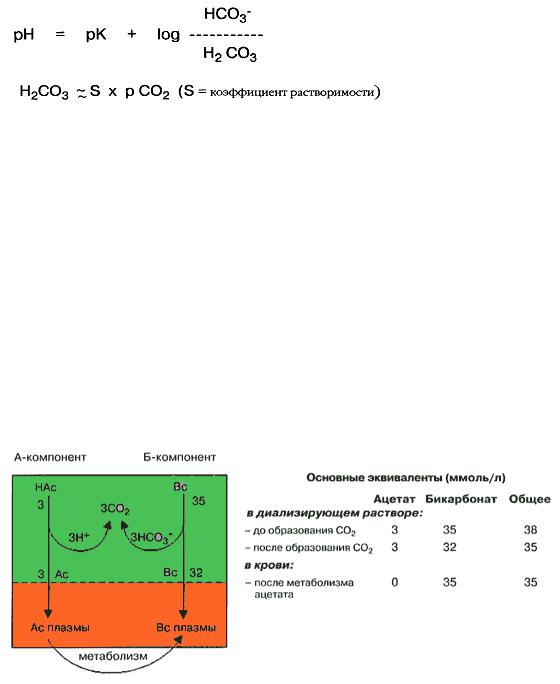
В стандартном бикарбонатном диализирующем растворе допускается содержание бикарбонатных ионов в диапазоне 30-40 ммоль/л и ионов кальция до 2 ммоль/л. Для уменьшения риска выпадения в осадок карбоната кальция, рН этого раствора не должна превышать 7.3. Как показано на буферной диаграмме (рис. 82), с увеличением рН растёт концентрация ионов карбоната, а растворимость образующегося в результате реакции карбоната кальция падает. Аналогичные процессы происходят и в концентрированных растворах.
Коэффициент растворимости: Ks = (Ca2+)(CO32-) = 4,8 x 10-9 (моль/л)2
Рис. 82. Диаграмма, показывающая влияние рН на компоненты бикарбонатной буферной системы (концентрация бикарбоната 35 ммоль/л, водный раствор, 37°С).
Следовательно, в концентратах для бикарбонатного гемодиализа ионы кальция должны отделяться от ионов карбоната до момента смешивания, при котором будет достигнута безопасная рН. На практике все электролиты, входящие в состав диализирующего раствора, за исключением бикарбоната, обычно включают в один концентрат (А - компонент), а бикарбонат - в другой (В - компонент). В А- концентрат добавляется кислота, которая при смешивании его с В-концентратом и с водой позволяет установить необходимую рН диализирующего раствора. Оба концентрата под контролем проводимости или фиксированных объёмов двумя отдельными насосами в два этапа в определённой пропорции смешиваются с водой ( рис. 83 ).
73
Рис 83. Двухэтапное пропорциональное смешивание бикарбонатного диализирующего раствора.
Традиционно в А-концентрате для бикарбонатного гемодиализа используется уксусная кислота. Она полностью диссоциирует при рН 7.0. Ионы водорода из А-концентрата реагируют с ионами бикарбоната из В- концентрата и образуют угольную кислоту, которая затем легко распадается на углекислый газ и воду (глава 3).
H+ + HCO3-  H2CO3
H2CO3  CO2 + H2O
CO2 + H2O
Во время гемодиализа ионы ацетата проникают в кровь и метаболизируются в организме. Поводом для дискуссий сегодня является вопрос о том, может ли ацетат оказывать патологическое влияние на больного в такой низкой концентрации, как 2-4 ммоль/л (Veech, 1988). Уровень ацетата в плазме во время бикарбонатного гемодиализа обычно не превышает 0,5-1 ммоль/л, что намного меньше, чем во время ацетатного гемодиализа, но всё ещё выше, чем в норме. Использование других органических кислот, таких как молочная или лимонная, вероятно, будет давать сходные эффекты. Применение неорганической кислоты, такой например, как соляная, может привести к экстремально низким величинам рН в А-концентрате, создавая трудности при его изготовлении, хранении и использовании.
Чтобы регулировать конечную рН диализирующего раствора и таким образом избегать осаждения карбоната кальция, используются различные количества уксусной кислоты, добавляемой в А-концентрат. В настоящее время на бикарбонатном гемодиализе рекомендуется использовать А-концентрат с таким количеством уксусной кислоты, чтобы её концентрация в конечном диализирующем растворе составляла 3-4 ммоль/л. Меньшее количество кислоты приближает концентрацию карбоната кальция к точке осаждения, и даже небольшое дополнительное увеличение рН может вызывать преципитацию карбоната кальция. Преципитация также может провоцироваться применением старого В- концентрата или чрезмерной потерей из него углекислого газа.
При применении центральных распределительных систем диализирующего раствора ситуация осложняется. Готовый бикарбонатный диализирующий раствор должен транспортироваться на достаточно большие расстояния между центральным распределительным пунктом, на котором происходит его приготовление, и диализными местами. Для предупреждения преципитации карбоната кальция в таких условиях может потребоваться более высокая концентрация кислоты в диализирующем растворе, чем было рекомендовано выше. В Японии, где распространены центральные распределительные системы для бикарбонатного гемодиализа, в диализирующий раствор добавляют только 2 ммоль/л уксусной кислоты, дополнительно включая в него 2-6 ммоль/л ацетата натрия. Таким образом, буферное содержание бикарбонатного диализирующего раствора, используемого в Японии, отличается относительно высокой концентрацией ионов ацетата (4-8 ммоль/л) в сочетании с достаточно низким уровнем бикарбоната (27.5 - 30 ммоль/л). Этого оказалось вполне достаточно для буферного замещения и одновременного поддержания в растворе необходимого равновесия ионов кальция и карбоната. При таких концентрациях между ионами ацетата и кальция может образовываться комплекс, который будет способствовать стабильности раствора. Недостатком включения большего количества кислоты и ацетата в А-концентрат является более высокий уровень ацетата на процедуре и более низкая рН, ведущие к повышению рСО2 диализирующего раствора.
В соответствии с американским стандартом (AAMI) для диализирующего раствора с ацетатом рекомендуется поддерживать рН в диапазоне 6.0 - 8.0. Для бикарбонатного диализирующего раствора рекомендуют поддерживать рН около 7.1 - 7.3, что позволяет избежать преципитации карбоната кальция. Необходимо учитывать, что в зависимости от содержания кислоты, концентрации бикарбоната, а также времени хранения бикарбонатного концентрата, величина рН в диализирующем растворе может отличаться от указанной.
74
Контроль концентраций
Концентрации различных компонентов бикарбонатной буферной системы в растворе при различных величинах рН проиллюстрированы на буферной диаграмме, приведенной выше (рис. 82). Её также можно выразить математическим уравнением HendersonHasselbalch, которое обычно используется при всех физиологических расчётах кислотноосновного равновесия.
Для облегчения клинических расчётов очень полезна номограмма Siggaard-Andersen. Поскольку эта номограмма была составлена, исходя из констант равновесия и растворимости для бикарбонатной системы в крови, её не следует применять непосредственно для диализирующего раствора. Более правильное определение концентрации бикарбоната и диализирующем растворе достигается прямым титрованием с использованием цветного стандарта или рН - метра. Также может использоваться техника стандартного равновесия или газового анализа, если константы для крови заменить константами для водного раствора (Engelhardt et al, 1988). В то время как рК1 для бикарбонатной системы крови составляет 6.1, в диализирую-щем растворе он равен 6.0 (35 ммоль/л, 37°С). Коэффициент растворимости для СО2 (S) составляет 0,030 ммоль/л, мм рт. ст. для крови, а в диализирующем растворе - только 0,025.
Концентрация бикарбоната, которая обычно указывается производителем концентратов на этикетке канистры, является его конечной концентрацией в диализирующем растворе, приготовленном при определенной комбинации концентратов А и В. Это значит, что при расчёте учитывается реакция нейтрализации между ионами водорода из А-компонента и соответствующим количеством бикарбонатных ионов из В - компонента концентрата (рис. 84).
Рис. 84. Общее содержание оснований в бикарбонатном диализирующем растворе.
Оценивая буферное содержание бикарбонатного диа-лизирующего раствора, следует также учитывать присутствующие в нём ионы ацетата, поскольку при их метаболизме в организме образуется бикарбонат (рис. 84). Таким образом, общее содержание оснований в бикарбонатном диализирующем растворе в основном складывается из бикарбоната и некоторого количества ацетата. В публикациях клинических исследований по бикарбонатному гемодиализу часто указывают только концентрацию бикарбоната в диализирующем растворе, обозначенную производителем концентрата, и, следовательно, недооценивают общее содержание оснований.
75

Концентрация двуокиси углерода в диализирующем растворе
Бикарбонатный диализирующий раствор всегда содержит некоторое количество двуокиси углерода, образовавшейся из угольной кислоты. Стандартный диализирующий раствор с концентрацией бикарбоната 35 ммоль/л и рН 7.2 имеет рСО2 близкое к 90 мм рт. ст. Это более чем в два раза выше физиологического уровня рСО2 в крови, и некоторые врачи по этому поводу могут высказывать свои опасения. Тем не менее, более низкие величины рСО2 в диализирующем растворе могут достигаться только при более высоких величинах рН, при которых теряется химическая стабильность раствора. В диализирующем растворе с содержанием бикарбоната 35 ммоль/л можно поддерживать рСО2 на уровне 40 мм рт. ст. только при величине рН выше 7.5. При этих условиях значительно возрастает риск выпадения в осадок значительного количества карбоната кальция.
Рис. 85. Уровни рСO2 в диализирующем растворе и в артериальной крови во время бикарбонатного гемодиализа. Данные из De Broe et al, 1990, персональное сообщение.
Гемодиализ с диализирующим раствором, содержащим двуокись углерода при более высоком, чем в крови парциальном давлении, ведёт к транспорту углекислого газа в кровь. Избыток СО2 немедленно удаляется лёгкими, и в крови поддерживается стабильное рСО2 (рис. 85). Отмечено, что при высоком рСО2 крови у больных происходит только увеличение вентиляции лёгких, и каких-либо осложнений не наблюдается. De Broe et al (1990) сравнили респираторный ответ больных во время бикарбонатного и ацетатного гемодиализов. Они обнаружили, что излишки углекислого газа во время бикарбонатного гемодиализа увеличивали респирацию на 8,5 %, тогда как уровни рСО2 и рO2 в артериальной крови продолжали оставаться стабильными. В этом исследовании рСО2 в диализирующем растворе составило 70-80 мм рт. ст. Во время ацетатного гемодиализа вентиляция уменьшилась на 10 %. Для предупреждения утечки углекислого газа во время хранения готовых бикарбонатных концентратов система должна быть закрытой. Однако имеются наблюдения, показывающие, что небольшие молекулы газа могут проникать даже через стенки пластиковых контейнеров. Потеря углекислого газа из бикарбонатного концентрата увеличивает его рН, и в растворе образуются ионы карбоната. Поэтому использование для приготовления бикарбонатного диализирующего раствора старых В- концентратов потребует дополнительного количества кислоты с целью снижения рН до безопасного диапазона. Оптимальным является применение свежеприготовленных бикарбонатных растворов. Установлено, что при хранении меняется химический состав и ухудшается микробиологическое качество бикарбонатного концентрата.
Профилактика бактериального роста
Ацетатный концентрат, как и кислотный А-компонент бикарбонатного концентрата, содержащие уксусную кислоту, имеют высокое содержание солей (больше 3.5 моль/л), которое препятствует бактериальному росту. Кроме того, А-компонент бикарбонатного концентрата имеет низкую рН (меньше 3.5). Эти растворы можно отнести к бактериостатическим.
Концентрированный раствор бикарбоната натрия (В-компонент для бикарбонатного гемодиализа) имеет рН около 8.0 и содержание солей только 1.2 моль/л. И то и другое не препятствует росту определенных видов бактерий, главным образом, грамм-
76
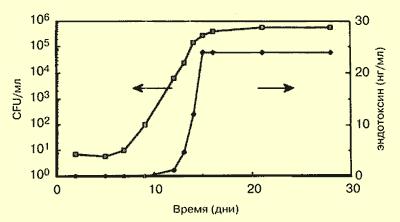
отрицательной флоры. Содержание солей в В-концентрате можно повысить, добавив некоторое количество хлорида натрия из А-компонента. Это будет предупреждать рост некоторых видов бактерий. В то же время существуют галотолерантные и даже галофильные виды бактерий, рост которых в присутствии хлорида натрия возрастает. Оптимальная температура для жизнедеятельности этих видов бактерий, передающихся через воду, приближается к комнатной или бывает чуть ниже, поэтому обычные условия хранения концентрата могут способствовать пролиферации этих видов микроорганизмов. Как только бактерии адаптируются к окружающим условиям (фаза запаздывания), их рост становится экспоненциальным и время воспроизведения нового поколения бактерий может составлять 2-3 часа (рис. 86). Культивируя эти бактерии в стандартных лабораторных условиях, можно недооценить их присутствие в количестве 100-1000 CFU/мл (Hording et al, 1989), поэтому питательные среды для них должны быть необогащённого типа или содержать небольшое количество соли (Bland et al, 1987), а их инкубацию следует проводить как при температуре 22° С, так и при 57° С (Bommer and Ritz, 1987).
Рис. 86. Концентрации бактерий и эндотоксина в бикарбонатном концентрате во время хранения.
Из Еbben et al, 1987.
Чтобы избежать высокого бактериального загрязнения бикарбонатного концентрата, необходимо тщательно контролировать условия приготовления и хранения В-компонента. В литературе встречаются сообщения о выявлении бикарбонатных концентратов с высоким уровнем живых бактерий (10000-100000 CFU/мл) и эндотоксина (10-200 нг/мл), приготовленных как в заводских условиях, так и в различных отделениях гемодиализа
(Bland et al, 1987; Elben et al, 1987; Mion et al, 1987). Большинство производителей сегодня вырабатывают стерильный В-концентрат, но содержание в нем эндотоксина не всегда контролируется. Кроме того, необходимо также предупреждать загрязнение концентрата после его изготовления. Если канистра с бикарбонатным концентратом была вскрыта, её следует использовать в этот же день, а остатки бикарбонатного концентрата не следует сохранять на последующие дни.
Микробиологических и химических проблем, связанных с хранением жидкого бикарбонатного концентрата, можно избежать, если В-компонент производится и хранится в виде сухого порошка бикарбоната натрия. В свою очередь это может добавить ряд практических проблем, вызванных появлением дополнительных организационных затрат на растворение порошка. Кроме того, концентрат из порошка следует готовить в строго асептических условиях, используя стерильную воду и избегая дополнительного загрязнения концентрата.
Лучшей альтернативой жидкого бикарбонатного концентрата является картридж с бикарбонатным порошком (BiCart), который имеет как микробиологические, так и практические преимущества (Delin et al, 1988). На производстве бикарбонатный порошок упаковывают в картридж, где он может храниться сухим без бактериального роста или
77
химического распада в течение многих лет. Перед началом диализа этот картридж устанавливается на аппарат "искусственная почка", где в ходе процедуры порошок бикарбоната автоматически растворяется подогретой стерильной водой, а получившийся при этом концентрированный раствор в установленной пропорции разводится в аппарате "искусственная почка". Таким образом, конечный диализирующий раствор готовится непосредственно перед его использованием. Это однолинейное приготовление диализирующего раствора из сухого бикарбонатного порошка представляет сегодня поистине настоящее искусство в бикарбонатном гемодиализе.
Другие источники загрязнения диализирующего раствора
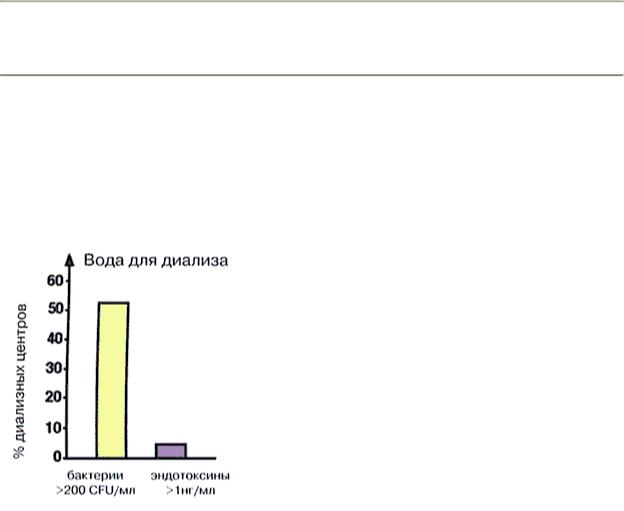
Один литр диализирующего раствора готовится приблизительно из 30 мл кислотного А - концентрата, 30 мл бикарбонатного В - концентрата и 940 мл воды. Отсюда становится понятным, что микробиологическое качество воды, используемой для гемодиализа, оказывает важное влияние на конечное качество диализирующего раствора. Вода для гемодиализа, согласно американскому стандарту (AAMI), должна содержать не более 200 CFU/мл микробных тел. В недавнем обзоре было показано, что 53% проверенных диализных центров в США используют воду с более высоким бактериальным содержанием, чем рекомендует AAMI-стандарт (Hording et al, 1990). Уровни эндотоксина в воде превосходили рекомендации AAMI (1 нг/мл*) в 4% гемодиализных центров (рис. 87). Обнаруженные в воде бактерии были представлены различными видами, но наиболее часто встречались условно патогенные Pseudomonas и Aeromonas. Это означает, что в обычных условиях эти виды бактерий безвредны и становятся патогенными только при определённых условиях (Klein et al, 1990).
* В настоящее время уровни эндотоксина предпочитают давать в единицах эндотоксина (EU), а не в весовых единицах. 1 EU = 100 pg of EC-5, эндomoкcuнoвый стандарт, признаваемый USP (примечание автора).
Бактериальное качество водопроводной воды не всегда удовлетворяет имеющимся стандартам, но оказалось, что нередко загрязнению воды способствует само оборудование для очистки воды (угольные фильтры, ионообменные смолы и мембраны обратного осмоса) и распределительная система диализирующего раствора (Bommer and Ritz, 1987; Klein et al, 1990). Непродуманно сконструированные системы распределения и резервуары для хранения концентратов также могут являться источником контаминации диализирующих растворов. Чтобы обеспечить высокое качество воды, необходимое для гемодиализа, требуется специальная конструкция систем очистки воды и регулярное поддержание их стерильности (Mion et al, 1990).
Рис 87. Бактериальное качество воды, используемой для гемодиализа по данным 51 центра США. Данные из Hording et al, 1990.
78

AAMI стандарт для диализирующего раствора допускает максимальное содержание микробных тел равное 2000 CFU/мл. Этот стандарт допускает попадание незначительного количества бактерий из диализного концентрата и путей, по которым проходит жидкость в аппарате "искусственная почка". Было выявлено, что количество бактерий в диализирующем растворе в 35% исследованных гемодиализных центров в США превышает указанный стандарт, а уровни эндотоксина выше рекомендуемой величины в 12 % центров (рис. 88) (Hording et al, 1990). Полученные результаты показывают, что высокие концентрации бактерий и эндотоксина отмечались чаще в тех диализных центрах, где использовался бикарбонат.
Рис 88. Бактериальное качество диализирующего раствора по данным 51 центра США.
Данные из Hording et al, 1990.
Загрязнение бикарбонатного диализирующего раствора не всегда связано только с применяемым концентратом. Поскольку диализирующий раствор может поддерживать рост микробов, "застойные" участки путей, по которым циркулируют растворы в аппаратах "искусственная почка", являются превосходными нишами для бактериального роста. При проектировании новых аппаратов "искусственная почка" следует избегать "мёртвых зон", сложных клапанных систем и других областей возможного застоя жидкости. Операции промывки и дезинфекции аппаратов "искусственная почка" должны стать частью необходимого ежедневного обслуживания.
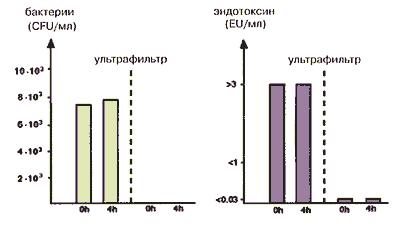
Из-за часто возникающих микробиологических проблем обычно не рекомендуют применять центральные распределительные системы диализных растворов. Тем не менее, имеются сообщения о положительном опыте эксплуатации таких систем (Elben et al, 1987). В этом исследовании для снижения бактериального загрязнения использовали ультрафиолетовое облучение воды, произведенной на установке обратного осмоса, и готового бикарбонатного концентрата. Однако авторы обнаружили, что такой метод не уменьшает содержание пирогенов в растворе, а скорее увеличивает его. Более того, появились данные, что ультрафиолетовое облучение часто не может в достаточной степени снизить бактериальное загрязнение раствора. Так Klein et al (1990) отметили, что многие диализные отделения с высокими уровнями бактериального загрязнения воды в процессе её очистки использовали ультрафиолетовую дезинфекцию. Единственный путь, обеспечивающий низкие уровни как бактерий, так и эндотоксина в конечном диализирующем растворе - использование ультрафильтра непосредственно перед диализатором (рис. 89) (Mion et al, 1987; Bambauer et al, 1989).
Клинические последствия
Клинические проблемы, появляющиеся при использовании загрязнённого диализирующего раствора, хорошо известны с ранних этапов диализа. Они достаточно многообразны: от фебрильных реакций до септицемии. Более широкое использование бикарбонатного гемодиализа в сочетании с высокопоточными мембранами сфокусировало внимание на проблемах чистоты диализирующего раствора. В последние годы почти на
79
каждом съезде специалистов по диализу появляются всё новые сообщения о пирогенных реакциях, наблюдаемых на гемодиализе.
Рис 89. Количество бактерий и эндотоксина в диализирующем растворе до и после его прохождения через полиамидный ультрафильтр. Данные из Bambauer et al, 1989.
Возможность транспорта эндотоксина путём конвекции или диффузии через неповреждённую диализную мембрану, как высокопоточную, так и низкопоточную, до сих пор вызывает много споров. Можно допустить, что бактериальные фрагменты с молекулярным весом в 2000 дальтон могут проникать через высокопроницаемую мембрану диализатора с отверстиями 30000 дальтон, особенно, когда этому помогает поток жидкости из диализирующего раствора в кровь при обратной фильтрации. С другой стороны, некоторые из этих мембран являются прекрасными ультрафильтрами для эндотоксинов (Dinarello et al, 1987).
О прямом транспорте эндотоксина через диализные мембраны имеется большое количество не подтверждённых практикой сообщений. И хотя прямо не доказана возможность поступления эндотоксина из диализирующего раствора в кровь, появляется всё больше исследований, показывающих влияние эндотоксина на компоненты крови, как в условиях in vitro, так и in vivo.
Lonneman et al (1988) использовали экспериментальную модель in vitro, пропуская через диализатор с низкопоточной целлюлозной мембраной диализирующий раствор, в который добавляли эндотоксин Е.Соli в концентрации 500 нг/мл, а вместо крови использовали различные питательные среды. Пробы, взятые из контура крови, анализировали на интерлейкин-1 - индуцирующую активность на моноцитах человеческой крови. При наличии в контуре крови 10 % человеческой плазмы уже через 15 минут после добавления эндотоксина в диализат, было отмечено образование значительного количества интерлейкина-1 (рис. 90). Использование среды с тканевой культурой, не содержащей белка, не выявило образования интерлейкина-1, а при применении сывороточного альбумина образование интерлейкина-1 наблюдалось только после пяти часов эксперимента. Полученные результаты, указывающие на потребность в плазме для транспорта эндотоксина в системе in vitro, смогли объяснить отрицательные результаты некоторых других исследователей (Bommer et al, 1987).
80
