
2 курс / Микробиология 1 кафедра / Доп. материалы / Молекулярный_и_генетический_анализ_некоторых_семейств_гликозил_гидролаз
.pdfНа правах рукописи
НАУМОВ ДАНИИЛ ГЕННАДИЕВИЧ
МОЛЕКУЛЯРНЫЙ И ГЕНЕТИЧЕСКИЙ АНАЛИЗ НЕКОТОРЫХ СЕМЕЙСТВ ГЛИКОЗИЛ-ГИДРОЛАЗ МИКРООРГАНИЗМОВ
Специальность 03.00.03 – молекулярная биология
АВТОРЕФЕРАТ диссертации на соискание учёной степени
кандидата биологических наук
МОСКВА – 2001
Работа выполнена в лабораториях генетики бактерий, генетики молочнокислых бактерий и генетики, таксономии и экологии дрожжей Государственного научно-исследовательского института генетики и селекции промышленных микроорганизмов (ГУП ГосНИИгенетика)
Научный руководитель: кандидат биологических наук В.А. Лившиц Научный консультант: доктор биологических наук, профессор Г.И. Наумов
Официальные оппоненты:
доктор биологических наук, профессор М.Д. Тер-Аванесян кандидат биологических наук А.Б. Шевелёв
Ведущая организация: Институт молекулярной генетики РАН
Защита диссертации состоится « 29 » мая 2001 года в 14 часов на заседании Диссертационного совета Д 217.013.01 при Государственном научно-исследовательском институте генетики и селекции промышленных микроорганизмов по адресу: 113545, Москва, 1ый Дорожный проезд, д.1.
С диссертацией можно ознакомится в библиотеке ГосНИИгенетика
Автореферат разослан « 27 » апреля 2001 года
Учёный секретарь |
|
Диссертационного совета |
|
кандидат биологических наук |
В.И. Щербакова |
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Трисахарид раффиноза и его компоненты: дисахариды сахароза и мелибиоза синтезируются многими высшими растениями. Для полного гидролиза раффинозы необходимо наличие двух гликозил-гидролазных активностей: β-фруктозидазной и α-галактозидазной.
Молочнокислые бактерии родов Lactobacillus и Pediococcus имеют важное промышленное значение, играя основную роль в ферментации молочнокислых и мясных продуктов и растительных материалов. Для бактерий рода Lactobacillus характерна способность сбраживать сахарозу. Однако молекулярные детерминанты этого признака остаются совершенно не изученным. Штаммы бактерий рода Pediococcus, как правило, не способны сбраживать сахарозу. Лишь редкие природные изоляты имеют плазмиды, детерминирующие ферментацию сахарозы, мелибиозы и раффинозы. "Излечивание" штаммов Pediococcus, используемых в ферментации мясных продуктов, от сахарозной плазмиды являлось предметом патентования, поскольку обеспечивает лучшие вкусовые качества пищевых продуктов.
Дрожжи-сахаромицеты являются важными промышленными микроорганизмами. Способность сбраживать мелибиозу не характерна для дрожжей Saccharomyces cerevisiae. Известны лишь редкие Mel+-штаммы этого вида. Они обычно выделяются из специфических экологических ниш – желудочно-кишечного тракта млекопитающих и отходов производства оливкового масла. Там часто обнаруживают изоляты, в которых накапливаются полимерные α-галактозидазные гены MEL ферментации мелибиозы. За исключением MEL1, остальные гены ферментации мелибиозы остаются мало изученными. Однако они представляют интерес не только для молекулярно-генетических исследований, но и для селекционной работы с пекарскими и спиртовыми штаммами Saccharomyces.
Фермент α-галактозидаза позволяет дрожжам наиболее полно усваивать дешёвый источник углерода – мелассу, содержащую α-галактозид раффинозу. В последние годы возрос также интерес к продуцентам α-галактозидаз в связи с использованием
этого фермента для обработки пищевых продуктов растительного происхождения.
Таким путём разрушают не утилизируемые α-галактозиды (раффинозу, стахиозу и др.), способствующие жизнедеятельности вредных микроорганизмов в кишечнике человека и животных. Исследование новых генов α-галактозидаз обеспечивает расширение возможностей для селекционной работы с дрожжами Saccharomyces.
Хорошо известно о наличии гомологии аминокислотных последовательностей многих гликозил-гидролаз, имеющих разные энзиматические активности. Однако
β-фруктозидазы принято относить к двум различным семействам гликозил-гидролаз (GH32 и GH68) вследствие отсутствия у них сходства аминокислотных последовательностей. Получение данных о структурном сходстве между
β-фруктозидазами, относящихся к разным семействам, а так же об их гомологии с другими гликозидазами позволит экстраполировать имеющиеся данные о пространственной структуре отдельных гликозидаз и о каталитически важных аминокислотных остатках на большее число ферментов.
С целью дальнейшего исследования генов и ферментов микроорганизмов, ответственных за гидролиз раффинозы, сахарозы и мелибиозы в представляемой диссертационной работе были поставлены следующие экспериментальные задачи:
1.Исследовать молекулярную структуру локуса утилизации сахарозы типового штамма Lactobacillus plantarum и сравнить её с ранее известной структурой того же локуса у Pediococcus pentosaceus.
2.Определить положение на генетической карте дрожжей Saccharomyces cerevisiae новых полимерных генов MEL ферментации мелибиозы.
3.Исследовать структурное сходство аминокислотных последовательностей
β-фруктозидаз, принадлежащих семействам GH32 и GH68. Провести скрининг полной базы данных аминокислотных последовательностей для выявления возможных гомологов β-фруктозидаз.
Научная новизна. Впервые определена молекулярная структура локуса утилизации сахарозы у молочнокислых бактерий рода Lactobacillus. Этот хромосомный локус состоит, по крайней мере, из четырёх генов и имеет очень высокую степень сходства с гомологичным плазмидным локусом Pediococcus
pentosaceus. Осуществлено генетическое картирование девяти ранее известных генов MEL2-MEL10 и впервые обнаружено и картировано три гена MEL12-MEL14,
представляющих новое дивергентное семейство α-галактозидазных генов дрожжей Saccharomyces cerevisiae. Проведено сравнительное исследование аминокислотных последовательностей ряда семейств гликозил-гидролаз. Полученные результаты позволили объединить четыре семейства гликозидаз в суперсемейство на основании наличия у их представителей α- или β-фуранозидазных активностей и статистически достоверного сходства наиболее консервативных участков аминокислотных последовательностей. К этому суперсемейству также отнесено новое семейство гипотетических белков, представленных, главным образом, у термофильных бактерий и, вероятно, обладающих гликозидазными активностями.
Апробация работы. Результаты исследований докладывались: на IV (1996) и V (1997) научных конференциях «ГосНИИгенетика» (Москва); на конференции, посвящённой 30-летию журнала «Молекулярная биология» (1997, Москва); на совместном семинаре «ГосНИИгенетика» и исследовательских лабораторий «Cultor Technology Center» (1998, Хельсинки, Финляндия); на II съезде Вавиловского общества генетиков и селекционеров (2000, Санкт-Петербург); на IV международном симпозиуме по фруктанам (2000, Аролла, Швейцария) и на конференции «Биосфера и человечество» (2000, Обнинск).
Публикации. По теме диссертации опубликовано 9 статей и 7 тезисов. Структура и объём диссертации. Диссертация состоит из введения, обзора
литературы, материалов и методов, результатов и обсуждения, выводов и списка цитируемой литературы (364 литературных источника). Диссертация изложена на 163 страницах машинописного текста, содержит 22 рисунка и 13 таблиц.
Обзор литературы содержит три главы, посвящённые принципам классификации гликозил-гидролаз, системам утилизации сахарозы грамположительных бактерий и генам ферментации мелибиозы дрожжей. Раздел «Материалы и методы» посвящён описанию разнообразных методов молекулярной биологии, генетики и микробиологии, используемых в работе.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Клонирование и секвенирование фрагмента гена scrB из Lactobacillus plantarum
На основе консервативных участков генов сахараз 5 видов молочнокислых бактерий сконструированы вырожденные праймеры DG-1 и DG-2. Амплифицированный с помощью этих праймеров в процессе ПЦР фрагмент генома типового штамма L. plantarum NRRL B-4496 клонирован в векторе pUC19. Секвенированная по двум цепям вставка имела длину 693 п.н. и на 98.6% идентична
5′-концевой части гена scrB плазмиды pSRQ1 из штамма Pediococcus pentosaceus
NRRL B-11465 (GenBank access. num. L32093). Эти две нуклеотидные последовательности отличаются 10 заменами (четыре замены на уровне аминокислотной последовательности), а также вставкой и делецией одного нуклеотида. Структура участка, соответствующего вставке и делеции, у
L. plantarum: 517-CCAAATCTGGTCTGGATCGATCAACAGCCCGTCTTATTGTTCTGTCCCCAA-567. У
P. pentosaceus вместо трёх аденозинов – четыре, а вместо четырёх цитидинов – три (подчёркнуты). Это приводит к локальному сдвигу открытой рамки считывания на участке, соответствующем 15 аминокислотным остаткам. Секвенированная последовательность L. plantarum идентична на 50-52% генам сахараз Lactococcus lactis, Streptococcus mutans, Streptococcus sobrinus и Staphylococcus xylosus, на
48-50% – генам сахараз бактерий родов Vibrio и Bacillus.
Секвенирование фрагмента генома L. plantarum позволило определить аминокислотную последовательность соответствующего белка из 231 аминокислотного остатка на 92.2% идентичного N-концевой части сахаразы ScrB из P. pentosaceus. Сходство этих двух последовательностей достигает 98.3%, если исправить локальный сдвиг рамки считывания, обнаруженный в гене scrB P. pentosaceus, и позволяет рассматривать эту гипотетическую аминокислотную последовательность как фрагмент сахаразы L. plantarum. Она гомологична сахаразам и других грамположительных бактерий: 41-48% идентичных аминокислотных остатков с белками представителей родов Lactococcus,
фруктаназа FruA Streptococcus mutans леваназа Bacillus sp. |
|||||
ОРС YveB Bacillus subtilis |
леваназа Paenibacillus polymyxa |
||||
фруктозилтрансфераза Arthrobacter nicotinovorans |
|
|
леваназа Bacillus subtilis |
||
сахараза Aspergillus niger |
|
|
|
экзо-инулиназа Pseudomonas mucidolens |
|
фруктозилтрансфераза Aspergillus niger |
c |
|
|
леваназа Bacteroides fragilis |
|
|
|
|
|
сахараза Tritrichomonas foetus |
|
ОРС FruB Streptococcus mutans |
|
|
сахараза Schizosaccharomyces pombe |
||
|
|
|
сахараза Saccharomyces cerevisiae |
||
|
|
|
|
|
сахараза Debaryomyces occidentalis |
эндо-инулиназа Pseudomonas mucidolens |
|
|
|
инулиназа Aspergillus ficuum |
|
|
|
|
инулиназа Penicillium purporogenum |
||
фруктозилтрансфераза Bacillus circulans |
|
|
|
||
|
|
|
фруктозилтрансфераза Aspergillus foetidus |
||
инулиназа Arthrobacter sp. |
|
|
|
|
|
|
|
|
|
леваназа Actinomyces naeslundii |
|
|
|
|
|
|
|
фруктозилтрансфераза Cynara scolymus |
|
d |
b |
a |
|
фруктозилтрансфераза Cichorium intybus |
|
|
инулиназа/сахараза Thermotoga maritima |
||
сахараза Tulipa gesneriana |
|
|
|
|
|
сахараза Vigna radiata |
|
|
|
|
сахараза Vibrio cholerae |
фруктозилтрансфераза Hordeum vulgare |
|
|
|
|
|
фруктозилтрансфераза Allium cepa |
|
|
|
|
сахараза Clostridium beijerinckii |
сахараза Triticum aestivum |
|
|
|
|
|
|
|
|
|
сахараза Lactobacillus plantarum |
|
сахараза Daucus carota |
|
|
|
||
|
|
|
сахараза Lactococcus lactis |
||
|
|
|
|
|
|
ОРС3 Leishmania major |
|
|
|
сахараза Streptococcus sobrinus |
|
|
|
|
сахараза Streptococcus mutans |
||
ОРС2 Leishmania major |
|
|
сахараза Staphylococcus xylosus |
||
ОРС1 Leishmania major |
|
|
сахараза Vibrio alginolyticus |
||
|
|
сахараза Clostridium acetobutylicum |
|||
сахараза RafD Escherichia coli |
|
|
сахараза Bacillus stearothermophilus |
||
сахараза CscA Escherichia coli |
|
|
сахараза Bacillus subtilis |
||
0.1 |
сахараза Zymomonas mobilis |
|
|
сахараза Klebsiella pneumoniae |
|
|
|
|
|
сахараза Salmonella typhimurium |
|
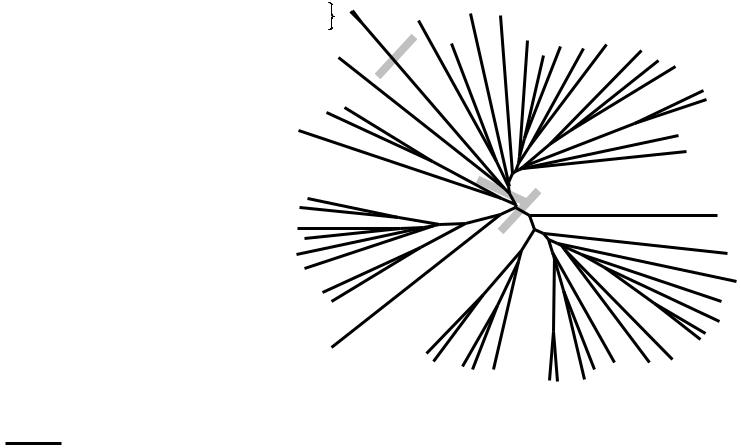
Рисунок 1. Филогенетическое древо β-фруктозидаз семейства GH32, построенное на основе анализа N-концевых фрагментов последовательностей, гомологичных вычисленной последовательности сахаразы L. plantarum. Буквами («a», «b», «c» и «d») отмечены кластеры ветвей древа, соответствующие последовательностям β-фруктозидаз подсемейств 32a-d.
Streptococcus и Staphylococcus; 36-38% – Clostridium; 35-36% – Bacillus. Более низкое сходство выявлено с сахаразами грамотрицательных бактерий и эукариот (Рис. 1).
Рестриктазное картирование локуса утилизации сахарозы L. plantarum
Праймеры DG-3 и DG-4, гомологичные участкам секвенированного ПЦРпродукта, использовали для амплификации фланкирующих его областей ДНК в процессе обращённой ПЦР. Такая ПЦР с расходящимися праймерами на кольцевых лигированных фрагментах хромосомной ДНК L. plantarum приводила к синтезу продуктов при использовании рестриктаз AluI (0.3 т.п.н.), BsuRI (0.3), MlsI (1.0),
Tru1I (0.4), Ecl136II/EheI (1.3) и HincII/SspI (1.5). Полученные результаты позволили построить рестриктазную карту фрагмента генома L. plantarum длиной около 2.3 т.п.н. Она совпадает с расположением сайтов рестрикции в соответствующем участке плазмиды pSRQ1 P. pentosaceus, содержащем гены scrA и scrB.
Хромосомную ДНК L. plantarum, гидролизованную рестриктазами, гибридизировали с клонированным ПЦР-продуктом. Зонд гибридизуется с
Ecl136II-фрагментом длиной 4.1 т.п.н., Ecl136II/DraI – 3.0, DraI – 5.1, Eco32I – 7, Eco32I/BamHI – 7, Eco32I/HindIII – 7, EcoRI – 5, HincII – 2.0, SalI – 7.5, SalI/XbaI –
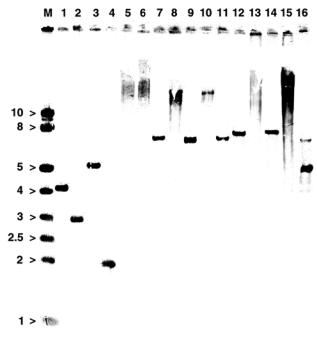
Рисунок 2. Саузерн-гибридизация клонированного ПЦР-продукта, соответствующего 5'-концевой части гена scrB из L. plantarum, с
разделёнными электрофорезом образцами геномной ДНК этого организма, рестрицированными эндонуклеазами: 1 – Ecl136II, 2 – DraI
и Ecl136II, 3 – DraI, 4 – HincII, 5 –
PaeI, 6 – BamHI, 7 – Eco32I, 8 –
HindIII, 9 – BamHI и Eco32I, 10 –
BamHI и HindIII, 11 – Eco32I и
HindIII, 12 – SalI, 13 – XbaI, 14 – SalI и
XbaI, 15 – PstI и 16 – EcoRI. M – маркер SmartLadder (Eurogentec, Belgium) молекулярных весов фрагментов ДНК (в т.п.н.).
7.5, (Рис. 2); BglI – 2.2, Cfr9I – 4.6, EheI – 3.0, Kpn2I – 4.7 и 6.8, NheI – 3.2, PstI/Eco32I – 4.1, PstI/HindIII – 4.4 и PvuII – 2.8 (данные не приведены), а также с BamHI-, BamHI/HindIII-, HindIII-, PstI- и XbaI-фрагментами размером более 10 т.п.н. (Рис. 2). Полученные данные позволяют построить рестриктазную карту участка генома L. plantarum длиной около 10 т.п.н. (Рис. 3). Этот участок состоит из двух частей: 3′-концевой (на Рис. 3 справа), гомологичной фрагменту плазмиды pSRQ1, содержащему гены сахарозо-специфичного EII ФТС scrA, сахаразы scrB,
α-глюкозидазы agl и регуляторного белка scrR; и 5′-концевой (около 4 т.п.н.), рестриктазная карта которой не совпадает с рестриктазной картой фрагмента pSRQ1, содержащего ген α-галактозидазы agaS. На этом основании можно предположить, что гомолог гена agaS у L. plantarum отсутствует.
Полученные результаты указывают на то, что в геноме типового штамма L. plantarum имеется локус утилизации сахарозы, содержащий гены scrA, scrB, scrR и agl. Возможно, что этот локус также включает в себя, подобно плазмиде pSRQ1, и ген фруктокиназы scrK. Следует обратить внимание на то, что предполагаемая организация центральной части локуса утилизации сахарозы L. plantarum, состоящей из двух расходящихся оперонов, scrAK и scrBR, полностью повторяет структуру этого локуса Lactococcus lactis. Сходная структура локуса утилизации сахарозы обнаружена и у стрептококков: четыре гена утилизации сахарозы S. mutans расположены аналогичным образом, однако гены scrB и scrR не образуют общего оперона; у S. sobrinus секвенирован только фрагмент сахарозного локуса, содержащий противоположно направленные гены scrA и scrB. Обнаруженный только у Pediococcus и Lactobacillus периферийный ген agl (Рис. 3) не является необходимым для утилизации сахарозы, так как он функционально дублирует ген scrB. Появление в сахарозном локусе плазмиды pSRQ1 P. pentosaceus дополнительного гена agaS можно объяснить присутствием в ней также локуса утилизации раффинозы и мелибиозы, который состоит из генов пермеазы раффинозы rafP, α-галактозидазы agaR и регуляторного белка rafR. Можно предположить, что второй ген α-галактозидазы, agaS, был компонентом этого же локуса, а затем переместился и встроился в локус утилизации сахарозы между

Рисунок 3. Структура локуса утилизации сахарозы Pediococcus pentosaceus и Lactobacillus plantarum. В верхней части рисунка представлена ранее известная генная структура локуса P. pentosaceus. Чёрные стрелки соответствуют генам гликозил-гидролаз (agaS – ген α-галактозидазы, scrB - β-фруктозидазы, agl – α-глюкозидазы); заштрихованные стрелки – генам гипотетических белков, гомологичных транспозазам IS30 и IS3 E. coli; серые стрелки – другим генам (scrK – ген фруктокиназы, scrA – сахарозо-специфичного фермента II фосфотрансферазной системы, scrR - регуляторного белка). Стрелки показывают направление транскрипции генов. В нижней части рисунка представлена комбинированная рестриктазная карта локусов P. pentosaceus и L. plantarum. Вертикальными штрихами отмечены сайты рестрикции P. pentosaceus, обнаруженные в ходе настоящей работы также у L. plantarum. Подчёркнуты названия сайтов (PstI и SalI), которые не были картированы у L. plantarum, но расположение которых у P. pentosaceus было учтено при построении карты L. plantarum. Над картой стрелками вниз указаны сайты P. pentosaceus, отсутствующие у L. plantarum; а под картой жирными стрелками вверх – примерное расположение сайтов рестрикции, обнаруженных у L. plantarum, но отсутствующих у P. pentosaceus. Треугольниками и цифрами над картой отмечены участки последовательности, гомологичные праймерам DG-1, DG-3, DG-4 и DG-2 соответственно. Условные обозначения сайтов узнавания рестриктаз: B – Bsh1236I, C – BclI, D – DdeI, P – Bsp143I, R – RsaI и S – BseNI. Справа указан масштаб для двух фрагментов рестриктазной карты.
