
6 курс / Медицинская реабилитация, ЛФК, Спортивная медицина / МЕХАНИЗМЫ_ВЛИЯНИЯ_ИНДУЦИРУЕМОЙ_АЦЕТИЛХОЛИНЭСТЕРАЗОЙ_ОЛИГОМЕРИЗАЦИИ
.pdf
71
Рисунок 12 – изменение уровня растворимого Aβ пептида в энторинальной коре головного мозга трансгенных APP/PS1(Tg+) мышей.
Показано среднее количество Aβ1-40 и Aβ1-42 в энторинальной коре головного мозга трансгенных APP/PS1 (Tg+) мышей, мышей контрольной группы и группы,
получавшей соединение 35 (5 мг/кг) оцененное с помощью ИФА. Данные
представлены как средние значения ± SEM.*-различие с контролем статистически
достоверно при p≤0,05. Статистический анализ проведен с помощью теста Манна-
Уитни.
t.me/medicina_free
72
3.11 Сравнительная оценка влияния соединения 35 и донепезила гидрохлорида на уровень иммуноэкспрессии синаптофизина
Количественное исследование иммуногистохимически выявленного синаптофизина на срезах энторинальной коры головного мозга трансгенных
APP/PS1 (Tg+) мышей показало, что у животных, получавших донепезила гидрохлорид, средняя интенсивность иммуноэкспрессии синаптофизина была достоверно ниже, чем у мышей дикого типа и составила 84,06±4,37% (p<0,01).
При этом на срезах коры головного мозга трансгенных животных, получавших соединение 35, не показано значимых отличий от уровня здоровых животных
(интенсивность иммуноэкспрессии синаптофизина в этой группе составила
94,77±3,81% от контроля) (Рисунки13,14).
Таким образом, можно предположить, что терапия ингибитором АХЭ,
снижающим олигомеризацию β-амилоида, намного более выраженно уменьшает токсическое действие амилоида на синаптические контакты у мышей с генетической моделью БА чем традиционный ингибитор АХЭ. Кроме того, важно отметить, что увеличение средней концентрации растворимого Aβ1-40, которое сопровождает снижение количества амилоидных бляшек при применении соединения 35, вероятно, не оказывает дополнительного токсического эффекта в отношении синапсов. Основываясь на результатах данных экспериментов можно предположить, что ингибиторы АХЭ, снижающие индуцируемую АХЭ олигомеризацию β-амилоида, будут способны оказывать более выраженный модифицирующий патогенез БА эффект чем традиционные ингибиторы АХЭ.
t.me/medicina_free

73
А |
Б |
В |
Г |
Рисунок 13 – иммуноэкспрессия синаптофизина в коре головного мозга трансгенных APP/PS1 (Tg+).
Представлено двойное окрашивание флуоресцентным красителем Тиофлавин S (слева) и антителами к белку пресинаптической плотности синаптофизину (справа) энторинальной коры головного мозга мышей дикого типа
(Tg-) (А), контрольных трансгенных APP/PS1 (Tg+) (Б), трансгенных мышей после введения соединения 35 (5 мг/кг) (В), трансгенных мышей после введения донепезила гидрохлорида (0,75 мг/кг) (Г) (Увеличение x10).
t.me/medicina_free
74
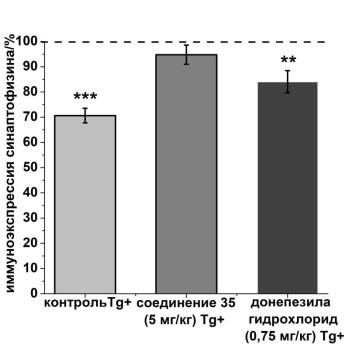
Рисунок 14 – интенсивность иммуноэкспрессии синаптофизина в энторинальной коре головного мозга трансгенных APP/PS1 (Tg+).
Показана средняя интенсивность иммуноэкспресии синаптофизина в энторинальной коре головного мозга мышей контрольной группы и групп,
получавших соединение 35 (5 мг/кг) и донепезила гидрохлорид (0,75 мг/кг).
Пунктирная линия показывает среднее значение иммуноэкспресии синаптофизина в энторинальной коре головного мозга контрольной группы мышей дикого типа
(Tg-). Данные представлены как средние значения ± SEM. ***- различие с контрольной группой мышей дикого типа статистически достоверно при p≤0,001,
**- при p≤0,01. Статистический анализ проведен с помощью теста Манна-Уитни.
3.12 Определение концентрации блокатора индуцируемой АХЭ олигомеризации
β-амилоида в ткани головного мозга
Таким образом, можно полагать, что соединение 35 восстанавливает способность к обучению в Т-лабиринте не только за счет продления времени жизни АХ (стандартная симптоматическая терапия БА), но, возможно, за счет снижения количества β-амилоидных бляшек обладает и модифицирующим патогенез БА компонентом действия. Для оценки наличия «модифицирующего
t.me/medicina_free
75
заболевание эффекта» лекарственных препаратов в клинических испытаниях стандартно применяются специальные схемы, основанные на оценке уровня патологических изменений через некоторое время после отмены приема препарата и полного вывода его из организма пациента. Данный подход позволяет отделить эффект симптоматической терапии (наблюдаемый только в присутствии препарата) от эффектов патогенетической терапии. При наличии у препарата только симптоматического эффекта, различия по сравнению с группой пациентов,
получавщих плацебо, быстро исчезают после отмены приема препарата. Однако,
если препарат оказывает влияние на патогенез заболевания, то различия с группой
«Плацебо» сохраняются и после отмены приема препарата (Yang et. al, 2011).
С целью «вычленения» возможного модифицирующего БА компонента действия, нами были проведены эксперименты «с отменой» введения препаратов
(Рисунок 3Б): соединение 35, донепезила гидрохлорид и физиологический раствор вводили внутрибрюшинно трансгенным APP/PS1 (Tg+) мышам в течение 18 дней,
а поведенческий тест начинали после отмены введения препаратов и физиологического раствора.
Для того, чтобы определить какой временной период необходим для того,
чтобы соединение 35 было выведено из головного мозга на момент начала поведенческого теста, предварительно были проведены эксперименты по определению концентрации соединения 35 в головном мозге методом высокоэффективной жидкостной хроматографии с применением масс-
спектрометрического дететектирования.
Было обнаружено, что при однократном введении соединения 35 в дозе 5
мг/кг его концентрация в мозге достигает максимума через 15 минут после введения, через 4 часа после однократного введения соединение в головном мозге уже не детектировалось (Рисунки 15,16).
В следующей серии экспериментов присутствие соединения 35 в головном мозге было проанализировано через 18 дней ежедневного введения соединения 35
в дозе 5 мг/кг, что соответствует используемому в данной работе протоколу введения препарата во время экспериментов, в которых было показано снижения
t.me/medicina_free
76
количества β-амилоидных бляшек. Исследование концентрации соединения 35 в
головном мозге через одни и трое суток после 18 дней введения в дозе 5 мг/кг и последующей после этого отмены введения соединения показало, что уже через сутки после прекращения ежедневного введения, соединение 35 в головном мозге обнаружено не было.
Таким образом, задержка начала обучения мышей в 3 суток после отмены терапии достаточна, чтобы утверждать, что на момент начала поведенческого теста соединение 35 уже не присутствует в головном мозге мышей в физиологически активных концентрациях.
t.me/medicina_free

77
А
Б
Рисунок 15. – репрезентативная ВЭЖХ МС хроматограмма.
Представлены репрезентативные хроматограммы соединения 35
экстрагированного из головного мозга мышей через 15 минут после однократного внутрибрюшинного введения в дозе 5 мг/кг (А) и через 1 день после отмены введения соединения 35 в течение 18 дней (Б).
t.me/medicina_free

78
Рисунок 16. – средняя концентрация соединения 35 в гомогенате головного мозга.
Покзана средняя концентрация соединения 35 в 1 мл гомогената головного мозга мышей через разные промежутки времени после однократного внутрибрюшинного введения и после отмены введения в течение 18 дней в дозе 5
мг/кг. Данные представлены как средние значения ± SEM.
t.me/medicina_free
79
3.13 Исследование параметров памяти и количества β-амилоидных депозитов после отмены терапии соединением 35 и донепезила гидрохлорнидом
Поведенческие тесты, проведенные после отмены введения препаратов,
показали, что мыши дикого (Tg-) типа в контрольной группе выбирали правильное направление в Т-лабиринте в 70,04±2,3% случаев, а для APP/PS1
(Tg+) мышей этот показатель составил 55,35±1,91% (p<0,001; Рисунок 17). В
контрольной группе мышей дикого типа (Tg-) критерия обученности достигли
75% мышей, при этом в контрольной группе трансгенных животных никто из мышей не обучился (p<0,001). После отмены терапии соединением 35 и
донепезила гидрохлоридом процент обученных мышей составил 44% и 13%, а
правильное направление выбирали 65,65±2,63% и 58,24±2,65% животных (p<0,01)
соответственно. При этом показатели мышей после отмены терапии соединением
35 значимо не отличались от показателей животных в норме, но достоверно отличались от показателей группы мышей после отмены терапии донепезила гидрохлоридом (p<0,01; Рисунок 17).
Таким образом, поскольку после отмены терапии препаратами в группе
APP/PS1 мышей, получавших соединение 35 (5 мг/кг) наблюдалось значимое улучшение параметров пространственной памяти, как в сравнении с контрольной группой мышей дикого типа, так и в сравнении с группой трансгенных APP/PS1
мышей, получавшей донепезила гидрохлорид (0,75 мг/кг), можно сделать вывод,
что соединение 35 способно восстанавливать способность к обучению в Т-
лабиринте не только за счет временного увеличения уровня АХ в головном мозге животных с моделируемой БА, но также, вероятно, оказывает влияние и на патогенез заболевания.
t.me/medicina_free

80
А
Б
Рисунок 17 – влияние соединений на показатели простаранственной памяти трансгенными APP/PS1 (Tg+) в Т-образном лабиринте после отмены терапии соединением 35 и донепезила гидрохлоридом.
Показаны процент выбора правильного направления трансгенными
APP/PS1 (Tg+) мышами (А) и количество трансгенных мышей, достигших критерия обученности (Б) в Т-лабиринте в контрольной группе трансгенных мышей, в контрольной группе мышей дикого типа (Tg-) и группах трансгенных мышей, получавших донепезила гидрохлорид (0,75 мг/кг) и соединение 35 (5
мг/кг) после отмены терапии. Данные представлены как средние значения ± SEM.
***-различие с контрольной группой мышей дикого типа статистически достоверно при p≤0,001, **- при p≤0,01; ##-различие c группой трансгенных мышей, получавших донепезила гидрохлорид статистически достоверно при p≤0,01, #-при p≤0,05. Статистический анализ проведен с помощью теста Манна-
Уитни (А) и точного теста Фишера (Б).
t.me/medicina_free
