
6 курс / Медицинская реабилитация, ЛФК, Спортивная медицина / МЕХАНИЗМЫ_ВЛИЯНИЯ_ИНДУЦИРУЕМОЙ_АЦЕТИЛХОЛИНЭСТЕРАЗОЙ_ОЛИГОМЕРИЗАЦИИ
.pdf51
3.2 Исследование антихолинэстеразной активности ряда производных 6-
метилурацила
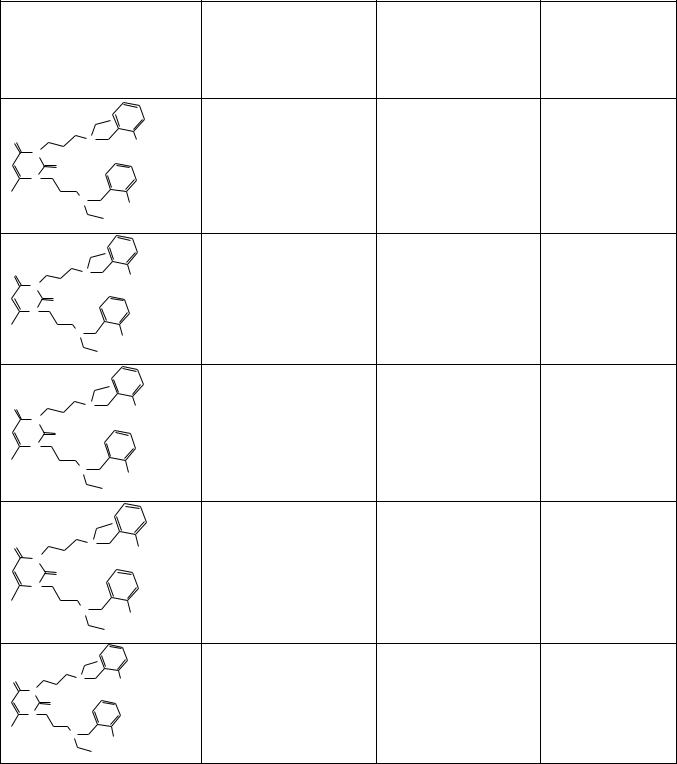
Структуры исследуемых ингибиторов холинэстераз на основе 1,3-
замещенного 6-метилурацила и вещества-сравнения донепезила гидрохлорида представлены в таблице 3. В тройках соединений 72, 35, 59 и 69, 60, 61 число метиленовых групп в алкильных цепочках меняется от 4 до 6 при сохранении одного и того же заместителя при бензольных кольцах бензильных фрагментов: в
соединениях 72, 35, 59 – о-нитро-радикала, в соединениях 69, 60, 61 – о-
трифтометильного радикала. Соединения 73, 70 c тетра- и пентаметиленовыми цепочками, соответственно, несут о-нитро и о-фторзаместители на фенильных кольцах, а соединения 75, 71 c пентаметиленовыми цепочками – о-трифтор-p-
трифторметил, о-трифторметил-о-фтор и пентафторбензильные фрагменты.
Синтезированные соединения проверяли на способность ингибировать активность рекомбинантной человеческой АХЭ и БуХЭ сыворотки крови человека in vitro. Данные о среднеингибирующих концентрациях (IC50) для АХЭ и БуХЭ, а так же индекс селективности ((IC50 БуХЭ)/(IC50 АХЭ)) для АХЭ по отношению к БуХЭ так же представлены в таблице 1.
Из данных таблицы 3 следует, что число метиленовых групп в алкильных цепочках и природа заместителей бензильных фрагментов, сильно влияют на ингибирующую активность в отношении АХЭ и БуХЭ.
Увеличение числа метиленовых групп в алкильных цепочках до пяти в соединениях 35 и 60 заметно увеличили силу ингибирования АХЭ – соединения ингибируют АХЭ в наномолярной концентрации, на порядок большей, чем традиционный для лечения БА донепезила гидрохлорид. При этом заместитель о-
трифторметил на бензильных фрагментах обеспечивал селективность ингибитора к АХЭ по сравнению с БуХЭ в отличие от о-нитро заместителя. Так,
селективность соединений 35 и 60 составляют 10000 и 35714 соответственно.
Тенденция увеличения сродства с АХЭ при удлинении цепочек наблюдается и у соединений 70 и 73 c двумя заместимтелями нитро- и фтором в орто положении
t.me/medicina_free
52
фенильных колец. Однако введение дополнительных фторгрупп снизило ингибиторную активность по сравнению с соединениями 35 и 72 с о-
нитрогруппой на фенильных кольцах. Последующее увеличение полиметиленовой цепи до шести метиленовых групп в соединениях 59 и 61
уменьшило ингибиторную активность соединений по отношению к АХЭ.
Соединения 72, 69 с тетраметиленовыми цепочками с о-нитро- и о-
трифторметильными заместителями при бензольных кольцах показывают большую селективность к АХЭ в сравнении с донепезила гидрохлоридом.
Введение при бензольных кольцах дополнительных атомов фтора ослабляет сродство к АХЭ. Также уменьшает сродство и селективность к АХЭ введение дополнительных заместителей с атомами фтора в бензильные фрагменты, в
частности две трифторметильные группы (соединение 75), пяти атомов фтора
(соединение 71) при бензольных кольцах в сравнении с соединениями 69, 60 с
одной о-трифторметильной группой при бензольном кольце.
Таким образом, оптимальными для селективного ингибирования АХЭ оказались производные 6-метилурацила, несущие при атомах азота 6-
метилурацилового кольца 5-(о-нитро- и о- трифтор метилбензилэтиламино)пентаметиленовые цепочки – соединения 35 и 60,
ингибирующие АХЭ в наномолярном диапазоне с крайне высокой селективностью в отношении АХЭ по сравнению с БуХЭ.
t.me/medicina_free
53
Таблица 1. Ингибирование активности рекомбинантной человеческой ацетилхолинэстеразы и бутирилхолинэстеразы плазмы крови человека производными 6-метилурацила in vitro в сравнении с донепезилом
гидрохлоридом.
|
Соединение |
АХЭ эритроцитов |
БуХЭ сыворотки |
Селективность |
||||
|
|
|
|
|
|
человека, |
крови человека, |
к АХЭ |
|
|
|
|
|
|
IC50 [M] |
IC50 [M] |
|
O |
( ) |
|
N |
NO2 |
|
|
|
|
N |
3 |
|
|
|
|
|||
|
|
|
|
3,5±0,5 10-9 |
3,5±0,5 10-5 |
|
||
|
|
|
|
|
10000 |
|||
|
O |
|
|
|
||||
N |
|
|
|
|
|
|
|
|
35 |
( |
)3 |
N |
|
|
|
|
|
|
|
|
|
NO2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
( )4 |
N |
NO2 |
|
|
|
||
N |
|
8,3±0,1 10-8 |
9,0±0,3 10-5 |
|
||||
|
|
|
|
|
1084 |
|||
|
O |
|
|
|
|
|||
N |
|
|
|
|
|
|
|
|
59 |
( )4 |
|
N |
|
|
|
|
|
|
|
|
|
NO2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
( ) |
|
N |
CF3 |
|
|
|
|
N |
3 |
|
|
|
|
|||
|
|
|
|
5,6±0,7 10-9 |
2,0±0,02 10-4 |
|
||
|
|
|
|
|
35714 |
|||
|
O |
|
|
|
||||
N |
|
|
|
|
|
|
|
|
60 |
( |
)3 |
|
N |
|
|
|
|
|
|
|
|
CF3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
( )4 |
N |
CF3 |
|
|
|
||
N |
|
1,4±0,09 10-9 |
2,0±0,02 10-4 |
|
||||
|
|
|
|
|
142 |
|||
|
O |
|
|
|
||||
N |
|
|
|
|
|
|
|
|
61 |
( |
)4 |
N |
|
|
|
|
|
|
|
|
|
CF3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
( )2 |
|
N |
CF3 |
|
|
|
|
N |
|
|
6,7±0,8 10-8 |
2,0±0,13 10-5 |
|
|||
|
|
|
|
|
299 |
|||
|
O |
|
|
|
|
|||
N |
|
|
|
|
|
|
|
|
69 ( )2 |
|
N |
|
|
|
|
||
|
|
|
CF3 |
|
|
|
||
|
|
|
|
|
|
|
|
|
t.me/medicina_free

54
|
Соединение |
АХЭ эритроцитов |
БуХЭ сыворотки |
Селективность |
||||||||
|
|
|
|
|
|
|
|
человека, |
|
крови человека, |
к АХЭ |
|
|
|
|
|
|
|
|
|
IC50 [M] |
|
IC50 [M] |
|
|
|
|
|
|
|
F |
|
|
|
|
|
|
|
O |
( ) |
|
|
N |
|
NO2 |
|
|
|
|
|
|
N |
3 |
|
|
|
|
|
|
|
||||
|
|
|
|
|
4,4±0,4 10-8 |
2,0±0,18 10-5 |
|
|||||
|
|
|
|
|
|
|
455 |
|||||
|
O |
|
|
F |
|
|
||||||
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
70 |
( |
)3 |
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NO2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
F |
F |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
F |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
F |
|
|
|
|
|
O |
( |
)3 |
|
|
N |
|
F |
2,1±0,2 10 |
-8 |
8,1±0,75 10 |
-7 |
39 |
N |
|
|
F |
|
||||||||
|
|
|
|
|
|
F |
|
|
||||
|
O |
|
|
|
F |
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
F |
|
|
|
|
|
|
|
( )3 |
|
|
|
|
|
|
|
|
|
||
71 |
|
N |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
F |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
( ) |
|
|
N |
|
NO2 |
|
|
|
|
|
|
N |
2 |
|
|
|
|
|
|
|
||||
|
|
|
|
|
4,7±0,27 10-8 |
5,0±0,3 10-5 |
|
|||||
|
|
|
|
|
|
|
1063 |
|||||
|
O |
|
|
|
|
|
||||||
N |
|
|
|
|
|
|
|
|
|
|
|
|
72 |
( |
)2 |
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NO2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
F |
|
|
|
|
|
|
|
O |
( ) |
|
|
N |
|
NO2 |
|
|
|
|
|
|
N |
2 |
|
|
|
|
|
|
|
||||
|
|
|
|
|
5,5±0,4 10-7 |
5,0±0,3 10-5 |
|
|||||
|
|
|
|
|
|
|
95 |
|||||
|
O |
|
|
F |
|
|
||||||
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
73 |
( |
)2 |
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NO2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,07±0,01 10-5 |
1,0±0,12 10-4 |
9 |
донепезила |
4,8±0,32 10-8 |
7,9±0,6 10-6 |
164 |
|
|
|
|
||
гидрохлорид |
|
|
|
|
|
|
|
|
|
|
Значения представляют собой среднее ± SEM |
|
|
|
t.me/medicina_free
55
3.3 Оценка острой токсичности соединений
Была определена острая токсичность 9 наиболее активных соединений (35, 59, 60, 61, 69, 70, 71, 72, 73). Значения полулетальных доз (ЛД50) исследуемых соединений находятся в интервале 51-408 мг/кг (Таблица 2), что по классификации Сидорова (Сидоров, 1973) позволяет отнести их к малотоксичным и умереннотоксичным типам веществ. Таким образом, для наиболее активных соединений были показаны значения ЛД50 <100 мг/кг.
Таблица 2. Значения ЛД50 наиболее активных соединений
Соединение |
ЛД50, мг/кг, мыши, в/б. |
|
|
35 |
51,48 |
|
|
59 |
93,08 |
|
|
60 |
90,00 |
|
|
61 |
90,00 |
|
|
69 |
284,63 |
|
|
70 |
64,27 |
|
|
71 |
245,38 |
|
|
72 |
281,02 |
|
|
73 |
407,61 |
|
|
t.me/medicina_free
56
3.4 Оценка способности соединений ингибировать АХЭ головного мозга in vivo
Для предварительной оценки способности выявленных наиболее активных соединений ингибировать АХЭ головного мозга in vivo были проведены эксперименты, во время которых оценивалась степень ингибирования АХЭ гомогенатов головного мозга мышей после внутрибрюшинной инъекции исследуемых соединений в дозе ЛД50, определенной на предыдущем этапе исследований.
Все 9 соединений оказались способными ингибировать АХЭ головного мозга мышей (Таблица 3). Причем, нами не было выявлено четкой взаимосвязи между способностью ингибировать АХЭ и БуХЭ in vitro и способностью ингибировать активность АХЭ в головном мозге in vivo. Так, активные in vitro
соединения 72, 70 и 59 показали самую слабую ингибиторную активность АХЭ головного мозга среди всех исследуемых соединений, заингибировав АХЭ на
37,6, 6,2 и 3,1% соответственно. Наиболее активные in vivo соединения 69, 35, 60, 61 ингибировали активность АХЭ головного мозга более чем на 50%.
Таким образом, соединение 35 показало себя как наиболее эффективный ингибитор АХЭ головного мозга среди исследованных производных 6-
метилурацила, учитывая достаточно низкую токсичность данного соединения, это позволило считать его перспективным в качестве ингибитора АХЭ,
предназначенного для исследования вклада индуцируемой АХЭ олигомеризации
β-амилоида в патогенез БА в условиях модели данного заболевания на животных.
t.me/medicina_free
57
Таблица 3. Процент ингибирования АХЭ головного мозга после внутрибрюшинной инъекции соединений в дозе ЛД50.
Соединение |
Ингибирование активности |
|
АХЭ в мозге, % |
||
|
||
|
|
|
35 |
70,56±0,69 |
|
|
|
|
59 |
3,14±0,61 |
|
|
|
|
60 |
52,62±16,33 |
|
|
|
|
61 |
57,89±10,92 |
|
|
|
|
69 |
59,36±4,51 |
|
|
|
|
70 |
6,21±1,94 |
|
|
|
|
71 |
45,74±11,26 |
|
|
|
|
72 |
37,61±7,54 |
|
|
|
|
73 |
50,61±11,22 |
|
|
|
Значения представляют собой среднее ± SEM
t.me/medicina_free
58
3.5 Исследование влияния соединения 35 на индуцируемую АХЭ олигомеризацию β-амилоида in vitro
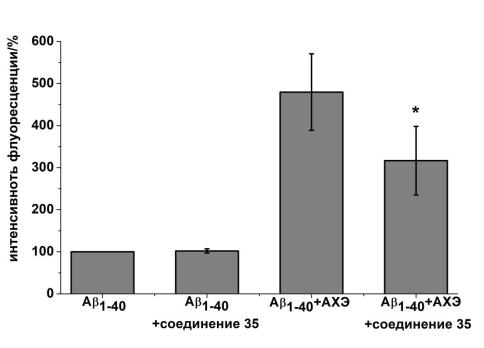
Для соединения 35, отобранного по результатам предыдущих экспериментов, была исследована способность снижать индуцируемую АХЭ олигомеризацию фрагментов Aβ in vitro. Известно, что молекулы амилоида в растворе натрий-фосфатного буфера (рН 7.4) при комнатной температуре спонтанно образуют агрегаты. Этот процесс значительно ускоряется при добавлении АХЭ, при этом блокирование ПАС фермента не дает взаимодействовать молекуле с β-амилоидом, существенно снижая индуцированную АХЭ агрегацию β-амилоида. Было показано, что соединение 35
в концентрации 10нм, полностью ингибирующей АХЭ, действительно демонстрирует способность снижать индуцированную АХЭ олигомеризацию фрагментов Aβ1-40: за 24 часа олигомеризация снижалась на 35±9% (p<0,05). При этом само по себе соединение 35 не оказывало влияния на скорость спонтанной олигомеризацию фрагмента β-амилоида Aβ1-40 (Рисунок 5).
Таким образом, соединение 35 может быть применено для исследования вклада индуцируемой АХЭ олигомеризации β-амилоида в патогенез БА.
t.me/medicina_free
59
Рисунок 5 – интенсивность флуоресценции спектров эмиссии тиофлавина. Показана интенсивность эмиссии тиофлавина Т (490 нм) при
взаимодействии с агрегированным β-амилоидом. Представлены результаты спонтанной агрегации Aβ1-40 (контроль, взятый за 100%), процент агрегации Aβ1-40
в присутствиии соединения 35по отношению к контролю, процент агрегации Aβ1- 40 в присутствии АХЭ по отношению к контролю, процент агрегации Aβ1-40 в
присутствии АХЭ и соединения 35 в концентрации 10 нМ по отношению к контролю. Данные представлены как средние значения ± SEM. *-различие с контролем статистически достоверно при p≤0,05. Статистический анализ проведен с помощью теста Манна-Уитни.
t.me/medicina_free
60
3.6 Исследование влияния соединения 35 и донепезила гидрохлорида на параметры памяти мышей в условиях фармакологической модели болезни Альцгеймера
До начала экспериментов на трансгенных животных нами был определен диапазон доз соединения 35, являющихся эффективными для коррекции нарушений памяти в условиях фармакологической модели БА. По результатам исследования соединения 35 в условиях вызванной инъекцией скополамина гидробромидом амнезии было показано, что внутрибрюшинное введение соединения 35 в дозе 5 мг/кг, или используемого в клинике ингибитора АХЭ донепезила гидрохлорида в дозе 1 мг/кг значимо уменьшило вызванный скополомина гидробромидом дефицит памяти: критерия обученности достигли
80% мышей в обеих группах (Рисунок 6). Мыши, получавшие соединение 35 (5
мг/кг), выбирали правильное направление в 65,95±4,02% тестах, а мыши,
получавшие препарат сравнения донепезила гидрохлорид в 68,17±4,87%, при этом статистически достоверные различия с контрольной группой отсутствовали. Дозы
1 мг/кг, 10 мг/кг и 15 мг/кг оказались менее эффективными: средний процент выбора правильного направления в группах составил 58,18±3,44% (p<0,01), 63,92±2,33% (p<0,05) и 63,54±2,12% (p<0,05) соответственно. В группе мышей,
получавших соединение 35 в дозе 1 мг/кг, обучилось только 30% (p<0,05)
животных, в группах, получавших 10 и 15 мг/кг, обучились 70% и 40% (p<0,05)
животных соответственно.
Таким образом, наиболее эффективная доза соединения 35 в условиях фармакологической модели БА, составила 5 мг/кг.
t.me/medicina_free
