
6 курс / Клинические и лабораторные анализы / Тромбоэластография_в_современной_клинической_практике
.pdfисточник фибриногена (широко применяемые в мире концентраты фибриногена в России пока не доступны). Применим и при дефиците XIII фактора свертывания (рис. 4-5).
Концентрат тромбоцитов
Источником тромбоцитов является донорский концетрат тромбоцитов.
Стандартный тромбоцитный концентрат, приготовленный из одной дозы консервированной крови содержит не менее 55 х 109 тромбоцитов. Переливание этого количества тромбоцитов может повысить их содержание в крови реципиента средней массой 70 кг на 5-10 х 109/л. В зависимости от технологии заготовки различают единичный концентрат, пулированный и аферезный. Перечисленные виды тромбоцитных концентратов различаются по содержанию тромбоцитов и клинической эффективности Максимальная эффективность ожидается от трансфузии концентрата, полученного методом тромбоцитафереза, минимальная – при использовании единичных концентратов.
Примерно в такой же зависимости состоит и их стоимость.
Определяя показания и оценивая эффективность трансфузии тромбоцитов следует четко представлять, что число тромбоцитов является весьма относительным критерием для этого и далеко не всегда отражает реальное состояние тромбоцитарного гемостаза.
Так умеренное снижение числа тромбоцитов при ДВС-синдроме часто сопровождается тяжелыми нарушениями гемостаза. Большая часть тромбоцитов в этом случаев вышла из лизированных тромбов и функционально не состоятельна. Другое дело иммунная тромбоцитопения, для которой характерна высокая активность тромбоцитов. При малом числе такие клетки вполне способны обеспечить нормальный гемостаз. Оптимальными критериями необходимости и эффективности включения концентрата тромбоцитов в трансфузионную программу является оценка их функции (агрегометрия, ТЭГ) и
клиническая картина. Динамика ТЭГ в результате эффективной трансфузии концентрата тромбоцитов представлена на рисунке 4-6.
Прежде чем перейти к обсуждению группы так называемых фармацевтических гемостатиков, следует уделить внимание некоторым принципиально важным аспектам применения тромбоцитов и криопреципитата (как источника фибриногена). В первой главе уже говорилось о том, что из всего массива прокоагулянтных факторов непосредственную работу по формированию тромба выполняют только два: фибриноген и тромбоциты. В связи с этим при кровотечении (да и при массивном тромбировании) эти компоненты потребляются существенно в большей степени, чем другие факторы свертывания. С другой стороны, коль именно они выполняют основную задачу в процессе
41
остановки кровотечения, образование тромба без их минимально допустимого количества невозможно. Состояние, развившееся при восполнении массивной кровопотери без трансфузии тромбоцитов и фибриногена, характеризующееся тромбоцитопенией и/или гипофибриногенемией (см. рис. 3-13) носит название постгеморрагической коагулопатии.
На рисунке 4-7 представлена динамика ТЭГ в процессе коррекции постгеморрагической коагулопатии у пациентки, перенесшей массивное акушерское кровотечение. Учтенная кровопотеря при выполнении кесарева сечения составила 4000 мл. Объем инфузионно-
трансфузионной терапии – около 6000 мл, включая СЗП, синтетические коллоидные и солевые растворы, эритроцитную массу. В связи с клиникой развернутого геморрагического синдрома
(кровотечение по дренажу, кровоточивость кожного шва, жидкая кровь в полости матки) через час после операции была выполнена ТЭГ (рис. 4-7а), продемонстрировавшая нарушения и динамики тромбообразования, и собственных свойств тромба. Последовательные трансфузии концентрата тромбоцитов и криопреципитата нормализовали показатели МА и угол α (рис.4-7б, в), а
клинически - купировали геморрагический синдром. На этот момент оставалось небольшое удлинение интервала r, отражающее умеренный дефицит факторов протромбинового комплекса
(протромбин по Квику – 59%). Консервативная (учитывая отсутствие клиники кровоточивости)
терапия препаратом витамина К через три дня купировала и эти нарушения (рис. 4-7г).
Препараты факторов свертывания. По технологии производства выделяют два типа препаратов факторов свертывания крови: вирусинактивированные концентраты
(полученные из донорской плазмы) и генноинженерные. В настоящее время для клинического использования доступны препараты VIII, IX, XIII факторов и фактора Виллебранда. Используются для коррекции гемостаза при дефиците соответствующих факторов свертывания.
Концентраты протромбинового комплекса (КПП). Группа препаратов,
содержащих в своем составе комплекс витамин К-зависимых факторов свертывания (II, VII, IX, X). В чистом виде комплекс отличается высокой тромбогенностью, в связи с чем,
в его состав введены антикоагулянты (в зависимости от конкретного препарата это может быть гепарин, антитромбин III и/или протеин С). Основное показание к применению – экстренная реверсия эффекта антикоагулянтов антагонистов витамина К. Следует помнить, что к этой группе помимо лекарственных средств (в настоящее время это,
главным образом, варфарин) относится и действующее начало крысиного яда. Прямым показанием к трансфузии КПК является кровотечение при редкой патологии – наследственном дефиците факторов протромбинового комплекса или изолированном
42
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
дефиците Х фактора. Применяется протромбиновый комплекс и в случаях необходимости быстрой коррекции нарушений гемостаза, связанных с дефицитом витамина К различного генеза (нарушения питания, длительное лечение цефалоспоринами), печеночной недостаточностью. Обсуждается использование КПП при острой кровопотере, для реверсии эффекта НМГ, прямого ингибитора Ха-фактора свертывания (ривароксабана) и в ряде других ситуаций.
У пациента О., 72 лет передозировка варфарина, принимаемого в связи с мерцательной аритмией, привела к развитию желудочного кровотечения. Введение протромплекса в дозе,
меньше расчетной под контролем ТЭГ (рис 4-8) устранило избыточное действие варфарина,
сохранив минимальный эффект препарата в пределах профилактического диапазона. Это дало возможность остановить кровотечение аргоно-плазменной коагуляцией через эндоскоп без риска развития тромботической ситуации.
Другой пример (рис. 4-9) демонстрирует эффективное использование КПК для купирования послеродового кровотечения, связанного с развитием гепариноподобного синдрома.
Важное стратегическое направление гемостатической терапия – применение
средств «шунтового гемостаза». К этой группе относятся активированный протромбированный комплекс (ФЕЙБА) и рекомбинантный активированный VII фактор свертывания. Действующее начало в обоих препаратах активированный VII фактор.
Обсужденная ранее клеточная модель свертывания крови позволяет наглядно представить его механизм действия. Как известно старт процессу свертывания крови дает контакт в норме присутствующего в крови активированного VII фактора и тканевого фактора,
попавшего в кровоток из поврежденной сосудистой стенки. В зоне повреждения сосуда тканевой фактор присутствует в многократном избытке. Обсуждаемые препараты дают такой же многократный избыток второго стартового компонента – VIIa. Это приводит к
«взрывной» (быстрой и интенсивной) активации свертывания крови, при которой полный нормальный процесс запуска тромбообразования не задействуется, а появляется некий
«коагуляционный шунт». Практический смысл этого – обойти известное или неизвестно поврежденное звено коагуляционного каскада и остановить кровотечение.
Основное показание, для которого были разработаны «шунтовые гемостатики», это ингибиторная форма гемофилии (прямое действие на поврежденное звено – замещение дефицитного фактора свертывания – не возможно). Эффективны они при коагулопатических кровотечениях другого генеза. В «негемофилических» ситуациях показанием к применению rVIIa служат резистентные кровотечения (или неизвестно поврежденное звено, или терапевтические действия не успевают за темпом кровопотери).
43
В этих случаях эффективный «шунтовой гемостаз» дает время разобраться с ситуацией и,
прерывая патологический круг, связанный с непрерывным потреблением компонентов гемостаза, позволяет «догнать» ситуацию необходимым объемом трансфузионой терапии.
Важно помнить, что для эффективного применения rVIIa необходимо соблюсти ряд условий: достаточная концентрация фибриногена и тромбоцитов (субстрата тромбообразования!), коррекция ацидоза, устранение гиперфибринолиза. Терапевтическая доза препарата для ингибиторной гемофилии (90-120 мкг/кг массы тела, а в ряде случаев до 200 мкг/кг) действует в течение 2 часов. В случае использования вне основных показаний рекомендуются меньшие дозы – от 40 мкг/кг.
«Шунтовые» препараты, впрочем, как и все фармацевтические гемостатики агрессивны, а, следовательно, требуют лабораторного контроля. Из рутинных коагуологических тестов введение VIIа изменяет только протромбиновое время. Но использовать данный показатель для контроля эффективности и безопасности «шунта» бессмысленно, так как он отражает только механизм действия – избыточную активацию пути тканевого фактора, но не степень изменения гемостатического потенциала крови.
Помочь в решении поставленной задачи могут только интегральные тесты, в частности ТЭГ (рис. 4-10).
Пациент Ш. страдает тяжелым геморрагическим диатезом – тромбастенией Гланцмана. И
без того непростая задача обеспечение системного гемостаза у пациента с этой нозологией, в
данном случае осложнена резистентностью к трансфузиям тромбоцитов. Основой гемостатической терапии становятся «шунтовые» препараты. Динамика показателей ТЭГ,
характеризующая действие активированного протромбинового комплекса (FЕIBA), представлена на рисунке 4-11. Исходное снижение МА в сочетание с удлиненным k отражают тяжелое нарушение функции тромбоцитов. Введение препарата не изменяет МА, но компенсирует гемостаза за «шунта», что проявляется укорочением (с выходом за пределы нормы) r и
нормализацией k.
Популярными средствами фармацевтического гемостаза являются ингибиторы фибринолиза. В настоящее время в клинической практике используются два основных типа антифибринолитиков: ингибиторы сериновых протеаз – типичный представитель апротинин и его аналоги (гордокс, трасилол, контрикал) и лизинсодержащие аминокислоты, к которым относится ε-аминокапроновая кислота (в связи с токсичностью для системного применения в настоящее время практически не используется) и
транексамовая кислота. Являясь универсальной антипротеазой, апротинин помимо фибринолиза снижает активность коагуляционного каскада, системы комплемента и др.
44
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
Описана значимая противовоспалительная активность апротинина. Транексамовая кислота – специфический конкурентный ингибитор плазминогена. Существенный недостаток апротинина – высокая аллергогенность и токсичность, склонили чашу весов в выборе препаратов к лизиновым производным. Шире всего в современной клинике используется транексамовая кислота. Тромбоэластографическая иллюстрация ее эффективности представлена на рисунке 4-12. Эффективность транексамовой кислоты продемонстрирована рядом больших многоцентровых исследований, как например,
недавно законченное CRASH-2 и представившее промежуточные результаты VOMEN.
Обнадеживающие результаты этих исследований явились основанием модной тенденции,
захватившей специалистов многих хирургических отраслей медицины,
профилактического использования транексамовой кислоты. Возможно в этом есть рациональное зерно, но неизбежно возникает вопрос: правильно ли воспринимать фибринолиз как ошибку природы? Что-то подсказывает, что нет.
Возможность обеспечить системный гемостаз, стимулировав собстветвеные резервы организма дает десмопрессин – синтетический аналог эндогенного вазопрессина.
Одним из эффектов его применения является выброс VIII фактора свертывания и фактора Виллебранда из депо – сосудистой стенки. В связи с этим препарат эффективно используется при легкой форме болезни Виллебранда, гемофилии, для повышения функции тромбоцитов при ряде тромбоцитопатий, в частности при тромбастении Гланцмана и др.
Противотромботические лекарственные средства
Антикоагулянты. По механизму действия подразделяются на прямые,
воздействующие непосредственно на компоненты коагуляционного каскада, и непрямые – угнетающие синтез факторов свертывания.
К непрямым антикоагулянтам относятся производные антагонисты витамина К
(АВК), основным представителем которых на сегодняшний день является варфарин.
Действие основано на блоке активации витамин К-зависимых факторов свертывания (II, VII, IX и Х). В клинике присутствуют в пероральной форме, что позволяет принимать их в течение длительного времени (часто – годами). Существенный недостаток – высокая зависимость эффекта от индивидуальных особенностей и диеты пациента. Так, пища,
богатая витамином К (зеленые овощи) ослабляет действие варфарина, тонизирующие напитки – усиливают. Список лекарственных средств, изменяющих фармакокинетику варфарина при совместном применении, содержит десятки наименований. Простым
45
способом мониторинга АВК является определение протромбинового времени,
выраженного через МНО. На ТЭГ эффект АВК, как уже обсуждалось, проявляется удлинением интервала r (см. рис. 2-7).
Основные представители прямых антикоагулянтов – гепарины – обсуждены в разделе специфических методик ТЭГ. Их применение входит в «зону интересов» теста с гепариназой. Не вызывает сомнений высокая эффективность гепаринов, но их использование имеет и ряд проблем. В первую очередь это зависимость от активности антитромбина III, кофактором которого они являются и гепарининдуцированная тромбоцитопения (ГИТ). Следует отметить, что реальную проблему составляет только иммунная тромбоцитопения или ГИТ II (табл.). И та, и другая проблемы проявляются резистентностью к гепарину, т.е. отсутствием ожидаемого антикоагулянтного эффекта от используемой дозы гепарина. Тест с гепариназой зафиксирует тромбогенные изменения на ТЭГ и отсутствие или небольшую выраженность коррекции гепариназой.
Пациент З, 72 лет с целью антитромботической профилактики после общирного оперативного вмешательства на брюшной полости по поводу перитонита получает гепарин в виде постоянной инфузии со стартовой дозой 500 ед/час и целевым значением АЧТВ 40 сек. Динамика в течение нескольких дней показывает, что цель периодически достигалась, но для этого потребовалось постоянное увеличение дозы, достигшей в итоге 1200 ед/час. При этом АЧТВ составило 31 сек. Тест с гепариназой (рис. 4-13) продемонстрировал тенденцию к гиперкоагуляции и следовой эффект гепарина. Выявленная тромбоцитопения (52 х 109/л при исходных 144 х 109/л) и снижение антитромбина до 62% дают основание обсуждать и версию ГИТ, и функционально значимого дефицита антитромбина. Более редкая причина гепаринорезистености – гиперфибриногенемия, также может обсуждаться, так уровень фибриногена по Клаусу на момент решения обсуждаемой клинической задачи составлял 5,4 г/л.
Однако выявление антител к комплексу гепарин – 4-й пластинчатый фактор в диагностическом титре (2,4 ед/мл) определил выбор в пользу ГИТ. Замена гепарина на фондапаринукс устранила возникшую гемостазиологическую проблему.
В другом случае пациентке М, 24 лет, страдающей наследственной микросфероцитарной гемолитической анемией была запланирована спленэктомия лапароскопическим доступом. В
рамках предоперационного обследования никаких нарушений со стороны системы гемостаза выявлено не было не смотря на пристальное внимание к вопросу. Причиной особого интереса к гемостазу пациентки, в первую очередь к поиску тромбофилических проявлений, был факт смерти матери и родной сестры от ТЭЛА после выполнения спленэктомии по тем же показаниям.
Для послеоперационной профилактики тромботических осложнений через 6 часов после
операции была начата терапия надропарином в дозе 5600 ед (0,6 мл) за два введения. Эффект
46
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
первого введения по данным ТЭГ укладывался в рамки требуемых значений (рис. 4-14). Второе же введение через 12 часов, эффекта уже не дало: по данным ТЭГ выявлена гиперкогуляция без следов присутствия фраксипарина (рис. 4-15). Расширение обследования выявило в качестве причины снижение антитромбина до 52% при исходном уровне до операции 98%. Очевидно у пациентки имел место функциональный дефицит антитромбина, не проявлявшийся в спокойных условиях, но проявившийся в связи с операцией и назначением гепарина. По-видимому, такие же нарушения имели место и у умерших от ТЭЛА родственников. Однократное добавление человеческого антитромбина восстановило эффект гепарина, что демонстрирует ТЭГ на рисунке
4-16. Причем в последующем в течение послеоперационного периода проблема не рецидивировала.
Все более популярной становится относительно новая группа прямых антикоагулянтов – прямые (без участия антитромбина III) ингибиторы тромбина
(дабигатран) и Ха фактора свертывания (ривароксабан, апиксабан). Для них характерен пероральный путь использования, что явилось основанием для обозначения англоязычной аббревиатурой NOA (New Oral Anticoagulants). Бесспорные преимущества по отношению
кгепаринам – отсутствие зависимости от уровня антитромбина и риска развития ГИТ.
Вмомент появления в клинике они были представлены как высоко эффективные,
абсолютно безопасные препараты, со стандартной выраженностью эффекта,
предсказуемой фармакокинетикой. Этим было обосновано отсутствие необходимости лабораторного контроля эффекта прямых ингибиторов. Близкое знакомство показало, что не все просто с новыми антикоагулянтами. Геморрагические осложнения при их применении случаются, причем более тяжелые, чем при использовании АВК.
Фармакокинетика значимо зависит от веса, возраста, функции почек (дабигатран) и
печени (ривароксабан). Выявленны и определенные лекарственные взаимодействия. Такое положение вещей остро поставило перед специалистами вопрос методах лабораторного контроля эффекта прямых ингибиторов. Проблема актуальна и весьма активно дискутируется. На настоящим момент в качестве показателя эффекта дабигатрана используется тромбиновое время, ривароксабана – активность против Ха фактора.
Обсуждает и возможность использования интегральных методов, в частности ТЭГ, в
контроле прямых ингибиторов.
Небольшой собственный опыт позволяет заключить, что ТЭГ имеет все основания стать базовым методом контроля новых антикоагулянтов. На рисунке 4-17 представлена динамика ТЭГ в процессе подбора ривароксабана у пациентки с мерцательной аритмией.
Рисунок 4-18 иллюстрирует эффект дабигатрана в рамках тромбопрофилактики у
пациента, перенесшего ТЭЛА.
47
Антиагреганты. Лекарственные средства, обладающие способностью подавлять агрегационные свойства тромбоцитов носят названия антиагрегантов.
В настоящее время на Российском фармацевтическом рынке можно встретить представителей следующих групп:
1.Вещества, действующие на метаболизм арахидоновой кислоты путем ингибирования циклооксигеназы-1 (ЦОГ-1): ацетилсалициловая кислота (аспирин).
2.Антагонисты рецептора АДФ на тромбоцитарных мембранах: тиенопиридины -
тиклопидин (тиклид), клопидогрел (плавикс) и празугрел.
3.Антагонисты гликопротеинов (GP) IIb/IIIa: абциксимаб (РеоПро).
4.Ингибиторы цАМФ фосфодиэстеразы: дипиридамол
Антиагрегантным действием обладают также НПВС (ингибиторы ЦОГ-1),
синтетические коллоиды и ряд других лекарственных средств.
Тромболитические препараты.
Теоретически тромболитическая терапия имеет два направления: введение предварительно активированного плазмина и введение активаторов фибринолиза.
Первое направление представлено фибринолизином. В связи с медленным развитием действия и не высокой эффективность популярность его низка.
Препараты активаторов эндогенного фибринолиза представлены тремя группами лекарственных средств:
1)препараты первого поколения, которые приблизительно в одинаковой мере активируют и связанный с фибрином, и циркулирующий в крови плазминоген (стрепто- и
урокиназа);
2)препараты второго поколения, обладающие относительной специфичностью к связанному с фибрином плазминогену (рекомбинантная проурокиназа, рекомбинантный тканевый активатор плазминогена - актилизе);
3)препараты третьего поколения, обладающие более высокой тромболитической активностью благодаря изменениям в их молекулах, которые были внесены с помощью метода генной инженерии негликозилированный рекомбинантный тканевого активатора плазминогена, химерные молекулы, содержащие различные участки тканевого активатора плазминогена и урокиназы).
Из методик тромболизиса все большую популярность приобретает локальный тромболизис, заключающийся в подведении тромболитика максимально близко к зоне
48
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
тромбирования. Созданы препараты для восстановления просвета тромбированного
венозного катетера на основе тромболитиков (тауролок U).
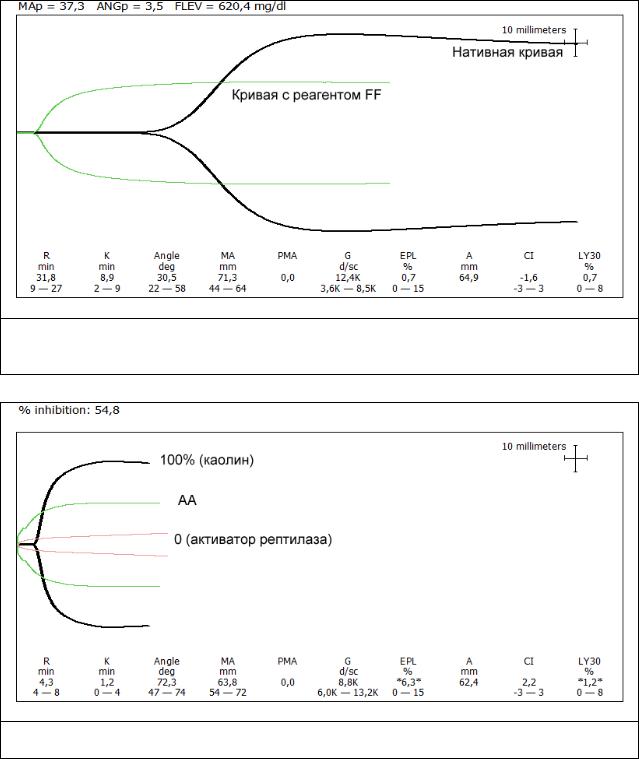
Рис. 4-1. ТЭГ (тест на функциональный фибриноген) пациента И. Имеет место удлинение r (дефицит протромбинового комплекса), при увеличении МА за счет избыточного содержания фибриногена.
Рис. 4-2. РМ-тест пациентки Г. Выявлен 50% блок рецепторов при стимуляции арахидоновой кислотой (рецепторы к аспирину).
49
а
б
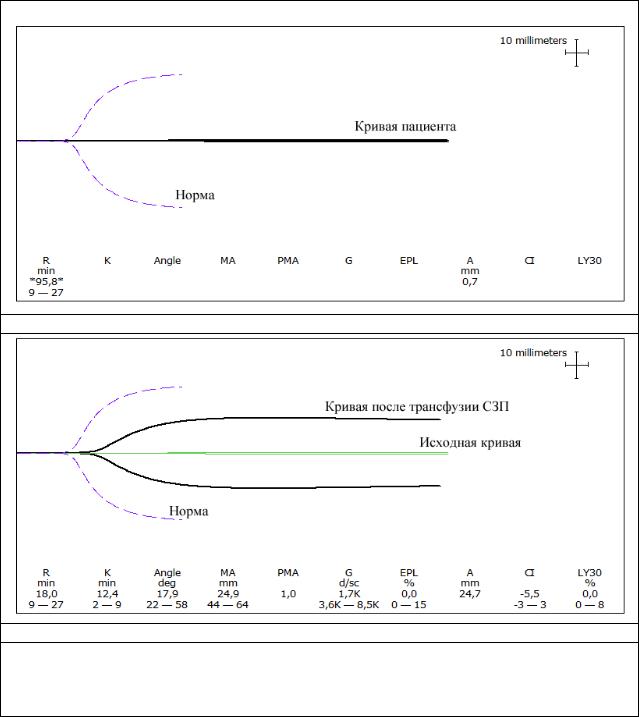
Рис. 4-3. Выраженная гипокоагуляция у больного с тяжелой печеночной недостаточностью (а) и результат трансфузии СЗП (б). Тромб формируется практически с нормальными динамическими показателями. Сохраняются признаки тяжелой тромбоцитопении (снижение МА и удлиннение k).
50
Рекомендовано к изучению сайтом МедУнивер - https://meduniver.com/
