
- •3.6.4. Микрохирургия в лечении патологии сосудов конечностей
- •3.8.1. Предоперационная подготовка
- •3.8.2. Анестезия в различных областях сосудистой хирургии
- •3.9. Лабораторная диагностика нарушений гомеостаза у больных во время и после хирургических вмешательств
- •3.10.1. Общие принципы ведения больных
- •3.10.1.1. Стандарты послеоперационного мониторинга
- •3.10.1.2. Методы измерения основных гемодинамических параметров
- •3.10.2. Общие принципы ведения больных в раннем послеоперационном периоде
- •3.10.2.1. Пациенты первого уровня мониторинга
- •3.10.2.2. Пациенты второго
- •3.10.2.3. Контроль за состоянием свертывающей системы крови и профилактика тромботических осложнений
- •3.10.2.4. Профилактическое применение антибиотиков
- •3.10.3. Осложнения раннего послеоперационного периода
- •3.10.3.1. Острая недостаточность кровообращения
- •3.10.3.2. Регуляция производительности сердца
- •3.10.3.5. Синдром острого повреждения легких и острый респираторный дистресс-синдром
- •3.10.3.6. Синдром полиорганной недостаточности
кожной артерии. Кроме того, мо- жет быть применен в островковом варианте.
Лучевой лоскут кровоснабжается лучевым сосудистым пучком, про- ходящим в межмышечном про- странстве вдоль лучевой борозды и осуществляющей сегментарное
кровоснабжение лоскута за счет ряда перегородочно-кожных вет- вей. Наибольшее количество по- следних в нижней трети предплечья (от 4 до 10 через каждые 1—2 см). Наиболее крупная ветвь может кро- воснабжать участок кожи размером 8 х 16 см. В верхней и средней тре- тях сосудистый пучок расположен глубоко, между плечелучевой мыш- цей и лучевым сгибателем кисти, а в нижней трети поверхностно. Дли- на сосудистой ножки соответствует длине предплечья. Венозный дре- наж осуществляют две комитант- ные вены и подкожная венозная сеть.
Иннервация осуществляется ла- теральным и внутренним кожными нервами предплечья.
Размеры могут достигать 2x3 диаметра предплечья на всем его протяжении. Лоскут имеет относи- тельно одинаковую толщину, кото- рая возрастает в верхней трети, у женщин с выраженной подкожной жировой клетчаткой эта разница может быть значительной. Забор лоскута приводит к выраженному косметическому дефекту, особенно при значительной площади лос- кута.
В предоперационном периоде для предотвращения развития ише- мии кисти обязателен тест Аллена (определение проходимости одной из парных магистральных артерий) для оценки состояния кровообра- щения в кисти. Как правило, опе- рацию начинают на обескровлен- ном операционном поле, что облег- чает идентификацию ветвей луче- вой артерии. Выделение лоскута происходит снизу вверх. При выде- лении сосудисто-нервного пучка в
средней и верхней третях особое внимание следует обращать на от- деление перегородочно-кожных ветвей от перимизия внутренней поверхности плечелучевой мышцы. Донорский дефект закрывают ли- нейно при небольшой ширине лос- кута или дерматомным кожным ло- скутом, при этом выступающие в рану сухожилия и нервы следует за- крывать местными тканями.
Лучевой лоскут может быть за- бран как кожно-фасциальный, кожно-мышечный (плечелучевая мышца, лучевой сгибатель кисти, поверхностный сгибатель I пальца) и кожно-костный с кортикальным фрагментом лучевой кости, при этом диаметр кортикала не должен превышать 1/3 диаметра лучевой кос- ти. Лучевой лоскут может быть ис- пользован также как островковый вариант.
Паховый лоскут кровоснабжается поверхностной артерией, огибаю- щей подвздошную кость (ПАОПК). ПАОПК в 48 % случаев отходит от бедренной артерии единым стволом с нижней надчревной поверхност- ной артерией и начинается около 5 см ниже паховой связки. Артерия входит в лоскут у медиального края портняжной мышцы. Диаметр ПАОПК в среднем составляет 1,4 мм. Конечные ветви последней анастомозируют с надкостницей гребня подвздошной кости. Длина сосудистой ножки от 2 до 4 см. Ве- нозный дренаж лоскута осуществ- ляют поверхностная кожная вена и комитантные вены, а также более изменчивая поверхностная вена, окружающая подвздошную кость. Нижняя поверхностная надчревная вена в ряде случаев сливается с по- верхностной веной, окружающей подвздошную кость, в этом случае ее диаметр составляет 2—4 мм.
Возможен вариант пересадки па- хового лоскута на глубоких сосудах, огибающих подвздошную кость.
Иннервация осуществляется раз- розненными ветвями из различных
371
источников, лоскут не имеет еди- ного кожного нерва, подходящего для реиннервации.
Описано использование пахового лоскута от 5 х 8 до 24 х 40 см, чаще всего лоскут бывает шириной около 10 см. При этом 1/3 ширины лоскута располагается выше паховой связ- ки, а центральная ось лоскута от spina illiaca ant. sup. до точки на 2,5 см ниже паховой связки. Основ- ными недостатками этого лоскута являются небольшой размер питаю- щих сосудов и сложность их выде- ления. Толщина трансплантата не- значительна при достаточно боль- шой его площади. Ширина лоскута значительно увеличена у тучных па- циентов, что также затрудняет вы- деление сосудов.
Для облегчения забора лоскута маркируют ход паховой связки, бедренной артерии и место отхож- дения ПАОПК, которое, как прави- ло, находится в проекции бедрен- ной артерии на 2,5 см ниже пахо- вой связки. Линия, проведенная от этой точки латерально и параллель- но паховой связке, служит проек- цией ПАОПК. Взятие лоскута на- чинают с медиальной стороны, со- храняя поверхностные вены. После выделения бедренной артерии на- ходят ПАОПК. На этом этапе вы- бирают питающий сосуд, так как в некоторых случаях более приемле- мым донорским сосудом может быть поверхностная надчревная ар- терия. После выделения артерии и вен лоскут поднимают. На уровне передней верхней ости и латераль- ного края портняжной мышцы сле- дует углубиться под широкую фас- цию для сохранения в лоскуте глу- бокой ветви ПАОПК, лежащей под последней. Рану ушивают линейно (при ширине лоскута не более 15 см) и в большинстве случаев дан- ной зоне не наносится ни функци- ональный, ни косметический де- фект.
Лоскут может быть как кожно- фасциальным, так и кожно-кост-
372
ным трансплантатом с участком гребня подвздошной кости длиной до 10 см. В настоящее время наибо- лее часто паховый лоскут применя- ют как несвободный лоскут на со- судистой ножке и островковый лос- кут. При использовании пахового лоскута на сосудистой ножке для уменьшения периода времени меж- ду пересадкой лоскута и отсечени- ем сосудистой ножки показана ме- тодика «тренировки» лоскута, за- ключающаяся в периодическом,си- стематическом пережатии ножки лоскута, что значительно сокращает срок отсечения ножки транспланта- та.
3.6.4. Микрохирургия в лечении патологии сосудов конечностей
Примерно 40 % больных с тромбо- облитерирующим поражением арте- рий дистальнее паховой связки имеют стенозы и окклюзии артерий голени, из них 18 % выполняют первичную ампутацию нижней ко- нечности на фоне хронической ар- териальной недостаточности. При хирургическом лечении окклюзи- онных заболеваний артерий средне- го и малого диаметра целью рекон- структивной сосудистой операции является восстановление кровооб- ращения в ишемизированном сег- менте нижней конечности.
Предложенный в 1960 г. J.Jacob- son и E.Suarez микрохирургический метод открыл перед хирургами, оперирующими на сосудах малого диаметра, широкие возможности. Микрохирургические реконструк- тивные операции позволили видо- изменить и улучшить результаты предложенных ранее операций, вы- полняя так называемый прецизион- ный шов [Петровский Б.В., Крылов B.C., 1976].
На сегодняшний день все рекон- структивные операции на артериях диаметром 4 мм и менее должны выполняться с помощью операци- онного микроскопа. Данное прави-
ло применяют при локализации тромбооблитерирующего процесса или травматического повреждения артерий нижних конечностей дис- тальнее паховой связки: при пора- жении глубокой артерии бедра, подколенной артерии, артерий го- лени и стопы.
При операциях на артериях голе- ни и стопы, а также ветвях глубо- кой артерии бедра используют опе- рационный микроскоп с увеличе- нием 10—12 крат. Для наложения анастомозов и пластики артерии показана комбинация узлового и непрерывного шва, выполняемая нитью 6/0—10/0 с атравматической иглой. Методом выбора при рекон- структивных операциях на артериях среднего и малого диаметра счита- ют аутовенозное шунтирование бо- льшой подкожной веной. Однако последняя в 25—30 % случаев не пригодна для шунтирования или же она использована при первичных операциях. Особую группу состав- ляют ранее оперированные боль- ные с тромбозами реконструиро- ванных артерий или сосудистого протеза.
При реваскуляризации наиболее дистальных отделов конечности (стопы, голени) на фоне поражения периферического русла частота не- пригодности аутовены как транс- плантата возрастает. Это обстояте- льство зачастую не позволяет ре- шить вопрос о прямой реваскуля- ризации. В таких случаях опера- цией выбора является пластика глу- бокой артерии бедра. Однако рас- пространенность поражения глубо- кой артерии бедра, подколенной артерии и артерий голени, недоста- точность коллатеральных связей между ними служат причиной не- удовлетворительных результатов ре- васкуляризации. В отдаленные сро- ки положительные результаты у данной группы больных сохраняют- ся только в 7,4 % случаев. В таких случаях может быть рекомендована непрямая реваскуляризация голени
трансплантацией большого сальни- ка на голень.
Большой сальник — орган, обла- дающий богатыми пластическими возможностями. Он хорошо васку- ляризирован и при трансплантации способствует быстрому образова- нию сосудистых анастомозов с окружающими тканями. Адгезив- ную способность большого сальни- ка можно объяснить экссудацией на его поверхности клеток белого рост- ка крови и фибрина. Он также при- нимает участие в процессах гумора- льного и клеточного иммунитета. Все эти свойства определяют цен- ность большого сальника как плас- тического материала, обеспечиваю- щего дополнительную васкуляриза- цию окружающих тканей и активно противостоящего инфекции.
Метод микрохирургической пе- ресадки большого сальника можно использовать благодаря его крово- снабжению достаточно крупными желудочно-сальниковыми сосуда- ми. Сосуды большого сальника имеют диаметр: желудочно-сальни- ковые артерии — 1,5—2 мм, одно- именные вены — 2—3,5 мм. С по- мощью микрохирургической техни- ки реваскуляризованный большой сальник может быть пересажен в любую область человеческого тела. Большой сальник у больных с хро- нической артериальной недостаточ- ностью нижних конечностей при- меняют с целью создания источни- ка дополнительного кровоснабже- ния плохо кровоснабжаемых тканей и восполнения дефектов мягких тканей.
Микрососудистая аутотрансплан- тация большого сальника впервые была предложена в 1967 г. Н.Gold- smith и E.S.Alday. Свободную аутот- рансплантацию большого сальника на голень впервые выполнил в 1977 г. A.Nishimura. Данное вмеша- тельство, по мнению И.И.Затевахи- на, является операцией выбора у больных облитерирующим тром- бангиитом.
373
В России при артериальной не- достаточности конечностей исполь- зование в качестве биологического шунта свободного сальникового ло- скута с последующим его удлине- нием до 1 м и более с сохранением непрерывности сосудистого русла было выполнено И.И.Затевахи- ным. В дальнейшем Ю.Ф.Горбен- ко (1987), Н.О.Миланов (1989), Н.Ф.Дрюк (1989), А.В.Троицкий (1991) доказали преимущество мик- рохирургической пересадки сальни- ка перед методикой его удлинения с сохранением питающей сосуди- стой ножки. Трансплантация саль- ника позволяет разместить сальник на дистальные отделы голени и сто- пы.
С целью предоперационной под- готовки больным выполняют арте- риографию нижних конечностей, УЗДГ.
Микрохирургическую аутотранс- плантацию большого сальника можно условно разделить на следу- ющие этапы:
подготовка реципиентной обла- сти;
лапаротомия, мобилизация бо- льшого сальника и ушивание брюшной полости;
размещение большого сальника на конечности;
формирование микрососуди- стых анастомозов и укрытие после- операционной раны.
Операцию выполняют под эндо- трахеальным наркозом 2 бригады хирургов.
Подготовка сосудов заключается в выделении максимально дисталь- но проходимого магистрального со- суда, который по данным артерио- графии был выбран как реципиент- ный. В качестве реципиентных все- гда используют магистральные арте- рии и никогда — даже крупные кол- латерали. Что касается реципиент- ных вен, то предпочтение отдается магистральным венозным стволам, т.е. соответственно бедренной, под- коленной и тибиальным венам.
Параллельно с подготовкой ре- ципиентной области вторая бригада хирургов выполняет верхнесредин- ную лапаротомию с последующей ревизией большого сальника, оце- нивает его анатомическое строение, выраженность подкожной жировой клетчатки, пульсацию сальниковых артерий. Мобилизацию сальника начинают с пересечения коротких ветвей желудочно-сальниковой ар- терии по большой кривизне желуд- ка. Левую желудочно-сальниковую артерию выделяют дистальнее от- хождения левой сальниковой арте- рии, правую — до передней верхней ветви поджелудочно-двенадцати- перстной артерии. Далее сальник отсекают от поперечной ободочной кишки и ее брыжейки. После выде- ления реципиентных сосудов бедра или голени сосудистую ножку боль- шого сальника пересекают. Саль- никовый лоскут укладывают на ко- нечности субфасциально на мыш- цы и межмышечные промежутки. Для предотвращения натяжения краев раны и сдавления сосудов трансплантата микроэтап и включе- ние кровотока в трансплантате це- лесообразно выполнять после уши- вания кожи над основной массой сальника с последующей интраопе- рационной допплерометрией.
Микроэтап: выполняют наложе- ние микрососудистых анастомозов с артерией и соответствующей ве- ной на голени или бедре. Артери- альный анастомоз формируют по типу конец в бок с бедренной, под- коленной или тибиальной артерия- ми; а микроанастомозы между же- лудочно-сальниковой веной и бед- ренной или подколенной веной — по типу конец в бок, с тибиальны- ми венами — по типу конец в ко- нец. Что касается последовательно- сти формирования сосудистых ана- стомозов, то первым, как наиболее трудоемким, предпочитают накла- дывать венозный анастомоз. Для наложения анастомозов используют операционный микроскоп, преци-
374
зионный инструментарий, атравма- тический шовный материал — 8/0—10/0. Анастомозы с артериями голени выполняют отдельными уз- ловыми швами. Используют 12— 16-кратное увеличение микроскопа.
По окончании микроэтапа опе- рации швы накладывают на кожу над областью анастомозов. С целью профилактики образования гема- том операционные раны на нижних конечностях в 1-е сутки после опе- рации дренируют трубками с актив- ной аспирацией содержимого.
Сосудистые связи между сальни- ком и ишемизированными тканями образуются через 10—12 нед, поэто- му выключение анастомозов из-за прогрессирования облитерирующих
заболеваний, возникающих в отда- ленном послеоперационном перио- де (более 1 года), существенно не влияет на дальнейшее состояние кровообращения в конечности. Об- разовавшаяся коллатеральная сеть имеет множественные связи с вет- вями функционирующих магистра- льных артерий и компенсирует не- достаточность кровообращения.
Таким образом, при отсутствии технических возможностей выпол- нения шунтирующей операции у пациентов с облитерирующими за- болеваниями сосудов нижних ко- нечностей пересадка большого сальника является альтернативой ампутации при критической ише- мии нижних конечностей.
3.7. Ангиохирургические аспекты гемодиализа
Формирование сосудистого доступа для проведения гемодиализа у па- циентов с терминальной стадией хронической почечной недостаточ- ности, учитывая широкое распро- странение данного метода замести- тельной терапии в зарубежной и отечественной практике, до настоя- щего времени является актуальной и окончательно нерешенной проб- лемой современной ангиохирургии. Лечение этих больных неразрывно связано с проблемой формирова- ния и функционирования сосуди- стого доступа.
В 1960 г. Quinton и Scribner пред- ложили использовать для програм- много гемодиализа у больных с тер- минальной стадией хронической почечной недостаточности артерио- венозный шунт (АВШ) (рис. 3.24, а—в), а в 1966 г. Brescia и Cimino разработали способ формирования «внутренней» подкожной арте- риовенозной фистулы (АВФ) (рис. 3.24, г). Данный метод заключается в артериализации подкожной вены путем наложения АВФ, через кото- рую в дальнейшем осуществляется
подключение больного к экстракор- поральному диализному контуру.
Существует четыре основных способа формирования артериове- нозной фистулы: бок вены в бок артерии, конец вены в конец арте- рии, конец вены в бок артерии, ко- нец артерии в бок вены.
Правильная предоперационная оценка исходного состояния боль- ного и выбор соответствующего типа доступа позволяют значитель- но увеличить сроки функциониро- вания АВФ, избежать безуспешных операций, повысить качество диа- лиза и жизни больного.
Из множества предложенных способов необходимо выделить сле- дующие основные виды сосудистых доступов.
Временный сосудистый доступ:
• артериовенозный шунт по Qu- inton—Scribner.
Постоянный сосудистый доступ:
сосудистый доступ (фистула, АВФ) по Brescia—Cimino на пери- ферических артериях;
АВФ на магистральных артери- ях;
375
• АВФ с использованием алло- протеза из PTFE.
Для применения каждого типа со- судистого доступа должны быть со- ответствующие показания, которые зависят от следующих условий:
исходное состояние сосудисто- го русла;
наличие в анамнезе повторных безуспешных попыток по формиро- ванию доступа;
наличие у больного различных ангиопатий: сахарный диабет, узел- ковый периартериит и пр.;
а наличие и выраженность сопут- ствующей патологии.
Временный сосудистый доступ по Quinton—Scribner в настоящее вре- мя применяется редко и использу- ется преимущественно при прове- дении гемодиализа у больных с ост- рой почечной недостаточностью. Сроки функционирования этого вида доступа ограничены 3—4 нед, но, по данным зарубежных авторов, могут быть продлены до 10—12 мес (см. схему 1).
Как правило, одновременно с АВШ формируется артериовеноз- ная фистула, через которую осуще- ствляется дальнейший (постоян- ный) гемодиализ. Однако существу- ет группа больных (преимуществен- но с сахарным диабетом и старче- ского возраста), у которых значите- льный сосудистый дефицит обу- словлен состоянием артериовеноз- ной системы конечностей (рассып- ной тип строения венозной систе- мы, диабетическая микро- и макро- ангиопатия, склеротические изме- нения вен и артерий) и которым в силу тяжести состояния был сфор- мирован АВШ по Quinton—Scrib- ner. Формирование АВФ на интакт- ных сосудах верхних конечностей у этих больных зачастую невозмож- но, так как порой задействован по- следний и единственный сосуди- стый доступ. В таких случаях воз- можно проведение сосудистой ре- конструкции — АВ-шунта в фисту- лу. Несмотря на все трудности, свя-
занные с повторным ангиохирурги- ческим вмешательством на одной анатомической области, порой это единственная возможность форми- рования АВФ на периферических сосудах у больных данной катего- рии. Эта операция имеет и свои не- оспоримые преимущества. За время функционирования АВШ венозный сегмент шунта адаптируется, про- исходит так называемая артериали- зация вены, что в свою очередь значительно сокращает сроки до начала диализа (возможно, через 3—4 дня после операции).
Формирование АВФ на перифери- ческих артериях. Наиболее оптима- льным является формирование АВФ между сосудами предплечья недоминантной конечности. Необ- ходимое условие, которое влияет на качество доступа, — исходное со- стояние сосудов. Как показывают собственный опыт и данные лите- ратуры, сроки и качество функцио- нирования доступа этого типа определяются следующими пара- метрами: диаметр сосудов должен быть не менее 2 мм для артерии и вены: минутный объем (для адек- ватного проведения диализа) по ар- терии — не менее 350 мл. Для опре- деления этих параметров необходи- мо тщательное обследование сосу- дов предплечья с использованием дуплексного сканирования. Арте- риовенозный анастомоз необходи- мо формировать как можно более дистально. Оптимальной является АВФ в так называемой анатомиче- ской табакерке. В этом случае зна- чительно увеличивается (иногда до 1/3) венозный сегмент АВФ. По на- шим наблюдениям, имеется прямая зависимость между длиной веноз- ного сегмента и сроками функцио- нирования фистулы.
При выборе типа сосудистого анастомоза формирование АВФ способом конец в конец является наиболее гемодинамически оправ- данным. Из основных осложнений, встречающихся при данном типе
376
сосудистого доступа, следует отме- тить следующие.
• Тромбоз — наиболее частое осложнение. Следует различать ранний тромбоз (от 1 до 7 сут), ко- торый обусловлен чаще всего тех- ническими погрешностями при формировании доступа (сужение просвета анастомоза или недоста- точный его диаметр, перекрут сосу- дов, наложение анастомоза рядом с венозным клапаном, вследствие чего нарушается гемодинамика в зоне анастомоза или створка клапа- на попадает в сосудистый шов; по- грешности в мобилизации сосу- дов — деформация излишне моби- лизованных сосудов, травматизация сосудов во время мобилизации, ге- матомы в зоне анастомоза и на протяжении венозного сегмента фистулы). Стойкая гипотония и на- личие гиперкоагуляции в послеопе- рационном периоде также нередко приводят к тромбозу артериовеноз- ной фистулы.
До 25 % артериовенозных фистул тромбируются в раннем после- операционном периоде. Частота поздних послеопераци- онных тромбозов обусловлена по- грешностями при эксплуатации фистулы и составляет до 12—15 %.
Кровотечение. Основными при- чинами кровотечений являются не- достаточный гемостаз, повышение артериального давления, гной- но-инфекционные осложнения, не- адекватная гепаринотерапия, гипо- коагуляция. Развитию кровотече- ния может способствовать неадек- ватная мобилизация оперирован- ной конечности в послеоперацион- ном периоде.
Аневризма. Как правило, разви- тие аневризмы в зоне артериове- нозного анастомоза связано с тех- ническими ошибками при форми- ровании доступа: большой диаметр анастомоза, наложение анастомоза отдельными узловыми швами с ис- пользованием рассасывающегося шовного материала, частая пункция
сосуда в одной области. Данное осложнение требует хирургической коррекции доступа: реконструкции анастомоза, резекции аневризмати- чески расширенного сегмента фис- тулы.
Инфекция. Проведение опера- тивных вмешательств сопряжено с высоким риском инфицирования, так как терминальная стадия хро- нической почечной недостаточно- сти характеризуется значительным снижением иммунитета пациента. Гнойно-воспалительные осложне- ния могут составлять до 5 % общего числа первично-формируемых до- ступов. Задача ангиохирурга состо- ит в раннем выявлении этого осложнения, что в дальнейшем по- зволит значительно снизить угрозу аррозивного кровотечения. При развитии кровотечения требуется перевязка сосудов в интактной зоне. С целью профилактики на- гноения необходимо назначение антибиотиков широкого спектра действия в послеоперационном пе- риоде.
Steal-синдром. Развитие этого осложнения обусловлено синдро- мом обкрадывания (steal-синдром) и ишемией дистальных отделов ко- нечности вследствие снижения пер- фузионного давления. Это ослож- нение развивается чаще всего при формировании анастомоза бок в бок. В случаях незначительной вы- раженности специального лечения не требуется. При значительных расстройствах кровообращения в дистальных отделах конечности не- обходима реконструкция анастомо- за (формирование анастомоза ко- нец в конец), что позволяет ликви- дировать явления обкрадывания в конечности.
Формирование АВФ на магистра- льных артериях. У значительного количества больных с терминаль- ной стадией хронической почечной недостаточности использование в качестве АВФ периферических со- судов невозможно вследствие рас-
377
Рис. 3.24. Этапы
формирования арте-
рио-венозной
фистулы.
а
— надсечение сосуда и заведение в
него
катетера;
б — фиксация катетера к сосуду;
в
— выведение катетера на кожу; г —
проек-
ция
хода лучевой артерии и подкожной ве-
ны
и места наложения подкожной фистулы.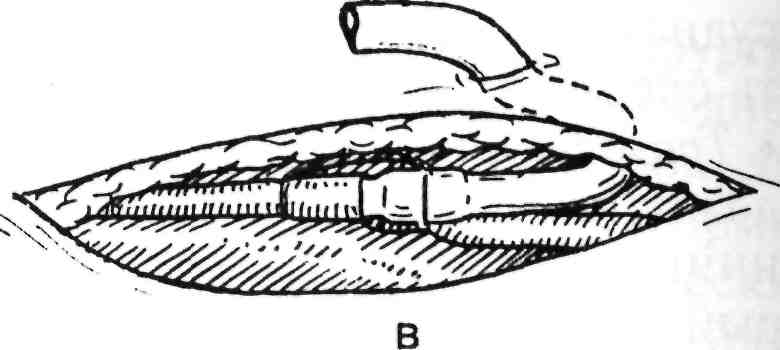
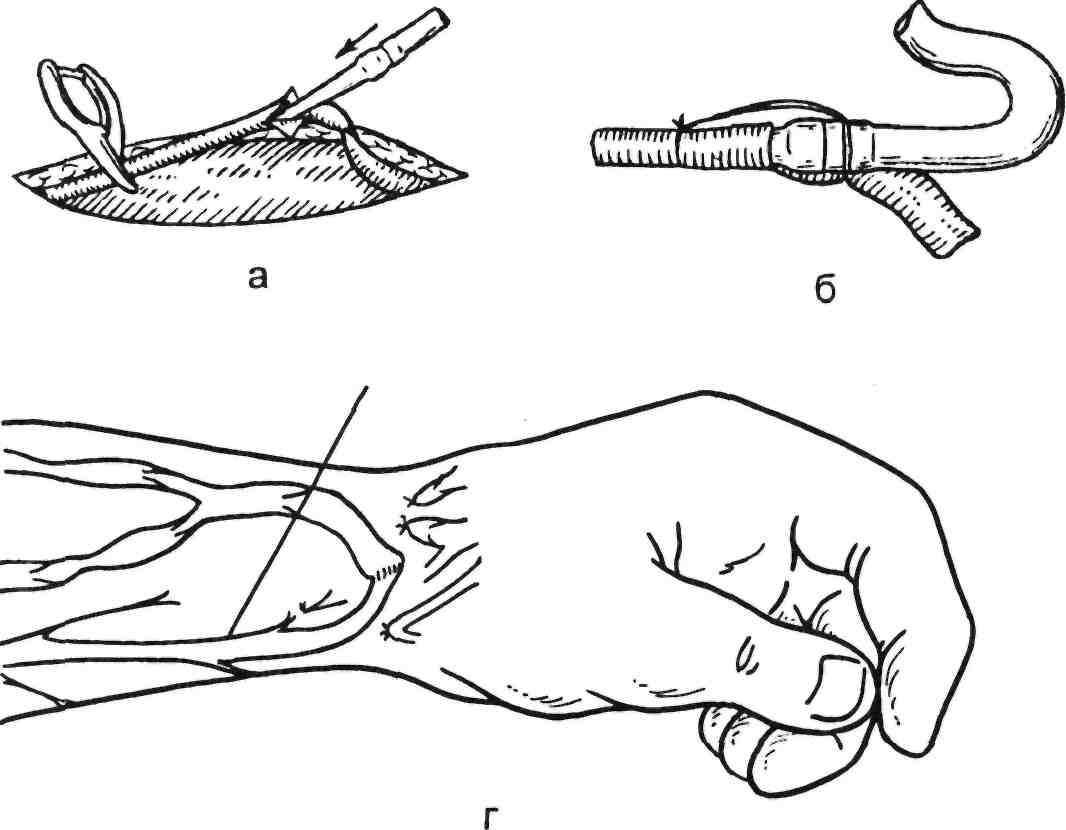
На нижней конечности для этих целей используют большую под- кожную вену, которую выделяют на протяжении (или из отдельных раз- резов) с уровня верхней трети голе- ни. Выделенную вену укладывают подкожно на переднебоковой по- верхности бедра и анастомозируют с поверхностной бедренной арте- рией, анастомозом по типу конец вены в бок артерии.
Еще одним, редко используе- мым, доступом является доступ в виде ожерелья, когда производят забор большой подкожной вены и АВФ формируют между подклю- чичной артерий и веной. Данный способ имеет строго определенные показания и используется при на- личии облитерирующего пораже- ния сосудов нижних конечностей с явлениями выраженной артериаль-
ной недостаточности, а также гной- но-воспалительных процессов ко- нечностей (рис. 3.25).
Функционирование АВФ на ма- гистральных артериях имеет как преимущества (удобство эксплуата- ции и возможность проведения бо- лее адекватного гемодиализа), так и отрицательные стороны. Из отри- цательных моментов следует отме- тить то, что все осложнения, харак- терные для АВФ, на магистральных сосудах более опасны ввиду боль- шего их калибра (от 5 до 15 мм). Поскольку минутный объем крови по магистральной АВФ составляет нередко более 1000 мл, следует бо-
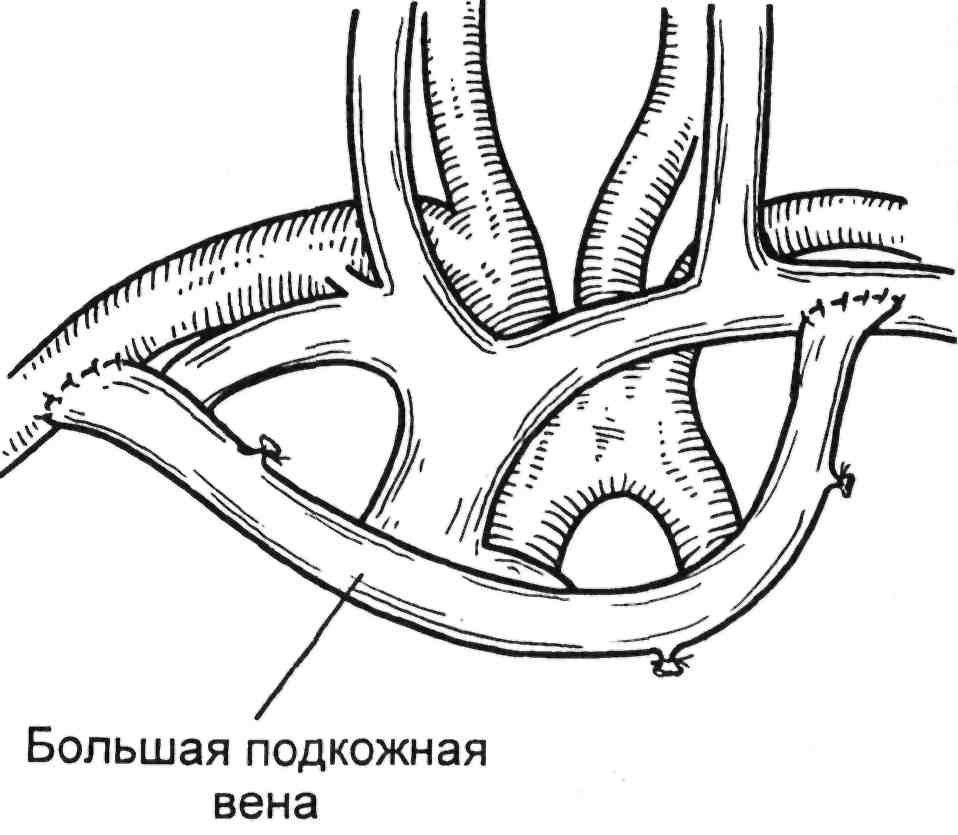
Рис. 3.25. Формирование АВФ. Доступ в виде ожерелья.
378

лее осторожно и взвешенно подхо- дить к решению вопроса о форми- ровании АВФ у больных с сердеч- но-легочной недостаточностью и тем более следует отказаться от формирования у таких пациентов одновременно АВФ и АВ-шунта.
Формирование АВФ с использо- ванием аллопротеза из PTFE. Уве- личение средней продолжительно- сти нахождения пациентов на хро- ническом гемодиализе (до 40— 50 мес) приводит к тому, что неред- ко в процессе лечения собственные сосуды больного становятся недо- ступными для проведения диализа. Частые операции по формирова- нию сосудистого доступа и ослож- нения, возникающие в процессе ле- чения пациента, приводят к воз- никновению так называемого сосу- дистого дефицита вследствие поте- ри этого доступа.
По данным разных авторов, у 5— 12 % пациентов, получающих лече- ние программным гемодиализом, формирование артериовенозного доступа с использованием собст- венных сосудов сопряжено с суще- ственными техническими сложно- стями.
25 лет назад (в 1975 г.) для фор- мирования АВФ предложено ис- пользовать сосудистые аллопротезы (рис. 3.26) из дакрон-велюра, а с 1977 г. для этих целей предложено
применять трансплантаты из по- литетрафторэтилена (PTFE).
Отечественный опыт применения аллопротезов для АВФ ограничен 7—9 годами.
Применение синтетических
трансплантатов позволило значите- льно продлить сроки пребывания больных на программном гемодиа- лизе и реально увеличить продол- жительность жизни таких пациен- тов. Основным и решающим преи- муществом, выгодно отличающим этот тип сосудистого доступа от остальных, является то, что начало (инициализация) диализа возможно в ближайшие послеоперационные часы (30—48 ч), тогда как для АВФ этот срок может достигать несколь- ких месяцев (от 1,5 до 3—4 мес). Необходимо подчеркнуть, что арте- риализованная вена проходит пери- од так называемого созревания, а инициализация диализа через «не- зрелую» АВФ может повлечь раз- личные осложнения и в дальней- шем потерю данного гемодиализно- го сосудистого доступа.
Для формирования АВФ на основе аллопротеза из PTFE пред- почтительно использовать линей- ные сосудистые протезы диаметром 6—7 мм. Сосуды, выбранные для формирования АВФ, должны быть не менее 1/2—1/3 диаметра трансплан- тата (4—5 мм для артерии и не ме-
379
нее 3—4 мм для вены) и иметь ми- нутный объем по артерии не менее 450 мл. С этой целью в предопера- ционном периоде выполняют дуп- лексное сканирование сосудов той конечности, где планируется фор- мирование АВФ. Дистальный ве- нозный анастомоз предпочтительно формировать конец в конец.
Особо тщательно следует отно- ситься к эксплуатации АВФ из PTFE, так как повторную пункцию протеза в одной точке следует про- изводить не ранее чем через 2 нед. Это связано с риском необратимого травмирования протеза (разрыв протеза по перфорационным отвер- стиям с образованием гематомы, ложной аневризмы), что может по- требовать экстренной ангиохирур- гической коррекции доступа. Ми- нимальный срок, необходимый для рассасывания гематомы в области пункции протеза и организации тромба в постинъекционном канале стенки протеза, составляет 2 нед. При частой пункции на одном сег- менте протеза возможна также от- слойка неоинтимы с тромбозом АВФ.
При выборе вида аллопротеза (имеются две модификации PTFE: тонкостенные с толщиной стенок
0,37 мм и стандартная толщина сте- нок — 0,64 мм предпочтение необ- ходимо отдавать стандартным про- тезам, так как, по данным зарубеж- ной литературы, средние сроки функционирования этих протезов на 15—20 % больше. Это объясня- ется тем, что шунты со стандартной толщиной стенок менее подверже- ны механическим повреждениям в процессе гемодиализа.
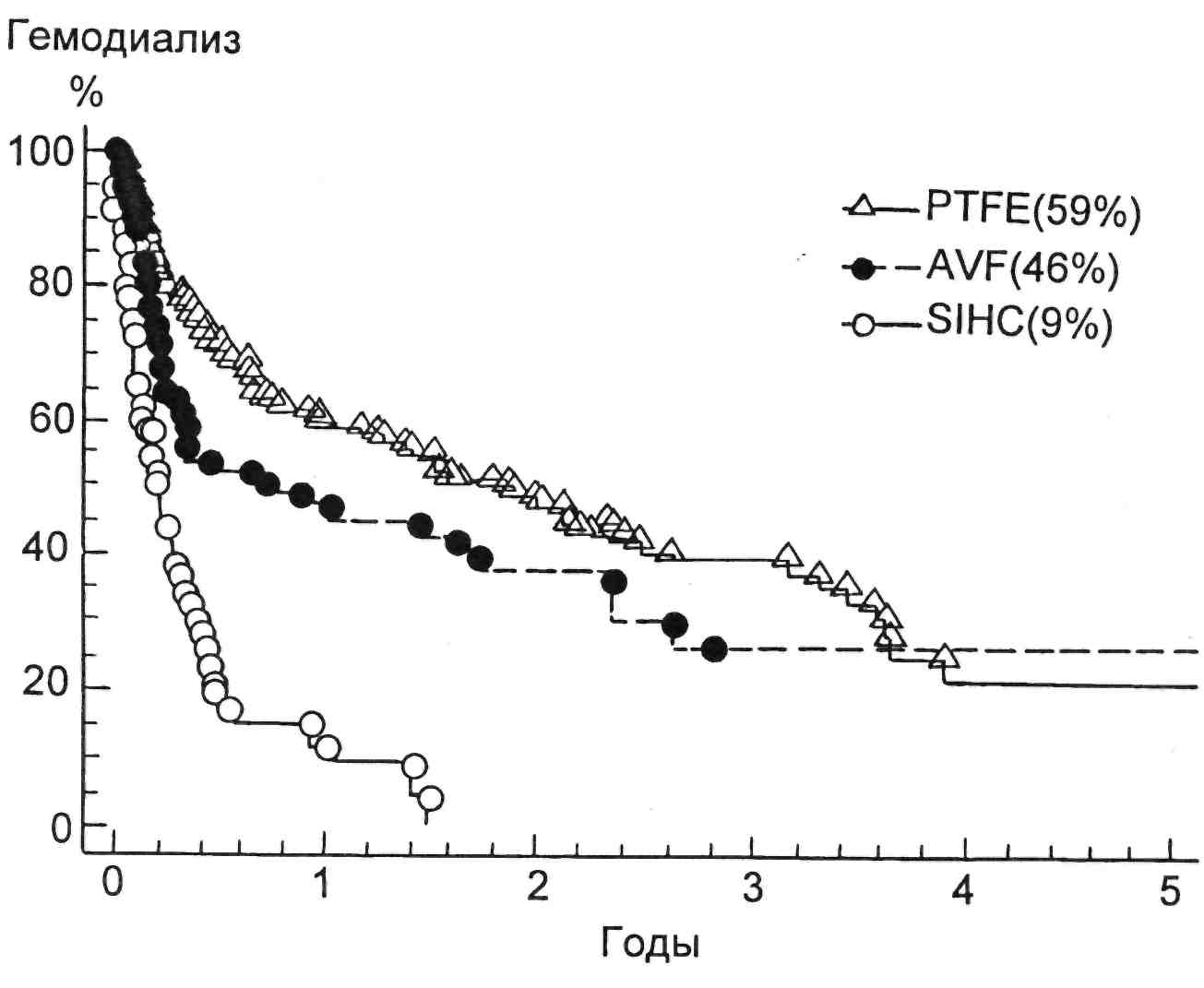
Представляет интерес сравнение сроков функционирования различ- ных типов сосудистых доступов. На рис. 3.27 представлены сроки функ- ционирования различных типов, сосудистых доступов (PTFE — арте- риовенозная фистула на основе ал- лопротеза; AVF — фистула с испо- льзованием собственных сосудов пациента; SIHC — артериовеноз- ный шунт). Из представленной схе- мы видно, что максимальный срок их функционирования составляет 4 года (48 мес) у АВФ; сроки функ- ционирования АВФ из PTFE на 25 % меньше.
Суммируя накопленный опыт в этой области ангиохирургии, мож- но предложить схему для адекват- ного выбора доступа при формиро- вании фистулы у пациентов, нахо- дящихся на диализе (табл. 3.1).
380
Таблица 3.1. Выбор доступа при формировании фистулы
Клейза В.Ю., Дайнис Б.Е. Антиохирурги- ческие аспекты подготовки больного к ге- модиализу. — Вильнюс: Мокслас, 1980.
Munda R., First R., Alexander J. W., Kittur D. Polytetrafluoroethylene graft survival in he- modialysis//J.A.M.A.- 1983.- Vol. 249.- P. 219-222.
Michael В., Silva, Jr. Robert W. et a I. A stra- tegy for increasing use of autogenous hemo- dialysis access procedures: Impact of preope-
rative noninvasive evaluation // J. Vase. Surg. - 1998. - Vol. 27. - P. 301-308.
Barbra J.Lenz, Henry C.Veldenz, Ja- mes W.Dennis et al. A three-year follow-up on standard versus thin wall ePTFE grafts for hemodialysis//!. Vase. Surg. — 1998. — Vol. 28. - P. 464-470.
Timothy C.Hodges, Mark F.Fi I linger, Ro- bert M.Zwolak et al. Longitudinal comparison of dialysis access methods: Risk factors for failure//J. Vase. Surg. - 1997. - Vol. 26. - P. 1009-1019.
3.8. Анестезиологическое обеспечение в сосудистой хирургии
Пожалуй, ни в одной из других хи- рургических дисциплин исход опе- ративного лечения пациентов с вы- соким риском не зависит в такой степени от анестезии и послеопера- ционного ведения, как в сосуди- стой хирургии.
Осложнения и смертность среди пациентов после реконструктивных операций в сосудистой хирургии связаны в первую очередь с мульти- фокальным атеросклеротическим поражением артериального сосуди- стого русла. Так, по данным S.Tar- kan и соавт. (1982), в группе боль- ных с аневризматическим расшире- нием инфраренального отдела аор- ты ИБС выявлена у 65 % больных, артериальная гипертензия — у 37 %, хронические неспецифиче- ские заболевания легких (ХНЗЛ) —
у 27 %, сосудисто-мозговая недо- статочность — у 13 %, сахарный диабет — у 7 %.
