
4 курс / Дерматовенерология / КОЛЛАГЕН_В_КОСМЕТИЧЕСКОЙ_ДЕРМАТОЛОГИИ_
.pdf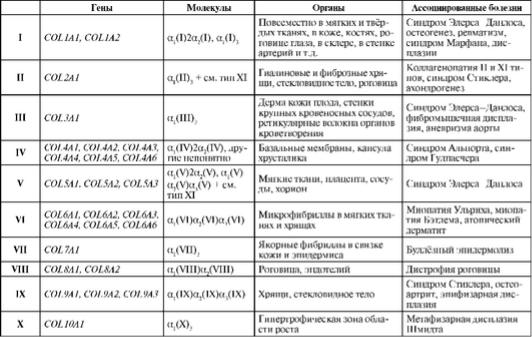
тройной спирали путём вставки/выпадения аминокислоты из полипептидной цепи или замены одного из оснований триплета, кодирующего аминокислоту глицин, другим основанием. Мутации в неколлагеновых доменах могут привести к неправильной пространственной сборке α-цепей в надмолекулярные структуры (фибриллы или сети), что также ведёт к утрате
функций. Мутантные α-цепи способны образовывать трёхспиральный комплекс с нормальными α-цепями. В большинстве случаев такие комплексы нестабильны и быстро разрушаются, однако такая макромолекула может и нормально выполнять свою роль, если не затронуты функционально важные области. Большинство болезней, вызванных мутациями в «коллагеновых» генах, является доминантными (Di Lullo, 2002).
1.2. ПОЛИМОРФИЗМ КОЛЛАГЕНА
В настоящее время описано 28 типов коллагена (см. табл. 1.1). Они отличаются друг от друга по аминокислотной последовательности, а также по степени модификации - интенсивности гидроксилирования или гликозилирования. Главная черта всех макромолекул коллагена - их жёсткая трёхцепочечная спиральная структура. Три первичные полипептидные цепи формируют вначале α-спирали, затем скручиваются в одну спираль и образуют молекулу коллагена длиной около 300 нм и толщиной 1,5 нм. После секреции из аппарата Гольджи в межклеточный матрикс макромолекулы разных коллагенов образуют упорядоченные нитевидные структуры - коллагеновые фибриллы. Фибриллы часто группируются в толстые пучки - коллагеновые волокна.
Таблица 1.1. Типы коллагенов, их гены, локализация коллагенов в тканях и ассоциированные с ними патологии (Северин и др., 2008)
Окончание табл. 1.1
Медицинские книги
@medknigi

Более 90% всего коллагена высших организмов приходится на коллагены I, II, III и IV типов. Коллаген I типа самый типичный. Он является тримерным белком, собирающимся в фибриллы, волокна, пучки и обладающим наибольшей механической прочностью. Коллаген I типа составляет 90% всего коллагена взрослого человека. Молекулы коллагена IV типа формируют сети и являются главными белковыми компонентами базальных мембран (табл. 1.2).
Таблица 1.2. Классификация коллагенов по видам структур, которые они образуют
1.3. СТРУКТУРА КОЛЛАГЕНА
В отличие от глобулярных белков, которые формируют растворимые в воде компактные структуры за счёт упаковки гидрофобных радикалов внутрь молекулы, фибриллярные белки имеют вытянутую, нитевидную структуру. В межклеточном матриксе макромолекулы коллагена образуют фибриллы огромной прочности и практически водонерастворимы и нерастяжимы. По прочности коллагеновые фибриллы превосходят прочность стальной проволоки такого же сечения.
Медицинские книги
@medknigi
Необычные механические свойства коллагенов связаны с их первичной и вторичной пространственной структурой. Молекулы коллагена состоят из трёх полипептидных α-цепей. Идентифицировано более 20 a-цепей, которые включают до 1000 аминокислотных остатков и несколько различаются по аминокислотной последовательности. Каждая третья аминокислота в полипептидной цепи коллагена представлена глицином, примерно 20% аминокислотных остатков составляет пролин или 4-гидроксипролин, около 11% - аланин. Полипептидную цепь коллагена можно представить как последовательность триплетов Гли-Х-Y, где Х и Y могут быть любые аминокислоты, но чаще в положении Х включается пролин, а в положение Y - гидроксипролин или гидроксилизин. В коллагене отсутствует триптофан и цистеин, а тирозин, метионин и гистидин включаются в небольших количествах. (Полная первичная структура цепей была определена К. Кюном в 1979 г.) Благодаря своей структуре пролин вызывает изгибы полипептидной цепи и стабилизирует левозакрученную вторичную спиральную конформацию. На один виток приходится три аминокислотных остатка. Спираль пептидной цепи коллагена стабилизирована силами стерического отталкивания пирролидиновых колец в остатках пролина. Далее спиралевидные полипептидные цепи перевиваются друг около друга, образуют трёхцепочечную правозакрученную суперспиральную макромолекулу, называемую тропокол-лагеном. Цепи удерживаются вместе за счёт водородных связей между аминогруппами и карбоксильными группами входящих аминокислот. Пролин и гидроксипролин, являясь «жёсткими» аминокислотами, ограничивают вращение полипептидного стержня и тем самым увеличивают стабильность тройной спирали. Глицин, имеющий вместо радикала атом водорода, находится в месте пересечения цепей. Отсутствие радикала у глицина позволяет цепям плотно прилегать друг к другу. Два других радикала из триады Гли-Х-Y оказываются на наружной поверхности молекулы тропоколлагена (Северин и др., 2008). Тропоколлаген - основная структурная единица коллагена, имеет молекулярную массу 285 кДа (Овчинников, 1987). Комплементарные участки молекул тропоколлагена могут объединяться и формировать коллагеновые фибриллы (рис. 1.1).
Эти комплементарные участки расположены таким образом, что одна нить тропоколлагена сдвинута по отношению к другой примерно на 1/4 . Поэтому фиксированные и контрастированные фибриллы коллагена при электронной микроскопии выглядят поперечно исчерченными с периодом 67 нм, который включает одну тёмную и одну светлую полоски (см. рис. 1.1). Полагают, что такое строение максимально повышает сопротивление фибрилл растягивающим нагрузкам (Северин и др., 2008).
Между радикалами аминокислот возникают водородные, ионные и гидрофобные связи. Важную роль в формировании коллагеновых фибрилл играет химическая модификация аминокислот, которая осуществляется в составе белков после их синтеза. В результате гидро-ксилирования пролина и лизина образуются 4-гидроксипролин и
Медицинские книги
@medknigi

Рис. 1.1. Электронная микроскопия коллагеновых фибрилл
5-гидроксилизин. Их гидроксильные группы образуют водородные связи между соседними цепями тропоколлагена и укрепляют структуру коллагеновых фибрилл. Дополнительное укрепление формируют радикалы лизина и гидроксилизина путем образования прочных поперечных сшивок между молекулами тропоколлагена. Установлено, что в образовании сшивок участвуют главным образом остатки лизина и гидроксилизина - их ферментативное окисление приводит к образованию альдегидов, которые вступают в реакцию альдольной конденсации или приводят к появлению «шиффовых оснований» (рис. 1.2). В результате аминокислотная последовательность полипептидных цепей коллагена формирует уникальную по механическим свойствам структуру волокон коллагена с огромной прочностью.
Изменения в первичной структуре коллагена в результате генетических мутаций может приводить к развитию наследственных заболеваний и патологий коллагена. Известно более 400 мутаций в генах разных коллагенов, вызывающих болезни соединительных тканей: несовершенный остеогенез, некоторые формы остеопороза и остеоартритов, хондродисплазии и др.
Медицинские книги
@medknigi

Рис. 1.2. Типы ковалентных сшивок в коллагене (Овчинников, 1987)
1.4. ЭТАПЫ СИНТЕЗА И СОЗРЕВАНИЯ КОЛЛАГЕНА
Биосинтез коллагена состоит из восьми (иногда указывают девять) этапов. Пять из них протекают в фибробластах, три - внеклеточно (рис.
1.3). Внутриклеточные этапы
•I - синтез препроколлагена, предшественника коллагена, на полирибосомах, связанных с мембранами эндоплазматического ре-тикулума.
•II - отщепление участка сигнальной пептидной цепи с образованием проколлагена в эндоплазматической сети фибробласта.
• III - гидроксилирование аминокислотных остатков пролина и лизина под влиянием ферментов.
•IV - перенос глюкозы и галактозы на проколлаген с помощью соответствующих ферментов.
•V - формирование растворимого коллагена (тропоколлагена) в виде тройной спирали.
Внеклеточные этапы
•I - секреция тропоколлагена в межклеточную среду и отщепление концевых N- и C-полипептидов.
•II - «сшивание» (самосборка) молекул коллагена «конец-в-конец» с образованием нерастворимого коллагена.
• III - соединение молекул последнего «бок-в-бок» с образованием прочных нерастяжимых фибрилл.
Очень наглядно, в более упрощенном виде, эти этапы синтеза коллагена представлены на рис. 1.4.
Медицинские книги
@medknigi

Рис. 1 .3. Этапы синтеза, химической модификации и самосборки коллагеновых волокон (Хабаров и др., 2014)
Медицинские книги
@medknigi
Рис. 1.4. Основные этапы синтеза коллагена (Овчинников, 1987)
Словами описать основные этапы синтеза коллагена можно следующим образом. Первоначально на рибосомах начинается синтез препроколлагена (предшественника проколлагена), который транспортируется в эндоплазматический ретикулум (ЭПР). В ЭПР происходит его первичная посттрансляционная модификация: гидроксилирование аминокислот пролина и лизина ферментами гидроксилазами. Образовавшиеся в ЭПР молекулы так называемых альфа-пептидов формируют нечто подобное тройным спиралям, которые затем подвергаются гликозилированию - добавлению молекул глюкозы или галактозы к лизиновым остаткам. Следующим этапом является скручивание троек молекул альфа-пептида в устойчивые тройные спирали с образованием проколлагена. Эти спирали упаковываются в специальные транспортные везикулы и транспортируются в аппарат Гольджи для дальнейшей секреции коллагена наружу клетки. Здесь происходит присоединение к проколлагену олигосахаридов, после чего такие молекулярные комплексы упаковываются теперь уже в секреторные везикулы для транспортировки к клеточной мембране и секреции наружу. На наружной поверхности клеточной мембраны их уже ждут ферменты коллагенпепти-дазы, которые удаляют концевые «сигнальные» участки у молекул прокол-лагена. Так образуется тропоколлаген, к которому теперь присоединяются ферменты лизилоксидазы и формируют альдегидные группы на лизиновых остатках. Эта завершающая модификация позволяет создание устойчивых полимерных молекул тропоколлагена. Только теперь образовавшиеся полимерные структуры называются «фибриллами» коллагена.
Определенную роль в синтезе коллагена играют белки-шапероны. Они обеспечивают «контроль качества» - способствуют правильному синтезу полипептидов коллагена, их транспорту по секреторным путям, отслеживают неправильно собранные макромолекулы и их разрушение (Северин и др., 2008). На биосинтез коллагена большое влияние оказывают гормоны надпочечников (глюкокортикоиды), половые гормоны и аскорбиновая кислота(витамин С). Гидроксилирование пролина тормозится при недостатке кислорода, ионов железа и аскорбиновой кислоты. При этом спирали проколлагена не образуются, а при глубоком недостатке витамина С негидроксилированные про- α-цепи расщепляются в клетке, что ведет к хрупкости кожи и кровеносных сосудов в коже - типичные симптомы заболевания цингой. Гидроксилирование остатков лизина играет решающую роль во второй посттрансляционной модификации прокол-лагена. Подобно большинству секретируемых белков, молекулы прокол-лагена гликозилируются в клетке, после чего переходят в межклеточный матрикс путем экзоцитоза. В межклеточном матриксе концевые пептиды проколлагенов I, II и III типов удаляются специфическими ферментами и превращаются, как уже говорилось, в макромолекулы коллагена (тропоколлагена). Последние объединяются в коллагеновые фибриллы за счёт тенденции коллагена к самосборке (см. рис. 1.4).
Последовательные этапы синтеза и формирования структур коллагена суммированы на рис. 1.5.
Медицинские книги
@medknigi

Концевые пептиды проколлагена выполняют две функции. Внутри клетки они направляют построение трёхцепочечной молекулы проколлагена и препятствуют образованию в клетке больших фибрилл, но столь же важно от них избавиться в межклеточном матриксе. При некоторых заболеваниях не происходит полного отщепления концевых полипептидов от проколлагена. В результате нарушается образование коллагеновых фибрилл и кожа становится хрупкой (Албертс и др., 1987).
Рис. 1.5. Последовательные этапы синтеза и самосборки структур коллагена (Албертс и др., 1987): А - структура коллагена; Б - биосинтез коллагена
Медицинские книги
@medknigi
Несколько слов скажем об эластине, являющемся близким аналогом коллагена. Способность эластина к взаимодействию с ГК и коллагеном, обусловленная особенностями структуры эластиновых волокон, определяет основные механофизические характеристики межклеточного матрикса дермы. Белок эластичных волокон в структурном отношении аналогичен коллагену, однако содержит незначительное количество ги-дроксипролина и совсем не имеет гидроксилизина. Хотя белок внеклеточного матрикса соединительной ткани, эластин, составляет около 2% от всех белков дермы, он выполняет уникальную функцию в гомеостазе кожи - поддержание её эластичности (Halper, Kjaer, 2014). У человека эластин кодируется единственным геном ELN на хромосоме 7, содержащим 34 экзона (кодирующих участка) и более 700 некодирующих вставок. При альтернативном сплайсинге в процессе транскрипции меняется взаимное расположение только экзонов 22, 23, 24, 26A, 32 и 33. В зависимости от варианта сплайсинга получаются 11 изоформ белка эластина, каждая с различной способностью вступать в комплексы с другими участниками внеклеточного матрикса (Mouw et al., 2014). Такое сложное строение гена эластина отражает его невысокую генетическую стабильность, различную у каждого человека. Соответственно, качество эластина различается у разных людей (Miao et al., 2017).
Процесс формирования эластина (эластогенез) схематично представлен на рис.
1.6.
В фибробластах дермы мономерные молекулы предшественника, тропоэластина, синтезируются в ЭПР и становятся полностью функциональными, пройдя посттрансляционную модификацию в аппарате Гольджи. Выйдя из клетки, несколько водорастворимых мономеров тропоэластина с молекулярной массой примерно в 70 кДа каждая подвергаются сшивкам с помощью фермента лизилоксидазы LOXL. Связываясь с белком фибулином-5, они формируют аморфный водо-нерастворимый клубок. После связывания десятков таких клубков на матрице микрофибрилл фибриллина новыми сшивками из десмози-на с помощью другой лизилоксидазы получаются волокна полимеров эластина (Jensen, Handford, 2016). В межклеточном матриксе макромолекулы эластина образуют волокна и слои, которые связаны между собой огромным количеством поперечных сшивок и образуют таким образом разветвленную сеть. Такие структуры называются десмозином (рис. 1.7). Именно наличие множества сшивок позволяет волокнам эластина легко деформироваться (растягиваться) и быстро восстанавливать прежнюю форму. Наибольшая концентрация эластина регистрируется в глубоких слоях дермы. В шрамах, особенно от глубоких ран, присутствуют лишь обрывки нормального эластина, что и определяет их жёсткость (Mora-Huertas et al., 2016).
Медицинские книги
@medknigi

Рис. 1.6. Процесс синтеза и формирования эластина (эластогенез) (Aziz et al., 2016). 1 - синтез мономеров в эндоплазматическом ретикулуме с «доводкой» в аппарате Гольджи; 2 - коацервация; 3 - кросслинкинг; 4 - упаковка; IGF-1 - инсулиноподобный фактор роста 1
При снижении эффективности реакций сшивания эластина с образованием десмозина поперечные сшивки образуются в недостаточном количестве, вследствие чего у эластичных тканей снижается предел прочности на разрыв. В коже это проявляется истонченностью, вялостью, растяжимостью, что приводит к потере резиноподобных свойств (Северин, 2006).
С возрастом, начиная в среднем с 30 лет, активность фермента LOXL постепенно снижается и полностью исчезает после 50 лет (Mora-Huertas
Медицинские книги
@medknigi
