
- •Лекция № 2 Химия белков
- •Лекция №3 Физико – химическое свойства белков
- •Лекция №4 Классификация белков. Простые и сложные белки. Нуклеопротеиды. Хромопротеиды.
- •Свойства днк
- •Лекция №5 Сложные белки. Гликопротеиды (углеводнобелковые комплексы), липопротеды (липид-белковые комплексы) и фосфопротеиды.
- •Гликолипиды
- •Строение мембран
- •Белки мембран
- •Общие свойства мембран
- •Функция мембран
- •Лекция 6: Ферменты, их роль в обмене веществ
- •Лекция№7 Механизм ферментативного катализа.
- •Лекция 8 Витамины – как коферменты
- •Лекция 9
- •Лекция 10:
- •Гипофиз,
- •Эндокринные железы
- •Лекция № 12. Биологическое окисление.
- •Лекция 13 Окислительное фосфорилирование. Хемиоосмотическая теория окислительного фосфорилирования
- •Лекция №14 Обмен и функции углеводов. Общая схема источников и путей расходования глюкозы. Анаэробный распад углеводов, судьба молочной кислоты
- •3 Фаза обмена углеводов- Метаболизм.
- •Лекция №15
- •Синтез гликогена
- •Лекция № 16 Прямое окисление углеводов. Нарушения углеводного обмена. Сахарный диабет. Гликогенозы
Сабурова А.М.
Курс лекций по биохимии для студентов ТГМУ имени Абуали ибни Сино
(I семестр)
Лекция №1
Введение в биохимию. Основные цели, задачи и разделы биохимии.
План лекции:
1. Предмет и задачи биохимии.
2.История биохимии
3.Разделы биохимии
Предмет и задачи биохимии, обмен веществ и энергии, структура организация и самовоспроизведение как важнейшие признаки живой материи. Гетеротрофные и аутотрофные организмы: различия по питанию и источникам энергии; катаболизм и анаболизм являются объектами биохимического исследования дисциплин. Важнейшие этапы истории биохимии. Основные разделы и направления в биохимии: биоорганическая химия, динамическая и функциональная биохимия, молекулярная биология. Биохимии и медицина (медицинская биохимия).
Биологическая химия взята от слова bios-жизнь, химия жизни. По классическому определению Ф.Энгельса: «Жизнь это способ существования белковых тел, которое сопровождается обменом». Но жизнь не только- обмен белков, но и обмен нуклеиновых кислот.
Для понимания этих процессов мы должны изучать химическую структуру, строение органических соединении, обмен белков, жиров и углеводов.
Биохимия-это наука изучающая строение, свойства органических молекул белков, жиров, углеводов, нуклеиновых кислот и ряда других соединении и т.е. Химические превращения, которые происходят с этими веществам в живом организме как в здоровом так и при различных заболеваниях.
Задачей биохимии является понимание тех молекулярных механизмов, которые лежат в основе целостности организма и которые нарушаются при патологических состояниях. Целью изучения биохимии является научить студентов овладеть современными методами клинических анализов, чтобы могли провести те или иные биохимические исследования.
Современная биохимия как самостоятельная наука сложилась на рубеже ХIХ и ХХ веков. Ещё в средние века в эпоху господствания алхимии делались тщательные попытки получить химическим путём
« панацею» или лекарство от вех болезней, изготовить «жизненный эликсир» для возвращения молодости, создать живое вещество из золы, и других веществ.
В ХVI-ХVII веках мировоззрения алхимиков получили дальнейшее развитие в трудах ятрохимиков ( ятрос –врач). Одним из представителей ятрохимиков был немецкий врач Парацельс, который выдвинул прогрессивное положение о тесной связи химии с медициной. Однако познание закономерности химических и ферментативных процессов, лежащих в основе жизнедеятельности, оказалось для ятрохимиков непосильной задачей. Это объясняется, прежде всего, отсутствием в то время знаний основных законов физики, химии. Кроме того, ятрохимики, также как и алхимики были метафизиками и придерживались виталистических взглядов.
С середины ХVIII века начинается период нахождения и выделения большого числа новых органических веществ растительного и животного происхождения. Сокрушительный удар по витализму был впервые нанесён работами Вёлера, которому удалось в 1828г. получить химическим путём мочевину - один из конечных продуктов азотистого обмена.
Дальнейший прогресс биохимических знаний привел к выяснению важнейших химических процессов, происходящих в организме растений, животных и человека. Здесь велика роль как отечественных, так и зарубежных биохимиков. А.И. Опарин - основал теория происхождения жизни на земле. Броунштейн - открыл реакцию переаминирования, Ненцкий – синтез мочевины, Лунин- установил существование важных для организма биологически активных веществ, получивших название витамины. Бах, Палладин – основали теорию биологического окисления,
В.А. Энгельгард – основатель процесса окислительного фосфорилирования, которое приводит к накоплению энергии в виде АТФ.
Биологическая химия большими шагами развивается за последние 20-30лет. Достижения биохимии коснулись и самой медицины. В медицине появились термины молекулярные болезни, больные молекулы, генная инженерия и др. Во всем мире в медицине используют различные биохимические препараты, это витамины, гормоны, ферменты.
Крупнейшим достижением последних лет является – это открытия, сделанные А.А. Баевым о строении валин - РНК, за что был удостоен Государственной премии, спириным открыта структура рибосом, Меерсоном описана биохимия сердечной мышцы. А.А. Покровским было много сделано в области биохимия питания.
Огромный вклад в биохимию был внесен и зарубежными учёнными:
определение последовательности аминокислот в белках, раскрытие пространственной структуры белков и нуклеиновых кислот (Сенджер, Чаргофф, Уотсон, Крик), что положило начало новому направлению
в биохимии «молекулярной биологии», расшифровки наследственного кода, заключённого в нуклеиновых кислотах и определяющего синтез белков (Ниренберг).
Для изучения биохимии, её разделяют на:
Статическую биохимию или химическую морфологию, или её называют биоорганической химией, которая изучает химическое строение, состав, структуру, свойства органических молекул нашего организма.
Динамическая биохимия- изучает обменные процессы, происходящие в организме.
Функциональная биохимия или частная биохимия - изучает особенности обмена веществ в различных органах и тканях.
Молекулярная биология, которая отпочковалась в результате открытия последовательности аминокислот в некоторых белках и изучение пространственной конфигурации белка. Она изучает различные биологические явления, связанные с пространственным расположением различных молекул. При появлении «больных» молекул появляются молекулярные болезни, возникают «белки-калеки», приводящие к наследственным заболеваниям (слабоумию, к гемолитической анемии).
Медицинская биохимия или клиническая биохимия-изучает химические процессы, которые возникают при патологических процессах.
Все эти химии неразрывно связаны между собой и являются частями одной и той же науки- современной биохимии. Биохимия тесно связана с любой клинической дисциплиной и необходима для каждой врачебной специальности.
Трудно представить себе врача, который не направлял бы для биохимического анализа тот или иной материал, взятый у больного: кровь, моча, желудочный сок и т.д. Конечно, выбор и направление материала на анализ, оценка результатов, то или иное лечебное вмешательство немыслимо без основательного знания биохимии.
Мы начинаем изучать биохимию со статистики, затем идёт динамическая биохимия. Любой организм находится в состоянии динамического равновесия. Это осуществляется благодаря обмену веществ. Обмен веществ, складывается из двух прямо противоположных процессов: катаболизма и анаболизма. Катаболизм-диссимиляция, распад идёт путём окисления, который сопровождается выделением энергии, накопленной в этих соединениях. Это энергия в организме накапливается в виде особого макроэргического соединения- АТФ.
Одновременно с этим процессом идёт прямо противоположный процесс - синтез крупных сложных органических молекул белков, жиров, углеводов, нуклеиновых кислот, уже специфических для данных тканей, клеток.
Этот процесс синтеза происходит либо из конечных, либо из прочих продуктов катаболизма и называется анаболизм или ассимиляция. Все процессы анаболизма протекают с использованием энергии. Эта так называемые эндэргонические реакции, а реакции катаболизма – экзоэргонические.
Энергия необходимая для процессов анаболизма, поставляется за счёт реакций катаболизма. Здесь можно применить один из законов диалектики – единство противоположностей. Без реакций анаболизма нет реакций катаболизма.
Различают два типа обмена веществ: а) аутотрофные – сами себя питающие (растения и некоторые бактерии). б) гетеротрофные - питающиеся
готовыми продуктами за счёт усвоения сложных структур(животные).
Гетеротрофы делятся на два класса: 1. аэробные – клетки, у которых акцептором является кислород.
2. анаэробы – существующие без кислорода.
Большинство клеток являются факультативными анаэробами, это такие, которые живут без кислорода и с кислородом (напр., мышцы). За свою жизнь человек потребляет 75т Н2О
14т – углеводов
2,5т – белков
1,4т - жиров
Эти процессы распада и синтеза происходят очень быстро. Так в организме за 5 дней распадается и синтезируется половина альбуминов крови. За сутки разрушаются и вновь синтезируются около 30% белков нашего организма. За один месяц происходит обновление всех белков организма. Половина митохондрии печени крыс обновляется за 10 дней. Следовательно, процессы ассимиляции и диссимиляции происходят быстро.
Литература:
А. Основные: 1. Биохимия. Т.Т.Берёзов, Б.Ф.Коровкин. 2010
2. Биохимия. Б.А.Строев. 1986
Б. Дополнительные:
1. Медицинская биохимия. С.М.Рапапорта. 1976
2.Биохимия. Р.Страер. 1985
3.Северин. 2003
Лекция № 2 Химия белков
План:
1. Строение и биологическая роль белков.
2. Cтруктура белка. Виды связей.
3. Способы выделения и очистки белков.
Цель лекции: Сформировать понятие о строение, биологической роли, структуре, видов связей, способов выделения и очистки белков.
70% веса организма приходится на долю Н2О, органических веществ, белков, жиров и углеводов. 50% из них приходится на долю белков. Именно благодаря белкам осуществляется передача информации по наследству.
Белки – протеины ( взято от греческого слова протос – главный, важный). Белки это вещества, состоящие из С,О,Н,N (16%), очень чувствительны к действию любых факторов среды, таких как to, ph – среды, действия кислот и щелочей. Отсюда и применяют к белкам термин специфичность. (Различают видовую, тканевую и клеточную).
 Белки
– это высокомолекуляные азотсодержащие
вещества, состоящие из аминокислот,
которые соединены между собой пептидной
связью. При гидролизе белка мы получаем
аминокислоты. Гидролиз бывает кислотный,
щелочной и ферментативной.
Белки
– это высокомолекуляные азотсодержащие
вещества, состоящие из аминокислот,
которые соединены между собой пептидной
связью. При гидролизе белка мы получаем
аминокислоты. Гидролиз бывает кислотный,
щелочной и ферментативной.
Белок HCl, NaOH аминокислоты.
 фермент
фермент
Какой бы мы белок не взяли для гидролиза, качественно получим перечень 20 аминокислот. В количественном отношении их может быть сотни тысячи, но обязательно разновидность 20 аминокислот. Что же такое аминокислота? Это такие органические кислоты у которых Н радикала замещен на NH2 - группу.
 R
– CH2
– CH – COOH
R
– CH2
– CH – COOH
NН2
Все аминокислоты в организме являются α-аминокислотами, т.е. NH2 находится в α- положении
С – С – С - СООН
β α
Все аминокислоты, за исключением гликокола содержат ассиметричный углеродный атом и поэтому является оптически активными соединениями, т.е. способны вращать плоскость колебаний поляризованного луча.
Оптически активные вещества вращают плоскость поляризации либо
вправо, либо влево. Вещества первой группы называют D-аминокислоты – правовращающие. L-аминокислоты – левовращающие. Физиологическое значение L и D – аминокислот совершенно разные. D – аминокислоты не усваиваются, на вкус сладкие. L- аминокислоты горькие, безвкусные.
Все аминокислоты имеют боковую цепь, ответвляется и записывается в виде R – (радикал). Радикалы могут быть различные, они придают специфичность белкам.
Классификация аминокислот.
В природе встречается всего 20 аминокислот, они делятся на 2 класса:
1. Циклические ароматические, в основе которых лежит кольцо
2. Ациклические. Их разделяют на 3 группы:
1) моноаминомонокарбоновые
NH2 – CH2 – COOH – глицин
CH3 – CH – COOH – аланин
NH2
NH2 – CH – COOH – цистеин
CH2 – SH
 NH2
– CH – COOH
NH2
– CH – COOH
CH2

CH2 – S – CH3 – метионин
2) моноаминодикарбоновые
COOH – CH2– CH - СООН
NH2 аспарагиновая кислота
COOH – CH2– CH2– CH - СООН

NH2 глутаминовая кислота
3) диаминомонокарбоновые
CH2– (CH2)3 – СН - СООН
NH2 NH2 лизин
NH2
C– NH - (CH2)3 – СН - СООН

NH NH2 аргинин
Циклические аминокислоты
 фенилаланин
фенилаланин
 тирозин
тирозин
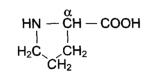 пролин
пролин
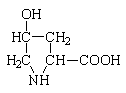 оксипролин
оксипролин
Они входят в состав соединительной ткани (коллагена). По современной классификации аминокислоты делят на 4 класса:
Какие существуют связи в молекуле белка?
1. Пептидная связь [- CO – NH -]
2. Дисульфидная связь – S – S – она очень прочная ковалентная и не
разрушается при кипячении.
3 . Водородная связь С=О --------- Н – N –
4. Гидрофобное взаимодействие
5. Ионные связи, очень лабильные легко рвутся при изменении окружающей среды.
I. Образование пептидной связи H2O
 H2N
– CH2
– COOH + H2N
– CH2
– COOH
H2N
– CH2
– COOH + H2N
– CH2
– COOH
H2N – CH2 –[- CO – NH -] CH2 – COOOH
пептидная связь
Пептидная связь образуется между карбоксильной группой одной аминокислоты и аминогруппой другой аминокислоты. Открывать её можно с помощью биуретовой реакции. Все белки дают положительную биуретовую реакцию.
II. Дисульфидная связь или дисульфидные мостики образуются между двумя серосодержащими аминокислотами, расположенными далеко или рядом стоящими. В инсулине две полипептидные цепочки связаны дисульфидными мостиками. Эта связь участвует в образования вторичной и третичной структуры.
III. Водородная связь возникает, когда Н+ притягивается к соседному атому и его электрическая конфигурация дополняется парой электронов. Самая многочисленная и самая непрочная связь. Участвует в образовании вторичной структуры белка.
IV. Гидрофобное взаимодействие. Полярные группировки лизина – СН2 – (СН2)3 , СН3 – аланина могут соединятся вместе совершают движение, не соединяющие Н2О. Такие группировки находятся внутри молекул. Участвуют в образовании третичной структуры.
V. Ионные связи. Свободные аминогруппы, СООН группы диаминомонокарбоновых и моноаминодикарбоновых аминокислот, ОН, SH легко отдают ион Н и частично в растворе подвергается электролитической диссоциации с образованием ионов.
При этом остатки аминокислот соответственно получают положительный и отрицательный заряд, который и образуют между двумя соседними полипетидами ионную связь.
NH2, COOH, SН2
легко отдают гуанидиновую группировку и аргенина. Между этими двумя группами образуется ионная связь. Она непрочная.
Структура белка
Различают первичную, вторичную, третичную и четвертичную структуру белка. К настоящему времени расшифрована первичная структура десятков тысяч разных белков.
Первичная структура белка – это последовательное расположение аминокислот в полипептидной цепочке и она генетически обусловлена. В белковой молекуле может содержаться несколько полипептидных цепочек, состоящих от 20 до 600 аминокислот.
Сенджером была расшифрована первичная структура гормона инсулина, за что он был удостоен Нобелевской премии. Инсулин состоит из 51 аминокислот, содержит 2 полипептидные цепочки ( в одной 30, в другой 21 – аминокислотных остаток). В инсулине содержится аланина – 4,6% цистина – 12,5% аргинина – 3,1%, глутаминовой кислоты – 17,5%.
Миоглобин состоит из 153 аминокислот. Первичная структура иммуноглобулина, была расшифрована Эдельманом и Портером, который состоит из 1300 аминокислотных остатков, и за это открытие они удостоены Нобелевской премии. В образовании первичной структуры белков участвует пептидная связь.
Первичная структура обуславливает видовую, тканевую специфичность. Если имеется дефект в ДНК в результате мутации генов, то синтезируется белок с измененной первичной структурой. Например, в эритроцитах имеется белок-гемоглобин НВА, при мутации генов разрушается первичная структура, нарушается последовательность амино кислотных остатков и появляется патологический белок – гемоглобин S (HBS), что приводит к развитию серповидноклеточной анемии.
Вторичная структура белка образуется за счет скручивания полипептидной цепочки в α – спираль. Полипептидная цепочка как бы скручена вокруг воображаемого цилиндра в право, потому что все аминокислоты являются L – аминокислотами.
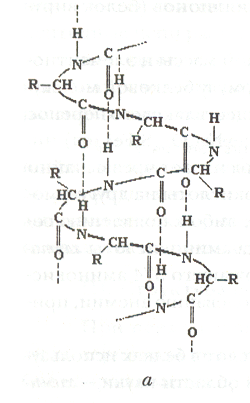 Период
этой спирали состоит из 5 витков и
включает 18 аминокислотных остатков. В
одном витке спирали умещается 3,6
аминокислотных
Период
этой спирали состоит из 5 витков и
включает 18 аминокислотных остатков. В
одном витке спирали умещается 3,6
аминокислотных
остатков, высота одного витка 5,4 Шаг
спирали удерживается за счет водородных связей.
Кроме того могут быть:
1) ионная связь
2) дисульфидная связь
3) гидрофобное взаимодействие, но главная связь - водородная связь.
В некоторых белках может быть складчатая структура, а не α- спираль.

Удерживается эта структура за счет тех же водородных связей.
Эта структура тоже неустойчива. Для того чтобы она была более устойчивой, α – спираль занимает в пространстве определенное положение.
Третичной структурой белка называется структура, возникающая при cкручивания α – спирали в пространстве в виде глобулы или фибриллы.
Третичная структура является более упорядоченной, зависит от первичной структуры.
Виды связей:
водородная
ионная
дисульфидная
гидрофобное взаимодействие.
Загибы и перегибы зависят от того, какие там находятся аминокислотные остатки. В инсулине имеется 3 дисульфидные связи. Per os нельзя употреблять, потому что ферменты разрывают эти связи и структура инсулина разрушается. Биологические свойства белка зависят от третичной структуры.
Четвертичная структура- создается объединением одинаковых белковых частиц, субъединиц, имеющих третичную структуру, по форме в пространстве различают фибриллярные и глобулярные белки. Четвертичную структуру имеет гемоглобин, фермент ЛДГ.
В гемоглобине имеется 4 – полипептидные цепочки : 2α - 2β.
В образовании четвертичной структуры участвуют водородные связи. Миоглобин имеет третичную структуру. От строения белка зависят физико-химические свойства
Литература:
А. Основные: 1. Биохимия. Т.Т.Берёзов, Б.Ф.Коровкин. 2010
2. Биохимия. Б.А.Строев. 1986
Б. Дополнительные:
1. Медицинская биохимия. С.М.Рапапорта. 1976
2. Биохимия. Р.Страер. 1985
3. Северин. 2003
