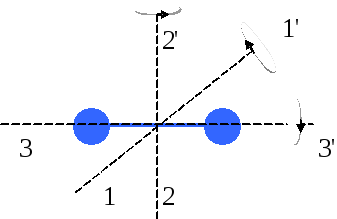
- •7. Абсолютно неупругий удар – это столкновение двух тел, в результате которого тела объединяются и двигаются дальше, как единое целое.
- •8. Работа силы - Количественная характеристика процесса обмена энергией между взаимодействующими телами.
- •1 Джоуль — работа, совершаемая силой, равной 1 н на пути 1 м.
- •Если на тело действуют несколько сил, то сумма работ всех сил равна работе равнодействующей силы.
- •10. Момент инерции — скалярная физическая величина, мера инертности во вращательном движении вокруг оси, подобно тому, как масса тела является мерой его инертности в поступательном движении.
- •14. Удивительные следствия принципа постоянства скорости света часто иллюстрируют на примере пассажира, который едет в вагоне сверхбыстрого поезда.
- •23. Числом степеней свободы называется наименьшее число независимых координат, которое необходимо ввести, чтобы определить положение тела в пространстве. – число степеней свободы.
- •Для молекулы одноатомного газа число степеней свободы .
23. Числом степеней свободы называется наименьшее число независимых координат, которое необходимо ввести, чтобы определить положение тела в пространстве. – число степеней свободы.
Рассмотрим одноатомный
газ.
Молекулу такого газа можно считать
материальной точкой, положение
материальной точки ![]() (рис.
11.1) в пространстве определяется тремя
координатами.
(рис.
11.1) в пространстве определяется тремя
координатами.
Молекула может двигаться в трех направлениях (рис. 11.2).
|
|
Рис. 11.1 |
Рис. 11.2 |
Следовательно, обладает тремя поступательными степенями свободы.
Молекула – материальная точка.
Энергии
вращательного движения ![]() ,
т.к. момент инерции материальной точки
относительно оси, проходящей через
точку равен нулю
,
т.к. момент инерции материальной точки
относительно оси, проходящей через
точку равен нулю ![]()
Для молекулы одноатомного газа число степеней свободы .
Рассмотрим двухатомный газ. В двухатомной молекуле каждый атом принимается за материальную точку и считается, что атомы жёстко связаны между собой, это гантельная модель двухатомной молекулы. Двухатомная жестко связанная молекула (совокупность двух материальных точек, связанных недеформируемой связью), рис. 11.3.
Положение
центра масс молекулы задаётся тремя
координатами, (рис. 11.4) это три степени
свободы, они определяют поступательное
движение молекулы. Но
молекула может совершать и вращательные
движения вокруг осей ![]() и
и![]() ,
это ещё две степени свободы,
определяющиевращение
молекулы.
Вращение молекулы вокруг оси
,
это ещё две степени свободы,
определяющиевращение
молекулы.
Вращение молекулы вокруг оси ![]() невозможно,
т.к. материальные точки не могут вращаться
вокруг оси, проходящей через эти точки.
невозможно,
т.к. материальные точки не могут вращаться
вокруг оси, проходящей через эти точки.
|
|
Рис. 11.3 |
Рис. 11.4 |
Для
молекулы двухатомного газа число
степеней свободы ![]() .
.
Рассмотрим трёхатомный газ. Модель молекулы – три атома (материальные точки), жёстко связанные между собой (рис. 11.5).
Трёхатомная молекула – жестко связанная молекула.
Рис. 11.5 |
Молекула обладает 3 поступательными и 3 вращательными степенями свободы. i = iпоступат + iвращат = 6. |
Для
молекулы трёхатомного газа число
степеней свободы ![]() .
.
Для многоатомной молекулы число степеней свободы .
Для реальных молекул, не обладающих жёсткими связями между атомами, необходимо учитывать также степени свободы колебательного движения, тогда число степеней свободы реальной молекулы равно
i = iпоступат + iвращат.+ iколеб. (11.1)
Закон
о равнораспределении энергии по степеням
свободы утверждает,
если система частиц находится в состоянии
термодинамического равновесия, то
средняя кинетическая энергия хаотического
движения молекул, приходящаяся на 1
степень свободы поступательного
и вращательного движения,
равна ![]()
Следовательно, молекула, имеющая степеней свободы, обладает энергией
![]() ,
(11.2)
,
(11.2)
где ![]() –
постоянная Больцмана;
–
постоянная Больцмана;![]() –
абсолютная температура газа.
–
абсолютная температура газа.
Внутренняя
энергия ![]() идеального
газа –
это сумма кинетических энергий всех
его молекул.
идеального
газа –
это сумма кинетических энергий всех
его молекул.
Находим
внутреннюю энергию ![]() одного
моля идеального газа.
одного
моля идеального газа.![]() ,
где
,
где![]() –
средняя кинетическая энергия одной
молекулы газа,
–
средняя кинетическая энергия одной
молекулы газа,![]() –
число Авогадро (число молекул в одном
моле). Постоянная Больцмана
–
число Авогадро (число молекул в одном
моле). Постоянная Больцмана![]() .
Тогда
.
Тогда
![]() .
.
Если
газ имеет массу ![]() ,
то
,
то![]() –
число молей, где
–
число молей, где ![]() –
масса моля, и внутренняя энергия газа
выражается формулой
–
масса моля, и внутренняя энергия газа
выражается формулой
![]() .
(11.3)
.
(11.3)
Внутренняя энергия идеального газа зависит только от температуры газа. Изменение внутренней энергии идеального газа определяется изменением температуры и не зависит от процесса, при котором это изменение произошло.
Изменение внутренней энергии идеального газа
![]() ,
(11.4)
,
(11.4)
где ![]() –
изменение температуры.
–
изменение температуры.
Закон
равномерного распределения энергии
распространяется на колебательное
движение атомов в молекуле. На колебательную
степень свободы приходится не только
кинетическая энергия, но и потенциальная,
причём среднее значение кинетической
энергии, приходящейся на одну степень
равно среднему значению потенциальной
энергии, приходящемуся на одну степень
свободы и равно ![]()
Следовательно,
если молекула имеет число степеней
свободы i = iпоступат + iвращат + iколеб,
то средняя суммарная энергия молекулы: ![]() ,
а внутренняя энергия газа массы
:
,
а внутренняя энергия газа массы
:
![]() .
(11.5)
.
(11.5)
P=nkT
dA=p*dv
В этом случае работа газа будет определяться площадью криволинейной трапеции.
Проинтегрировав получаем:
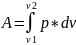
25. В изобарном процессе, предполагающем постоянность значения давления (p=const)(p=const), работа, совершаемая газом, выражается в виде соотношения:
A=p(V2−V1)=pΔVA=p(V2-V1)=p∆V.
Первый закон термодинамики для изобарного процесса дает:
Q=U(T2)−U(T1)+p(V2−V1)=ΔU+pΔVQ=U(T2)-U(T1)+p(V2-V1)=∆U+p∆V.
При изобарном расширении Q>0Q>0 тепло поглощается газом, и он совершает положительную работу. При изобарном сжатии Q<0Q<0 тепло переходит внешним телам. В таком случае A<0A<0. При изобарном сжатии уменьшаются температура газа T2<T1T2<T1 и значение внутренней энергии ΔU<0ΔU<0.
26. В изохорном процессе, то есть в условиях неизменного объема (V=const)(V=const), газ не совершает работы, A=0A=0.
В этом случае справедливой будет формула внутренней энергии газа:
Q=ΔU=U(T2)−U(T1)Q=∆U=U(T2)-U(T1).
В данном выражении U(T1)U(T1) и U(T2)U(T2) представляют внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит лишь от температуры, что исходит из закона Джоуля. При изохорном нагревании газ поглощает тепло (Q>0)(Q>0), чем провоцирует увеличение его внутренней энергии. В условиях охлаждения тепло отдается внешним объектам (Q<0)(Q<0).
27. В изотермическом процессе температура газа не меняет своей величины, следовательно, не изменяется и внутренняя энергия газа, ΔU=0ΔU=0.
Первый закон термодинамики для изотермического процесса выражается соотношением
Q=AQ=A
Теплота QQ, приобретенная газом в процессе изотермического расширения, превращается в работу, совершаемую над внешними объектами. И наоборот, изотермическое сжатие приводит к преобразованию уже работы внешних сил, произведенной над газом, в передающееся окружающим телам тепло.
Вместе с изохорным, изотермическим и изобарным процессами в термодинамике нередко исследуют процессы, происходящие в условиях отсутствующего теплообмена с окружающими объектами.
28. Адиабатическая оболочка – это сосуд с теплонепроницаемыми стенками.
Процессы сжатия или расширения газа в подобных емкостях называют адиабатическими.
В адиабатическом процессе Q=0Q=0. По данной причине первый закон термодинамики принимает вид:
A=–ΔUA=–ΔU.
Выходит, что газ производит работу за счет падения значения его внутренней энергии.
Расширение или сжатие газа на плоскости p, Vp, V проиллюстрирована кривой, называемой адиабатой.
В процессе адиабатического расширения газом совершается положительная работа A>0A>0, что является причиной понижения значения внутренней энергии ΔU<0ΔU<0. Данное явление провоцирует падение его температуры. Исходя из этого, можно заявить, что величина давления газа при адиабатическом расширении понижается быстрее, чем это происходит в изотермическом.
В условиях координат (p, V)(p, V) выводящееся в термодинамике уравнение адиабатического процесса для идеального газа принимает следующий вид:
pVγ=constpVγ=const.
Данное выражение, в котором γ=CpCVγ=CpCV – показатель адиабаты, CpCp и CVCV – теплоемкости газа в процессах с постоянным давлением и с постоянным объемом, называется уравнением Пуассона. В условиях одноатомного газа γ=53=1,67γ=53=1,67, двухатомного γ=75=1,4γ=75=1,4, многоатомного γ=1,33γ=1,33.
Работа газа в адиабатическом процессе выражается через температуры начального T1T1 и конечного T2T2 состояний и принимает вид:
A=CV(T2−T1)A=CV(T2-T1)
Адиабатический процесс относится к изопроцессам.
В термодинамике важное место занимает физическая величина, называемая энтропией. Изменение энтропии в том или ином квазистатическом процессе эквивалентно некоторому обретенному системой теплу ΔQTΔQT. Так как на каждом участке адиабатического процесса ΔQ=0ΔQ=0, энтропия в нем не претерпевает изменений.
Любые изопроцессы, в том числе и адиабатические, являются квазистатическими. Промежуточные состояния газа в таких процессах близки к состояниям термодинамического равновесия. Каждая точка, принадлежащая адиабате, описывает равновесное состояние. Однако, процесс, который проводится в адиабатической оболочке, то есть при отсутствующем теплообмене с окружающими объектами, не обязательно удовлетворяет данному условию.
29. Движение, при котором состояния движущегося тела с течением времени повторяются, причём тело проходит через положение своего устойчивого равновесия поочерёдно в противоположных направлениях, называется механическим колебанием.

Условием возникновения колебания является наличие в системе возвращающей силы, всегда направленной к положению устойчивого равновесия. Каждый законченный цикл колебательного движения, после которого оно вновь повторяется, называется полным колебанием.
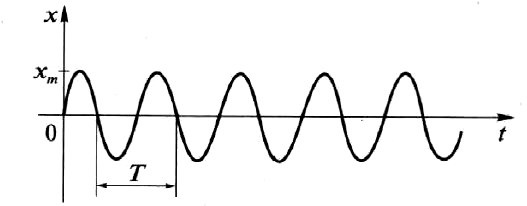
Смещением х называется отклонение колеблющейся точки от положения равновесия в данный момент времени.
Амплитудой колебаний хm называется модуль наибольшего смещения тела от положения равновесия при колебательном движении.
Периодом колебания Т называется время, за которое совершается одно полное колебание: Т = t/N.
Величину,
равную числу колебаний, совершаемых за
единицу времени, называют частотой
колебаний ![]()
Механическое колебание, при котором координата тела меняется по закону синуса или косинуса, называется гармоническим колебанием.
Математическим маятником называют материальную точку, подвешенную на тонкой нерастяжимой нити. Маленький металлический шарик, подвешенный на длинной нити, можно условно считать математическим маятником.
При колебаниях математического маятника (в отсутствие сил трения) выполняется закон сохранения механической энергии и периодически происходит переход потенциальной энергии в кинетическую и обратно.
В положении максимального отклонения от положения равновесия потенциальная энергия маятника максимальна, а кинетическая равна нулю. При приближении к положению равновесия потенциальная энергия уменьшается, а кинетическая увеличивается, достигая максимального значения в положении равновесия, в котором потенциальная становится равной нулю: Wполн = Wп + Wк = const Eполн = Eк max = Еп maх.

Затухающими называются колебания, амплитуда которых уменьшается с течением времени. Затухание свободных механических гармонических колебаний связано с уменьшением механической энергии колебательной системы за счёт работы сил сопротивления (трения).