
книги / Электрохимическая коррозия и защита металлов
..pdfэнергии, чем соединение металла. В результате свободный металл, контактирующий с коррозионно-активной средой (газообразной или жидкой), стремится в энергетически более выгодное состояние с меньшим запасом энергии, т.е. образует соединение, в котором металл находится в ионном состоянии (оксид, соль и т.д.).
Принципиальная возможность (невозможность) самопроизвольного протекания процесса определяется изменением энергии Гиббса
∆G = Gкон – Gисх,
где Gисх и Gкон соответствуют исходному состоянию свободного металла и конечному состоянию продуктов коррозии. Поскольку Gисх
больше Gкон, то ∆G < 0.
Таким образом, первопричиной коррозии металла является термодинамическая неустойчивость металлов в заданной среде. Если же ∆G > 0, то это однозначно указывает на то, что металл в данных условиях не корродирует, он абсолютно устойчив. Термодинамика дает сведения о возможности и невозможности самопроизвольного протекания коррозионного процесса при определенных условиях. Однако термодинамика не дает ответа на весьма важный как с практической, так и с теоретической точки зрения вопрос: с какой скоростью будет протекать термодинамически возможный коррозионный процесс? Рассмотрением этого вопроса, а также установлением влияния различных факторов на скорость коррозии и характер разрушения занимается кинетика (учение о скоростях) коррозионных процессов.
Часто возникают расхождения между термодинамическими данными и данными скоростей коррозии. Так, например, из справочных данных известно, что ∆ GAl(OH)3< ∆ GNaOH , т.е. термодинамическая вероятность перехода Al в Al(OH)3 больше, чем Na в NaOH. Тем не менее алюминий широко используется для конструкций, контактирующих с водой. В то же время натрий бурно (возможно, даже с возгоранием) реагирует с водой. Повышенная устойчивость алюминия в воде (как и в воздухе) обусловлена
11
большим торможением процесса окисления (коррозии) вследствие образования на поверхности алюминия плотного слоя продуктов коррозии, которые тормозят доступ коррозионной среды к поверхности металла.
1.2. Классификация коррозионных процессов
По механизму процесса различают химическую и электрохимическую коррозии металлов. Химическая коррозия — это взаимодействие металла с коррозионной средой, при котором окисление металла и восстановление окислительного компонента среды протекают в одном акте. Так окисляется большинство металлов в газовых средах, содержащих окислители (например, окисление в воздухе при повышенных температурах):
Mg + 0,5O2 = MgO;
4Al + 3O2 = 2Al2O3.
В отличие от химической коррозии, которая обычно протекает в газовой среде, электрохимическая коррозия протекает в электролитах. При электрохимической коррозии ионизация металла и восстановление окислительного компонента среды осуществляются не в одном акте и их скорости зависят от электродного потенциала металла. По такому механизму взаимодействуют металлы с кислотами:
Zn + 2HCl = Zn2+ + 2Cl– + H2 или Zn + 2H+ = Zn2+ + H2.
Эта суммарная реакция состоит из двух актов, пространственно разделенных:
—процесса окисления Zn – 2е– = Zn2+;
—процесса восстановления 2H+ + 2е– = H2.
Посредником переноса электронов для этих электрохимических сопряженных реакций является металлическая поверхность.
По характеру коррозионного разрушения различают общую (сплошную) и местную (локальную) коррозию. Общая (сплошная) коррозия поражает всю поверхность металла (рис. 2). Сплошную коррозию дифференцируют на равномерную, неравномерную и из-
12
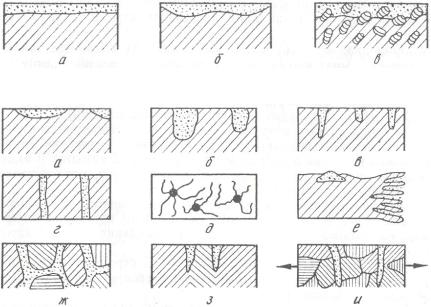
бирательную, при которой коррозионный процесс распространяется по какой-либо структурной составляющей сплава (обесцинкование латуни, графитизация чугуна и т.д.).
Рис. 2. Общая коррозия: а — равномерная; б — неравномерная; в — избирательная
Рис. 3. Местная коррозия
Местная (локальная) коррозия поражает отдельные участки металла. Различают следующие ее разновидности:
— коррозия пятнами (рис. 3, а) — разрушение происходит
ввиде отдельных сравнительно больших пятен (коррозия латуни
вморской воде);
—коррозияязвами(рис. 3, б) — металлпоражаетсякоррозиейввиде отдельныхязв(раковин), этохарактернодлястальныхконструкций;
—точечная или питтинговая (от англ. pit — точка) коррозия
(рис. 3, в) — в виде отдельных точек коррозия поражает аустенитные нержавеющие стали в хлоридных средах. Основная часть поверхности при этом не корродирует;
13
—сквозная коррозия (рис. 3, г) — возникает перфорация, если язвенная или питтинговая коррозия разрушает листовой металл насквозь;
—нитевидная коррозия (рис. 3, д) — разрушение идет в виде нитей обычно под пленками лакокрасочных покрытий;
—подповерхностная коррозия (рис. 3, е) — коррозионный про-
цесс начинается с поверхности, а затем распространяется под поверхностью металла;
—межкристаллитная коррозия (рис. 3, ж) — коррозионный процесс распространяется по границам кристаллов металла. Является наиболее опасным видом коррозии, так как может казаться, что внешний вид поверхности остается без изменений. При этом прочность и пластичность металла резко понижаются. Межкристаллитной коррозии подвержены алюминиевые сплавы, хромоникелевые нержавеющие и углеродистые стали;
—ножевая коррозия (рис. 3, з) — коррозионное поражение возникает в отдельных местах в виде надреза ножом. Надрез располагается параллельно сварному шву оборудования из нержавеющей стали в концентрированной азотной кислоте;
—коррозионное растрескивание (рис. 3, и) — процесс возника-
ет при одновременном воздействии коррозионной среды и растягивающих напряжений. При этом возникает узкая трещина, распространяющаяся по границам зерен или через тело зерна. Является очень опасным видом коррозии, так как происходит разупрочнение высокопрочных сталей.
По условиям протекания коррозии различают следующие виды:
—газовая коррозия — коррозия металлов в газах при высоких температурах. Газовой коррозии подвергается расплавленный металл. При разливе расплава металла, его постепенном остывании, при горячей прокатке, штамповке и т.д. наблюдается интенсивная газовая коррозия;
—атмосферная коррозия — коррозия металлов в атмосфере воздуха, а также любого влажного газа (например, ржавление стальных конструкций в цехе или на открытом воздухе);
14
—жидкостная коррозия — коррозия как в растворах электролитов, так и в неэлектропроводных жидкостях (броме, расплаве серы, жидком топливе и т.д.);
—подземная коррозия — коррозия в почвах и грунтах (например, ржавление подземных стальных трубопроводов);
—биокоррозия — коррозия металлов под влиянием жизнедеятельности микроорганизмов (например, усиление коррозии стали
вгрунтах сульфатредуцирующими бактериями);
—структурная коррозия — коррозия вследствие структурной
неоднородности металла. Например, графит в чугуне, карбиды
всталях способствуют развитию этого вида коррозии в кислотах;
—коррозия внешним током — коррозия под воздействием внешнего источника тока. Примером может служить растворение анодного заземления станции катодной защиты;
—коррозия блуждающими токами — электрохимическая кор-
розия металла (например, подземного трубопровода) под воздействием блуждающего тока под электрифицированными железными дорогами;
—контактная коррозия — электрохимическая коррозия, вызванная контактом металлов, имеющих разные стационарные потенциалы в данном электролите (например, коррозия в морской во-
де деталей из алюминиевых сплавов, находящихся в контакте
смедными деталями);
—щелевая коррозия — коррозия, возникающая в щелях и зазорах между металлами (резьбовые и фланцевые соединения), между металлом и неметаллом вследствие неодинакового доступа кислорода к разным зонам щели или зазора;
—коррозия под напряжением — результат одновременного воздействия коррозионной среды и механических напряжений, как постоянных, так и переменных;
—коррозионная усталость — локализованное в виде трещин разрушение металла при одновременном воздействии коррозионной среды и знакопеременных (или циклических) механических нагрузок;
15
—коррозионное растрескивание — локализованное в виде тре-
щин разрушение металла при одновременном воздействии коррозионной среды и постоянного растягивающего напряжения;
—коррозионная кавитация — следствие одновременного воздействия на поверхность металла коррозионной (жидкой) среды
иударного воздействия схлопывающихся микропустот в жидкости. Этому виду коррозии подвержены быстродвижущиеся в жидкой коррозионной среде лопасти гребных винтов кораблей, направляющие насадки гребных винтов и другие детали;
—коррозия при трении (коррозионная эрозия) — разрушение металла, обусловленное одновременным воздействием коррозионной среды и трения;
—фреттинг-коррозия — коррозия, возникающая при колеба-
тельном перемещении одной поверхности относительно другой в коррозионной среде, например разрушение вибрирующих металлических поверхностей, соединенных болтами, в электролите.
1.3. Показатели, характеризующие коррозию металлов
Скорость коррозии может быть определена по изучению зависимости изменения какого-либо показателя процесса от времени. На практике определяют интегральную скорость процесса за время τ. Наиболее употребительными показателями процесса коррозии являются: массовый, глубинный, объемный, механический, токовый.
Массовый показатель Km± = |
∆ m |
характеризует изменение мас- |
|
S τ |
|||
|
|
сы ∆m образца в результате коррозии, отнесенное к единице поверхности металла S и к единице времени τ (единицы измерения г/(м2·ч)). Этот показатель может быть отрицательным, если масса металла за время испытания после удаления продуктов коррозии уменьшилась. Он может быть и положительным, если масса образца за время испытаний увеличилась.
16
PNRPU
В случае равномерной коррозии металла можно сделать пересчет от отрицательного показателя изменения массы к глубинному показателю (проницаемости) Kп (мм/год):
|
|
Kп= |
Km− |
8,76 |
(1.1) |
||
|
|
|
|
, |
|||
|
|
ρ |
|
||||
|
|
|
|
Me |
|
||
где ρМе — плотность металла, г/см3. |
|
||||||
|
На основе глубинного показателя коррозии разработана десяти- |
||||||
бальная шкала коррозионной стойкости металлов (табл. 1). |
|
||||||
|
|
|
|
|
|
Таблица 1 |
|
|
Шкала коррозионной стойкости (ГОСТ 13819—68) |
|
|||||
|
|
|
|
|
|
||
|
Группа стойкости |
|
|
Скорость коррозии, мм/год |
Балл |
||
1. |
Совершенно стойкие |
|
|
|
<0,001 |
1 |
|
2. |
Весьма стойкие |
|
|
|
0,001–0,005 |
2 |
|
|
|
|
|
|
|
0,005–0,01 |
3 |
|
|
|
|
|
|
|
|
3. |
Стойкие |
|
|
|
|
0,01–0,05 |
4 |
|
|
|
|
|
|
0,05–0,1 |
5 |
|
|
|
|
|
|
|
|
4. |
Пониженностойкие |
|
|
|
|
0,1–0,5 |
6 |
|
|
|
|
|
|
0,5–1,0 |
7 |
|
|
|
|
|
|
|
|
5. |
Малостойкие |
|
|
|
|
1,0–5,0 |
8 |
|
|
|
|
|
|
5,0–10,0 |
9 |
|
|
|
|
|
|
|
|
6. |
Нестойкие |
|
|
|
>10,0 |
10 |
|
На основе закона Фарадея можно установить связь между токовым показателем i (А/см2) и показателем изменения массы
Km− (г/(м2·ч)):
i=K m− ·nF/AMe·104= K m− ·(n/AMe)·2,68·10–3, |
(1.2) |
где n — валентность иона металла, переходящего в раствор; F — постоянная Фарадея, F = 26,8 А·ч/г-экв; AMe — атомная масса металла.
Механический показатель Kм — изменение какого-либо показателя механических свойств металла за время коррозии τ. Сравни-
17
тельно часто пользуются изменением предела прочности. Прочностной показатель за время τ
Kσ=(∆σв/σв0)·100 %, |
(1.3) |
где ∆σв — изменение временного сопротивления разрыву (предела прочности при растяжении) после коррозии образца в течение времени τ; σв0 — предел прочности при растяжении образца до коррозии.
Существует также показатель изменения электрического со-
противления, применяемый при исследовании коррозии тонкого листового материала
KR=(R1–R0)/R0,
где R0 и R1 — электрическое сопротивление образца соответственно до и после коррозии в течение времени τ.
18
2.ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ МЕТАЛЛОВ
2.1.Основные сопряженные процессы электрохимической коррозии
Электрохимическая коррозия является наиболее распространенным типом коррозии металлов. По электрохимическому механизму корродируют металлы в контакте с растворами электролитов (морская вода, растворы кислот, щелочей, солей, расплавы солей и щелочей). В атмосфере и в земле коррозия также протекает электрохимически, так как на поверхности металлов имеется пленка влаги с растворенными компонентами воздуха и земли.
Все коррозионные процессы протекают с уменьшением свободной энергии и потому совершаются самопроизвольно. Однако в практическом отношении более существенно установление не принципиальной возможности коррозии, а ее скорости в заданных условиях. Учение о коррозии металлов в качестве основной задачи ставит определение скорости коррозии и влияющих на нее факторов.
В отличие от растворения солей в воде металлы в растворах электролитов растворяются по электрохимическому механизму. Различие в растворении солей и металлов было отмечено М.В. Ломоносовым в 1750 г. Однако гипотезу об электрохимическом механизме растворения металлов впервые выдвинул швейцарский ученый А. де-ля Рив лишь в 1830 г. Де-ля Рив обратил внимание на то, что скорость растворения цинка возрастает с увеличением в нем примесей. Он предположил, что между цинком и его примесями возникает множество миниатюрных гальванических элементов. Эта идея была зарегистрирована в качестве открытия. Идея де-ля Рива, к сожалению, скоро и надолго была забыта. Лишь в начале двадцатого столетия она становится общепризнанной, получив надежное экспериментальное подтверждение. Именно с этого периода приня-
19
то вести отсчет развития учения о коррозии металлов как научного направления.
При электрохимической коррозии протекают по крайней мере две сопряженные электрохимические реакции, которые пространственно разделены:
— анодный процесс ионизации металла с высвобождением электронов:
Ме – ne → Men+;
— катодный процесс восстановления окислительного компонента среды, идущий с ассимиляцией (поглощением) электронов:
Ох + ne → Red,
где Ox — окислительный компонент среды (окисленная форма); Red — восстановленная форма.
В качестве окислительного компонента среды часто выступают О2, растворенный в воде, водных растворах солей и щелочей, и ионы гидроксония Н3О+ (или упрощенно Н+) в растворах кислот.
В вышеуказанных реакциях участвуют электроны, поэтому в отличие от химических реакций электрохимические процессы зависят не только от концентрации реагирующих веществ, но и, главным образом, от потенциала поверхности металла. От потенциала зависят как процесс окисления металла, так и процесс восстановления окислителя. В связи с этим возникает необходимость рассмотреть вкратце сведения о природе возникновения скачка потенциала на границе металл—раствор, дать понятие электродного потенциала (термодинамической характеристики) и затронуть вопрос о поляризации электродов (кинетической характеристике).
2.2. Межфазная разность потенциалов
На границе Ме—раствор протекают процессы переноса заряда из одной фазы в другую (ионизация металла: Ме → Ме+ + е или разряд ионов металла: Ме+ + е → Ме). Кроме того, молекулы растворителя адсорбируются ориентированно полярными концами к поверхности металла (специфическая адсорбция). Поэтому в боль-
20
