- •Шкала эм волн. Система уравнений Максвелла (дифф. И интег. Формы)
- •Волновое уравнение (лекция 2).
- •Плоская электромагнитная волна. (лекция 2).
- •Энергия электромагнитных волн. Вектор Пойнтинга. (лекция 2)
- •Импульс электромагнитного поля. (лекция 2)
- •Отражение и преломление электромагнитных волн (лекция 2)
- •Стоячие волны. (лекция 3)
- •Волновые пакеты. Фазовая и групповая скорость. (лекция 3)
- •Интерференция волн, излучаемых двумя точечными источниками.
- •Основные свойства света.
- •Когерентность. (лекция 4)
- •Способы наблюдения интерференции ( кольца Ньютона, просветление оптики, плоско- параллельная пластинка). (лекция 4)
- •Отражение от тонких пластинок:
- •Кольца Ньютона
- •Явление дифракции. Принцип Гюйгенса-Френеля (лекция 4)
- •Зоны Френеля. (лекция 5)
- •Дифракция Френеля от простейших преград (диск, отверстие). (лекция 5)
- •Дифракция от диска
- •Дифракция Фраунгофера от щели. (лекция 5)
- •Поляризация электромагнитных волн, Естественный и поляризованный свет. (лекция 3_6)
- •Степень поляризации. Закон Малюса. (лекция 3_6)
- •Поляризация при отражении и преломлении. Закон Брюстера. (лекция 3_6)
- •Полное внутреннее отражение. Световод. (лекция 3_6)
- •Поляризация при двойном лучепреломлении. (лекция 3_6)
- •Основные характеристики спектральных приборов. (лекция 3_6)
- •Абсолютно черное тело. Закон Кирхгофа. (лекция 6)
- •Закон Стефана — Больцмана. Закон Вина. (лекция 6)
- •Оптическая пирометрия. (лекция 7)
- •Формула Редея - Джинса. (лекция 7)
- •Формула Планка. (лекция 7)
- •Фотон как частица. (лекция 8)
- •Давление света. (лекция 8)
- •Внешний фотоэффект. (лекция 8)
- •Эффект Комптона. (лекция 8)
- •Волновые свойства частиц. Волна де Бройля. Опыт Дэвиса и Джермера. (лекция 9)
- •Вероятностный характер волн де Бройля.
- •Принцип неопределенности Гейзенберга. (лекция 10)
- •Оценки характеристик микрочастиц с помощью соотношения неопределенностей. (лек 10)
- •Уравнение Шредингера.
- •Простейшие задачи квантовой механики (потенциальная яма с бесконечно высокими стенками) (лекция 11).
- •Простейшие задачи квантовой механики (потенциальный барьер) (лекция 11).
- •Квантовый гармонический осциллятор (лекция 12).
- •Атом водорода по Бору (лекция 12).
- •Опыт Франка и Герца. Доказательство справедливости теории Бора.
- •Атом водорода в квантовой механике.
- •Орбитальный угловой и магнитный момент электрона в атоме (лекция 13).
- •Классификация состояний электронов в атоме (лекция 13).
- •Экспериментальное определение магнитных моментов. Спин электрона (лекция 14).
-
Атом водорода в квантовой механике.
Потенциальная энергия электрона в атоме водорода определятся соотношением:
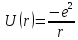 ,
Гауссова система единиц.
,
Гауссова система единиц.
![]() ,
СИ.
,
СИ.
С учетом уравнений Шредингера уравнение (1) принимает вид:
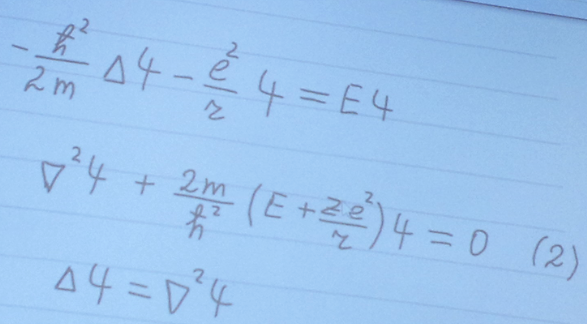
Выражение (1) сферически симметрично, поэтому естественно искать решения уравнения (2) в сферической системе координат. В этом случае волновая функция зависит от все трех сферических переменных:
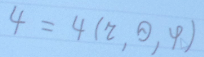
Энергия. В теории дифференциальных уравнений доказывается, что уравнения типа (2) имеют решения, удовлетворяющие требованиям однозначности, конечности и непрерывности волновой функции Ψ, только при собственных значениях энергии
 (n
= 1,
2, 3,…), (3) т. е. для дискретною набора
отрицательных значений энергии.
(n
= 1,
2, 3,…), (3) т. е. для дискретною набора
отрицательных значений энергии.
-
Орбитальный угловой и магнитный момент электрона в атоме (лекция 13).
Под угловым моментом понимается механический момент импульса электрона в атоме. Магнитный момент электрона аналогичен магнитному моменту элементарного кругового тока. Между ними в квантовом физике, как и в классической имеется прямая связь. Пусть электрон вращается по круговой орбите радиусом r. Под механическим моментом электрона в этом случае понимается выражение:

Момент
кругового тока в разделе электромагнетизма
мы обозначали Pm.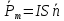
Магнитным момент в гауссовой системе единиц применительно к вращающемуся электрону в атоме определяется соотношением:

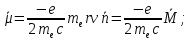
Знак "-" говорит о разной направленности векторов орбитального магнитного и углового моментов, а коэффициент в (5) называется гиромагнитным.

Введем
также проекцию углового момента М на
ост OZ – Mz:

Естественным
будет требование что:
 (9)
(9)
(9) определяет допустимые значения m.
m и l - квантовые числа, которые определяют квантование проекции углового момента на ось OZ и квантование самого углового момента.
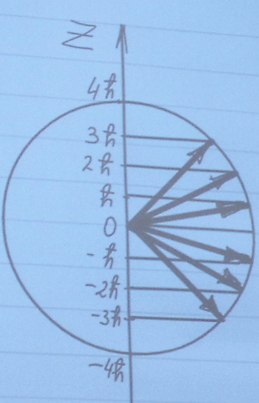
M2 и Mz могут 6ыт определены одновременно (они не подчиняются принципу неопределённости) и их задание полностью определяет вращательное состояние частицы.
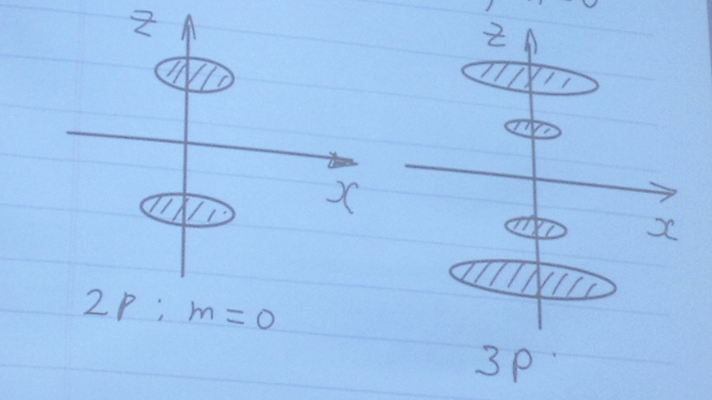
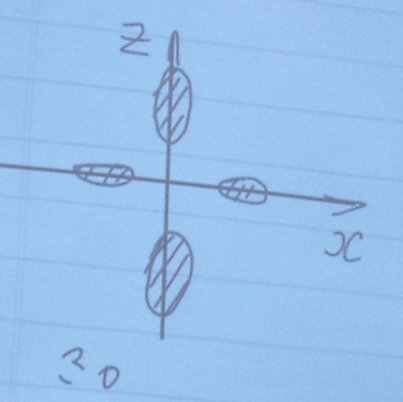
Итак, величина M2 задается квантовым числом l, и ему отвечает (2l + 1) значения Mz. Выбрав в пространстве ось OZ (произвольно), можно проиллюстрировать это утверждение на рисунке для l = 3.
-
Классификация состояний электронов в атоме (лекция 13).
Электроны атома движутся в центральном электрическом поле и могут обладать как нулевым, так и ненулевым угловым моментом, причём угловой момент и его проекция квантуются. Но правилам (7) и (8). Кроме того, энергия электрона определяется квантовым числом n, причём можно показать, что n > 1. Итак имеются три квантовых числа, описывающих состояние электрона в атоме:
n – главное квантовое число, n = 1,2,3,…
l – орбитальное квантовое число, l = 0,1,2,…n-1
m – магнитное квантовое число, m = 0,+-1,+-2,…+-l
Главное квантовое число определяет энергию уровней:

Магнитное квантовое число определяет проекцию углового момента на ось OZ:
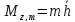
Если теперь учесть, что при каждом l‚ электрон может находиться в состояниях с (2l +l) значениями m, то число состояния с разными l и m на уровне, характеризуемом главным квантовым числом n, равно:
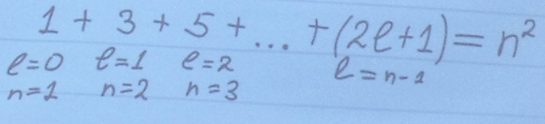
В атомной физике применяются заимствованные из спектроскопии условные обозначения состояний электрона с различным значением момента импульса.
l = 0 S – состояние;
l = 1 P – состояние;
l = 2 d – состояние;
l = 3 f – состояние.
Итак, в атоме водорода возможны следующие состояния: