
-
, То и , тогда
Вывод: Линейные размеры тела максимальны в той ИСО, относительно которой тело покоится.
Промежуток времени между события (длительность событий)
Пусть в системе К¢ в одной и той же точке (х2¢=х1¢=х¢) происходит некое событие длительностью t¢ = t2¢ - t1¢.
t¢ - собственное время
Найдем длительность t этого события в системе K:

Используем
обратные преобразования времени.
Релятивистское изменение промежутков времени.
Вывод:

-
И , то , тогда - классическая физика
-
И чем больше скорость u, тем
-
Неподвижному наблюдателю процессы в движущейся со кажутся замедленными.
23. Релятивистский закон сложения скоростей.
Релятивистский закон сложения скоростей.
Запишем преобразования Лоренца в дифференциалах:

dy = dy¢
dz = dz¢

Разделим
dx,
dy
и
dz
на
dt:



Получаем:
Релятивистская
теорема о сложении скоростей:
Следствия:

-
Если , тогда получаем - классический закон сложения скоростей
-
Пусть частица (фотон, нейтрино) движется в СО К¢ со скоростью

Если частица движется относительно ИСО со скоростью света с, то относительно любой другой ИСО она также движется со скоростью с, что подтверждает 2-ой постулат СТО.
24. Релятивистская динамика.
Релятивистская динамика.
Масса.
m ¹ const m0 – масса покоя
m – релятивистская масса (масса движущегося тела)
u – скорость частицы


Вывод: Масса одной и той же частицы различна в разных инерциальных системах отсчета.
Из принципа относительности Эйнштейна следует, что математическая запись любого закона физики должна быть одинаковой во всех ИСО, т.е. следует условие инвариантности уравнений физических законов относительно преобразований Лоренца.
Основной закон классической динамики Ньютона для материальной точки:


в
котором масса m
точки считается постоянной и одинаковой
во всех ИСО. Данное уравнение оказывается
неинвариантным к преобразованиям
Лоренца. Следовательно, эта запись
закона не может служить основой
релятивистской динамики.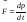
Вторая запись основного закона динамики Ньютона:
оказывается инвариантной по отношению к преобразованиям Лоренца, если в нем справа стоит производная по времени от релятивистского импульса.
Основной закон релятивистской динамики материальной точки имеет вид:



релятивистский импульс м.т.

Следует учитывать, что ни импульс, ни сила в СТО не являются инвариантными величинами. В общем случае движения м.т. ее ускорение может не совпадать с направлением силы действующей на эту м.т.
В релятивистской механике в силу однородности пространства выполняется закон сохранения релятивистского импульса: релятивистский импульс в замкнутой системы сохраняется, т.е. не изменяется с течением времени.
Примечание: для тел движущихся со скоростями, близкими к скорости света с, необходимо использовать только релятивистское выражение для импульса.
Следствия:
1°
при , ;

2°
при
масса m
неограниченно возрастает.
Со
скоростью движутся частицы,
масса покоя которых m0 = 0.
Для других тел , . 


3°
при
, основной закон релятивистской динамики
переходит во второй закон Ньютона.
Следовательно, законы классической
механики получаются как следствие
теории относительности для предельного
случая . 

Закон взаимосвязи массы и энергии.
Уравнение
используется при изучении
строения атома и в ядерной физике, при
ознакомлении с устройством и работой
ядерных энергетических установок. 
Следует отметить, что именно на основании этой формулы было установлено существование огромных запасов ядерной энергии и намечены пути ее «высвобождения».
АЛЬБЕРТ ЭЙНШТЕЙН:
(1879 — 1955) — один из основателей современной теоретической физики, лауреат Нобелевской премии по физики 1921 года. Он разработал несколько значительных физических теорий:
СТО (1905). В её рамках — закон взаимосвязи массы и энергии
Общая теория относительности (1907-1916)
Квантовая теория фотоэффекта и теплоемкости и т.д.
E0 = m0c2 - энергия покоя тела.
Wk = E – E0 – кинетическая энергия тела.


Релятивистская кинетическая энергия.
Рассмотрим движение со скоростями u0 << c.
Используем известное из математики приближение:



Вывод:
При движении с малыми скоростями (u0 << c) формулы релятивистской механики переходят в формулы классической механики. Таким образом, классическая механика является частным случаем релятивистской механики.
Возведем в квадрат выражение E = mc2:

Извлечем квадратный
корень:
Связь полной энергии с релятивистским импульсом:
Инвариантные и неинвариантные величины в СТО.
|
Неинвариантные |
Инвариантные |
|
|
25. Основные положения МКТ. Основное уравнение МКТ.
Методы изучения основ молекулярной физики и термодинамики.
Термодинамические параметры.
Молекулярная физика – это раздел физической науки, в котором рассматриваются зависимости агрегатных состояний и свойств тел от их строения, взаимодействия между частицами, из которых состоят тела, и характера движения частиц.
Термодинамика – это раздел физики, изучающий общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями.
Термодинамика не рассматривает процессы, которые лежат в основе этих превращений.
Молекулярная физика и термодинамика изучают макроскопические процессы в телах (системах), связанные с огромным числом содержащихся в них атомов и молекул.
Для исследования макроскопических процессов применяют два взаимно дополняющих друг друга метода: статистический (молекулярно-кинетический) и термодинамический.
Статистический метод лежит в основе молекулярной физики.
Термодинамический метод лежит в основе термодинамики.
В основе статистического метода лежит рассмотрение микроскопического строения системы, анализ свойств и движения отдельных частиц, рассмотрение «механизма» явлений. Статистический метод основан на использовании теории вероятностей и определенных моделей строения изучаемых систем. В совокупном поведении большого числа частиц, координаты и импульсы которых случайны в любой момент времени, проявляются особые статистические закономерности. Важной задачей статистического метода является нахождение средних и наиболее вероятных значений величин, характеризующих движение частиц системы, поскольку между этими величинами и макроскопическими свойствами системы существует прямая связь.
Термодинамический метод не рассматривает внутреннее строение изучаемых тел (систем) и характер движения отдельных их частиц. Термодинамический метод основан на анализе условий и количественных соотношений при различных превращениях энергии, происходящих в системе. Соотношения между разными видами энергии позволяют изучить физические свойства исследуемых систем при самых разнообразных процессах, в которых эти системы участвуют.
В основе термодинамики лежат два опытных закона: первое и второе начала термодинамики, а также на тепловой теореме Нернста (третье начало термодинамики).
Опытно установлено, что макроскопические системы обладают такими свойствами, каких нет у отдельных частиц. Так, любое макроскопическое тело (система) характеризуется температурой. К отдельным частицам понятие температуры не применимо. Это свидетельствует о том, что законы движения для большой группы частиц не сводятся к законам движения отдельных частиц. Движение большой совокупности частиц является качественно новой по сравнению с механической формой движения и подчиняется не динамическим, а статистическим закономерностям.
Термодинамической системой называется мысленно выделенная макроскопическая система, рассматриваемая методами термодинамики.
Все тела, не включенные в состав термодинамической системы называются внешними телами или внешней средой.
Обмен энергией и веществом может происходить как внутри самой системы между ее частями, так и между системой и внешней средой.
В зависимости от возможных способов изоляции от внешней среды различают следующие виды термодинамических систем:
1. Открытая;
2. Закрытая;
3. Изолированная;
4. Замкнутая;
5. Адиабатическая.
замкнутая; адиабатическая.
Открытой термодинамической системой называется система, которая может обмениваться веществом с внешней средой.
Закрытая термодинамическая система не можем обмениваться веществом с внешней средой.
Изолированная термодинамическая система не может обмениваться с внешней средой ни энергией, ни веществом.
Замкнутая термодинамическая система – это система, которая изолирована в механическом отношении от окружающей среды, т.е. она не способна к обмену энергией с внешней средой путем совершения работы.
Адиабатной термодинамической системой называется система, если она не может обмениваться с внешней средой энергией путем теплообмена.
Термодинамическими параметрами (параметрами состояния) называются физические величины, служащие для характеристики состояния термодинамической системы.
Параметры состояния системы разделяются на внешние и внутренние.
Внешними параметрами системы называются физические величины, зависящие от положения в пространстве и различных свойств тел, которые являются внешними по отношению к данной системе. Например: объем; площадь внешней поверхности системы; напряженность электрического поля, индукция магнитного поля и т.д.
Внутренними параметрами системы называются физические величины, зависящие как от положения внешних по отношению к системе тел, так и от координат и скоростей частиц, образующих данную систему. Например: давление; температура, плотность, концентрация, внутренняя энергия и т.д.
Термодинамическое состояние системы может быть равновесным и неравновесным.
Состояние макроскопической системы называется равновесным, если все характеризующие ее параметры во всех участках системы остаются неизменными сколь угодно долго.
Равновесное термодинамическое состояние – это состояние, к которому система приходит самопроизвольно, если ее изолировать от внешней среды или поместить в среду с неизменными внешними параметрами.
Состояние системы называется неравновесным, если оно без всякого воздействия извне самопроизвольно изменяется со временем.
В неравновесном состоянии всем или некоторым параметрам системы нельзя приписать определенные значения.
Любое изменение термодинамического состояния системы называется термодинамическим процессом.
Различают равновесные и неравновесные процессы.
Термодинамический процесс называется равновесным, если в этом процессе система проходит непрерывный ряд бесконечно близких термодинамически равновесных состояний.
Процесс, состоящий из последовательности неравновесных состояний, называется неравновесным.
Реальные процесс изменения состояния системы всегда происходят с конечной скоростью и поэтому не могут быть равновесными. Однако, реальный процесс изменения состояния системы будет тем ближе к равновесному, чем медленнее он совершается, поэтому такие равновесные процессы называются квазистатическими.
Равновесный процесс – это абстракция.
В термодинамике изучаются следующие термодинамические процессы: изотермический, изобарический, изохорический и адиабатический.
Основными термодинамическими параметрами термодинамической системы являются: давление, объем (удельный объем) и температура.
Давление
р
– СФВ,
характеризующая распределение силы по
поверхности, равная проекции силы на
направление нормали к площадке, на
которую сила действует, и отнесенная к
единице этой площади.
При
равномерном распределении силы по
поверхности давление равно: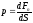
При неравномерном распределении силы давление равно:
Объем V – это область пространства, занимаемая телом (системой).
Удельным
объемом системы
называют скалярную физическую величину
u,
равную отношению объема системы к ее
массе.
Размерность удельного объема [u]=1 м3/кг.
Температура Т термодинамической системы, находящейся равновесном состоянии, является мерой интенсивности теплового движения атомов, молекул или других частиц, образующих эту систему.
Температура характеризует степень нагретости тела.
Различают термодинамическую (абсолютную) температуру Т и температуру Цельсия t°.

Размерность термодинамической температуры [T] =1 К.
1 К = 1 °С
Т
= 0 К – абсолютный
ноль температуры,
или нулем
по термодинамической шкале температур:
k=1,38∙10-23
Дж/К –
постоянная Больцмана. 

Все тела состоят из атомов, молекул или ионов, находящихся в непрерывном тепловом движении.
Теория строения вещества базирующаяся на этих представлениях, называется молекулярно-кинетической теорией (МКТ).
Газ, поведение которого описывается законом Бойля-Мариотта называется идеальным газом.
Идеальный газ обладает следующими свойствами:
1°. Его молекулы – это гладкие шарики. Взаимодействие между молекулами настолько мало, что им пренебрегают.
2°. Размер молекул настолько мал, что его в расчетах не учитывают.
3°. Взаимодействие молекул происходит по законам классической механики, в момент их непосредственного соприкосновения, как удары абсолютно упругих шаров. Удары молекул обуславливают давление газа на стенку сосуда, в котором он заключен.
В основе молекулярно-кинетической теории лежат три основных положения:
-
Все тела состоят из частиц (молекул, атомов и ионов).
Тепловое движение молекул в жидкости.

Тепловое движение молекул в газе.

Тепловое движение атомов в твердых телах.
-
Частицы непрерывно и беспорядочно движутся.

3. Частицы взаимодействуют друг с другом.
Подтверждение основных положений:
-
Диффузия;
-
Испарение жидкости;
-
Делимость тел;
-
Возникновение сил упругости;
-
Броуновское движение.
Броуновское движение – это тепловое движение мельчайших микроскопических частиц, взвешенных в жидкости или газе.
Основное уравнение МКТ.
Основное
уравнение МКТ связывает между собой
макроскопические и микроскопические
параметры.
- основное уравнение МКТ
Макроскопические параметры – это параметры, которые характеризуют данную термодинамическую систему (давление р и концентрация n).
Концентрация
– эта скалярная физическая величина,
которая показывает какое число молекул
находится в единице объема термодинамической
системы.
Микроскопические
параметры
– это параметры, которые характеризуют
отдельную частицу
(атом, молекулу) данной
термодинамической системы (средняя
квадратичная скорость движения
молекул газа, масса m0
молекулы газа, кинетическая энергия Wk
молекулы газа).
Вывод основного уравнения МКТ.

Рассмотрим одноатомный идеальный газ, находящийся в термодинамическом равновесии.
Молекулы газа движутся хаотически, число столкновений между молекулами очень мало. Соударения молекул со стенками сосуда являются абсолютно упругими.
Выделим
на стенке сосуда элементарную площадку
и вычислим давление, оказываемое
молекулами на эту площадку. При каждом
соударении молекула, двигаясь
перпендикулярно площадке молекула
передает ей импульс:
где
m0
– масса молекулы, а υ
– ее скорость. За время Δt
площадки S
достигнут только те молекулы, которые
заключены в объеме цилиндра с основанием
S
и высотой υΔt.
Число этих молекул равно:
n – концентрация молекул.
Необходимо учитывать, что молекулы движутся к площадке S под разными углами и имеют различные скорости, причем скорость молекул при каждом соударении меняется.
Для
упрощения расчетов хаотическое движение
молекул заменим движением вдоль трех
взаимно перпендикулярных направлений,
так что вдоль каждого направления
движется молекул, причем половина
из них, т.е. молекул, движется
вдоль выбранного положительного
направления, а другая – вдоль отрицательного
направления.

Число
ударов молекул, движущихся в заданном
направлении, о площадку S
будет равно: 
При столкновении с площадкой эти молекулы передадут ей импульс:

Тогда давление газа, оказываемое на стенку сосуда будет равно:
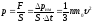
С
учетом , основное
уравнение МКТ имеет вид: 

26.Уравнение состояния идеального газа. Газовые законы.
Уравнение состояния идеального газа.
Зависимость давления газа от температуры.





Концентрация молекул газа:


NA = 6,022·1023 моль-1 – постоянная Авогадро
R = kNA = 8,31 Дж/(моль·К) - молярная газовая постоянная
Основное уравнение состояния идеального газа (уравнение Клапейрона- Мендлеева)

Следствиями основного уравнения состояния ИГ являются ГАЗОВЫЕ ЗАКОНЫ
Изопроцесс в ИГ – это процесс, происходящий с газом постоянной массы (m = const), при котором один из параметров состояния (p, V или T) остается неизменным.
Изотермический процесс.
Изотермический
процесс – процесс,
при котором масса и температура газа
остаются постоянными.
m,
T = const

Закон
Бойля – Мариотта:
Если
в ходе процесса масса и температура ИГ
не изменяются, то произведение давления
газа на его объем есть величина постоянная.


Изобарический процесс.
Изобарический процесс – процесс, при котором масса и давление газа остаются постоянными. m, p = const
Закон
Гей-Люссака:
Если в ходе процесса давление и масса ИГ не изменяются, то отношение объема газа к его абсолютной температуре есть величина постоянная.


Изохорический закон.
Изохорический
процесс - процесс,
при котором масса и объем газа остаются
постоянными.
m,
V = const

Закон
Шарля:
Если в ходе процесса объем и масса ИГ не изменяются, то отношение давления к его абсолютной температуре есть величина постоянная.


Объеденный
газовый закон.
Пусть m = const, а p, V и T изменяются:

Объединенный газовый закон (уравнение Клапейрона):
Закон
Авогадро.
Пусть для двух разных газов: p1 = p2; T1 = T2; V1 = V2
Закон Авогадро:
Моли
любых газов при одинаковых температуре
и давлении занимают одинаковые объемы.
При нормальных условиях этот объем
равен: 


следовательно
N1
= N2

Одинаковые объемы двух разных газов, находящихся при одинаковых условиях, содержат одно и то же число частиц.
Закон Дальтона.
Пусть имеется механическая смесь газов
NS = N1 + N2 + … + Nn
N
= nV

p = nkT, отсюда

Закон
Дальтона:
Давление механической смеси газов равно сумме парциальных давлений входящих в нее газов.
Парциальное давление газа – это давление, которое бы оказывал только данный газ, если бы других газов в сосуде не было.






27.Распределение Максвелла. Характерные скорости молекул.
Распределение молекул идеального газа по скоростям (распределение Максвелла).
Молекулы газа движутся хаотично с разными скоростями. Для практических целей необходимо оценить долю молекул, обладающих той или иной скоростью. Эту оценку можно сделать, используя аппарат теории вероятности и математической статистики.
Математической
вероятностью P
некоторого
случайного события называется предел
отношения числа случаев Δn,
благоприятных данному событию к числу
всех возможных случаев n,
при стремлении последних к бесконечности:
Математическая вероятность заключена в интервале 0 ≤ P ≤ 1.
dP = f(u)du – вероятность попадания скорости в диапазон от u до u + du (u Î [u , u + du])
Функция
плотности вероятности или функцией
распределения вероятностей:
Распределение молекул по скоростям.
Пусть имеется n тождественных молекул, находящихся в состоянии беспорядочного теплового движения при определенной температуре. После каждого столкновения между молекулами, их скорости меняются случайным образом. В результате очень большого числа столкновений устанавливается стационарное равновесное состояние, когда число молекул в заданном интервале скоростей остается постоянным.
В результате каждого столкновения проекции скорости молекулы испытывают случайное изменение на Δux, Δuy, Δuz, причем изменения каждой проекции скорости независимы друг от друга. Предположим, что силовые поля на частицы не действуют. Найдем в этих условиях, какое число частиц dN из общего числа N имеет скорость в интервале от u до u+Δu. При этом мы не можем ничего определенного сказать о точном значении скорости той или иной частицы ui, поскольку за столкновениями и движениями каждой из молекул невозможно проследить ни на опыте, ни в теории. Вряд ли такая детальная информация имела бы практическую ценность.
Распределение молекул идеального газа по скоростям впервые было получено знаменитым английским ученым Дж. Максвеллом в 1860 году с помощью методов теории вероятностей.
Максвелл
теоретически вывел формулу
распределения молекул по скоростям:


DN = P(u)N – число молекул, скорости которых лежат в интервале скоростей от u до u + du;
N – общее число молекул газа.


условие нормировки плотности вероятности:
Наиболее
вероятная скорость
uв
молекул (вероятнейшая скорость) – это
скорость, вблизи которой лежат скорости
наибольшего числа молекул.
Исследуем функцию f(u) на экстремум:





R = kNA.
Молекулярные скорости.
В
молекулярной физике используют следующие
скорости движения молекул:

Средняя арифметическая скорость молекул:
Среднюю
арифметическую скорость можно найти,
используя закон распределения молекул
по скоростям: 
Подставив
выражение для функции Максвелла и
проинтегрировав, получим:

Среднее значение квадрата скорости молекул газа:

Средняя квадратическая скорость молекул газа:

Подставив f(u), проинтегрировав и извлекая корень, получим:

Все
три скорости незначительно отличаются
друг от друга множителем порядка единицы,
причем:

Формула Максвелла для относительных скоростей.
Для решения многих задач удобно использовать формулу Максвелла, где скорость выражена в относительных единицах. Такая скорость называется относительной.
Относительная
скорость –
это скорость, характеризующаяся
отношением средней арифметической
скорости к наивероятнейшей. 
Относительную скорость обозначим через u:
Тогда
получим 
Это уравнение универсальное. В таком виде функция распределения молекул по скоростям не зависит ни от рода газа, ни от температуры.
Формулы
распределения молекул по импульсам и
кинетическим энергиям имеют схожий вид
с формулой распределения по скоростям.
Распределение молекул по импульсам:
Распределение
молекул по кинетическим энергиям
поступательного движения:
Зависимость функции распределения Максвелла от температуры газа.

На рисунке показана зависимость f(υ) при различных температурах T1<T2<T3 (при m=const). С увеличением температуры газа максимум кривой смещается в сторону больших скоростей, а его абсолютная величина уменьшается. Следовательно, при нагревании газа доля молекул, обладающих малыми скоростями, уменьшается, а доля молекул с большими скоростями увеличивается.
Площадь под кривой величина постоянная, равная единице (f(υ)=const=1).
Максвелловский закон распределения по скорости и все вытекающие следствия из него справедливы только для газа в равновесной системы. Это закон статистический, и выполняется тем лучше, чем больше число молекул.
Опыт Штерна.
Опыт Штерна — опыт, впервые проведённый немецким физиком Отто Штерном в 1920 году. Опыт явился одним из первых практических доказательств состоятельности молекулярно-кинетической теории строения вещества. В нём были непосредственно измерены скорости теплового движения молекул и подтверждено наличие распределения молекул газов по скоростям.
Для проведения опыта Штерном был подготовлен прибор, состоящий из двух цилиндров разного радиуса, ось которых совпадала и на ней располагалась платиновая проволока с нанесённым слоем серебра. В пространстве внутри цилиндров посредством непрерывной откачки воздуха поддерживалось достаточно низкое давление. При пропускании электрического тока через проволоку достигалась температура плавления серебра, из-за чего атомы начинали испаряться и летели к внутренней поверхности малого цилиндра равномерно и прямолинейно со скоростью υ, соответствующей подаваемому на концы нити напряжению. Во внутреннем цилиндре была проделана узкая щель, через которую атомы могли беспрепятственно пролетать далее. Стенки цилиндров специально охлаждались, что способствовало «оседанию» попадающих на них атомов. В таком состоянии на внутренней поверхности большого цилиндра образовывалась достаточно чёткая узкая полоса серебряного налёта, расположенная прямо напротив щели малого цилиндра.

Затем
всю систему начинали вращать с некой
достаточно большой угловой скоростью
ω.
При этом полоса налёта смещалась в
сторону, противоположенную направлению
вращения, и теряла чёткость. Измерив
смещение s
наиболее
тёмной части полосы от её положения,
когда система покоилась, Штерн определил
время полёта, через которое нашёл
скорость движения молекул:



Опыт Ламмерта.
Прямые измерения скорости атомов ртути в пучке были выполнены Ламмертом в 1929 году.

Упрощенная схема опыта Ламмерта:
1 - быстро вращающиеся диски,
2 - узкие щели,
3 - печь,
4 - коллиматор,
5 - траектория молекул,
6 - детектор
Два диска 1, насаженные на общую ось, имели радиальные прорези 2, сдвинутые друг относительно друга на угол φ. Напротив щелей находилась печь 3, в которой нагревался до высокой температуры легкоплавкий металл. Разогретые атомы металла, в данном случае ртути, вылетали из печи и с помощью коллиматора 4 направлялись в необходимом направлении. Наличие двух щелей в коллиматоре обеспечивало движение частиц между дисками по прямолинейной траектории 5, параллельной их оси. Атомы, прошедшие через прорези в дисках, регистрировались с помощью детектора 6. Вся установка помещалась в глубокий вакуум.
При
вращении дисков с постоянной угловой
скоростью ω,
через их прорези беспрепятственно
проходили только атомы, имевшие скорость
υ:
где L- расстояние между вращающимися дисками.
Опыт Эстермана.
Несколько иначе был организован эксперимент по определению распределения по скоростям для атомов цезия, выполненный в 1947 году немецким физиком-экспериментатором Иммануэлем Эстерманом (1900 - 1973) совместно с О. Симпсоном и Штерном.
На рисунке приведено схематическое изображение опыта Эстермана. Пучок атомов цезия вылетал через отверстие в печи 1 с некоторой скоростью v и под действием силы тяжести начинал двигаться по параболе. Атомы, прошедшие через узкую щель в диафрагме 2, улавливались детектором 3, который можно было располагать на различных высотах h.
Величина отклонения h пучка в гравитационном поле Земли зависела от скорости атома. В этих опытах отклонение h составляло величину порядка нескольких долей миллиметра при расстоянии L от печи до детектора равном 2 метрам. Перемещая датчик и регистрируя количество атомов цезия, попадающих в детектор за единицу времени, можно было построить зависимость интенсивности пучка от величины h. Последующий пересчет, с учетом известной зависимости высоты h от скорости атома υ, давал распределение по скоростям атомов цезия.

Схема опыта Эстермана:
1 – печь;
2 - диафрагма с узкой щелью;
3 – детектор.
Все проведенные эксперименты подтвердили справедливость полученного Максвеллом распределения по скоростям для атомных и молекулярных пучков.
28. Барометрическая формула. Распределения Больцмана.
Распределение Больцмана.
Предположим, что на систему не действуют внешние силы и она находится в состоянии термодинамического равновесия, то концентрация микрочастиц будет одинакова во всех точках системы: n(x, y, z)=const. В случае, когда на микрочастицы системы воздействует внешнее силовое поле, например, гравитационное, то их концентрация становится различной в разных точках пространства. При этом состояние термодинамического равновесия также должно сохраняться.
Идеальный газ во внешнем гравитационном поле.
Пусть ИГ находится во внешнем гравитационном поле (в поле силы тяжести Земли). При нахождении концентрации молекул газа n(x, y, z) в этом поле будем исходить из предположения, что любой бесконечно малый объем газа находится в состоянии механического равновесия, а температура газа T во всех точках одинакова. Только при выполнении этих условий состояние газа можно считать равновесным, так как иначе в газе возникли бы потоки вещества и теплоты, что сделало бы состояние газа неравновесным.
Поле силы тяжести Земли будем считать однородным. Ось OZ направлена вертикально вверх. Тогда концентрация молекул газа будет зависеть только от координаты z (высоты h): n=n(z) или n=n(h). На рис. (1) схематически изображен бесконечно малый выделенный объем газа dV=dSdz, находящийся в равновесии.
Снизу
на этот выделенный объем газа воздействует
давление p,
а сверху – соответственно давление
p+dp.
Разность давлений на нижнее и верхнее
основание выделенного объема газа
dV=dSdz
равна гидростатическому давлению: 
где:
r=(Mp)/(RT)
– плотность газа, g
– ускорение свободного падения, M
– молярная масса газа.
Отсюда

Подставим
в полученное выражения плотность газа:


Из этого
уравнения следует, что
Интегрирование
последнего уравнения при условии
позволяет определить
зависимость давления от высоты:
где p0
- давление газа на высоте, принятой
за начало отсчета.
С учетом формулы для постоянной Больцмана:
и того, что М = m0NA и z = h
Барометрическая
формула: 
Барометрическая формула позволяет рассчитывать зависимость давления атмосферы от высоты в случае, если температура атмосферы постоянна, а гравитационное поле - однородно. Для реальной атмосферы Земли на высотах примерно до 10 км её температура уменьшается в среднем на 6 К на 1 км подъема. Далее до высот порядка 20 км температура остается практически постоянной, а выше - постепенно возрастает до ~ 270 К на высоте около 55 км. На этой высоте давление атмосферы становится уже меньше 0,001 от атмосферного давления на уровне моря.
Несмотря на указанную зависимость температуры атмосферы Земли от высоты, барометрическая формула позволяет достаточно точно определять высоту по результатам измерения давления, что нашло применение в приборах, предназначенных для определения высоты полета самолетов.

Распределение Больцмана было получено в 1866 году Л. Больцманом. Это распределение позволяет рассчитывать концентрацию газа, находящегося в равновесном состоянии во внешнем силовом поле. Причем это поле не должно быть обязательно гравитационным, а может иметь любое происхождение, в частности, быть электростатическим или полем сил инерции.
Анализ распределения Больцмана показывает, что концентрация молекул газа тем выше, чем меньше их потенциальная энергия. Кроме этого, с понижением температуры увеличивается отличие концентраций в точках с различными значениями потенциальной энергии молекул. А при стремлении температуры к абсолютному нулю, молекулы начинают скапливаться в месте, где их потенциальная энергия принимает наименьшее значение. Указанные особенности распределения Больцмана являются следствием теплового движения молекул, так как кинетическая энергия их поступательного движения в среднем равна Wк=(3/2)kT и уменьшается пропорционально уменьшению температуры. А уменьшение кинетической энергии приводит к уменьшению количества молекул, способных преодолеть потенциальный порог, высота которого характеризуется величиной потенциальной энергии высотой Wp.
Опыт Перрена.
Распределение Больцмана было использовано французским физиком Жаном Батистом Перреном (1870–1942) при экспериментальном определения постоянной Больцмана k и постоянной Авогадро NA.
В
работах, выполненных Перреном в 1908-1911
гг., измерялось распределение концентрации
микроскопических частиц во внешнем
гравитационном поле. Отметим, что
совокупность микрочастиц, находящихся
во взвешенном состоянии в жидкости,
близка по своей молекулярно-кинетической
структуре к идеальному газу и может
описываться газовыми законами. Это дает
возможность при определении распределения
микрочастиц во внешнем силовом поле
использовать формулу Больцмана.
Исследуя
в микроскоп броуновское движение, Ж.
Перрен убедился, что броуновские частицы
распределяются по высоте подобно
молекулам газа в поле тяготения. Применив
к этим частицам больцмановское
распределение, можно записать: 
где m – масса частицы,
m1 – масса вытесненной ею жидкости;
m=4/3πr3ρ, m1= 4/3πr3ρ1
(r
– радиус частицы, ρ
– плотность частицы, ρ1
–
плотность жидкости).

Если n1 и n2 – концентрации частиц на уровнях h1 и h2,

Значение NA, получаемое из работ Ж. Перрена, соответствовало значениям, полученным в других опытах. Это подтверждает применимость к броуновским частицам распределения Больцмана.

Статистика Максвелла–Больцмана.
Полученные
распределения Больцмана и Максвелла
позволяют определить соответственно
зависимость концентрации молекул от
координат n(x,
y,
z)
и функцию
распределения по скоростям f(υx,
υy,
υz).
При этом распределение Больцмана
описывается в пространстве координат
x,
y
и z,
а распределение Максвелла в пространстве
скоростей υx,
υy,
υz.
Если
ввести 6-мерное пространство, координатами
молекулы в котором являются величины
x, y,
z, υx,
υy,
υz,
то функция распределения в таком
пространстве будет зависеть от этих
шести переменных: nf(x,
y, z,
υx,
υy,
υz).
Считая пространственные переменные x,
y, z
и компоненты скорости υx,
υy,
υz
статистически независимыми друг
от друга, можно записать:
nf(x, y, z, υx, υy, υz)=n(x, y, z)f(υx, υy, υz) или

где выражение для кинетической энергии имеет вид:
Формула (1) описывает распределение, называющееся распределением Максвелла-Больцмана. Она может быть использована в случае, когда полная энергия молекулы равна сумме её потенциальной энергий во внешнем силовом поле и кинетической энергии её поступательного движения: W=Wp+Wк.
29. Средняя длина свободного пробега. Явление диффузии.
Среднее число столкновений и средняя длина свободного пробега.
Конечные размеры молекул их огромная концентрация в газах при обычных условиях приводят к тому, что молекулы непрерывно сталкиваются друг с другом. Между двумя последовательными столкновениями молекулы движутся равномерно и прямолинейно.
Расстояние λ, которое проходит молекула за время свободного пробега от одного столкновения до следующего называется длиной свободного пробега.
Эти расстояния различны, так как в молекулярной физике имеем дело с огромным числом молекул и они находятся в беспорядочном движении, то можно говорить о средней длине свободного пробега молекул <λ>.
Для вычисления длины свободного пробега примем определенную модель молекул газа. Будем считать, что молекулы представляют собой шарики диаметром d порядка 10-10 м, зависящие от химической природы газа. Минимальное расстояние, на которое сближаются при столкновении центры двух молекул, называется эффективным диаметром молекулы d (рис.1).

Рассчитаем среднее число столкновений <z>, которое испытывает молекула за единицу времени при своем движении в однородном газе.
Так за 1 с молекула проходит путь, равный средней арифметической скорости <υарф>, и если <z> – среднее число столкновений, испытываемых одной молекулой газа за 1 с, то средняя длина свободного пробега:

Для определения <z> представим себе молекулу в виде шарика диаметром d, которая движется среди других «застывших» молекул, со скоростью равной средней арифметической скорости <υарф>.
При своем движении молекула будет сталкиваться со всеми молекулами газа, центры которых отстоят от траектории движения ее центра на расстояниях меньших или равных диаметру молекулы d, т.е. лежат внутри «ломанного» цилиндра радиусом d (рис.2). За единицу времени рассматриваемая молекула столкнется со всеми частицами, центры которых лежат внутри этого цилиндра.

Среднее
число столкновений за 1 с равно числу
молекул в объеме «ломанного» цилиндра:



где
n
– концентрация молекул,
( - средняя скорость
молекул газа или путь, пройденный ею за
1 с). Таким образом, среднее число
столкновений:
В
начале было сделано неверное предположение
о том, что все молекулы, кроме одной
неподвижны. В действительности все
молекулы движутся и возможность их
соударения зависит от их относительной
скорости. Поэтому в формулу вместо
средней арифметической скорости
должна входить средняя относительная
скорость , которая равна:



Поэтому среднее число соударений должно определяться по формуле:
Средняя
длина свободного пробега: 
Из
уравнения состояния идеального газа:



следует: , тогда
Получаем,
что при постоянной температуре
концентрация молекул пропорциональна
давлению газа, то средняя длина свободного
пробега обратно пропорциональна
давлению:
Для
данного газа при постоянной температуре
(Т=const)
и различных давлениях р1
и р2
имеем: 
С
другой стороны имеем:
Диффузия. Закон Фика. Коэффициент диффузии.
Явление, связанное с взаимным проникновением двух граничащих веществ при их непосредственном соприкосновении называется диффузией.
Диффузия обусловлена тепловым движением молекул в результате которого происходит самопроизвольное выравнивание концентраций в смеси несколько различных веществ.
Ограничимся рассмотрением только газообразных сред.
Рассмотрим только двухкомпонентную смесь газов.
Пусть
в единице объема смеси находится
концентрация n1
молекул одного газа и концентрация n2
молекул другого газа. Концентрацию
смеси газов найдем по формуле:
Относительной
концентрацией i-й
компоненты в смеси называется безразмерная
величина: 

Сумма относительных концентраций всех компонент (газов) равна единице:
Абсолютной
концентрацией какого-либо газа называется
масса молекул данного газа, содержащаяся
в единице объема. Определенная таким
образом концентрация представляет
собой парциальную плотность данного
газа. Если масса молекулы i-го
газа mi,
то абсолютная концентрация будет равна:
Давление
газовой смеси равно сумме парциальных
давлений отдельных газов и определяется:
Может случиться так, что концентрация отдельных газов в различных точках пространства будет неодинакова. В этом случае вследствие теплового движения молекул будет происходить процесс выравнивания концентраций, сопровождающийся переносом массы i-го газа в направлении убывания его концентрации. Этот процесс называется диффузией.
Предположим,
что концентрации n1
и n2
изменяются вдоль оси z.
Быстрота этого изменения характеризуется
производными и 


Производную называют градиентом концентрации.
Чтобы наблюдать процесс диффузии в чистом виде, будем считать давление в газообразных смесях постоянным, т.е. не зависящем от z, так что гидродинамические потоки не возникают.



Производные и в этом случае имеют разные знаки.
Вследствие
теплового движения возникает поток
молекул каждой из компонент газа в
направлении убыли ее концентрации.
Экспериментально установлено, что поток
молекул i-й
компоненты через перпендикулярную к
оси z
поверхность S
определяется уравнением.
Эмпирическое уравнение диффузии, закон Фика :
где D – коэффициент диффузии. Знак минус в уравнении Фика обусловлен тем, что поток направлен в сторону убывания концентрации. Умножим обе части уравнения Фика на массу молекулы i-го газа mi, получим.
Закон
Фика.
Выведем
уравнение диффузии, исходя из
молекулярно-кинетических представлений.
Будем считать, что молекулы обоих газов
мало отличаются по массе (m1≈m2≈m)
и имеют практически одинаковые эффективные
диаметры (d1≈d2≈d).
В этом случае молекулам обоих газов
можно приписать одинаковую среднюю
скорость теплового движения, а среднюю
длину свободного пробега вычислить по
формуле:
где n=n1+n2 – общая концентрация газов 1 и 2.
Процесс
диффузии в газах будет протекать тем
интенсивнее, чем быстрее движутся
молекулы, а так же чем реже сталкиваются
они друг с другом, т.е. чем больше у них
длина свободного пробега λ.
Следовательно можно предполагать, что
коэффициент диффузии D
пропорционален произведению средней
скорости и средней длине свободного
пробега.
Пусть
изменение концентрации первого газа
вдоль оси z
описывается функцией n1(z).
Обозначим число молекул первого газа,
пролетающих в единицу времени сквозь
воображаемую поверхность S
в направлении оси z,
через N’1;
то же число для противоположного
направления – через N”1.
Разность этих чисел даст поток N1
молекул первого газа через поверхность
S:

Количество
молекул первого газа, пролетающих в
единицу времени через поверхность S
в каждом направлений (слева направо и
справа на лево), будем рассчитывать по
формулам:

где n’1 – «эффективная» концентрация молекул первого газа слева от S, а n”1 – «эффективная» концентрация молекул первого газа справа от S.
Через
поверхность S
пролетают молекулы, претерпевшие
последнее соударение на различных
расстояниях от этой поверхности. Однако
в среднем последнее соударение происходит
на расстоянии от S,
равном средней длине свободного пробега
λ.
Поэтому в качестве n’1
взять значение n1(z–λ),
а в качестве n”1
– значение n1(z+λ).
Тогда для N1
получаем: 
Разность
значений функции n1(z)
можно представить в виде:
Подставим
это выражение в закон Фика, получим:

Выражение для коэффициента диффузии имеет вид :
30. Явление вязкости теплопроводности.
Вязкость (внутреннее трение). Закон Ньютона. Коэффициент вязкости.
Вязкость (внутреннее трение) связано с возникновением сил трения между слоями газа (жидкости), перемешивающимися друг с другом с различными по модулю скоростями.
Со стороны слоя движущегося быстрее, на более медленно движущийся слой действует ускоряющая сила и наоборот, медленно перемещающийся слой тормозит более быстро движущиеся слои газа (жидкости). Силы трения которые при этом возникают, направлены по касательной к поверхности соприкосновения слоев. С молекулярно-кинетической точки зрения причиной вязкости является упорядоченное движение слоев с различными скоростями u и хаотичного движения молекул υ.
Согласно
закону Ньютона сила трения между двумя
слоями газа или жидкости равна.
Эмпирическое
уравнение вязкости, закон Ньютона:
где η – коэффициент вязкости; - величина показывающая, как быстро изменяется
скорость
течения жидкости или газа в направлении
z,
перпендикулярном к направлению движения
слоев (градиент скорости u),
S
– площадь лежащей на границе между
слоями поверхности, по которой действует
сила F.

Согласно
2-му закону Ньютона: 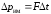

или,
, тогда 
Уравнение Ньютона для внутреннего трения можно представить в виде:
где Δрим – импульс, передаваемый от слоя к слою за секунду (Δt=1 с), т.е. поток импульса через поверхность S. Знак «минус» в формуле обусловлен тем, что импульс «течет» в направлении убывания скорости u. Поэтому знаки импульса и градиента скорости u противоположны.

В формуле Ньютона минус писать нельзя, потому что она определяет одинаковый модуль двух противоположно направленных сил, с которыми слои действуют друг на друга. Кроме того нужно брать модуль градиента скорости, так как производная может иметь любой знак, а модуль силы – положительная величина.

Рассмотрим происхождение силы внутреннего трения.
Рассмотрим два соприкасающихся слоя газа толщиной Δz. Слои движутся с различными скоростями u1 и u2. Каждая молекула газа участвует в двух движениях: хаотическом тепловом, средняя скорость которого равна <υ>, и упорядоченном движении со скоростью потока u. Скорость потока намного меньше, чем скорость теплового движения. В неподвижном газе средний импульс молекулы равен нулю. Молекула в потоке газа обладает средним импульсом mu. При рассмотрении внутреннего трения нас будет интересовать этот импульс.
Пусть в некоторый момент времени слои обладают импульсами рим1 и рим2. При отсутствии внешнего воздействия на слои, их импульсы не могут оставаться неизменными, так как вследствие теплового движения происходит непрерывный переход молекул из одного слоя в другой. Попав в другой слой, молекула претерпевает столкновения с молекулами этого слоя, в результате чего она отдает избыток своего импульса другим молекулам ( если она прилетела из слоя, движущегося быстрее), либо увеличивает свой импульс за счет других молекул (если она прилетела из слоя, движущегося медленнее). В итоге импульс слоя, движущегося быстрее, убывает, а слоя, движущегося медленнее, возрастает. Следовательно, слои ведут себя так, как если бы к слою, скорость которого больше, была приложена сила, тормозящая его движение, а к слою, скорость которого меньшая, - такая же по модулю сила, ускоряющая его движение. Таков механизм возникновения сил внутреннего трения.
Через
поверхность S,
лежащую на границе раздела слоев,
переходит в единицу времени из одного
слоя в другой количество молекул,
определяемое выражением:
на
среднюю скорость молекул в направлении,
перпендикулярном к слоям, движение
слоев со скоростью u
не оказывает влияния). В результате
возникает в направлении от более быстрого
слоя к более медленному поток импульса
через поверхность S,
равный:
В реальном потоке газа скорость при переходе через воображаемую границу двух слоев изменяется не скачком, а непрерывно по закону u=u(z). Будем считать, что каждая молекула, пролетающая через поверхность S, несет с собой импульс mu, определяемый скоростью u в том месте, где произошло столкновение молекулы. Это столкновение происходит на различных расстояниях от S. В среднем последнее столкновение происходит на расстоянии, равном длине свободного пробега λ. Поэтому молекулам, летящим в направлении оси z, припишем значение скорости u1=u(z–λ), а молекулам, летящим в противоположном направлении, – значение скорости u2=u(z+λ). Подстановка этих значений в формулу для потока импульса через поверхность S в направлении оси z дает выражение:


Произведение
nm
равно плотности газа ρ.
Поэтому полученное уравнение можно
записать в виде:
Сравнение
полученного уравнения с эмпирической
формулой Ньютона дает для вязкости
выражение:
Размерность вязкости [η] = 1 (кг/(м∙с)) = 1 (Па∙с).
Теплопроводность. Закон Фурье. Коэффициент теплопроводности.
Теплопроводность возникает при наличии разности температур, вызванной какими-либо внешними причинами. При этом молекулы газа в разных местах имеют разные средние кинетические энергии (скорости хаотического теплового движения молекул), что приводит к направленному переносу молекулами газа внутренней энергии.
Опытным
путем установлено, что в случае, если в
какой-либо среде вдоль некоторого
направления z
температура не остается постоянной, то
вдоль этого направления устанавливается
поток тепла, величина которого определяется
формулой.
Закон Фурье:
где
q
– количество теплоты, протекающее за
единицу времени через площадку S,
расположенную перпендикулярно к оси
z,
c
– коэффициент теплопроводности;
Градиент температуры:
Знак «минус» в законе Фурье отражает то обстоятельство, что направление, в котором возрастает температура, и направление, в котором течет тепло, противоположны, т.е. что тепло течет в направлении убывания температуры. Поток тепла в уравнении Фурье – величина алгебраическая: если тепло течет в положительном направлении оси z, q положительно, если же тепло течет в отрицательном направлении оси z, то q отрицательно.
Чтобы
вычислить количество теплоты Q,
протекающее через площадку S
за время t,
нужно q
умножить на t:
Вычислим поток тепла в газе, основываясь на молекулярно-кинетических представлениях.
Если температура газа в разных местах различна, то и средняя энергия молекул также будет различной. Перемещаясь вследствие теплового движения из одних мест в другие, молекулы переносят запасенную ими энергию, что обуславливает процесс теплопроводности.
Кроме факторов, определяющих скорость диффузии, т.е. средней скорости молекул , <υ> и длины свободного пробега λ, количество переносимой молекулами энергии должно зависеть от способности молекул запасать энергию, т.е. От теплоемкости газа. Поскольку поток молекул определяется их числом в единице объема, то и теплоемкость должна относиться к единице объема.

Пусть
в газе поддерживается градиент температуры
вдоль направления z.
Представим мысленно поверхность S,
перпендикулярно к этому направлению.
Количество молекул, пролетающих в
единицу времени через поверхность S
в каждом направлений (слева направо и
справа на лево), будем считать равным:
Вычислим
тепловой поток.
Каждая молекула имеет энергию , соответствующую температуре в том месте, где
произошло ее столкновение с другой молекулой. В среднем это столкновение происходит на расстоянии от S, равном длине свободного пробега λ. Поэтому молекулам, летящим слева на право, надо приписывать среднюю энергию <ε1>, соответствующую температуре Т1=Т(z–λ), т.е. температуре в плоскости z–λ, молекулам же, летящим справа налево – среднюю энергию <ε2>, соответствующей температуре Т2=Т(z+λ).
Величины n и <υ> зависят от температуры. Число частиц, летящих через площадку S во встречных направлениях, не могут быть различными. Если бы они оказались неодинаковыми, то кроме потока тепла через площадку S наблюдался бы поток вещества (диффузия) – происходило бы перемещение газа из одной части пространства в другую. В самом начале сделали предположение, что движение газа, как целого, отсутствует.
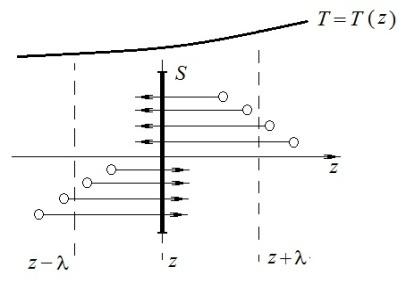
Таким
образом, для теплового потока q
через поверхность S
получается выражение:
где N определяется формулой .
Подстановка
значений N,
<ε1>
и <ε2>
приводит к формуле:
Вследствие
малости λ
разность Т1–Т2
можно представить в виде:

где - производная Т по z в том месте, где расположена поверхность S. Подстановка выражения для разности температур приводит к формуле Фурье:

Полученная
формула совпадает с эмпирическим
уравнением Фурье, если положить
теплоемкость равной: 


Величина молярная теплоемкость газа при постоянном объеме.

Следовательно выражение представляет собой теплоемкость при постоянном.
объеме
количества газа, содержащего n
молекул, т.е. теплоемкость единицы объема
газа. Эту теплоемкость можно получить,
умножив удельную теплоемкость газа сV
при постоянном объеме на плотность газа
ρ.
Следовательно
Учитывая
это значение, получим для теплопроводности
газа следующее выражение:
31. Первое начало термодинамики (ПНТ).
Введение в термодинамику.
Термодинамическая система - это совокупность тел, подверженных общему тепловому воздействию.
Термодинамические параметры состояния системы – это физические величины, характеризующие состояние термодинамической системы. К ним можно отнести, например, массу газа, температуру, давление газа, его объем, теплоемкость и т.д. К основным термодинамическим параметрам состояния системы относят давление, объем и температуру.
Термодинамический процесс – это процесс изменения термодинамических параметров системы.
Состояние термодинамического равновесия – это состояние, при котором параметры состояния остаются неизменными в любых точках системы.
Равновесный процесс - это процесс, при котором газ из начального в конечное состояние переходит путем прохождения таких равновесных состояний.
В зависимости от возможных способов изоляции от внешней среды различают следующие виды термодинамических систем: открытая; закрытая; изолированная; замкнутая; адиабатическая.
Открытой термодинамической системой называется система, которая может обмениваться веществом с внешней средой.
Закрытая термодинамическая система не можем обмениваться веществом с внешней средой.
Изолированная термодинамическая система не может обмениваться с внешней средой ни энергией, ни веществом.
Замкнутая термодинамическая система – это система, которая изолирована в механическом отношении от окружающей среды, т.е. она не способна к обмену энергией с внешней средой путем совершения работы.
Адиабатной термодинамической системой называется система, если она не может обмениваться с внешней средой энергией путем теплообмена.
Внутренняя энергия. Первое начало термодинамики (ПНТ)
Внутренняя
энергия
является однозначной
функцией состояния термодинамической
системы. Значение внутренней энергии
системы в каком-либо произвольном
состоянии не зависит от того, каким
образом система пришла в это состояние.
Т.е. изменение внутренней энергии ΔU1-2
при переходе системы из состояния 1 в
состояние 2 не зависит от вида процесса
и равно:
Если
в результате каких-либо процессов
система возвращается в исходное
состояние, то полное изменение внутренней
энергии равно нулю.
Обмен энергией между закрытой термодинамической системой и внешней средой может быть осуществлен двумя способами: совершением работы над термодинамической системой и путем теплообмена.
Энергия, передаваемая при этом рассматриваемой термодинамической системе внешними телами, называется работой, совершаемой над системой.
Энергия, передаваемая системе внешними телами путем теплообмена, называется количеством теплоты, получаемой системой от внешней среды.
Количество теплоты – это одна из форм изменения внутренней энергии в результате микропроцессов, т.е. процессов, происходящих с отдельными частицами.
Термодинамическая работа – это одна из форм изменения внутренней энергии в результате макропроцессов, т. е. процессов, происходящих над всей системой.
Величины, изменение которых не зависит от формы процессов, а определяется только начальными и конечными параметрами состояния, называется функциями состояния.
Пример – внутренняя энергия.
В противном случае (если зависит от формы процесса) – функциями процесса.
Пример – термодинамическая работа и количество теплоты.
DU = A¢ + Q
A¢ - работа, совершаемая над системой внешними силами
A = -A¢ - работа, совершаемая системой над внешними телами.
Первое начало термодинамики (ПНТ).
Количество теплоты, сообщаемое системе, затрачивается на приращение внутренней энергии системы и совершение системой работы над внешними телами:
ПНТ
в интегральной форме:
ПНТ
в дифференциальной форме:

Первое начало термодинамики – это следствие закона сохранения энергии, поэтому ПНТ носит универсальный характер.
Вторая формулировка ПНТ:
Невозможно построить вечный двигатель первого рода, т.е. такой периодически действующий тепловой двигатель, который бы работал без затрат энергии извне.
Q = 0, DU = A¢
Запас внутренней энергии у тела не безграничен, следовательно, по исчерпании этого запаса такой двигатель должен остановиться.
Все
физические величины входящие в ПНТ:
могут быть как положительными, так и отрицательными.
Возможны случаи когда δQ, δА или dU равны нулю. Например:
dU = 0 – изотермический процесс;
δА = 0 – изохорный процесс;
δQ = 0 – адиабатический процесс.
Если к системе подводиться теплота, то δQ>0; если отводиться, то δQ<0.
Если температура термодинамической системы увеличивается, то изменение внутренней энергии считается положительным (dU>0), если температура уменьшается, то изменение внутренней энергии считается отрицательным (dU<0).
Работа газа при изменении объема.
Найдем работу, которую совершает ИГ при расширении или сжатии, заключенного в сосуде с подвижным поршнем площадью S (рис. 1).
Если
газ расширяясь, передвигает поршень на
бесконечно малое расстояние dL,
то производит над ним работу

где S – площадь поршня; SdL=dV – изменение объема системы; р – давление, которое производит газ на поршень.
Термодинамическая
работа для малого равновесного процесса:


В общем случае или , где р = const.
Давление р газа всегда положительно. Поэтому при расширении газа (dV>0), газ совершает положительную работу (δА>0). Если газ сжимается, то dV<0 и δА<0.
В этом случае положительную работу над газом совершают силы внешнего давления.
Произведенную при том или ином процессе работу можно изобразить графически, с помощью кривой в координатах pV. Пусть изменение давления газа при его расширении изображается кривой (рис. 2). При увеличении объема на dV совершаемая газом работа равна pdV, т.е. определяется площадью плоскости с основанием dV, тонированной на рисунке. Поэтому полная работа, совершаемая газом при расширении от объема V1 до V2, определяется площадью, ограниченной осью абсцисс, кривой p=f(V) и прямыми V1 и V2.
Графически можно изображать только равновесные процессы – процессы, состоящие из последовательности равновесных состояний. Они протекают так, что изменение термодинамических параметров за конечный промежуток времени бесконечно мало. Все реальные процессы неравновесны (они протекают с конечной скоростью), но в ряде случаев неравновесностью реальных процессов можно пренебречь (чем медленнее протекает процесс, тем он ближе к равновесному).
Недостатки первого начала термодинамики.
Первое начало термодинамики (ПНТ) устанавливает количественное соотношение между теплотой, работой и изменением внутренней энергии тела.
ПНТ не определяет направление термодинамического процесса.
Недостатки первого начала термодинамики
Во-первых. Согласно ПНТ возможны такие самопроизвольные процессы, которые в природе не существуют. Например: процесс самопроизвольной передачи тепла от холодного тела к горячему не противоречит ПНТ.
Во-вторых. ПНТ не исключает возможности такого процесса, единственным результатом которого было бы превращение всего тепла, полученного от какого-либо тела, в эквивалентную работу.
В-третьих. ПНТ не исключает возможности построить вечный двигатель второго рода.
Вечный двигатель второго рода – это такой периодически действующий двигатель, который совершал бы работу за счет самопроизвольного охлаждение тел до температур более низких, чем температура окружающих тел.
32. Теплоемкость идеальных газов.
Теплоёмкость идеальных газов.
Если в результате теплообмена телу передается некоторое количество теплоты, то внутренняя энергия тела и его температура изменяются. Количество теплоты Q, необходимое для нагревания 1 кг вещества на 1 К называют удельной теплоемкостью вещества c.
c = Q / (mΔT).
Во многих случаях удобно использовать молярную теплоемкость C: C = M · c,
где M – молярная масса вещества.
Определенная таким образом теплоемкость не является однозначной характеристикой вещества. Согласно первому закону термодинамики изменение внутренней энергии тела зависит не только от полученного количества теплоты, но и от работы, совершенной телом. В зависимости от условий, при которых осуществлялся процесс теплопередачи, тело могло совершать различную работу. Поэтому одинаковое количество теплоты, переданное телу, могло вызвать различные изменения его внутренней энергии и, следовательно, температуры.
Такая неоднозначность определения теплоемкости характерна только для газообразного вещества. При нагревании жидких и твердых тел их объем практически не изменяется, и работа расширения оказывается равной нулю. Поэтому все количество теплоты, полученное телом, идет на изменение его внутренней энергии. В отличие от жидкостей и твердых тел, газ в процессе теплопередачи может сильно изменять свой объем и совершать работу. Поэтому теплоемкость газообразного вещества зависит от характера термодинамического процесса. Обычно рассматриваются два значения теплоемкости газов: CV – молярная теплоемкость в изохорном процессе (V = const) и Cp – молярная теплоемкость в изобарном процессе(p = const).
В процессе при постоянном объеме газ работы не совершает: A = 0. Из первого закона термодинамики для 1 моля газа следует
|
Изменение ΔU внутренней энергии газа прямо пропорционально изменению ΔT его температуры.
Для процесса при постоянном давлении первый закон термодинамики дает:
|
где ΔV – изменение объема 1 моля идеального газа при изменении его температуры на ΔT. Отсюда следует:
|
|
Отношение ΔV / ΔT может быть найдено из уравнения состояния идеального газа, записанного для 1 моля:
|
pV = RT, |
где R – универсальная газовая постоянная. При p = const
|
|
Таким образом, соотношение, выражающее связь между молярными теплоемкостями Cp и CV, имеет вид (формула Майера):
|
Cp = CV + R. |
Молярная теплоемкость Cp газа в процессе с постоянным давлением всегда больше молярной теплоемкости CV в процессе с постоянным объемом (рис. 3.10.1).
|
|
|
Рисунок 3.10.1. Два возможных процесса нагревания газа наΔT = T2 – T1. При p = const газ совершает работу A = p1(V2 – V1). Поэтому Cp > CV |
Отношение теплоемкостей в процессах с постоянным давлением и постоянным объемом играет важную роль в термодинамике. Оно обозначается греческой буквой γ.
|
В частности, это отношение входит в формулу для адиабатического процесса
Между двумя изотермами с температурами T1 и T2 на диаграмме (p, V) возможны различные пути перехода. Поскольку для всех таких переходов изменение температуры ΔT = T2 – T1 одинаково, следовательно, одинаково изменение ΔU внутренней энергии. Однако, совершенные при этом работы Aи полученные в результате теплообмена количества теплоты Q окажутся различными для разных путей перехода. Отсюда следует, что у газа имеется бесчисленное количество теплоемкостей. Cp и CV – это лишь частные (и очень важные для теории газов) значения теплоемкостей.
|
|
|
Модель. Теплоемкости идеального газа |
Термодинамические процессы, в которых теплоемкость газа остается неизменной, называются политропическими. Все изопроцессы являются политропическими. В случае изотермического процесса ΔT = 0, поэтому CT = ∞. В адиабатическом процессе ΔQ = 0, следовательно, Cад = 0.
Следует отметить, что «теплоемкость», как и «количество теплоты» – крайне неудачные термины. Они достались современной науке в наследство от теории теплорода, господствовавшей в XVIII веке. Эта теория рассматривала теплоту как особое невесомое вещество, содержащееся в телах. Считалось, что оно не может быть ни создано, ни уничтожено. Нагревание тел объяснялось увеличением, а охлаждение – уменьшением содержащегося внутри них теплорода. Теория теплорода несостоятельна. Она не может объяснить, почему одно и то же изменение внутренней энергии тела можно получить, передавая ему разное количество теплоты в зависимости от работы, которую совершает тело. Поэтому лишено физического смысла утверждение, что «в данном теле содержится такой-то запас теплоты».
В
молекулярно-кинетической теории
устанавливается следующее соотношение
между средней кинетической
энергией ![]() поступательного
движениямолекул
и абсолютной температурой T:
поступательного
движениямолекул
и абсолютной температурой T:
|
|
Внутренняя
энергия 1 моля идеального газа равна
произведению ![]() на
число Авогадро NА:
на
число Авогадро NА:
|
|
При изменении температуры на ΔT внутренняя энергия изменяется на величину
|
Коэффициент пропорциональности между ΔU и ΔT равен теплоемкости CV при постоянном давлении:
|
Это соотношение хорошо подтверждается в экспериментах с газами, состоящими из одноатомных молекул (гелий, неон, аргон). Однако, для двухатомных (водород, азот) и многоатомных (углекислый газ) газов это соотношение не согласуется с экспериментальными данными. Причина такого расхождения состоит в том, что для двух- и многоатомных молекул средняя кинетическая энергия должна включать энергию не только поступательного, но и вращательного движения молекул.
|
|
|
Рисунок 3.10.2. Модель двухатомной молекулы. ТочкаO совпадает с центром масс молекулы |
На рис. 3.10.2 изображена модель двухатомной молекулы. Молекула может совершать пять независимых движений: три поступательных движения вдоль осей X, Y, Z и два вращения относительно осей X и Y. Опыт показывает, что вращение относительно оси Z, на которой лежат центры обоих атомов, может быть возбуждено только при очень высоких температурах. При обычных температурах вращение около оси Z не происходит, так же как не вращается одноатомная молекула. Каждое независимое движение называется степенью свободы. Таким образом, одноатомная молекула имеет 3 поступательные степени свободы, «жесткая» двухатомная молекула имеет 5 степеней (3 поступательные и 2 вращательные), а многоатомная молекула – 6 степеней свободы (3 поступательные и 3 вращательные).
В классической статистической физике доказывается так называемая теорема о равномерном распределении энергии по степеням свободы:
Если
система молекул находится в тепловом
равновесии при температуре T,
то средняя кинетическая энергия
равномерно распределена между всеми
степенями свободы и для каждой степени
свободы молекулы она равна ![]()
Из этой теоремы следует, что молярные теплоемкости газа Cp и CV и их отношение γ могут быть записаны в виде
|
где i – число степеней свободы газа.
Для газа, состоящего из одноатомных молекул (i = 3)
|
Для газа, состоящего из двухатомных молекул (i = 5)
|
Для газа, состоящего из многоатомных молекул (i = 6)
|
Экспериментально измеренные теплоемкости многих газов при обычных условиях достаточно хорошо согласуются с приведенными выражениями. Однако, в целом классическая теория теплоемкости газов не может считаться вполне удовлетворительной. Существует много примеров значительных расхождений между теорией и экспериментом. Это объясняется тем, что классическая теория не в состоянии полностью учесть энергию, связанную с внутренними движениями в молекуле.
Теорему о равномерном распределении энергии по степеням свободы можно применить и к тепловому движению частиц в твердом теле. Атомы, входящие в состав кристаллической решетки, совершают колебания около положений равновесия. Энергия этих колебаний и представляет собой внутреннюю энергию твердого тела. Каждый атом в кристаллической решетке может колебаться в трех взаимно перпендикулярных направлениях. Следовательно, каждый атом имеет 3 колебательные степени свободы. При гармонических колебаниях средняя кинетическая энергия равна средней потенциальной энергии. Поэтому в соответствии с теоремой о равномерном распределении на каждую колебательную степень свободы приходится средняя энергия kT, а на один атом – 3kT. Внутренняя энергия 1 моля твердого вещества равна:
|
U = 3NАkT = 3RT. |
Поэтому молярная теплоемкость вещества в твердом состоянии равна:
|
Это соотношение называется законом Дюлонга–Пти. Для твердых тел практически не существует различия между Cp и CV из-за ничтожно малой работы при расширении или сжатии.
Опыт показывает, что у многих твердых тел (химических элементов) молярная теплоемкость при обычных температурах действительно близка к 3R. Однако, при низких температурах наблюдаются значительные расхождения между теорией и экспериментом. Это показывает, что гипотеза о равномерном распределении энергии по степеням свободы является приближением. Наблюдаемая на опыте зависимость теплоемкости от температуры может быть объяснена только на основе квантовых представлений.
33. Применение ПНТ к изопроцессам.
Применение ПНТ к изопроцессам.
Изотермический процесс (Т=const; m=const).
При
изотермическом процессе изменяющиеся
параметры p
и V
связаны законом Бойля – Мариотта:
Так
как Т=const,
то и внутренняя энергия газа в этом
процессе остается неизменной: dU=0
или ΔU=0.
Следовательно ПНТ для изотермического
процесса имеет вид:
Т.е. подводимое количество теплоты идет на совершение газом внешней работы.
Найдем
работу совершаемую газом в изотермическом
процессе:
Давление
р
выразим из уравнения Менделеева–Клайперона:

Или

Подставим
полученную формулу в выражение для
работы, совершаемым ИГ при расширении
от объема V1
до объема V2:

Проинтегрируем полученное уравнение:

Получим:
Графически работа при изотермическом процессе определяется площадью заштрихованной на рисунке фигуры.
При
изотермическом процессе изменение
теплоты отлично от нуля, а изменение
температуры равно нулю, то теплоемкость
в данном процессе:
Изохорический процесс (V=const; m=const).
При
изохорическом процессе изменяются
параметры p
и Т,
которые связаны законом Шарля:
Из
графика видно, что для изохорного
процесса δА=0
и, следовательно, ПНТ для изохорического
процесса имеет вид:
Молярная
теплоемкость при изохорном процессе
для ИГ определяется по формуле:
Удельная
теплоемкость при изохорном процессе
для ИГ определяется по формуле:

Изобарический процесс (р=const; m=const).
При
изобарическом процессе изменяются
параметры V
и Т,
которые связаны законом Гей-Люссака : 
ПНТ
для изобарного процесса имеет вид:
Молярная
теплоемкость при изобарном процессе
для ИГ определяется по формуле:
Удельная
теплоемкость при изохорном процессе
для ИГ определяется по формуле:
Работа
совершаемая при изобарном процессе,
определяется по формуле:
34. Адиабатный процесс. Уравнение Пуассона. Понятие о политропном поцессе.
Адиабатический процесс (Q=0; m=const).
Адиабатический
процесс –
это процесс, происходящий без теплообмена
с окружающей средой. 
Для получения адиабатического процесса используют два способа:
1) поместить термодинамическую систему в теплонепроницаемую оболочку;
2) сделать процесс настолько быстрым, что теплообмен просто не успевает совершиться.
Примерами первого способа является принцип действия обычного термоса, второго способа – работа дизельного двигателя (за счет быстрого сжатия горючей смеси она воспламеняется). Адиабата всегда круче изотермы.


ПНТ
для адиабатного процесса имеет вид:
т.е.
работа совершается за счет убыли
внутренней энергии. Так как при этом ИГ
меняет свою температуру без подведения
количество теплоты, то теплоемкость ИГ
при адиабатном процессе равна нулю:
Адиабатный процесс называют изоэнтропийным (S=const, постоянная энтропия).
При адиабатном процессе изменяются все три параметра состояния (давление, температура и объем).
Используя ПНТ для адиабатного процесса и уравнение состояния ИГ, установим связь между этими параметрами состояния термодинамической системы (попарно).

Найдем
полный дифференциал от основного
уравнения состояния идеального газа:


Отсюда:
Подставим
в ПНТ для адиабатного процесса, получим:


Получаем:
Разделим
переменные выражение на pVCmV,
получим 



Проинтегрируем полученное выражение:


Уравнение
адиабатного процесса:

g
- показатель адиабаты (коэффициент
Пуассона). 


где , а , .
При помощи основного уравнения состояния идеального газа можно получить уравнение адиабатического процесса и через другие основные параметры состояния.






dQ = dU + dA = 0
Будем обозначать адиабатический процесс с индексом S:
dUS = nCmVdT DUS = nCmVDT
dAS = - dUS = - nCmVdT AS = - nCmVDT
Получим более удобное для практических вычислений выражение для работы газа при адиабатическом процессе.
CmV
=
Cmp
–
R
=
gCmV
–
R

gCmV – CmV = R


Из
уравнения Пуассона: 
Работа при адиабатическом процессе:
Политропический процесс.
Политропический процесс – это процесс, который протекает при постоянной теплоемкости газа (С=const).
Выше рассмотренные процессы являются частным случаем политропического процесса.
Уравнения
политропического процесса:

- показатель политропы
где Cmx – молярная теплоемкость газа при данном изопроцессе.
Можно показать, что уравнению политропического процесса удовлетворяют все изопроцессы в идеальных газах.
Например,
для изобарического процесса имеем Сmх
= Сmр

pV0 = p = const.
Очевидно,
что при Сmх
= 0, n
= γ,
тогда из уравнения политропического
процесса получаем уравнение адиабаты:
При
Сmх
= ¥,
n
= 1 – уравнение изотермы
При Сmх = СmV , n = ±¥ – уравнение изохорического процесса.
Уравнение адиабатного процесса ( уравнение Пуассона).

35. Второе начало термодинамики (ВНТ). Тепловые машины.
Обратимые и необратимые термодинамические процессы. Круговые процессы.
Обратимые процессы.
В термодинамике большое значение имеет рассмотрение различных термодинамических процессов и циклов.
Среди них: обратимые и необратимые; замкнутые и не замкнутые; круговые и некруговые циклы; а также специальные циклы и т.д.
Обратимым процессом называется процесс при прохождении которого термодинамической системой в прямом, а затем в обратном направлении, система возвращается в исходное (первоначальное) состояние, при этом в окружающей среде не остается никаких следов (изменений).
Примерами обратимых процессов могли бы быть все механические, электрические процессы, при которых не происходит потеря тепла.
Признаками обратимых процессов являются следующие особенности:
1. Допускается обратный ход, путем простого изменения направления процесса.
2. Восстановление исходного состояния не требует подвода энергии из вне.
3. Процессы протекают без трения и теплопередачи.
4. Процесс не оставляет ни в одном из участвующих тел системы длительного изменения состояния.
5. Оба направления процессов (прямое и обратное) являются равноправными и равновероятными.
Рассмотрение обратимых процессов важно по двум причинам:
1) многие процессы в природе и технике практически обратимы;
2) Обратимые процессы являются наиболее экономичными; имеют максимальный КПД, что позволяет указать пути повышения КПД реальных тепловых двигателей.
Необратимые процессы.
Тепловые процессы которые могут протекать только в одном направлении называются необратимыми процессами. Как показывает опыт, многие тепловые процессы являются необратимыми.
Например, при тепловом контакте двух тел с разными температурами тепловой поток всегда направлен от более теплого тела к более холодному. Никогда не наблюдается самопроизвольный процесс передачи тепла от тела с низкой температурой к телу с более высокой температурой. Следовательно, процесс теплообмена при конечной разности температур является необратимым.
Необратимыми являются процессы превращения механической работы во внутреннюю энергию тела из-за наличия трения, процессы диффузии в газах и жидкостях, процессы перемешивания газа при наличии начальной разности давлений и т. д. Все реальные процессы необратимы, но они могут сколь угодно близко приближаться к обратимым процессам.
Признаками необратимых процессов являются следующие особенности:
1. Необратимые процессы идут сами по себе лишь в одном направлении.
2. Энергия этих процессов тратиться без восстановления, упускается возможность совершить полезную работу.
3. Состояние термодинамической системы изменяется на длительное время.
Таким образом, с учетом этих признаков можно утверждать, что все реальные процессы являются необратимыми.
Обратимые процессы являются идеализацией реальных процессов.
Работа в обратимых и необратимых процессах.
Рассмотрим расширение газа в пустоту.
В начальный момент времени весь газ находился в нижней части цилиндра под перегородкой, а между поршнем и перегородкой газа нет.
В перегородке образуется отверстие и газ занимает все пространство под поршнем и самопроизвольно установиться новое давление одинаковое на разных участках.
Этот процесс имеет только одно направление, т.е. он необратимый.
Газ самопроизвольно перешел из одного состояния в другое, и он никогда не вернется в исходное состояние без внешних воздействий.
В данном случае интенсивность теплового движения молекул газа не изменилась, так как температура оставалась постоянной.
Чтобы
вернуть газ в начальное состояние нужно
произвести изотермическое сжатие.
При этом внешние силы совершают работу, равную:

Во
время изотермического сжатия от газа
отводиться тепло окружающим телам:
При этом какое-то внешнее тело оказывается нагретым. В цилиндре, как в некоторой термодинамической системе, произошло изменение, сопровождающееся уменьшением порядка в системе.
При расширении в пустоту, газ не совершал работу против внешних сил. При этом расширении не было равновесия между различными частями газа и между газом и внешними телами. Этот процесс не был равновесным.
Необратимые
процессы
являются
неравновесными
процессами, так как работа, совершаемая
газом над внешними телами всегда меньше,
чем работа, совершаемая системой при
том же самом изменении параметров в
обратимом процессе.
Суть второго начала термодинамики: самопроизвольные процессы протекают в направлении увеличения беспорядочный движения частиц за счет упорядоченных.
Строгие формулировки ВНТ дадим позднее.
Круговые процессы.
Круговым процессом (циклом) называется такая термодинамическая последовательность превращений, в результате которых система, выйдя из какого-либо исходного состояния вновь в него возвращается.
На диаграмме цикл изображается замкнутой кривой.
Цикл, который совершает идеальный газ, можно разбить на процессы расширения (1—a—2) и сжатия (2—b—1) газа. Работа расширения (равна площади фигуры 1a2V2V11) положительна (dV>0), работа сжатия (равна площади фигуры 2b1V1V22) отрицательна (dV<0).
Следовательно, работа, которую совершает газ за цикл, равен площади, охватываемой замкнутой кривой. Если за цикл совершается положительная работа A=∫pdV>0 (цикл идет по часовой стрелке), то он называется прямым.
Если за цикл осуществляется отрицательная работа A=∫pdV<0 (цикл идет против часовой стрелки), то он называется обратным.

Прямой цикл применяется в тепловых двигателях — периодически действующих двигателях, которые совершают работу за счет полученной извне теплоты.
Обратный цикл применяется в холодильных машинах — периодически действующих установках, в которых за счет работы внешних сил теплота переходит к телу с более высокой температурой.
В
результате кругового процесса система
возвращается в исходное состояние и,
значит, полное изменение внутренней
энергии газа есть нуль. Поэтому первое
начало термодинамики для кругового
процесса:
т.
е. работа, которая совершается за цикл,
равна количеству теплоты, полученной
извне. Однако в результате кругового
процесса система может теплоту как
получать, так и отдавать, поэтому 
где
Q1
— количество теплоты, которая получила
система, Q2
— количество теплоты, которое отдала
система. Поэтому термический
коэффициент полезного действия для
кругового процесса:
Макро- и микросостояние. Термодинамическая вероятность (статистический вес) данного макросостояния.
Первое начало термодинамики указывает на возможность теплового процесса.
Второе начало термодинамики указывает на направление теплового процесса.
Различные формулировки второго начала термодинамики:
-
Все реальные самопроизвольные процессы идут в таком направлении, что теплота передается от более горячего тела к более холодному (формулировка Клаузиуса).
-
Все реальные самопроизвольные процессы идут в таком направлении, что система переходит из менее вероятных в более вероятные состояния.
-
Все реальные самопроизвольные процессы идут в таком направлении, что энтропия системы увеличивается.
-
Невозможно построить такой периодически действующий тепловой двигатель (вечный двигатель второго рода), который работал бы только за счет охлаждения какого-либо тела (формулировка Кельвина).
Рассмотрим термодинамическую систему, которая разделена на пространственные и энергетические ячейки.
Макросостоянием называется состояние термодинамической системы с заданным распределением частиц по ячейкам безотносительно к их номерам.
Пусть в системе имеется N одинаковых частиц и много ячеек.
Одним из макросостоянием системы будет такое, для которого в первой ячейке находится N1 частиц, во второй – N2 частиц и т.д.
Если одна частица из первой ячейки, поменялась местом с частицей из любой другой ячейки, то макросостояние системы осталось неизменным.
Если же частица перешла из одной ячейки в другую и количественное распределение частиц по ячейкам изменилось, то макросостояние системы также изменилось.
Каждое макросостояние может быть осуществлено большим числом микрораспределений.

Микросостоянием термодинамической системы это одно из возможных распределений нумерованных частиц по ячейкам системы.
Рассмотрим систему, состоящей из четырех частиц, каждая из которых может находиться в одной из двух ячеек системы.
В данном случае возможно пять различных макросостояний.
Эти макросостояния могут быть реализованы различными способами.
Рассчитаем
число микросостояний W,
с помощью которых может быть осуществлено
заданное макросостояние
по формуле:
где N – полное число частиц в системе, состоящей из ячеек; Nm – число частиц в m-ой ячейке.
Из формулы видно, что разные микросостояния имеют различную термодинамическую вероятность (статистический вес).
Число микросостояний, посредством которых реализуется данное макросостояние системы, называется термодинамической вероятностью этого макросостояния.
То есть это число микросостояний, которые реализуют данное макросостояние системы.
Максимальная термодинамическая вероятность соответствует равновесному макросостоянию.
В отличие от математической вероятности термодинамическая вероятность W >1. Математическая вероятность P <1.
Найдем термодинамические вероятности макросостояний.
1
случай. N=4,
N1=4,
N2=0.
По определению 0!=1.
-
случай. N=4, N1=3, N2=1.
3
случай. N=4,
N1=2,
N2=3.

Из полученных данных видно, что даже в случае небольшого числа частиц термодинамическая вероятность макросостояния, при котором распределены по ячейкам равномерно (равновесное состояние) заметно больше термодинамической вероятности макросостояний, при которых частицы распределены неравномерно (неравновесное состояние). Чем больше число частиц в системе, тем больше термодинамическая вероятность равновесного состояния.
Термодинамическая вероятность позволяет предсказать возможное направление изменения состояния системы при самопроизвольных процессах.
В термодинамической системе вероятнее всего будут развиваться такие процессы, которые сопровождаются возрастанием термодинамической вероятности.
Особенности термодинамической вероятности.
1. Термодинамическая вероятность W – однозначная функция состояния системы, т.е. она является полным дифференциалом.
2. В равновесном состоянии термодинамическая вероятность W максимальна.
3. Если система не находится в равновесии, то ее наиболее вероятным изменением термодинамической вероятности W является ее возрастание.
4. Термодинамическая вероятность W – величина мультипликативная.
Термодинамическая вероятность W системы, состоящей из невзаимодействующих частей, равна произведению вероятностей состояния этих частей (теорема умножения вероятностей).
Подсчитаем
число микросостояний, посредством
которых может быть реализовано
макросостояние системы, состоящей из
двух независимых подсистем, находящихся
в макросостояниях с вероятностями W1
и W2.
Очевидно, взяв с одним из W1
микросостояний из первой подсистемы
любое из W2
микросостояний второй подсистемы,
получим одно из микросостояний всей
системы. Число всех возможных пар равно:

36. Идеальная тепловая машина. Цикл Карно. Теорема Карно.
Идеальная тепловая машина.
Тепловая машина- это устройство, преобразующее тепловую энергию и механическую машину ( тепловой двигатель) или механическую работу в тепло (холодильник).
Идеальная тепловая машина- это машина, в которой произведенная работа и разница между количеством подведенного и отведенного тепла равны.
Одним из важных применений термодинамики для практики, является теория тепловых машин.
Тепловые двигатели.
Тепловой двигатель – это устройство, преобразующее внутреннюю энергию одних тел (топлива) в механическую работу других тел.
Тепловой двигатель состоит из:
-
Нагревателя.
-
Рабочего тела.
-
Охладителя.
В качестве рабочего тела в тепловых двигателях используется газ.

1 – нагреватель;
2 – охладитель;
3 – рабочее тело, совершающее круговой процесс.
Q1
> 0, A
> 0, Q2
< 0; T1
> T2.
КПД теплового двигателя:
где Q1 – количество теплоты подводимое от нагревателя к рабочему телу; Q2 – количество теплоты отданное рабочим телом охладителю.
Работа тепловой машины происходит по схеме.
От
нагревателя 1
с температурой Т1
– теплота передается рабочему телу 3
и частично преобразуется последним в
работу; частично же теплота от рабочего
тела передается охладителю 2
с температурой Т2,
а рабочее тело возвращается в исходное
состояние.
В соответствии с ПНТ необходимо, чтобы выполнялось равенство:

Работа за один цикл измеряется площадью, охваченной кривой, описывающий процесс.
В соответствии со
ВНТ необходимо, чтобы изменение энтропии
всей системы ΔS=0,
т.е. для обратимого процесса:

КПД тепловой машины:

Для идеальной тепловой машины КПД определяется выражением:
КПД идеальной машины определяется только температурами нагревателя и охладителя. Мощность тепловой машины определяется произведением работы, совершаемой за один цикл, на число циклов, происходящих за 1 с.
Цикл Карно.
В 1824 году французский инженер С. Карно рассмотрел круговой процесс, состоящий из двух изотерм и двух адиабат. Этот круговой процесс сыграл важную роль в развитии учения о тепловых процессах. Он называется циклом Карно.
Цикл Карно имеет наибольший КПД среди всех циклов, работающих между данными температурами T1 и T2.
Цикл Карно – это цикл, состоящий из двух изотерм и двух адиабат.
Тепловой двигатель, работающий по циклу Карно, называется идеальным.

На участке 1–2 газ изотермически расширяется, совершая работу A12, при этом к газу подводится количество теплоты Q1. Далее на адиабатическом участке 2–3 газ помещается в адиабатическую оболочку и продолжает расширяться в отсутствие теплообмена. На этом участке газ совершает работу A23 > 0. Температура газа при этом падает до значения T2. На участке 3–4 происходит процесс изотермического сжатия.
Газ отдает тепло Q2 < 0. На участке 4-1 газ вновь помещается в адиабатическую оболочку. При сжатии температура газа повышается до значения T1. Полная работа A, совершаемая газом за цикл, равна сумме работ на отдельных участках:
A = A12 + A23 + A34 + A41.
На p-V- диаграмме эта работа равна площади цикла.
Рассчитаем
КПД такого цикла:



Воспользуемся
уравнением Пуассона для участков 2-3 и
4-1:

Поменяем
в уравнении (5) левую и правую часть
местами и поделим почленно на него
уравнение (4):

Подставляя
(2), (3) и (6) в (1), получим:

КПД цикла Карно:
Теоремы Карно.
Первая теорема Карно: КПД идеального цикла Карно не зависит от рада рабочего тела.
Вторая теорема Карно: КПД идеальной обратимой тепловой машины не может быть меньше КПД реальной необратимой машины.
37. Энтропия. Неравенство Клаузиуса. Приращение энтропии в изопроцессах.
Энтропия.
Л. Больцман доказал, что функция состояния термодинамической системы, называемой энтропией S, связана с термодинамической вероятностью W соотношением:
S = klnW + C
где
C
= const,
для удобства берем C
= 0.
Формула Больцмана:
где k – постоянная Больцмана.
Энтропия, а значит, и второй закон термодинамики имеет вероятностный характер. Она связана с процессом перехода системы из менее вероятных в более вероятные состояния. Такой процесс происходит за счет хаотического теплового движения. Поэтому энтропия является мерой хаоса в системе.
Энтропия – СФВ, характеризующая макросостояние термодинамической системы и числено равная постоянной Больцмана, умноженной на логарифм термодинамической вероятности этого состояния.
Формула Больцмана имеет фундаментальное значение. Она соединяет термодинамику со статистической физикой и позволяет рассчитать энтропию статистическими методами.
Энтропия непосредственно связана с термодинамической вероятностью и ее свойства определяются свойствами термодинамической вероятности.
Свойства энтропии:
1. Энтропия – однозначная функция состояния системы.
2. В равновесном состоянии энтропия максимальна.
3. Если система не находится в равновесии, то наиболее вероятным изменением энтропии является ее возрастание.
4.
Энтропия – величина аддитивная: энтропия
системы, состоящей из невзаимодействующих
частей, равна сумме энтропий этих частей:
5. Энтропия – величина статистическая.
Найдем связь между изменением энтропии и количеством теплоты сообщённого ей:
Рассмотрим
равновесное изотермическое расширение
ИГ от объема V1
до V2.

В
процессе расширения газа его энтропия
получает приращение ΔS:
Так
как процесс изотермический, то в данном
случае изменяется только число
пространственных ячеек (объем системы
увеличивается). При изотермическом
расширении выполняется соотношение:
Подставим
полученное соотношение в формулу
изменения энтропии, получим:


Найдем воспользовавшись ПНТ для изотермического процесса :
Работа,
совершаемая газом при обратимом
изотермическом расширении (ν=1
моль), равна:
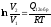
Откуда

Подставив это выражение в , получим равенство Клаузиуса:

Если
процесс связан с малым обратимым
изменением состояния, то 
Величина,
числено равная отношению количества
тепла , полученной системой в
изотермическом процессе, к температуре
процесса Т,
называется приведенным
количеством теплоты
(приведенной
теплотой).

Соотношение
справедливо для любого
обратимого процесса.
Конечное приращение энтропии при произвольном обратимом процессе равно:
где 1 и 2 обозначают начальное и конечное состояние системы.
Строгий
теоретический анализ показывает, что
приведенное количество теплоты,
сообщаемое телу в
любом обратимом круговом процессе,
равно нулю:

Из равенства нулю интеграла, взятого по замкнутому контору, следует, что подынтегральное выражение есть полный дифференциал некоторой функции, которая определяется только состоянием системы и не зависит от пути, каким система пришла в это состояние.
Таким образом, энтропия является функцией состояния.
Приращение энтропии в изопроцессах.
Каждый из изопроцессов идеального газа характеризуется своим изменением энтропии, а именно:
-
Изохорический процесс:
 ,
т. к.
,
т. к.

-
Изобарический процесс:
 ,
т.к. Р1 =
Р2;
,
т.к. Р1 =
Р2; -
Изотермический процесс:
 ,
т.к.
,
т.к.

-
Адиабатический процесс:
 ,
т.к.
,
т.к.

Отметим,
что в последнем случае адиабатический
процесс называют изоэнтропийным
процессом,
т.к. ![]() .
.
38. Статистический смысл ВНТ. Третье начало термодинамики.
Применение второго начала термодинамики (ВНТ) к изопроцессам.
Для решения задач и проведения расчетов удобно выразить изменение энтропии ΔS через параметры состояния.
Изменение
(приращение) энтропии находим из равенства
Клаузиуса:
Дифференциальная форма выражения:

Интегральная форма выражения:
-
Изотермический процесс (Т=const, m=const)

Так
как Т=const,
то изменение энтропии ΔS
найдем из выражения:

ПНТ для изотермического процесса имеет вид: или .
Работу
при изотермическом процессе находим
по формуле:
Подставляем
в выражение для изменения энтропии,
получаем:
-
Изобарический процесс (p=const, m=const).
Изменение энтропии ΔS найдем из выражения:

Количество теплоты подводимой к телу найдем по формуле:
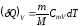
Подставляем
эту формулу в выражение для изменения
энтропии, получаем:
Полученная
формула применима для расчета изменения
энтропии не только для идеального газа
(ИГ), но и для любых тел, молярная
теплоемкость Сmp
которых не зависит от температуры. Для
ИГ она может быть также записана в виде:
-
Изохорический процесс (V=const, m=const) .

Изменение энтропии ΔS найдем из выражения:
Количество
теплоты подводимой к телу найдем по
формуле:
Подставляем
эту формулу в выражение для изменения
энтропии, получаем





