
1)Чистое вещество
+ 2)вещество, построенное атомами одного химического элемента
3)вещество, построенное атомами разных химических элементов
4)отдельные атомы одного химического элемента
5)совокупность атомов с одинаковым зарядом ядра
6)вид атомов
21. Количество вещества – это:
+ 1)отношение массы вещества к его молярной массе
2)отношение молярной массы вещества к его массе
3)отношение молярного объема газообразного вещества к его объему
4)произведение числа Авогадро на число молекул
5)совокупность одинаковых молекул
6)совокупность атомов с одинаковым зарядом ядра
22. Формула сернистого газа:
1)H2S
+ 2)SO2
3)SO3
4)S8
5)H2SO3
6)H2S2O3
23. Кислотными являются оксиды
1)только металлов
2)только неметаллов
+ 3)металлов с высокой валентностью и неметаллов
4)металлов с низкой валентностью и неметаллов
5)взаимодействующие с водой
6)взаимодействующие с водой с образованием кислоты
24. Формуле соли Ba(HSO3)2 соответствует название:
ОТВЕТ: гидросульфит бария
25. Какой оксид является ангидридом азотной кислоты
1)N2O
2)NO
3)N2O3
4)NO2
5)N2O4
+ 6)N2O5
26. Только кислотные оксиды содержатся в ряду
1)ZnO, CO2, N2O
2)CO, SiO2, SnO2
+ 3)CrO3, N2O3, SiO2
4)N2O5, P2O3, Cs2O
5)NO2, P2O5, SO3
6)CaO, Al2O3, Mn2O7
27. При взаимодействии хрома с соляной кислотой образуются
+ 1)CrCl2 и H2
2)CrCl3 и H2O
3)CrCl2 и H2O
4)CrCl3 и H2
5)CrO и H2
6)Cr2O3 и H2
28. Оксид кремния реагирует с
1)карбонатом натрия
2)фтороводородной кислотой
3)сульфатом меди
4)магнием
5)водой
+ 6)гидроксидом калия
29. С каким из веществ будет реагировать SO2
1)H2SiO3
2)NaCl
3)CrO3
4)KNO3
+ 5)KOH
6)P2O5
30. Какой кислоте соответствует формула оксида фосфора Р2О3
1)НРО3
+ 2)Н3РО3
3)Н3РО4
4)Н4Р2О7
5)Н3РО2
31. Гидроксид железа (II) реагирует с
1)KOH
2)NaCl
3)Ca(OH)2
+ 4)H2SO4
5)Na2O
6)Cu(OH)2
32. При прокаливании Cr(OH)3 образуется
1)Cr2O3 и H2
+ 2)Cr2O3 и H2О
3)CrO и H2
4)CrO и H2О
5)CrO3 и H2
6)CrO3 и H2О
33. Чему равно количество вещества аммиака (моль), массой 1 г (округлять до сотых долей
ОТВЕТ: 0,06
34. Какова масса (г) 2 л водорода (округлять до сотых долей)
ОТВЕТ: 0,18
35. Сумма коэффициентов в уравнении реакции взаимодействия гидроксида натрия с сульфатом меди
ОТВЕТ: 5
36. Чему равна плотность хлора по воздуху ( округлить до сотых)
ОТВЕТ: 2,45
37. Масса 2,24 л газа (условия нормальные) равна 2,8 г. Чему равна молекулярная масса газа (г/моль)
ОТВЕТ: 28
38. Какой объем (л) при нормальных условиях занимают 27·1021 молекул газа
ОТВЕТ: 1
39. Какова формула соединения азота с кислородом, если плотность этого газа по водороду равна 15
+ 1)NO
2)N2O
3)N2O3
4)NO2
5)N2O4
6)N2O5
40.
В цепочке превращений
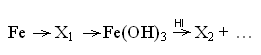 веществами
Х1
и Х2
являются…
веществами
Х1
и Х2
являются…
41.
Для цепочки превращений конечным
веществом
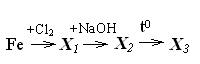 Х3
является
Х3
является
42. При взаимодействии оксида серы (IV) с избытком раствора NaOH образуется
43. Оксид углерода (IV) взаимодействует с каждым веществом пары
44. С кислотами и щелочами взаимодействует оксид
45.
В схеме превращений
 веществом Х2
является:
веществом Х2
является:
46.
В схеме превращений
 веществом
X2
является:
веществом
X2
является:
47. В цепочке превращений ZnO → Х1→ Х2 → Zn(OH)2 веществами Х1 и Х2 могут быть соответственно
48. Общая схема превращений Э → Э2О3 → Э(ОН)3 соответствует генетическому ряду:
49. Кислотные свойства сильнее выражены у оксида, формула которого
50. Амфотерным является оксид
51. В генетическом ряду Li → Li2O → X →LiCl вещество Х имеет формулу:
52.
В генетическом ряду
![]() вещество Х имеет формулу:
вещество Х имеет формулу:
53. В одну стадию можно осуществить превращение:
54. Формулы веществ, реагирующих с разбавленной серной кислотой, входят в группу:
55. В генетическом ряду Р → Х → Н3РО4 → К3РО4 вещество Х имеет формулу
56.
В цепочке превращений
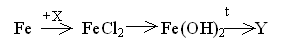 вещества
Х
и Y
имеют формулы:
вещества
Х
и Y
имеют формулы:
57. В одну стадию нельзя осуществить превращение
58. Формулы веществ, взаимодействующих с водой при обычных условиях, входят в группу
59. Формулы только амфотерных оксидов входят в пару:
60. Формулы только оснований входят в пару:
61. Формулы только гидроксидов входят в пару:
62. Формулы кислоты, кислотного оксида, соли и основания входят в группу:
63. Несолеобразующим и кислотным являются оксиды, формулы которых входят в пару:
64. Формулы только щелочей входят в пару:
65. Формулы кислотных гидроксидов входят в пару:
66. С наибольшей скоростью при комнатной температуре протекает реакция между
67. Катализатор – это вещество
68. Чем объясняется повышение скорости реакции при введении в систему катализатора
69. Для каких из перечисленных процессов изменение энтропии положительно
70. Чем объясняется повышение скорости реакции при повышении температуры
71. Какой фактор не влияет на смещение химического равновесия
72. Энтальпия – это
73. Энтропия – это
74. Энергия Гиббса – это
75. Формулировка какой закономерности приведена: «Изменение энтальпии реакции зависит только от начального и конечного состояний участвующих в реакции веществ и не зависит от промежуточных стадий процесса»:
76. Формулировка какой закономерности приведена: «Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ»:
77. Формулировка какой закономерности приведена: «При увеличении температуры на каждые 10 градусов скорость реакции увеличивается в 2 – 4 раза»:
78. Формулировка какой закономерности приведена: «Если на систему, находящуюся в состоянии химического равновесия, оказать какое-либо воздействие, то равновесие сместится в таком направлении, что оказанное воздействие будет ослаблено»:
79. Какие из перечисленных воздействий приведут к изменению константы скорости
80. Если константа скорости одной реакции (k1) больше константы скорости второй реакции (k2), то какое соотношение между энергиями активации этих реакций правильно
81. Для некоторой реакции ΔG < 0. Какие из приведенных утверждений правильны:
82. Скорость реакции описывается уравнением 2NO + O2 = 2NO2 . Как изменится скорость этой реакции при увеличении концентрации оксида азота (II) в 3 раза?
83.Для какой из приведенных реакций изменение давления не будет оказывать влияние на смещение равновесия?
84.Для каких реакций повышение давления смещает равновесие в том же направлении, что и понижение температуры?
85. Как изменится скорость реакции 2NO (г) + O2 (г) ↔ 2 NO2 (г), если объем реакционного сосуда увеличить в 2 раза
86. Для увеличения скорости реакции 2СО + О2 = 2СО2 + Q необходимо
87. Равновесие в системе 3О2(г) ↔ 2О3(г) – Q сместится вправо при
88. При одновременном понижении давления и повышении температуры равновесие сместится вправо в реакции
89. Согласно термохимическому уравнению 2NO + O2 = 2NO2 + 113,7 кДж
при образовании 4 моль NO2
90. Для увеличения скорости химической реакции FeО(тв) + СО(г) = Fe(тв) + СО2 (г) + 17 кДж необходимо
91. Среди приведенных реакций обратимой является
92. При повышении температуры на 10 градусов скорость некоторой реакции увеличивается в 2 раза. При температуре 300 С скорость реакции равна 0,2 моль/л∙с, а при температуре 500 С составляет, моль/ л∙с:_________________
93. При повышении температуры на 10 градусов скорость некоторой реакции увеличивается в 3 раза. При температуре 200 С скорость реакции равна 0,2 моль/л∙с, а при температуре 500 С составляет, моль/ л∙с:_____________________
94. Обратимой является реакция:
95. Необратимой является реакция:
96. Необратимой является реакция
97. Если энтальпия образования SO2 равна 297 кДж/моль, тогда количество теплоты, которое выделяется при сгорании 16 г серы, равно (кДж)__________
98. Для увеличения скорости взаимодействия железа с соляной кислотой следует
99. Смещению равновесия вправо в системе СО2 (г) + С(тв) ↔ 2СО(г) – Q будет способствовать
100. При повышении давления равновесие смещается вправо в системах:
101. Изменение давления не смещает равновесия в системах
102. Согласно термохимическому уравнению ZnS(тв) + 2HCl(г) = ZnCl2(тв) + H2S(г) + 139,3 кДж при образовании 4 моль HCl в обратной реакции
103. Согласно термохимическому уравнению ZnS(тв) + 2HCl(г) = ZnCl2(тв) + H2S(г) + 139,3 кДж при образовании 0,25 моль ZnCl2
104. Тепловой эффект химической реакции при постоянном давлении – это
105. Какая из написанных ниже реакций отвечает теплоте образования оксида азота (II) в стандартных условиях (ΔНº298)?
106. Раздел химии, изучающий скорости и механизмы химических реакций, называется
107. Скорость химической реакции – это
108. Химические реакции, протекающие в противоположных направлениях, называют
109. Состояние химического равновесия количественно характеризуют
110. Условием химического равновесия является
111. Неэлектролитом является
112. Электролитом является
113. Слабым электролитом является вещество, формула которого:
114. Наиболее сильным электролитом является
115. В качестве анионов только ионы ОН- образуются при диссоциации
116. Ионы I- образуются при диссоциации
117. Газ выделяется при сливании растворов
118. Нерастворимая соль образуется при взаимодействии
119. Сокращенное ионное уравнение Fe2+ + 2OH- = Fe(OH)2 соответствует взаимодействию веществ
120. Сумма коэффициентов в сокращенном ионном уравнении взаимодействия 1 моль гидроксида цинка с 2 моль соляной кислоты равна
__________________________
121. К электролитам относятся все вещества, указанные в ряду
122. Сильным электролитом является
123. Какое молекулярное уравнение соответствует сокращенному ионному Ba2+ + SO42- = BaSO4
124. Какое молекулярное уравнение соответствует сокращенному ионному Са2+ + СО32- = СаСО3↓
125. Какое молекулярное уравнение соответствует сокращенному ионному Н+ + ОН- = Н2О
126. Химической реакции между гидроксидом меди (II) и раствором серной кислоты соответствует сокращенное ионное уравнение
127. Сумма коэффициентов в уравнении реакции полной нейтрализации серной кислоты гидроксидом натрия равна:__________________________
128. В сокращенном ионном уравнении 2Н+ + ? = SO2 + H2O пропущен ион
_______________________________________
129. Химическая реакция возможна между водными растворами веществ
130. Уравнение реакции, практически осуществимой в водном растворе, имеет вид
131. Самопроизвольный распад молекул растворенного (иногда расплавленного) вещества на катионы и анионы называется
132. Мерой электролитической диссоциации электролита принято считать
133. Степень диссоциации – это
134. Величиной, характеризующей диссоциацию и не зависящей от концентрации раствора, является
135. Ионное произведение воды зависит только от температуры, численное значение этой величины при 25ºС составляет
136. Вода – очень слабый электролит, поэтому ее молярная концентрация [Н2О] остается практически постоянной при ее диссоциации, а следовательно, остается постоянной и величина Кw = [H+]∙[OH-], которую называют
137. Массовая доля показывает:
138. Молярная концентрация показывает
139. Титр показывает
140. Указать формулу для определения молярности раствора
141. Величина, показывающая содержание массы вещества в 1 мл раствора называется
142. Смешали 200 г 20%-ного и 300 г 10%-ного раствора глюкозы. Массовая доля вещества в полученном растворе равна,(%)_______________________
143. Чему равен титр раствора (г/мл), полученного растворением 3,5 г хлорида натрия в 100 мл воды (плотность полученного раствора 1,12 г/мл). (До тысячных долей)_________________________________
144. Какова массовая доля (%) растворенного вещества в растворе, полученного растворением 50 г соли в 450 мл воды_____________________
145. Какова масса NaNO3 (г), необходимая для приготовления 300 мл раствора с молярной концентрацией 0,2 моль/л. (До десятых долей)_________
146. Какова массовая доля (%) растворенного вещества в растворе, полученного растворением 20 г соли в 80 мл воды____________________
147. рН раствора соляной кислоты равен 5. Вычислить молярную концентрацию этой кислоты
148. Какая концентрация гидроксид-ионов ОН- соответствует щелочной среде
149. Какой концентрации ионов водорода соответствует рН = 10
150. Какая концентрация (моль/л) гидроксид-ионов ОН- соответствует кислой среде
151. Какой концентрации гидроксид-ионов ОН- (моль/л) соответствует рН=10
152. рН раствора равен 4. Какую окраску будет иметь в этом растворе метиловый оранжевый
153. Чему равен рН 0,01 н раствора КОН____________________
154. В каких пределах может меняться pH реальных растворов?
155. Что такое буферные растворы?
156. Как изменится рН воды, если к 10 л ее добавить 10-2 моль NaOH
157. Как надо изменить концентрацию ионов водорода в растворе, чтобы рН раствора увеличился на единицу
158. рН раствора равен 3. Какую окраску будет иметь в этом растворе лакмус
159. рН раствора равен 7. Какую окраску будет иметь в этом растворе фенолфталеин
160. Как изменится рН воды, если к 1 л ее добавить 10-3 моль HCl
161. рН раствора NаОН равен 8. Какой концентрации щелочи соответствует это значение рН
162. Вычислить рН 0,001М раствора соляной кислоты, считая ее полностью диссоциированной________________________________________
168. Раствор, в 500 мл которого растворено 1,825 г HCl, имеет рН равный… __________________
169. Вещества, способные менять свою окраску в зависимости от среды раствора, называются
170. В растворе какой из солей среда щелочная?
171. Раствор какой из перечисленных солей будет иметь рН равный 7.
172. Фенолфталеин окрасится в растворе соли
173. В растворе какой из солей среда кислая
174. Гидролиз по аниону протекает в растворе соли
175. Раствор кислоты и раствор основания смешивают в эквивалентных соотношениях. Для каких перечисленных пар (кислота + основание) раствор будет иметь нейтральную среду?
176. В растворе какой из солей метиловый оранжевый окрасится в розовый цвет:
177. Какая соль соответствует типу гидролиза по катиону
178. Какая соль соответствует типу гидролиза по аниону
179. Кислая реакция среды в водном растворе
180. Какая соль образована слабым основанием и сильной кислотой
181. Какая соль образована сильным основанием и слабой кислотой
182. Какая соль, образована слабым основанием и слабой кислотой
183. Какие продукты реакции взаимодействия HNO3 (конц) + C
184. В каком соединении степень окисления хрома максимальна
185. Какой металл не вытесняет водород из разбавленной серной кислоты
186. В результате взаимодействия серы с разбавленной азотной кислотой образуется
187. Указать, какой из известных процессов, представляет собой окисление:
188. Какая из реакций с участием соединений меди является окислительно-восстановительной:
189. В какой окислительно-восстановительной реакции пероксид водорода Н2О2 проявляет свойства восстановителя
190. В результате какой окислительно-восстановительной реации с участием перманганата калия KMnO4получается оксид марганца (IV) MnO2
191. Какая из реакций с участием соединений железа является окислительно-восстановительной
192. Какой из известных процессов представляет собой окисление
193. В результате какой окислительно-восстановительной реакции с участием перманганата калия получается манганат калия
194. Какая из реакций является окислительно-восстановительной
195. Какой из известных процессов представляет собой восстановление
196. В результате какой окислительно-восстановительной реакции с участием перманганата калия происходит обесцвечивание раствора
197. Реакция, уравнение которой 4NH3 + 5O2 = 4NO + 6H2O соответствует схема превращения азота
198. Процесс окисления – это:
199. Степень окисления – это:
200. Схеме превращения S-2 → S+4 соответствует уравнение реакции
201. Восстановительные свойства проявляет простое вещество
202. Процессу окисления соответствует схема
203. Какой из перечисленных процессов относится к окислительно-восстановительным
204. Степень окисления хлора в кислородсодержащих кислотах НСlО, НСlО2, НСlО3, НСlО4 соответственно равна____________________________
205. Коэффициент перед молекулой восстановителя в уравнении реакции
KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O равен…
_______________________________
206. Минимальная степень окисления фосфора в соединении:
207. Формула вещества, в котором углерод проявляет степень окисления – 4:
208. В окислительно-востановительной реакции NH3 + O2 → NO + H2O сумма всех коэффициентов равна_______
209. В окислительно-востановительной реакции MnO2 + HCl → MnCl2 + Cl2 + H2O сумма коэффициентов перед формулами продуктов реакции равна
______________________________
210. В окислительно-востановительной реакции P + KClO3 → KCl + P2O5 сумма коэффициентов перед формулами реагирующих веществ равна
______________________________________
211. При взаимодействии какого металла с концентрированной азотной кислотой выделится оксид азота (IV):
212. При взаимодействии какого металла с концентрированной серной кислотой H2SO4образуется сероводород (H2S)?
213. При взаимодействии какого металла с разбавленной азотной кислотой выделится оксид азота (II):
214. Какое из соединений серы является и окислителем и восстановителем:
215. В каком из соединений степень окисления серы наибольшая?
216. Какое из соединений является типичным окислителем:
217. Продукты химической реакции K2SO3 + KMnO4 + KOH =
218. Продукты взаимодействия цинка с концентрированной азотной кислотой
219. Продукты взаимодействия меди с разбавленной азотной кислотой
220. Дихромат калия в кислой среде восстанавливается до…
221. В ядре атома содержатся
222. Атом хлора содержит
223. Атом углерода содержит
224. Состояние электрона в атоме определяется
225. Главное квантовое число определяет
226. Орбитальное квантовое число определяет
227. Магнитное квантовое число определяет
228. Спиновое квантовое число определяет
229. Формулировка какой закономерности приведена: « В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми»
230. Формулировка «Устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально» соответствует
231. Электронную конфигурацию внешнего электронного слоя 2s22p5 имеет атом
232. Электронную конфигурацию внешнего электронного слоя 3s23p5 имеет атом
233. Электронную конфигурацию внешнего электронного слоя 2s22p3 имеет атом
234. Электронную конфигурацию внешнего электронного слоя 3s23p1 имеет атом
235. Неметаллические свойства элементов в ряду Si – P – S – Cl
1) остаются неизменными
236. Неметаллические свойства элементов в ряду O – N – С – B
237. Металлические свойства элементов в ряду Be – Ca – Sr – Ba
238. Неметаллические свойства элементов в ряду I – Br – Cl – F
239. Самым активным неметаллом является
240. Самым активным металлом является
241. Номер периода, в котором находится элемент, равен:
242. Для элементов главных подгрупп номер группы равен
243. Порядковый номер элемента в Периодической системе равен
244. По электронной формуле элементов определить, какой из них находится в 4 – м периоде:
245. По электронной формуле элементов определить, какой из них находится в V – ой группе:
246. Какая характеристика атома определяет его принадлежность к тому или иному химическому элементу?
247. С точки зрения строения атома у какого из элементов наиболее выражены неметаллические свойства:
248. Электроотрицательность – это:
249. Среди приведенных ниже электронных конфигураций указать невозможные:
250. Атом какого элемента третьего периода имеет в основном состоянии максимальное число неспаренных электронов?
251. По электронной формуле элементов определите, какой из них находится в VII – ой группе:
252. С точки зрения строения атома у какого из элементов наиболее выражены металлические свойства:
253. Как меняется электроотрицательность элементов в периодах с ростом заряда ядра?
254. Какая электронная конфигурация атома указать не существует:
255. Максимальное число неспаренных электронов на d-орбиталях составляет:
256. В каком периоде и группе располагается элемент, если его электронная формула имеет окончание …4s23d2
257. Какая характеристика атомов определяет способность отдавать или принимать электроны?
258. Как меняется электроотрицательность элементов главных подгрупп с ростом заряда ядра?
259. Элемент, атом которого содержит 19 протонов, называется
260. Ион, в составе которого 16 протонов и 18 электронов, имеет заряд
261. В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
262. Наименьшее число нейтронов содержится в ядре атома
263. Наибольшей восстановительной активностью обладает
264. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
265. Электронную емкость энергетического уровня и подуровня определяет
266. Какая электронная конфигурация соответствует формуле частицы Cl+3
267. В атомах щелочных металлов одинаковое число
268. Наибольшее число протонов содержится в атоме
269. С увеличением заряда ядра окислительные свойства атомов химических элементов третьего периода
270. Наиболее сходными физическими и химическими свойствами обладают простые вещества, образованные элементами:
271. Характер высших гидроксидов, образованных элементами главной подгруппы II группы, с увеличением порядкового номера изменяется
272. Наибольшим сходством физических и химических свойств обладают простые вещества, образованные химическими элементами
273. Характер оксидов в ряду P2O5 – SiO2 – Al2O3 – MgO изменяется:
274. n – главное квантовое число. Орбитальное (побочное) квантовое число может принимать значения
275. Главное квантовое число n для 5f-электронов ________________
276. Орбитальное (побочное) квантовое число l для 6d-электронов _________
277. Суммарное число d-электронов в атоме хрома _____________
295. Число неспаренных d-электронов в атоме никеля _________________
278. Электронная конфигурация атома 1s22s22p63s23p64s23d104p65s24d105p4 соответствует элементу… (название введите в именительном падеже)
________________________________
279. Чем отличаются атомы двух изотопов одного и того же элемента
280. Что такое электронная орбиталь?
281. Какая из электронных конфигураций валентных электронов описывает элемент, проявляющий в соединениях максимальную степень окисления +7?
282. Какая из химических связей является наиболее полярной:
283. В молекуле какого соединения связь наиболее прочная:
284. В молекуле какого вещества связь наиболее короткая:
285. Формула соединения с ионной связью:
286. Соединение, в котором электронная плотность смещена в противоположную сторону от атома кислорода – это:
287. В каком оксиде связь «элемент-кислород» будет более полярной:
288. В молекуле какого соединения ковалентная связь образуется по донорно-акцепторному механизму?
289. Преимущественно ионная связь образуется между атомами:
290. Только ковалентные (полярные и неполярные) связи имеются в соединении:
291. В молекуле какого соединения кратность связи наибольшая:
292. Какая из двухатомных молекул не существует?
293. В каких кристаллических соединениях реализуется металлическая связь?
294. Среди простых веществ, образованных элементами VIА группы, при комнатной температуре газом или смесью газов являются:
-------------------------------------------------------------------------------------------------------------------
295. Ионный характер связи наиболее выражен в соединении
296. Ковалентная неполярная связь характерна для
297. Соединения с ковалентной полярной и ковалентной неполярной связью являются соответственно
298. Веществами молекулярного строения являются все вещества ряда
299. Длина химической связи «элемент – водород» в ряду соединений NH3 → PH3 → AsH3 → SbH3
300. Молекулярное строение имеет
301. Неполярной является молекула…
302. Вещества, содержащие только ковалентные полярные химические связи, приведены в ряду
303. Формулы веществ с ионной и ковалентной неполярной связью входят в пару 304. Формулы веществ с ионной и ковалентной полярной связью входят в пару 305. Формула вещества, атомы в котором связаны и ионной, и ковалентной полярной связями:
306. Все вещества с ионной связью:
307. Вещества с атомной кристаллической решеткой
308. Свойства, характерные для веществ с металлической кристаллической решеткой
309. Свойство, характерное для веществ с молекулярной кристаллической решеткой
310. Причина образования химической связи –
311. Какой тип связи в молекуле Н2
312. В каком ряду молекулы расположены в порядке увеличения полярности связей
313. Какая из частиц не может быть донором электронов
314. В какой частице есть связи, образованные по донорно-акцепторному механизму
315. В каком из перечисленных веществ есть водородные связи
316. Валентность атома – это
317. В молекуле I2 связь
318. В соединении NI3 связь
319. В соединении NaI связь
320. В веществе Na связь
321. Формула соединения, которому соответствует название пентанитроамминкобальтат (III) калия:
322. В каком из комплексных соединений координационное число платины максимально:
323. Какова степень окисления ванадия в соединении [V(CO)6]Cl3? _______
324. Каково координационное число Cr (III) в катионе триэтилендиамин хрома? ______________________________
325. Какова степень окисления платины в соединении [Pt(NH3)4Cl2]Cl2 ?
_____________________________
326. Каково координационное число Cr3+ в соединениях хлорид гексааквахрома (III) [Cr(H2O)6]Cl3 триоксалатохромат (III) калия К3[Cr(C2O4)3]? ________________
327. В комплексном соединении [Pd(H2O)(NH3)2Cl]Cl степень окисления комплексообразователя равна__________________________
328. Указать какая из комплексных частиц является анионом
329. У какого из комплексных соединений координационное число максимально
330. Чему равна степень окисления комплексообразователя в соединении (NH4)3[RhCl6]? ___________________________
331. Продукты реакции FeCl2 + KCN(избыток) →
332. Химической формуле K3[Fe(CN)6] соответствует название
333. Химической формуле K4[Fe(CN)6] соответствует название
334. Химической формуле [Ni(NH3)6](OH)2 соответствует название
335. Какие свойства дисперсных систем относятся к электрическим?
336. Какие свойства дисперсных систем относятся к кинетическим?
337. Какое свойство дисперсных систем относится к оптическим?
338. Движение частиц дисперсной фазы в электрическом поле называется ________________…
339. Дисперсная система, состоящая из частиц твердой дисперсной фазы и жидкой дисперсионной среды, называется ___________________________________
340. Промежуточное место между истинными растворами и дисперсными системами занимают
341. Что не относится к дисперсным системам?
342. Если пропускать луч света через коллоидный раствор, свет частично рассеивается. Это явление носит название
343. Разновидности электрохимических методов анализа:
344. Разновидности спектроскопических методов анализа:
345. Процесс поглощения газов, паров или растворенных веществ жидкими или твердыми поглотителями, лежащий в основе хроматографии называется
346. Методы анализа, основанные на способности вещества поглощать свет определенной волны, называют
347. В методе фотометрии измеряемой величиной является
348. В методе потенциометрии измеряемой величиной является
349. К внешнему аналитическому эффекту, возникающему в результате реакции можно отнести:
350. Что такое реагент?
360. Физико-химический метод разделения жидких или газообразных смесей, при котором компоненты смесей выделяются в виде отдельных полос или зон называется:
361. Совокупность ОВР, которые протекают на электродах в растворах или расплавах электролитов при пропускании электрического тока, называют________________
362. При электролизе водного раствора сульфата меди с инертным анодом образуются следующие продукты:
363. Какое вещество дает одинаковые продукты при электролизе водного раствора и расплава?
364. За точку отсчета стандартных ОВ потенциалов принято значение φ0 полуреакции 2Н+ =2е- → Н2 равное
365. При электролизе водного раствора нитрата калия с инертным анодом образуются следующие продукты:
