
Примеры к осн.закономерностям
.docxТермодинамика
Пример 1: Рассчитать изменение энтальпии ΔНº298 для химической реакции: 4NН3 (г) + 5O2 (г) = 4NO(г) + 6H2O(ж).
Написать термохимическое уравнение данной реакции. Рассчитать количество теплоты, которое выделится или поглотится, если подвергнуть окислению 200 л (н.у.) аммиака?
Решение. Запишем выражение следствия из закона Гесса для данной реакции:
ΔНº298 = 4ΔНºf (NO(г)) + 6ΔНºf (H2O(ж)) – [4ΔНºf (NН3 (г)) + 5ΔНºf(O2 (г))].
Стандартные энтальпии образования веществ: NН3(г), NO(г), H2O(ж) находим в справочнике: ΔНºf (NO(г)) = 90,25 кДж/моль; ΔНºf (NН3 (г)) = –46,19 кДж/моль; ΔНºf (H2O(ж))= –285,83 кДж/моль. ΔНºf(O2 (г)) = 0 кДж/моль, т.к. молекулярный кислород – простое вещество.
ΔНº298 =[4·90,25+6·(–285,83)] –[4·(–46,19) + 5·0] = –1169 кДж.
В термохимическом уравнении необходимо указать рассчитанное значение стандартного изменения энтальпии:
4 NН3 (г) + 5 O2 (г) = 4 NO(г) + 6 H2O(ж); ΔНº298 = – 1169 кДж.
При окислении 4 моль аммиака выделяется 1169 кДж. Рассчитаем (NH3) в200 л – (NH3) = 200/22,4 = 9 моль. При окислении 9 моль аммиака выделится в 2,25 раза больше тепла, чем при окислении 4 моль: 1169 ∙ 2,25 = 2630,3 кДж.
Пример 2: В каком направлении пойдёт процесс: С2Н4(г) = С2Н2(г) + Н2(г); ΔНº298 =175 кДж при Т= 800 К? В каком диапазоне температур возможно самопроизвольное протекание процесса?
Решение: Из термохимического уравнения следует, что процесс эндотермический, следовательно, он не может самопроизвольно протекать при низких температурах. Рассчитаем изменение энергии Гиббса в ходе данного процесса при Т= 800 К:
ΔG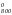 = ΔH
= ΔH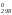 – T ΔS
– T ΔS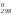
Так как ΔНº298 известно, рассчитаем изменение энтропии в ходе процесса ΔSº298. Стандартные значения энтропий химических соединений находим в справочнике: Sº(C2H2(г))= 201 Дж/(моль·К); Sº(H2 (г))= 130 Дж/(моль·К); Sº(C2H4 (г) ) = 219 Дж/(моль·К).
ΔSº298 = Sº (C2H2(г)) + Sº(H2 (г)) – Sº(C2H4 (г) )= 201 + 130 – 219 = 112 Дж/К = 0,112 кДж/К.
ΔG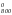 = ΔH
= ΔH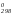 – T ΔS
– T ΔS = 175 – 800 · 0,112 = 85,4 кДж.
= 175 – 800 · 0,112 = 85,4 кДж.
ΔG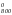 >0,
следовательно, при Т= 800 К процесс может
протекать самопроизвольно только в
обратном направлении.
>0,
следовательно, при Т= 800 К процесс может
протекать самопроизвольно только в
обратном направлении.
Для ответа на второй вопрос рассчитаем
температуру равновероятности протекания
реакции: ТР = ΔH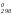 /
ΔS
/
ΔS = 175/ 0,112 = 1562,5 К.
= 175/ 0,112 = 1562,5 К.
Следовательно, только при Т > 1562,5 К возможно самопроизвольное протекание указанного процесса.
Пример 3 Рассчитать изменение энергии Гиббса ΔGº298 для химических реакций: SO3(г) + CuO(к) = CuSO4(к) ; 3SO3(г) + Al2O3(к) = Al2(SО4)3(к) .Какой из оксидов – CuO или Al2O3 реагирует с оксидом серы (VI) более энергично?
Решение: Запишем выражение следствия из закона Гесса для первой реакции:
ΔGº298 = ΔGºf (CuSO4 (к) ) – [ΔGºf ( SO3(г) ) + ΔGºf (CuO(к))].
Стандартные значения энергий Гиббса соединений находим в справочнике: ΔGºf (SO3(г)) = −368,4 кДж/моль; ΔGºf (CuO (к)) = –129,4 кДж/моль; ΔGºf (CuSO4 (к))= –661,8 кДж/моль.
Подставим значения: ΔGº298 = –661,8 − [−368,4 –129,4] = –164,0 кДж.
Запишем выражение следствия из закона Гесса для второй реакции:
ΔGº298 = ΔGº f (Al2(SО4)3 (к)) – [3 ΔGº f ( SO3 (г)) + ΔGº f (Al2O3 (к))].
Стандартные значения энергии Гиббса соединений находим в справочнике: ΔGºf (SO3(г)) = −368,4 кДж/моль; ΔGº f (Al2O3 (к) ) = –1582 кДж/моль; ΔGºf (Al2(SО4)3 (к))= –3100 кДж/моль.
ΔGº298 = ( –3100 ) − [ 2 (−368,4) –1582 ] = –412,8 кДж.
Поскольку в ходе и первой и второй реакций энергия Гиббса уменьшается (ΔGº<0), оба процесса могут протекать самопроизвольно в прямом направлении. Но для второй реакции стандартное изменение энергии Гиббса меньше, чем для первой (–412,8<–164,0), следовательно, оксид алюминия Al2O3 реагирует с оксидом серы (VI) более энергично.
Кинетика
Пример1: Во сколько раз изменится скорость прямой и обратной реакций в системе: 3H2( г.)+ N2(г.) =2NH3(г.) при увеличении давления в два раза?
Если в закрытом реакционном сосуде, где протекает реакция 3H2 + N2 = 2NH3, давление увеличить в два раза, то объем уменьшится тоже в два раза, а значит, вдвое увеличится и концентрация газов:
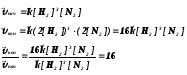
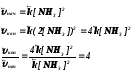
Следовательно, при увеличении давления в 2 раза скорость прямой реакции возрастет в 16 раз, а скорость обратной реакции только в 4 раза.
Пример2: Как надо изменить параметры процесса синтеза аммиака 3H2( г.)+ N2(г.) = 2NH3(г.) ; ΔН0<0 (давление, температуру, концентрации) чтобы сместить равновесие в сторону продукта?
Данная реакция протекает с уменьшением объема – из 4 молей образуется 2 моля, следовательно, чтобы сместить равновесие в сторону продукта давление надо увеличить.
К такому же выводу мы приходим в примере1– при увеличении давления прямая реакция будет преобладать над обратной – равновесие сместится вправо.
Прямая реакция экзотермическая (ΔН0<0),а обратная эндотермическая. Чтобы сместить равновесие в сторону экзотермической реакции температуру надо понизить.
Чтобы сместить равновесие в сторону продукта надо увеличить концентрацию одного из реагентов, например, взять избыток одного из реагентов относительно стехиометрии реакции.
