
- •Российский национальный исследовательский медицинский университет имени н.И. Пирогова
- •Содержание
- •Строение атома
- •Заряд атома нейтральный!
- •Заполнение орбиталей
- •Виды атомных орбиталей
- •Главные характеристики атома
- •Периодический закон и периодическая система химических элементов д.И. Менделеева
- •Физический смысл Периодического закона (на примере )
- •Закономерности изменения свойств элементов
- •Семейства химических элементов
- •Характер оксидов и гидроксидов I-VII групп
- •Химическая связь
- •Механизмы образования ковалентной связи
- •Способы перекрывания электронных облаков
- •Свойства ковалентной связи
- •Типы гибридизации
- •Кристаллические решетки
- •Сравнительная характеристика кристаллических решеток
- •Валентность и степень окисления
- •Правила определения степени окисления элемента в соединении
- •Химические реакции и закономерности их протекания Классификация химических реакций
- •Методы расстановки коэффициентов в уравнениях овр
- •Обратимые химические реакции. Химическое равновесие
- •Растворы. Электролитическая диссоциация
- •Способы выражения состава раствора
- •Теория электролитической диссоциации (1887 г., Сванте Аррениус)
- •Реакции ионного обмена
- •Гидролиз
- •Случаи гидролиза солей
- •Важнейшие классы неорганических соединений
Типы гибридизации
|
Тип гибридизации |
Пространственная конфигурация молекулы |
Примеры |
|
sp |
Линейная |
CO2, C2H2 |
|
sp2 |
Треугольная Угловая |
SO3, C2H4, O3, SO2 |
|
sp3 |
Тетраэдрическая Пирамидальная Угловая |
CH4, CCl4, NH3, H2O |
Кристаллические решетки
Кристаллическая решётка – это упорядоченное расположение частиц в кристалле.
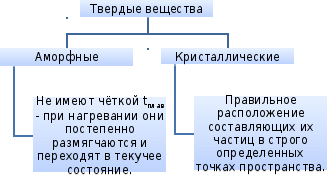
Сравнительная характеристика кристаллических решеток
|
Признаки сравнения |
Ионная |
Атомная |
Молекулярная |
Металлическая |
|
Частицы, находящиеся в узлах кристаллической решетки |
«+» и «-» заряженные ионы |
Отдельные атомы |
Молекулы |
Отдельные атомы и «+» заряженные ионы |
|
Характер связи между частицами кристалла |
Ионная связь |
Ковалентная связь |
Силы межмолекулярных взаимодействий |
Металлическая связь |
|
Прочность связи |
Прочная |
Очень прочная |
Слабая |
Прочная |
|
Физические свойства |
Твердые, тугоплавкие, имеют высокие tкип и tплав. Многие растворимы в воде. Растворы и расплавы проводят электрический ток. |
Большая твердость, хрупкость, непластичность, высокие tкип и tплав. В воде практически не растворимы. |
Невысокая прочность, легкоплавкость, в основном растворимы в воде, водные растворы не проводят электрический ток. |
Металлический блеск, электропроводность, теплопроводность, пластичность. |
|
Примеры веществ |
Большинство солей, гидроксиды металлов (NaOH, KOH, NaCl, KF…) |
Алмаз С, бор В, кремний Si, карбид кремния SiC… |
P4, I2, CO2 (тв.), органические вещества |
Металлы и сплавы (Na, K, Сu…) |
Валентность и степень окисления
Валентность элемента определяется числом ковалентных связей, образованных атомом элемента в соединении.
Понятие «валентность» применимо только к соединениям с ковалентными связями.
Правила определения степени окисления элемента в соединении
Свободные атомы и простые вещества имеют степень окисления, равную нулю (Са0, Na0, S0…).
Кислород в соединениях имеет степень окисления -2. Исключения: в соединениях с фтором степень окисления +2, в пероксидах степень окисления кислорода равна -1.
Водород в соединениях с неметаллами имеет степень окисления +1, а в гидридах металлов степень окисления водорода -1.
Фтор во всех соединениях имеет степень окисления -1.
Металлы в соединениях имеют положительную степень окисления, и ее максимальное значение равно номеру группы в Периодической системе химических элементов Д.И. Менделеева.
Алгебраическая сумма степеней окисления всех атомов в нейтральном соединении равна нулю.
Степень окисления одноатомного иона (например, Fe3+) совпадает с зарядом иона. В данном случае степень окисления железа равна +3.
Алгебраическая сумма степеней окисления всех атомов, входящих в многоатомный ион, определяет заряд иона.
Высшая степень окисления элемента равна номеру группы Периодической системы, в которой находится элемент. Низшая степень окисления элемента определяется по формуле: 8-N группы.
10) Значения степеней окисления элемента между высшей и низшей степенями называются промежуточными.
