
шпоры мясо
.doc|
01. Макросистема живой природы. Надцарства прокариот и эукариот их деления на царства. Характерными признаками, отличающими живую материю от не живой, явля-ся: 1) питание; 2) дыхание; 3) раздражительность; 4) подвижность; 5) вьделение; 6) размножение; 7) рост. Эти семь главных признаков живого более или менее выражены у любого организма и служат единственными показателями. Однако все эти признаки - лишь наблюдаемые проявления главных свойств живой материи (протоплазмы), т.е. её способность извлекать, превращать и использовать энергию извне. К тому же, протоплазма способна увеличивать свои энергетические запасы. Живые существа обладают встроенной системой саморегулирования, которая поддерживает процессы жизнедеятельности. Все одноклеточные и многоклеточные организмы делятся на две большие группы: прокариоты и эукариоты. К прокариотам относятся вирусы, бактерии и сине-зелёные водоросли. К эукариотам - зелёные растения (остальные водоросли), грибы, животные. Первые эукариоты появились = 3 млрд. лет назад, они по-втдимому происходили от прокариот. Клетки прокариот не имеют оформленного ядра, материал наследов. (ДНК) прокариот находится прямо в Ц. П. и не окружён ядерной мембраной. У эукариот имеется настоящее ядро, т.е. их генетический материал окружён двойной мембраной (ядерной оболочкой). Живые организмы прокариоты эукариоты вирусы бактерии грибы растения и животные сине-зел. водоросли слизевики. С-з водоросли - фотосинтетические простейшие. Вирусы - мельчайшие живые организмы, состоят из фрагментов ДНК или РНК, окружённые белковой защитной оболочкой. Вирусы могут воспроизводить себе подобных только внутри человека, поэтому они являются паразитами. Грибы - одна из самых распространённых групп организмов. Размеры от одноклеточных - дрожжи, до больших поганок. Грибы - эукариоты, утратившие хлорофилл, поэтому являются гетеротрофами. Растения – фотосинтетич-е эукариоты или автотрофные |
1. эукариоты. Слизевики - можно было бы отнести к животным, т.к. они способны передвигаться, а грибы - к растениям, т.к. у них есть клеточная стенка, и они не способны к передвижению. Однако в свете последних данных более правильным кажется, что слизевики, грибы, растения и животные настолько далеки друг от друга, что их всех можно выдвинуть в разные царства. Надцарства Царства безядерные предъядерные ядерные вирусы acaryotae procariyotae eucaryotae Клетка Бактерии грибы растения животные Морфологическая элементарная единица Неклет-я организованная частица Клетка Клетка Тип, содержащейся нуклеиновой кислоты ДНК или РНК (иногда вместе) ДНК и РНК РНК и ДНК Прокариоты - нет обособленного ядра, ядрышка, центриолей, высоорганиз. хромосом, митохондрий, пластид. ДНК - одна нить. Основу клет. стенок сост. гликопептид - муреин. Митоз и мвйоз у них неизвестны. Половой процесс по типу кон'югации, не наблюдается смена ядерных фаз. Клетки у них гаплоидны. 2 класса', дробенки и археобактерии, цианобактврии (с-з водор.). Эукариоты - наличие ядра, окруж ядерной мембраной, ограничивающей ядерное вещество от цитоплазмы. Генетический материал локализуется в хромосомах, состоящих из ДНК и белка. Ядро обуславливает митоз и половой процесс с чередованием гаплоид, и диплоид. фаз. Есть митохондрии, у растений - пластиды. В основном аэробы, по талу питания - автотрофы и гетеротрофы. 3 царства: грибы, растения и животные. растения: багрянки; настоящие водоросли и высшие растения [зукариоты] животные: одноклеточные и многоклеточные грибы (высшие и низшие) ________________дробенки Прокариоты] археобактерии цианобактерии (или с-з водоросли) Эукариоты: грибы-гетеротрофы, запас, гликоген, размножаются спорами. 2п/ц - миксобионты, микобионты.
|
|
|
Высшие растения - сложное вегетативное тело, дифференцированное на корень, стебель, лист, разнообр. ткани. Органы полового размножения - многоклеточные, жен. - архегопии; муж. - аптеридии. 9 отделов моховидные -* риниофиты -* 3 остерофита -> псилофиты -> плауновидные -»хвощевые -» папортниковые -> голосеменные -» цветковые. Царство животных на 2 п/ц -» одно и многокл. Главная черта одноклеточных - ядро несущее всю информацию организма и управляет им с помощью РНК. бол-во пост. ф. тела. Многие способны к движению. Гр. одноклеточных животных -+ жгутиковые, саркодовые, споровики, инфузории - способны отвечать на раздражения. У многоклеточных животных - жизненные функции выполняются различными органами, образующими систему органов. Покровы образуются однослойным или многослойным эпителием, защищающим животное от неблагоприятных условий среды. Z |
|
|
|
2. Особенности строения про- и эукариотич-х клеток. Клетка – основная структурная единица живого. Изучение её строения и функционирования необходимо для познания процессов жизнедеятельности организмов и разработки новых технологий. Морфология прокариотической клетки: организация генного материала. Одна кольцевая молекула ДНК – нуклеоид. Он как правило обособлен, не связан с белками. Присутствуют плазмиды - кольцевые двухцепочечные ДНК, несущие как правило 2 –3 гена. Рибосомы 70 S типа. Мембранные органеллы отсутствуют. Плазм. мембр. образует выступы – мезосомы. Плоские впячивания ПМ могут образовывать стопки – тилакоиды. С ПМ связаны ферменты переноса электронов и окислительного фосфорилирования. Клеточная стенка содержит муреин (пептидогликан). Морфология эукариотической клетки: организация генного материала. Днк отграничена от цитоплазмы, т. е. находится в ядре. Рибосомы 80 S типа. Цитоплазматические органеллы присутствуют – мембранные ( ЭПР, АГ, вакуоли, митохондрии, пластиды (у растений), лизосомы) немембранные (центриоли (у животной клетки), рибосомы, микротрубочки. В целом, вся цитоплазма разделена на компартменты. Клеточная стенка содержит целлюлозу или хитин. Клеточная мембрана – жидкостно-мозаичная модель. Молекулы липидов расположены в два слоя таким образом, что их неполярные хвосты обращены внутрь мембраны, а полярные головки – к поверхности мембраны. Белки погружены в билипидный слой на различную глубину (периферические, погруженные, интегральные б.). Белки соединены с полисахаридами. Клеточная стенка. Её основные компоненты – микрофибриллы целлюлозы, погруженные в полисахаридный матрикс (гемицеллюлоза + пектиновые в-ва). Для животных клеток характерно наличие эластичного слоя – гликокаликса, который состоит из полисахаридов. Структура и химический состав цитоплазмы. Цитоплазма – основная часть клетки – её внутренняя среда. Это сложная коллоидная система, состоящая из воды, неорганических ионов, белков, полисахаридов. Наружный слой цитоплазмы – эктоплазма – обладает более высокой плотностью. Внутренний слой – эндоплазма – содержит различные гранулы, обладает меньшей вязкостью. В гиалоплазме имеется микротрабекулярная сеть – система, состоящая из тонких |
2. виде АТФ. Происхождение – митохондрии – бывшие прокариоты, вступившие в симбиоз с эукариотическими клетками. Пластиды – форма сферическая, овальная или дисковая (4 – 6 мкм). Состоят из 2-х мембран, матрикс пронизан хорошо развитой системой мембран, имеющих форму плоских пузырьков – тилакоиды, которые состоят из 2-х мембран и образуют стопки – граны. Хим состав: белки – 35 – 55%, липиды – 30%, углеводы – 9%, хлорофилл – 4,5%, а также НК. Функции – фотосинтез, синтез аминокислот и жирных кислот, временное хранение крахмала. Происхождение: синезелёные водоросли были захвачены эукариотами – симбиоз. Лизосомы – мембранные мешочки круглой формы,стенка которых представлена одной мембраной. Наполнены гидролитическими ферментами. Рибосомы – состоит из 2-х субъединиц (50s и 30s – бактерии, 60s и 40s – эукариоты). Хим. состав – ДНК + белок. Рибосомы осуществляют биосинтез белка. Вакуоль – мембранный мешок, внутри находится клеточный сок (концентрированный р-р минер. солей, сахаров, органических кислот, пигменты, вторичные метаболиты). Вакуоли происходят от ЭПР. Функции: 1. Осмотическое поглощение воды, обеспечивает тургор. 2. Пигменты обусловливают окраску цветов и тд. 3. Накапливают продукты метаболизма и запасные в-ва (сахара). 4. Содержат гидролитические ферменты. Микротельца – структуры, напоминающие лизосомы. Основная функция – накопление и изоляция ферментов. Пероксисомы – содержат каталазу, оксидазы. Глиоксисомы – содержат каталазу, оксидазы и ферменты, расщепляющие запасные жиры и углеводы. Микротрубочки – цилиндрические органеллы (d=24нм) построены из глобулярного белка тубулина. Функции: 1. Образуют центриоли, реснички, жгутики. 2. Участвуют в перемещении клеточных органелл. 3. Образуют опорную систему клетки. Микрофиламенты – нити, состоящие из белка актина (d=5 – 7 нм). Образуют пучки под плазматической мембраной и на поверхности раздела экто- и эндоплазмы. Участвуют в экзоцитозе и эндоцитозе. Ядро. Форма ядра зависит от формы клеток и бывает |
|
|
2. фибрилл (белки). Она пересекает цитоплазму во всех направлениях и связывает все внутренние компоненты. Она с одной стороны создаёт каркас, а с другой – обладает динамичностью и может распадаться при изменении внешних условий. Цитоплазма заполнена сложной системой связаных с мембранами канальцев, пузырьков, которые сообщаются друг с другом. Она представляет собой трехмерную сетчатую структуру, состоящую из замкнутых или открытых полостей, так что цитоплазма оказывается разделённой на отсеки. ЭПР – система мембран формирующая цистерны и канальцы. Функции гранулярного ЭПР:1. Механическая (компартментация и дополнительная - механический остов) 2. Ферментная активность (в ЭПР содержатся ферменты синтеза фосфолипидов, гликолипидов, ж.к., т.е. факторы обмена стероидов и фосфолипидов 3. Транспортная 4. Синтез белка. Агранулярный ЭПР. Функции: 1. Синтез липидов (синтез триглицеридов с образованием липопротеидных комплексов). 2. Синтез гликогена (у животных) и других полисахаридов (у растений). 3. Детоксикация. 4. Внутриклеточное проведение возбуждения – мембранная система разделяет цитоплазму на отсеки, следовательно, возможно возникновение ионных градиентов, электрических потенциалов, что позволяет ЭПР участвовать в проведении возбуждения. АГ состоит из цистерн (уплощённых мешочков, образующих стопки; плотных пузырьков, связанных с цистернами; и прозрачных вакуолей, расположенных как правило на периферии. Функции: накопление и секреция веществ (липиды, ферменты, гормоны и тд.). 2. Участие в образовании первичных мезосом. 3. Химическая модификация поступающих в АГ клеточных продуктов.4. Секреция углеводов (материал клеточных стенок у растений). Основные органеллы клетки: Митохондрии – гранулы или палочковидные органоиды. Состав: белки – 65 – 70%, липиды – 25 – 30% и небольшое кол-во НК. Состоят из 2-х мембран (6 нм). Имеется межмембранное пространство. Внутренняя мембрана образует выросты – кристы. На внутренней мембране и кристах расположены молекулы АТФ-синтетазы, участвующие в процессах окислительного фосфорилирования. Митохондрии накапливают энергию в |
сферической, элипсоидной и дисковидной. Размер зависит от объёма цитоплазмы и определяется ядерно-плазменным отношением Vя/(Vп-Vя)=const. Бывают одно-, дву- и многоядерные клетки. Хим. состав: белки – 50 – 90%, ДНК – 5 – 40%, РНК – 3 – 20%, небольшое количество липидов. Строение – 1. Ядерная оболочка состоит из 2-х мембран, разделённых межмембранным пространством. Мембраны соприкасаются в области пор. 2. Кариоплазма – р-р в-в: липиды, белки и др. ионы. Функции кариоплазмы – участие в регуляции синтеза НК, участие в поддержании общей структуры интерфазы ядра. 3. Ядрышки. Функции: синтез рибосомальной РНК и сборка субъединиц рибосом. 4. Хромосомы – компонент ядра, обладающий особой организацией, индивидуальностью и функцией. Эволюция клетки: Концепция первичной клетки – первичная клетка – это самостоятельный организм, имеющий следующие черты строения: способность к обмену с окружающей средой (проницаемая мембрана), к росту, к делению и почкованию, к метаболизму (синтез АТФ). Археоклетка – основа про- и эукариотических клеток. Происхождение эукариотической клетки – 1. Мутагенная теория: постепенное усложнение и дифференцировка системы типа прокариотической клетки. 2. Гипотеза симбиогенеза: симбиоз прокариотных организмов. 3. Гипотеза незавершённого разделения прокариотической клетки: на отдельных стадиях образования эндоспоры произошла мутация, процесс образования споры не завершён. Следствие – образование ядра, окружённого оболочкой и органеллами. Z |
|
|
3. Молекулярные основы наследственности. Первым доказательством генетической роли ДНК послужила её способность переносить клетке в-ва из другой. Обнаружена у пневмококков. Трансформацию пневмококков Diplococcus pheumonial открыл бактериолог Ф. Гриффитс (1928) У пненмоккоков два типа штаммов различающихся по характеру роста на плотных средах и свойству патогенности по отношению к подопытным мышам. S-форма образует гладкие блестящие колонии потому что клетки заключены в полисахаридную капсулу. S -форма патогенна для .мышей, мыши, которым вводили живые клетки S-фсрмы пневмококка погибали. По антигенным свойствам капсулы различают несколько типов S-форм: IS, IIS, IIIS и т.д. Другая форма R форма не имеет капсулы, образует шероховатые колонии и непатогенна для мышей Известны редкие мутационные взаимопревращения S и R форм: IS↔IR, IIS↔IIR и тд. Гриффитс обнаружил, если мышам ввести убитые нагреванием до 65 С формы IIIS и одновременно живые клетки формы IIR ; то мыши погибают, а из трупов выделяются формы IIIS. В контрольных экспериментах мыши, зараженные только убитой формой IIIS или только живой IIR не заболевали. Сл-но, живые клетки IIR трансформируются в присутствии убитых нагреванием клетокток IIIR, тем самым приобретая свойства патогенности. Таким образом было до показано, что клетки бактерий, обладающие определенным признаком. под влиянием какого-то в-ва, выделявшегося из клеток с противоположными признаками преобразовывались, трансформировались свойства, приобретаемые клетками, при трансформации признаки передавались из поколения в поколение. Природа трансформации была не ясна до 1914 г. Когда О. Эверт, К. Маклеод, И. Мак-Карти показали, что за трансформацию у пневмококков ответственна ДНК, второе доказательство роли ДНК в наследственности было получено при изучении размножения Бактериофага Т2, инфицирующего E. сoli. Бактериофаги – вирусы бактерий. Частица бактериофага заражает клетку. Внутри неё образуются новые частицы бактериофага, Через 20 минут при 37оC клетка лизируется и примерно 100 дочерних частиц выходят наружу. Бактериофаг состоит только из 2-х компонентов – ДНК и белка. В эксперимиенте белок фага метили радиоактивным изотопом 35S, т.к. серу содержат |
только аминокислоты метионин и цистеин. ДНК метили изотопом 32Р примерно 99% фосфора фага Т2 заключено в его ДНК. Мечеными фагами заражали клетки кишечной палочки, не содержащие радиоактивные серу и фосфор. После периода адсорбции фага на клетках последнего отмывали. Из культуры бактерий удаляется 80% радиоактивной серы и это не влияет на дальнейшее размножение фага. В то же время основная масса радиоактивного фосфора не может быть удалена, так как проникает внутрь бактерий и в дальнейшем при размножении фага радиоактивный фосфор передаётся потомству, то есть именно ДНК, а не белок определяет размножение фага в заражённых клетках. Генетическая роль РНК у ВТМ (вирус табачной мозаики) доказана в экспериментах Гирера и др в 50-х годах 20 века. Известны штаммы ВТМ различающиеся по способности инфицировать различные формы растения-хозяина. Если отделить белок от РНК ВТМ, то РНК теряет инфекционность (на 99,9%). При реконструировании вирусных частиц (смешивании РНК и белка ВТМ) они вновь инфекционны. Реконструированные вирусные частицы были получены из РНК стандартного штамма и белка штамма HP. Стандартный штамм не содержит гистидина и метионина. Вирусные частицы-потомки, образовавшиеся в результате инфекции растений по аминокилотному составу белка оболочки соответствовали тому штамму ВТМ, от которого брали РНК. Таким образом, показана роль РНК как носителя генетической информации у ВТМ. Итак, свойство наследовать оказалось связано с нуклеиновыми кислотами, прежде всего с ДНК. Модель структуры ДНК Уотсона и Крика (1953) давала объяснение кодирования генетической информации. В 1957 Мезельсон и Сталь подтвердили представления Уотсона и Крика о полуконсервативном механизме воспроизведения (репликации) ДНК в клетках бактерий.. При этом механизме новая молекула представлена одной родительской и одной вновь синтезированной цепями. Мезельсон и Сталь (1958) брали кишечную палочку (у неё одна молекула ДНК). Бактерии выращивали в течение многих поколений на среде, содержащей тяжёлые изотопы азота, которые |
|
|
включались в цепь ДНК (в состав азотистого основания) Клетки меченой ДНК переносили на среду с обычным изотопом 14N и выращивали на этой среде в течение промежутка времени, соответствующего времени одной генерации этой клетки (т.е. был один митоз). Брали пробы клеток, выделяли из них ДНК и центрифугировали в градиенте плотности хлористого цезия и обнаруживали 2 пика, один из которых по плотности соответствует денатурированной лёгкой (14N) и тяжёлой (15N) ДНК. Так доказали полуконсервативный механизм репликации ДНК. У бактерий ДНК уложена в несколько десятков петель (доменов), в пределах каждого домена ДНК суперспирализована. Бактериальная «хромосома» практически не содержит белков в качестве компонентов. Сложнее организованы хромосомы эукариот. Основная единица хроматина – нуклеосома. Ядро нуклеосомы составляют 5 типов особых белков – гистонов ( Н2А, Р2В, Н3, НН, Н1). Гистоны – белки массой 10 – 15 кДа. Нуклеосома – диск, внутри него находится белковая глобула, которая образована 8-ю молекулами гистонов (по 2 молекулы каждого из гистонов, кроме Н1. Вокруг глобулы накручена ДНК длиной примерно 146 пар оснований. Уровни компактизации хроматина: 1) двойная спираль ДНК, 2) нуклеосомная нить – компактизация 1 : 6, 3) хроматиновая фибрилла 30 нм (1 : 30 – 40, т.е. в 30 – 40 раз, ДНК стала более свёрнутой. 4) Серия петельных доменов – 1 : 1000, 5) Метафазная хромосома (1 10000 – 100000). Последовательность нуклеотидов в цепи ДНК представляетгенетический код, посредством которого записана информация о синтезе белков. Код триплетный, т.е. каждая аминокислота кодируется сочетанием из 3-х лишних нуклеотидов, называемых кодоном, генетический код носит вырожденный характер, то есть характеризуется избыточностью генетической информации, Каждое свойство кодируется несколькими триплетами, что обеспечивает устойчивост информации. Z |
|
|
|
4. Спонтанные и индуцированные мутации. Мутации – наследуемые изменения генетического материала. О них появлении судят по изменениям признаков. До 1925-27гг. имели дело только со спонтанными мутациями. Думали, что мут. процесс не зависит от окр. среды. Впервые повышение частоты наследственной изменчивости под влиянием внешних агентов обнаружили в 1925г. Надсон и Филлипов. Им удалось получить мутацию плесневых и дрожжевых грибов под воздействием радия и рентгеновских лучей. В 1927г. Меллер предложил методику количественного учета рецессивных летальных мутаций в Х-хромосомах дрозофилы, за что получили Нобелевскую премию. Стадлер (1928г.) описал влияние рентг. лучей на мутационный процесс у ячменя. В 30-х годах открыт химический мутагенез у дрозофилы: Сахаров (1932), Лобашов и Смирнов (1934) показали, что йод, уксусн. к-та, аммиак индуцируюр регрессивные летали в Х-хромасоме. Мощные хим. мутагены открыты в 1946г. Раппопортом (этиленин) и Ауэрбах и Робсоном (азотистый иприт). С тех пор в арсенал мутоген. факторов вошли разные хим. соединения: аналоги оснований, включающихся в ДНК (этиленметансуфат и др.) и мн. др. Одна из первых попыток объяснить причины спонтанных мутаций сводилась к тому, что их индуцирует естеств-й фон радиации. Но таким путем можно объяснить возникновение ~0,1% всех спонтанных мутаций у дрозофилы. Современная точка зрения на причины спонтанных мутаций сформировалась в 60-е гг. благодаря выяснению механизмов воспроизведения, репарации, рекомбинации генов. Генные мутации стали объяснять как ошибки в работе ферментов матричного синтеза ДНК. Эта гипотеза позволяет рассматривать и индуц-й мутац-й процесс, как результат вмешательства внешних факторов в нормальное воспроизведение носителей генетич. информации, т.е. дает единое объяснение причин спонтанных и индуц-х мутаций. Были открыты гены мутации, которые могут повышать или понижать частоту спонтан. или индуц. мутаций. Первое объяснение мутац-х изменений (генных мутаций в хромосомах аберрации) предложил в 1935г. Тимофеев-Рисовский, Циммер на основании анализа радиац-го мутагенеза у высш. организмов (прежде всего дрозофилы) мутация - результат мгновенной перестройки атомов в сложной молекуле гена, причиной перестройки |
считали попадание в ген кванта или ионизирующ. частицы (принцип попадания) или же случ-е колебания атомов. В 1946г. Лобашов высказал гипотезу физиологич-го мутац-го процесса. Согласно ей, появлению мутации должно предшествовать потенциальное изменение, которое может быть устранено (тождественная репарация), либо реализуется в виде мутации (не тождеств. репарация). Для док-ва этой гипотезы Лобашова, его ученики Тихомиров и Ватти в опытах с дрозофилой, облученной рентг-ми лучами дополнительно воздействовали высокой температурой, которая сама по себе мутаций практически не вызывала. Мухи, подвергнутые такому комбинир-му воздействию, обнаруживали более высокую мутабельность, чем после возд-я только рентг-ми лучами. Исслед-е мутац-го процесса как часть генетич-го анализа ставит 2 задачи: 1.изучение мех-мов спонтанного и индуц-го мутагенеза и 2.получение мутантов для маркирования генетич. материала или для получения полезных форм организмов. Частота мутац-го процесса служит критерием присутствия в окр. среде генетически активных факторов. Осн. метод изучения мутац-го процесса – опред-е его частоты. При этом следуют правилам сформулир-м Тихомировым-Рисовским:1) Работа возможна только с чистыми линиями, гомозиготными по исследуемым генам;2) Большая численность как в контроле, так и в опыте;3) Анализировать полученные изменения, чтобы установить наследственны ли они (цитоплазматич. или ядерные или генные).;4) Требуется знание способа действия мутагена на зародышевые кл. обраб-го организма. Эти правила касаются изучения индуц. мутац. процесса, и его частоту опред-ют вычитая частоту мутаций, возникающих в контроле, из частоты мутаций в опыте. Метод Меллера, открывший действие рентг-х лучей на мутац процесс у дрозофилы наиболее удобный. Мутации делят: 1)физиологические;2)морфологические;3)мутации стерильности. Макромутации затрагивают внутри видовые признаки, но иногда из-за них появл-ся признак, который нет у рода, вида, семейства – это системные мутации. Малые мутации – в фенотипе вызывают незначит-е отклонения от нормы. Баур обнаружил, что они затрагивают колич-е признаки урожайности и др. По признаку фенотипич. выраж-ти провести четкую грань между макро- и микромутациями невозможно, между ними есть все степени перехода. Z |
|
|
5 Оперонная система организации бактер-х генов.
L
Б Прокариоты: Терминатор (Т) может располагаться за опероном и внутри него. Терминатор обладает особой |
нуклеотидной последовательностью: 1) по ходу транскрипции идёт GC богатый участок; 2) далее идёт участок из нескольких А (4 – 8). Транскрипция заканчивается на конце олиго-А-последовательности. Предполагают, что после прохождения РНКpol GC участка в РНК-продукте возникает шпилька. Это приводит в остановке РНКpol и к разрушению гибрида ДНК с РНК. Оставшаяся часть гибрида содержит олиго-U-последовательность. Водородные связи между А и U нестабильны, РНК-ДНК гибрид легко разрушается и РНК-продукт освобождается. Это универсальный механизм терминации и осуществляется без дополнительных белковых факторов. Многие терминаторы узнают РНКpol с помощью особого белка - -фактора (46 к Да) – обладает РНК-зависимой нуклеозидтрифосфатазной активностью. Эта активность -фактора проявляется только в комплексе с однонитчатой РНК. -фактор присоединяется к РНК-продукту до того, как РНКpol достигает терминатора. В местах -зависимой терминации РНКpol делает паузы в отсутствии -фактора (он должен вытеснять РНКpol в паузах). 2 модели функционирования -фактора: 1) -фактор движется по синтезируемой цепи РНК, в местах пауз достигает РНКpol и вытесняет РНК-продукт. 2) Пирофосфат подавляет нуклеозидтрифосфатазную активность -фактора. Он движется за РНКpol без отставания, но при нормальной скорости элонгации ингибируется пирофосфатом (в паузах -фактор активируется). Аттенуатор – регулируемый терминатор прокариот. В треониновом опероне перед структурными генами. Перед аттенуатором находится несколько областей с центральной симметрией, образующаяся на них лидерная РНК содержит 4 участка, которые способны образовывать шпильки в различных сочетаниях.
Шпилька 3 4 – терминаторная шпилька (после неё следует несколько Uостатков).Если образуется 3:4, то в аттенуаторе |
|
|
за участком 4 происходит терминация. Если эта шпилька не образуется за счёт образования 2 : 3, то аттенуации не происходит. У прокариот транскрипция и трансляция идут в одном месте. В лидерной РНК 2 кодона, соответствующих треонину (около 1). Если в клетке мало треонина, то рибосома задерживается на треониновых кодонах, при этом она перекрывает область 1 и мешает образованию шпильки 1 : 2, образуется 2 : 3 – терминации не происходит (2 : 3 не является терминаторной). В клетках эукариот аттенуации нет, а процессы транскрипции и трансляции пространственно разделены. Z |
|
|
|
5. Аминокислоты. а/к явл. структурными элементами белков. Их подразделяют на группы в зависимости от расположения NH2 групп: α, β, гамма. Классификация: Электрохимическая: 1. нейтральные (1 кислотная гр. и 1 основная гр. Аланин-CH3-CH(NH2)-COOH ) 2. кислые. (кислотн. гр.> осн. гр. аспаргиновая кислота-HOOC-CH2-CH(NH2)-COOH ) 3. основные. (Лизин) H2N-(CH2)-CH(NH2)-COOH Структурная: ациклические, алифатические, циклические (гомо- и гетеро-) Биологическая: 1. незаменимые(вал, лей, илей, тре, мет, фен, три, лиз).2. частично заменимые. Скорость их синтеза низка(Гис, арг.) 3. условно заменимые. Синтезируются из заменимых(цис из мет, тир из фен.). 4. заменимые(ала, асп, глу, про, гли, сер.). Растворимость - хорошо растворяются в полимерных растворителях (этанол, вода) и не растворяются в неполярных (бензол, гексан, эфир). Амфотерность – действуют как кислоты и основания (СООН и NH2 гр.) Обладают оптической активностью: + и -. Встречаются в живых организмах и те и другие. Аминокислоты могут существовать в виде пары энантиомеров D и L (расположение Н и ОН у хирального центра). Чаще в природе встречается L-форма. Химические реакции аминокислот: Реакция с нингидрином используется для кол-ого определения а/к. Ход реакции: 1) образуется восстановленный нингидрин за счет окислительного дезаминирования а/к, одновременно происходит её декарбоксилирование. 2) образовавшийся NH3 реагирует с восстановленным нингидрином с образованием сине-фиолетовых продуктов. Алкилирование (метилирование – перенос на а/к СН3 гр.) Ацетелирование – перенос на а/к ацетильной гр СН3СО.
|
[CH3-CH-COOH]HSO4--CH3-CH-COOHCH3-CH-COONa NH3 H2SO4 NH2 NH2 cоль по NH2 гр. аланин соль по COOH гр.
Со спиртами образуют эфиры: +C2H5OH CH3-CH(NH2)-COOH------------CH3-CH(NH2)-COOC2H5 -H2O Образование амидов: Аспаргин синтетаза HOOC-CH2CH(NH2)-COOH + NH3 + АТФ---------- H2N-CO-CH2-CH(NH2)-COOH + H2O+АДФ+H3PO4 амид аспарагиновой к-ты
При декарбоксилировании образуются амины:
декарбоксилазы а/к R-CH(NH2)-COOH ------------------------ CO2 + R-CH2-NH2
Биологически активные амины: Гистамин – сосудорасширяющие свойства. Адреналин и норадреналин – гормоны мозгового слоя надпочечников, образующиеся из тирозина – повышает глюкозу в крови, увеличивает силу сердечных сокращений, секрецию амилазы слюнных желез. Серотонин – сосудосуживающий агент, стимулирующий сокращение гладких мышц. С помощью аспарагина и глутамина происходит связывание NH3 в тканях – это очень важно при фиксации N у растений. Z |
|
|
6 Строение белковой молекулы Основой белков и пептидов является последовательность аминокислот составляющих их первичую структуру: NH2-CH-CO-NH-CH-COOH | | R R -спираль образуется при закручивании полипептидной цепи вокруг себя с образованием жёсткого цилиндра. Витки скрепляются посредством водородных связей ,которые образуются между CO и NH гр. Водородные связи направлены вдоль оси цилиндра. На каждый виток спирали приходится 3,6 аминокислотных остатка. -складчатый лист-полипептидные цепи укладываются параллельно друг другу (антипараллельно) в один слой-подобно листу сложной гармошкой. Образованию -спирали припяптствуют аминокислоты с длинной R-цепью. Способны изгибать цепь валин и пролин. -спираль и -складчатый лист комбинируются друг с другом и упаковываются образованием белковых доменов. Типы связей в белках : ковалентная - сильная хим. связь между атомами в молекулах, образующаяся за счёт обобществления электронов, принадлежащим нескольким атомам (дисульфидная связь - играет очень важную роль при образовании третичнойструктуры белков (нарушение –S-S-связи приводит к инактивации белка)). Водородная – слабая связь, образующаяся между атомами С и H или H и N в результате смещения электронов (это приводит к появлению дробного заряда + на Н и – на О. При этом образуется электрический диполь, взаимодействующий с другим диполем и т.д. Ваандервальсовы силы (слабая связь) - притяжение возникает за счёт наличия взаимодействия между колеблющимися электрическими диполями, образующими электронные облака и +ядром каждого атома. Атомы сближаются пока их электронные облака не перекроются (далее действуют силы отталкивания). Ионная связь(солевой мостик) образуется при сближении 2-ух атомов с разными зарядами. Гидрофобные взаимодействия – образуются в белках при взаимодействии неполярных цепей аминокислот (алифатические и ароматические аминокислоты). Третичная структура белка – взаиморасположение всех атомов полипептидной цепи в пространстве (вторичная |
структура определённым образом располагается в пространстве). Четвертичная структура - взаимное расположение мономеров в пространстве. Самосборка - способность белковых молекул к спонтанному и упорядоченному ассоциированию друг с другом и с другими полимерами, что приводит к образованию биоактивных структур (ферментные комплексы мембраны, рибосомы). Конформация белка – расположение белковой молекулы в пространстве. Двигательная функция белка – любые движения (движение жгутиков, сокращение актомиозинового комплекса). Транспортная функция - (перенос кислорода гемоглобином, транспорт веществ через плазматическую мембрану). Защитная функция (иммуноглобулины, супероксид-дисмутаза). Регуляторная функция осуществляется посредством гормонов (инсулин, вазопрессин). Запасательная функция - запас питательных веществ (овальбумин яиц, казеин молока и др.) Опорная функция - в костях, копытах (остеин, кератин). Рецепторная функция - избирательное узнавание и присоединение отдельных веществ (гликопротеиды, лектины). Z |
|
|
8 Биосинтез белка.
Рнк pol прочно соединяется с ДНК, взаимодействует на промоторных участках. За промоторным участком (P) следует инициаторный участок, с которого и начинается транскрипция. РНК pol соединяется с P, происходит частичное расплетение спирали ДНК (плавление). Образуемый открытый промоторный комплекс содержит ограниченное число пар оснований. Образованию такого комплекса препятствует белок – репрессор, который соединяется с P на специальном участке – операторах. Специальные молекулы – эффекторы, снижают сродство репрессора к оператору. 1. Необходимо наличие четырёх нуклеозидтрифосфатов (АТФ, ГТФ, ЦТФ, УТФ). Первый нуклеотид входит в состав цепи не теряя трифосфатной группы. Следующий нуклеотид присоединяется к 3’-OH-группе предыдущего нуклеотида, теряя трифосфатные группы. 2. Стадия элонгации. Уменьшается сродство α-субъединицы в РНКpol и она диссоциирует от холофермента. Расплавляется участок в 18 п.н. (12 п.н. образуют цепь). Рост РНК |
сопровождается плавлением по мере продвижения РНК pol. Чтобы вращения фермента не происходило используются топоизомеразы. 3. Терминация. Обрывается синтез РНК и высвобождается фермент. Происходит при участии РНК pol на специальных нуклеотидных последовательностях (терминаторах). РНК pol достигает терминаторов и цепь обрывается. У бактерий терминатор называется аттенюатором. Далее РНК-транскрипты созревают (процессинг). мРНК 1) кэпирование – химическая модификация 5’-концевой последовательности мРНК; 2) сплайсинг – удаление интронов и сшивание экзонов; 3) полиаденилирование – химическая модификация 3’-конца. тРНК синтезируется в виде предшественника (длиннее), подвергается нуклеолитическому процессингу (18-и членный интрон), происходит сплайсинг антикодоновой области. Далее присоединяется триплет ЦЦА и образуется акцепторный участок, к которому присоединяется аминокислота. рРНК с помощью специальных нуклеаз и метилаз превращается в зрелые молекулы. Аминоацилирующая-тРНК-синтетаза (аатРНК) катализирует активирование аминокислот и их связывание с определёнными тРНК. Чувствительна к реагентам на SH-группы и требует присутствия Mg2+. Обладает абсолютной специфичностью к аминокислотам и тРНК. В активном центре содержит гистидин, имидазольное кольцо которого участвует в связывании АТФ посредством Mg2+. тРНК имеет вид клеверного листа: псевдоуридиновая петля участвует в связывании аатРНК с рибосомой, а дигидроуридиловая петля необходима как место узнавания для аатРНК-синтетазы. На 3’-OH конце тРНК ЦЦА для присоединения аминокислоты (эфирная связь). Антикодоновая петля содержит триплет (петля состоит из 7 нуклеотидов). Антикодон является специфичным и комплементарным кодону на мРНК (они антипараллельны). Этапы синтеза белка (трансляция): 1. Активация аминокислоты, чтобы она была со внутренним запасом энергии. Осуществляется при помощи специальных ферментов: аатРНК-синтетаз в присутствии АТФ в 2 стадии: 1) аминокислота вступает в реакцию с АТФ, при этом освобождается пирофосфат и образуется промежуточный продукт, 2) промежуточный продукт |
|
|
реагирует с 3’-OH группой тРНК, затем освобождается аатРНК-синтетаза и АМФ. 2. Инициация трансляции. Инициатором является метионин. Существуют 2 метионинспецифичные тРНК: 1) тРНКmMet отвечает за включение метионина в состав полипептидной цепи, 2) тРНКfMet – инициатор. У прокариот синтез всех белков, начинается с образования N-формилметионин-тРНКfMet (катализируется трансформилазой). Остаток муравьиной кислоты переносится с N10-формилтетрагидрофолиевой к-ты на метионин-тРНК, который далее инициирует полипептидную цепь. У эукариот метионинспецифичная тРНК не формилируется. Инициация: инициирующий фактор IF-3 соединяется с меньшей субъединицей рибосом 30S. Белковый фактор IF-2 соединяется с ГТФ. К комплексу IF-2 – ГТФ присоединяется тРНКfMet. На второй стадии с образованным комплексом взаимодействует 30S – IF-3. К этому комплексу присоединяется мРНК своим 5’ – концом при участии инициирующего фактора IF – 1. На заключительной стадии присоединяется 50S-частица и освобождается 3 фактора инициации, ГДФ и Фн. У эукариот метионил-тРНК реагирует с eIFS, ei-2, ei-3, c 40S субъединицей рибосом и мРНК, по той же схеме, что и у прокариот. 3. Элонгация полипептидной цепи. В образовавшемся рибосомальном комплексе формируется 2 участка связывания мРНК 1) А - участок (аминокислотный участок), в нём располагается аатРНК, которая соединена с соответствующим кодоном мРНК, 2) Р – участок (пептидильный участок), в нём располагается растущая полипептидная цепь. По окончании стадии инициации в Р-участке находится инициирующая тРНКfMet , А-участок свободен, но в нём уже находится следующий кодон мРНК. Вновь поступившая аатРНК связывается с А-участком (фактор элонгации, у прокариот – EF-T , у эукариот – EF-1). Затем происходит образование пептидной связи. В пептидилтрансферазном центре происходит перенос пептидильного остатка на аминогруппу аминокислотного остатка в А-участке. Эта реакция протекает по механизму нуклеофильного замещения (вытеснение тРНК предыдущей кислоты). Затем осуществляется транслокация (перемещение) в рибосоме мРНК на один кодон (один триплет). 4. Терминация. Элонгация заканчивается, когда в |
рибосому на мРНК приходят сигналы окончания синтеза белка (УАА, УАГ, УГА) – терминирующие. В терминации участвуют белковые факторы (RF, RF-2). Они присоединяются к терминирующим кодонам и блокируют элонгацию цепи. RF-3 освобождает полипептидную цепь от последней тРНК. Ингибиторы транскрипции: актиномицин-D – связывается с ДНК между Г и Ц и блокирует действие РНКpol; гепарин – взаимодействует с РНКpol; рифампицин – взаимодействует с β-субъединицей бактериальной РНКpol. Ингибиторы трансляции: к ингибиторам, связывающимся с аатРНК относятся: стрептомицин, неомицин, канамицин. Ингибиторы, подавляющие присоединение мРНК к инициирующему комплексу – глицеральдегид, метилглиоксаль. Пуромицин на стадии пептидилтрансферазной реакции – конкурирует с аатРНК. Тетрациклин – блокирует вход аатРНК в акцепторный участок рибосомы. Z |
|
|
7 Классификация белков. Из-за относительно больших размеров белковых молекул , сложности их строения и отсутствия достаточно точных данных о структуре большинства белков еще нет рациональной химической классификации белков. Существующая классификация в значительной мере условна и построена главным образом на основании физико-химических свойств белков, источников их получения , биологической активности и других, нередко случайных, признаков. Так, по физико-химическим свойствам белки делят на фибриллярные и глобулярные , на гидрофильные(растворимые) и гидрофобные (нерастворимые) и т.п. По источнику получения белки подразделяют на животные, растительные и бактериальные; на белки мышечные, нервной ткани, кровяной сыворотки и т.п.; по биологической активности – на белки-ферменты, белки-гормоны, структурные белки, сократительные белки, антитела и т.д. Следует, однако, иметь в виду, что из-за несовершенства самой классификации, а также вследствие исключительного многообразия белков многие из отдельных белков не могут быть отнесены ни к одной из описываемых здесь групп. Все белки принято делить на простые белки ,или протеины, и сложные белки , или протеиды (комплексы белков с небелковыми соединениями).Простые белки являются полимерами только аминокислот; сложные, помимо остатков аминокислот, содержат также небелковые, так называемые простетические группы. Протеины представляют собой простые белки, состоящие только из остатков аминокислот. Они широко распространены в животном и растительном мире. Гистоны Имеют сравнительно низкую молекулярную массу (12-13тыс.), с преобладанием щелочных свойств. Локализованы в основном в ядрах клеток. Растворимы в слабых кислотах, осаждаются аммиаком и спиртом. Имеют только третичную структуру. В естественных условиях прочно связаны с ДНК и входят в состав нуклеопротеидов. Основная функция — регуляция передачи генетической информации с ДНК и РНК (возможна блокировка передачи). Протамины Самая низкая молекулярная масса (до 12 тыс.). Проявляет выраженные основные свойства. Хорошо растворимы в воде и слабых кислотах. Содержатся в половых клетках и составляют основную массу белка хроматина. Как и гистоны Липопротеины Сложные белки, простетическая группа которых образована липидами. По строению это небольшого размера (150-200 нм) сферические частицы, наружная оболочка которых образована белками (что позволяет им передвигаться по крови), а внутренняя часть — липидами и их производными. Основная функция липопротеинов — транспорт по крови липидов. В зависимости от количества белка и липидов, липопротеиды подразделяются на хиломикроны, липопротеиды низкой плотности (ЛПНП) и высокой плотности (ЛПВП), которые иногда обозначаются как - и -липопротеиды. Металлопротеины Содержат катионы одного или нескольких металлов. Наиболее часто это — железо, медь, цинк, молибден, реже марганец, никель. Белковый компонент связан с металлом координационной связью. Гликопротеины Простетическая группа представлена углеводами и их производными. Исходя из химического строения углеводного компонента, выделяют 2 группы: Истинные — в качестве углеводного компонента наиболее часто встречаются моносахариды. Протеогликаны — построены из очень большого числа повторяющихся единиц, имеющих дисахаридный характер (гиалуроновая кислота, гипарин, хондроитин, каротинсульфаты). Функции: структурно-механическую (имеются в коже, хряще, сухожилиях); каталитическую (ферменты); защитную; участие в регуляции клеточного деления. Хромопротеины Выполняют ряд функций: участие в процессе фотосинтеза и окислительно-восстановительных реакциях, транспорт С и СО2. Являются сложными белками, простетическая группа которых представлена окрашенными соединениями. Нуклеопротеины Роль протеистической группы выполняет ДНК или РНК. Белковая часть представлена в основном гистонами и протаминами. Такие комплексы ДНК с протаминами обнаружены в сперматозоидах, а с гистонами — в соматических клетках, где молекула ДНК “намотана” вокруг молекул белка-гистона. Нуклепротеинами по своей природе являются вне клетки вирусы — это комплексы вирусной нуклеиновой кислоты и белковой оболочки — капсида. |
образуют комплекс с ДНК, функция - придают ДНК химическую устойчивость. Глютелины Растительные белки, содержащиеся в клейковине семян злаковых и некоторых других, в зеленых частях растений. Нерастворимые в воде, растворах солей и этанола, но хорошо растворимы в слабых растворах щелочей. Содержат все незаменимые аминокислоты, являются полноценными продуктами питания. Проламины Растительные белки. Содержатся в клейковине злаковых растений. Растворимы только в 70%-м спирте (это объясняется высоким содержанием пролина и неполярных аминокислот). Протеиноиды Белки опорных тканей (кость, хрящ, связки, сухожилия, ногти, волосы). Нерастворимые или трудно растворимые в воде, солевых и водно-спиртовых смесях белки с высоким содержанием серы. К протеиноидам относятся кератин, коллаген, фиброин. Альбумины Невысокой молекулярной массой (15-17 тыс.). Характерны кислые свойства. Растворимы в воде, и слабых солевых растворах. Осаждаются нейтральными солями при 100%-м насыщении. Участвуют в поддержании осмотического давления крови, транспортируют с кровью различные вещества. Содержатся в сыворотке крови, молоке, яичном белке. ГлобулиныМолекулярная масса до 100 тыс.. В воде нерастворимы, но растворимы в слабых солевых растворах и осаждаются в менее концентрированных растворах (уже при 50%-м насыщении). Содержатся в семенах растений, особенно в бобовых и масленичных; в плазме крови и в некоторых других биологических жидкостях. Выполняющие функцию иммунной защиты, обеспечивают устойчивость организма к вирусным инфекционным заболеваниям. Сложные белки делят на ряд классов в зависимости от характера простетической группы. ФосфопротеиныИмеют в качестве небелкового компонента фосфорную кислоту. Представителями данных белков являются казеиноген молока, вителлин (белок желтков яиц). Такая локализация фосфопротеидов свидетельствует о важном их значении для развивающегося организма. У взрослых форм эти белки присутствуют в костной и нервной тканях.
|
|
|
12. Строение молекулы ДНК. ДНК – это линейная система биополимеров, имеющая пространственно сложный уровень организации. Линейными молекулами являются нуклеотиды ковалентно сшивающиеся друг с другом, с образованием фосфодиэфирных связей между 5’ – фосфатом одного нуклеотида и 3’ – OH группой сахара соседнего нуклеотида. В состав ДНК входят пуриновые и пиримидиновые основания, моносахарид пентоза и фосф. кислота. В Н.К. пуриновые и пиримидиновые азотистые основания образуют N-гликозидную связь с рибозой и дезоксирибозой. Эти основания (азотистое основание + дезоксирибоза или рибоза) называются нуклеозидами, а их фосфорные эфиры – нуклеотидами. Аденозин + рибоза = нуклеозид аденозин + остаток фосфорной кислоты в 5’-положении = аденозин-5’-монофосфат (адениловая кислота). Все нуклеотиды – сильные кислоты, т.к. остаток фосфорной кислоты легко диссоциирует. Нуклеозидмонофосфат + остаток фосфорной кислоты (фосфоангидридная связь) = нуклеозиддифосфат. Если в состав нуклеозида вместо рибозы входит дезоксирибоза, то + приставка дезокси-.Первичная структура ДНК – последовательность нуклеотидов (А, Г, Т, Ц). Вторичная структура – двойная спираль – состоит из 2-х антипараллельных полинуклеотидных цепей. Углеводно-фосфатные группы располагаются снаружи, а пуриновые и пиримидиновые основания – внутри. Азотистые основания 2-х цепочек избирательно соединяются друг с другом водородными связями, образуя специфические пары А – Т, Г – Ц. Специфичность спаривания азотистых оснований Кодирующие области – экзоны, некодирующие – интроны. Удаление интронов и сшивание экзонов – сплайсинг. Энхансеры – участки ДНК, повышающие уровень транскрипции.Геном – минимальный набор генов, который необходим для сохранения и пролиферации клеток (у E. сoli – 4000000 п.н., человек – 3000000000 п.н.). В геноме содержится информация, направленная на репликацию, транскрипцию и трансляцию и на их регуляцию. Репликация (Уотсон, Крик) – механизм синтеза ДНК путём удвоения. Полуконсервативная репликация – две цепи ДНК расходятся, на каждой из них образуется новая. Кроме полуконсервативного метода: консервативный и дисперсный. Репликативная вилка:Важную роль в инициации играет белок В. После расплетения цепи ДНК белок В инициирует репликацию. ДНК-полимераза: у прокариот 3 типа. ДНКpol 1, 2 и 3
9 Углеводы Углеводы – альдегиды и кетоны многоат-ых спиртов и полимеры этих соед-ий. В биосфере У >, чем всех др орг соед-ий вместе взятых. В растит мире 80-90% от СВ, в живых 2% от массы тела. В раст обр-ся из СО2 и Н2О за счет энергии солн света. Функции: 1. Энергетическая – дыхание (окисл-е), 2. Пластическая – исп для синтеза НК, А/К, орг к-т, белков, т.д. 3. Защитная – в оболочках раст тк, в мембранах, в кл/ст. 4. Опорная – целлю-лоза и др поли-сах-ды кл/ст. 5. Регуляторная – клет-чатка вызывает раздражение желудка и способ-ствует перестальтике, 6. Запас пит в-в: гликоген, крахмал, 7. Специфические – в межкл адгезии. КЛАССИФИКАЦИЯ 1. Моносахариды (МС)– не спо-собны расщ-ся без потери углевод св-в (триозы, пентозы), 2. Дисахариды – при гидролизе – 2 молекулы полисах-в (глюк, лактоза, мальтоза). 3. Олигосахариды – 3-6 молекул моносах-в (мальто-триоза). 4. Полисахариды – 6 мол моносахар (крах-мал, декстрины). Моносахариды делят на альдозы и кетозы (триозы, тетрозы, пенто-зы, ексозы,т.д.) По хим природе: нейтральные, кислые, аминосахароза. D и L формы (по распол-ю) ОН-группа у последнего хирального центра, лево- и правовращение. Устойчивы к разбавлению в неорг к-тах, в конц – дегидротируются. Могут окисл-ся, восст-ся водородом. (Написать формулы глюк, гала, рибозы, фруктозы) О=C-Н СНО СНО СН2ОН Н-С-ОН Н-С-ОН Н-С-ОН С=О ОН-С-Н ОН-С-Н Н-С-ОН ОНСН Н-С-ОН ОН-С-Н Н-С-ОН НСОН Н-С-ОН Н-СО-Н СН2ОН НСОН СН2ОН СН2ОН СН2ОН Глюкоза Галактоза Рибоза Фруктоза
Глюкоза – встреч-ся в зел растях, в крови чел-ка и жив. Входит в состав большого числа п/сах. Галактоза – входит в состав лактозы. Рибоза – и дизоксирибоза сод-ся в НК. Фосфорные производные этих соед-ий играют важ роль в окисл углеводов (пентозофосфатный путь). В . дизоксирибозе ОН-гр заменена на Н. Фруктоза – сод-ся в свободном виде в зеленых частях растений, плодах, мёде. |
обладают корректирующей экзонуклеазной активностью. ДНКpol 1 состоит из одного полипептида, обладает 5’ – 3’ экзонуклеазной активностью. ДНКpol 2 – полипеитид, обладающий полимеразной и 3’ – 5’ экзонуклеазной активностью. Участвует в процессах репарации. ДНКpol 3 состоит из 7 субъединиц. α-субъединица – полимеразная активность, ε-субъединица – 3’ – 5’ экзонуклеазная активность, β - АТФазная активность. Для репликации необходима АТФ. ДНКpol эукариот: α, β, γ, δ ДНК pol α - основной фермент при репликакции ядерной ДНК. ДНК pol γ - митохондриальный фермент – синтез ДНК в митохондриях и хлоропластах. Z
Дисахариды – сост из 2 моносах-ых остатков (гексоза+пентоза, пентоза + пентоза, гексоза + гексоза). ДС делят на 2 типа: ДС типа мальтозы – связь за счет полуацетального гидроксила одной молекулы и гидроксилов, нах-ся в др положении др МС (мальтоза, целлобиоза, лактоза). ДС типа сахарозы – связь обр-ся за счет полуацетальных гидроксилов обоих МС-ых комп-в (сахароза, трегалоза). Мальтоза – обр-ся при гидролизе крахмала под дейс-ем β-амилазы. Много в солоде и солодовых экст-рактах (сост из 2 глюкоз). Сахароза (глю + фрук-тоза) – очень много в раст. Явл-ся транспортной формой и запасной у раст (сахарная свекла, тросник). Сахароза легко гидрол-ся в кислой среде (из-за наличия в ее составе фруктозы) под действием инвертазы, обр-ся равное кол-во глю и фру. Полисахариды (ПС) – разде-ляют гомо- и гетеро ПС. В завис-ти от биол функции их делят на резервные и стр-ные. В отличие от МС олигосах-в они или не раств-мы в воде или обр-ют очень вязкие коллоидные р-ры, не имеют сладкого вкуса, трудно выделить из тканей. Крахмал – сост из ПС (амилоза и амилопек-тин)-91-97%, 0,2-0,7%- мин в-ва (фосфаты), жир к-ты (пальметиновая, стеарино-вая) – 0,6%. Явл резерв. питат в-вом. Целлюлоза – п/сах, сост из β-D-глюкопи-ранозных звеньев с 1-4-связ. Гликоген - главный энерг-ий и углев-ый резерв чел и жив. разветвлен полимер, обр-ый остатка-ми D-глюко-пиранозы. При кисл-ом гидролизе обр-ся глю, мальтоза и изомальтоза. Z
|
|
|
11 Основные св-ва и мех-м действия ферментов.(S) Скорость V ферм-ых реакций сущ-но зависит от t. Завис-ть const V (k) от t выраж-ся ур-ем Аррениуса: k = e-Ea/RT. Ln k =-Ea/RT.
Д Н |
мол-л к дальнейшей хим модификации. Уч-ют глу, аск, гис, тир, цис. Электрофильно-нуклеофильный к-з (ЭНК) В а.ц. У есть эл-ые и нукл-ые гр, прин-ие уч-е в акте катализа. Эл гр – акцептор электронной пары (ионы Ме: Zn? Fe3+) Н-гр – донор эл/пары (гис, ОН-гр, сер, SН-гр, цис). Нукл-ые гр Е вступ-ют в р-цию нукл-го замещения, обр-ся ковал-ые промежут-ые соед – ковалентный катализ. Н-гр стан-ся на место занимаемой гр, обр-ся ковал-ый интермедиат, далее распад на продукты р-ции. Ингибирование – действие ингибиторов препятствующих обр-ю продуктивного ЕS. Е имеющие субъединичное строение имеет аллостерический центр, кот отдален от а.ц.. С ним связ-ся аллост-ие эффекторы (не имеющие сродства кс S), изменяют конформацию Е. Е, кот регул-ют акт-ть метаб-их путей должны гибко реагировать на изменение конц S. Это отражает кооперативность. «+» кооп-ть: S связ-ся с 1 а.ц. и увелич-ет сродство к S др а.ц. Способствует быстрому ответу Е на изм конц S/ «-» кооп: половина стан-ся неактивной. Обеспеч-ся пост-во ферм-ой акт-ти при колебаниях конц. S. Ковал-ая рег-ция Принцип – ковал-ое измен-е Е. Эти изм-ия вызыв-ся др Е. 1. Обратимые ков изменения. Отн-ся фосфорилирование – дефосфор-е. Фосф-е реагир: пируватдегидрогеназный мультиферм-ый комплекс, триацилглицеролипаза и т.д. 2. Необратимые ков превращения. Превращ-е зимогена в фермент (пепсиногена в пепсин). 3. Биосинтез de novo Конститутивные Е (постоянно в кл) и адаптивные. П-р конкур. Ингиб: стрептоцит и N-аминобензойная к-та. Z |
|
|
10 Строение ферментов. Основная часть ферментов является белками. Масса от 15 тыс. до млн. Да. Состоят из нескольких полипептидных цепей, т.е. имеют субъеденичное строение. Любая биологическая активность определяется теми R гр, которые находятся на поверхности белков и способны образовывать слабые связи с др. R гр. биомолекулами. Ферменты являются глобулярными белками, могут быть простыми и сложными. Белковая часть сложных ферментов называется апоферментом, а молекула в целом холоферментом. Небелковые компоненты коферменты. Они действуют как акцепторы(доноры) функциональных групп удаляющихся от субстрата или присоединяющихся к нему. Если небелковая часть прочно связана с белковой и не отсоединяется, от неё в ходе реакции, то её называют простетической группой(кофакторами). Функциями коферментов или простетических групп явл.: 1. участвуют в акте катализа. 2. осуществление контакта между ферментным белком и субстратом. 3. стабилизация апофермента. Апофермент усиливают каталитическую активность небелковой части, определяет специфичность для ферментов. Функции коферментов. 1.участвуют в окислительно-восстановительных реакциях, т.е. коферменты дегидрогеназ(НАД, ФАД, ФМН), гемопротеиды(цитохромы, каталаза, пероксидаза). Вит. В12 участвует в переносе водорода, вит.С – восстанавливающий агент. 2.участвуют в других реакциях катализа. Тиамин - окислительное декарбоксилирование α-кетокислот. Пиридоксальфосфат – в реакциях трансаминирования, рацемизации и декарбоксилирования. Фоливая кислота – перенос одноуглеродных фрагментов. Биотин – в реакциях карбоксилирования. Активный центр – та область фермента, в которой происходит связывание и превращение субстрата. Каталитическая зона(каталитический сайт) – контактир. с подверг-ся превращению фрагмента субстрата. Группировки контактирующие с непревращ-ся фрагментами субстрата – зона связывания(субстрат-связывающий сайт). Активный центр построен из а/к остатков, которые пространственно сближены в линейные последовательные структуры белка, они могут находится далеко друг от друга. |
Фермент-субстратный комплекс образуется за счет слабых связей(исключение протеазы – ковал. связь). Активный центр обуславливает специфичность действия: 1. абсолютная специфичность (только 1 субстрат) 2. групповая (несколько субстратов) 3. специфичность по отношению к определенному типу реакций 4. стереохимическая или пространственная специфичность. Z |
|
|
14 Классификация липидов Липиды – неоднород в хим отн-ии в-ва, общим св-вом кот явл хорошая раств-ть в неполярн орг раств-ях (эфире, ацетоне, хлороформе). Сост из сложн эфиров высших ж/к с глицирином (ил некот др спирт). Классиф: 1)нейтральные жиры и свобод ж/к, 2)фосфолипиды, 3)гликолипиды, 4)стероиды, 5)воска, 6)терпены.
Н Ф |
Сфинголипиды –(ж/к, фосфат и х гр). вместо глицер – сфингозин – аминоспирт (18 углер ат чаще). Церамиды – N-ацильные производные свингозинов, в кот аминогр ацилирован ж/к. Сфингомиелины – фосфохолиновое произв-е церамидов. Сод поляр головки и 2 неполярн хвоста (1 – длин цепь сфингозина, др – этерифицир ж/к). Цереброзиды явл цераминмоносахаридами (отн к гликосфинголипидам). Сод углевод ост (гексозы), фосфорн к-та отсутст. Нах преимущ в тканях мозга, игр важ роль в функц-ии биомембран. Ганглиозиды – сост из гетероолигосахаридов связ гликозид св с церамидом + ост маловой к-ты. Нах в сером в-ве мозга, на внешн пов-ти мембран. В крови неск фракций липопротеинов ВП и НП (высш и низш плотн). Хиломикроны – капельки липид, стабилиз небольшим поверхн слоем белка. Липопротеиды – сферич частицы, диаметр уменьш с уменьш плотности. Ядро частиц сод-т неполярн лип (триацилглиц, эстерифиц холин), ядро окруж оболочкой (фосфолипиды, бел и своб холестерин). ЛПНП и ЛПОНП вызыв атеросклероз – проникн в стенку артерии, образ бляшки (триацилглицерин и холестерин). Z |
|
|
15 Энергетический обмен Метаболисческие пути разделяют на 3 процесса: 1)Анаболические пути - синтез компонентов различных структур организма и соединений обеспечивающих его функционирование(синтез белка); 2)Катоболические пути - окислительные процессы, поставляющие свободную энергию и запасание её в форме высокоэнергетических фосфатов; 3)Амфиболические пути - связывают анаболические и катоболические пути(ЦТК). В митохондриях свободная энергия окисления S запасается в АТФ в ходе окислительного фосфорилирования. Дыхательная цепь состоит из ферментов и переносчиков электронов, которые улавливают и переносят восстановленные эквиваленты, в конечном счёте направляют их реакцию с кислородом с образованием воды. Они расположены во внутренней мембране митохондрий. В дыхательной цепи атомы Н+ и е- переносятся от более электроотрицательных компонентов к более эллектроположительному кислороду. При этом изменение окислительно-восстановительного потенциала при переходе от НАДФН/НАД+ к О2/Н2О составляет 1,1В. Дыхательная цепь: начинается с НАД-зависимых дегидрогеназ, проходит через флавопротеины, включает цитохромы и заканчивается молекулярным кислородом. Стадии: А)Убехинон катализирует двухэлектронное окисление НАДН2. этот комплекс функционирует как НАДН2КоА-оксидоредуктаза. Б)Сукцинатдегидрогеназа превращает сукцинат в фумарат. Эта реакция сопряжена с переносом электрона на КоА. В)Убехинонцитохром-с-оксидоредуктаза. Цитохром-с содержит Fe(II)или Fe(III)=>обозначают какFec(II)или Fec(III) Цитохром-с катализирует реакцию: КоQH2+2Fec(III)-->KoQ+2Fec(II)+2H+ Г)Цитохром-с-оксидаза переносит электрон от ферроцитохрома на О2 с образованием Н2О: 4Fec(II)+4H++O2 2Fec(III)+2H2O Одновременно функционирует механизм улавливания свободной энергии и превращения её в высокоэнергетические фосфаты. Химическая энергия окисления переходит в электрическую и накапливается в форме мембранного потенциала. Обратный поток протонов по градиенту их концентрации к матриксной строме мембраны осуществляется через АТФ-синтетазный |
комплекс. Это служит движущей силой для синтеза АТФ. На каждые 2Н+ прошедшие через мембрану синтезируется 1АТФ. Таким образом АТФ-синтетаза - это протонный насос, использующий движение Н+ для синтеза АТФ. Дыхательный контроль скорость дыхания митохондрий контролируется концентрацией АДФ. Это обуславливается тем, что окисдение и фосфорилирование жёстко сопряжены, т.е. необходимо фосфорилирование АДФ. Ганс и Уильямс разработали 5 состояний дыхательного клнтроля: 1) Доступность АДФ и S; 2) Доступность S; 3) Возможности дыхательной цепи при насыщающих количествах S и компонентов; 4) Достаточность АДФ; 5) Доступность О2 Дыхательный контроль - процесс, позволяющий организму избегать неконтролируемого самоокисления. Z |
|
|
16 Биотехнология – пром исп-ие биол проц0в на основе м/о, культур кл и ткан, и отдел сртр-р и комп кл жив и раст с задан-ми св-ми. Назв науки происх от греч слов: биос – жизнь, teken - искуство, логос – наука. Ее становление ученые делят на 4 периода (Блинов 1995г.): 1. Эмперический (греч – опытный) – доисторический, самый длит, охват около 8000 лет, древ народы методом проб и ошибок науч-сь изгот-ть пиво и хлеб. Молоч-кисл прод нач получать позднее, стали делать квашен капусту, силосование, медо-вуху, мочку волокнис раст. 2. Этиологический (причины) охватыв 2 полов 19в и 1/3 20в. Связан с Луи Пастером, основопол научной микробиол. (Кох, Листер, Ивановский). 1982г – вирус тобачной мозайки. Доказали индивид-ть м/о, получили их в чистых культурах, научились их размн-ть в пит ср, исп-ть в целях воспроиз-я. Началось получ-е ацетона, бутанола, лимон и молоч к-т. Клюйвер и Перкин в 1933 разраб теорию и технич подходы глубин культ-я. 3. Биотехнологический началось внедр в биот-ию крупно-масшт-го гермет-го оборуд-я. Началось произ-во антибиот (1939-45). За 40 лет этого периода были решены осн задачи по констр-ию, созд и внедр в практику необх оборуд – био-реакторов. 4. Генотехнический (возникновение) с 1972г. С работ Крика и Уотсона по установл стр-ры ДНК. В 1982г поступ в продажу чел инсулин, выраб киш палочкой, кот несет в себе искус-но встроенную ген инф-ю об этом гормоне. Также получили интерферон, фактор никротиза-ции опухоли TNF интерлейкин-2, соматотропный гормон. Цели: 1)активация и поддерж-е путей обмена кл, ведущих к накопл задан прод при домин-ии над др р-циями обмена у культ-го орг-ма, 2)получ кл или их сост-ых частей (преим ферм-в); для направленного измен-я слож молекул (рестриктаза, изомераза, пеницилинамидаза). 3)углубление и соверш-е форм рДНК для биот-ии и кл инжен-ии. 4)создание безотход и экол-ки безоп биот-их проц, 5) соверш-е и оптимиз-я аппарат-го оформления биотехн-их проц-в с целью достиж max выходов конеч прод при культ-ии естеств видов с измен наследст-тью методами клет и генной инженерии, 6) повышение техникоэкономич показ-лей биотехн проц-в по сравн с сущ-ми. Объекты и методы биотехнологииии: вирусы, бактерии, грибы – микро- и макромицеты, протозойные организмы, кл (ткани) растений, жив и чел, нек биогенные и функц-но сходные с ними в-ва (ферменты, простагландины, лектины, НК). |
Объекты биот-ии м.б. представлены организ-ми частицами (вирусы), кл (ткани) или их метаболитами (первичные, вторичные). Методы биотехнологииии – крупномасштабное глубин культивирование биообъектов в период, полунепрерывном или непрерывном режиме, выращ-е кл растит и жив тканей в особых усл. Другие методы явл общими, напр с методами в микробиол, биохимии, биоинженерии, орг химии, т.д. Следует особо выделить методв клет и генной инженерии, когда в экспер-ых усл удается созд-ть клетки с заведомо известными свойствами. Z |
|
|
17 Технология рекомбинантных ДНК. Рестриктазно-лигазный 1) Определённой рестриктазой (Eco RI) разрезают молекулу ДНК, содержащую сайты узнавания, на фрагменты, которые несут идентичные взаимокомплементарные липкие концы. 2) Препараты различных молекул ДНК тоже гидролизуют этой рестриктазой, смешивают их и подвергают отжигу, т.е. реассоциации фрагментов за счёт комплементарных взаимодействий по их липким концам одной и той же специфичности. 3) Добавляют в реакционную смесь фермент ДНК-лигазу, которая катализирует ковалентное объединение ассоциированных фрагментов ДНК, в том числе исходно принадлежащих к разным молекулам ДНК (щелочная фосфатаза E. coli). Коннектор – объединение двунитевых фрагментов ДНК путём наращивания (ферментативного) на их концах однонитевых комплементарных участков. К 3'-концу с помощью концевой дезоксинуклеотидилтрансферазы присоединяется олиго-dA сегмент, а к концу другого сегмента – олиго-dT сегмент. Затем молекулу обрабатывают ферментами ДНКpol 1 и ДНК-лигазой. Создание линкерных последовательностей – основан на введении во фрагмент ДНК искусственных сайтов рестрикции (короткий фрагмент ДНК с тупым концом, содержащий последовательности для разрезки специфическими рестриктазами). Их получают химическим синтезом, присоединяя к ДНК с помощью ДНК-лигазы фага Т 4. Гидролизуют рестриктазой для получения липких концов. Внутренние сайты рестрикции метилируют. Способы получения гена. Выделение из ДНК: воздействием рестриктаз, гидродинамическим способом или ультразвуком. Химический или ферментативный синтез. Очень трудно в связи с вырожденностью генетического кода. Используют для генетического зондирования при ДНК-ДНК-, ДНК-РНК-гибридизации, для праймеров (коротких цепочек ДНК, используемых в качестве затравок синтеза ДНК при ферментативном синтезе). Исходным материалом являются дезоксирибонуклеозиды. Они связываются 3' – 5' фосфодиэфирными связями. При ферментативном синтезе применяется фермент полинуклеотидфосфорилаза бактериального происхождения. Обратная транскрипция. Используют обратную |
транскриптазу. Матрицей служит мРНК с поли-А 3'-концом, а затравкой является цепочка полидезоксириботимидиновой кислоты с поли-Т концом. Он присоединяется к dA с образованием ДНК и РНК, Вблизи 3'-конца – шпилька – затравка для синтеза второй цепи кДНК (используются ДНКpol 1 и обратная транскриптаза). Шпилька удаляется нуклеазой S1. Вектор – это специально сконструированная молекула, содержащая регуляторные участки и другие элементы, необходимые для переноса, реализации и поддержания генетической информации в рецепиентной клетке. Плазмида – кольцевая молекула ДНК, стабильно передающаяся потомству бактериальной клетки независимо от хромосом. PBR 322 – гены устойсивости к тетрациклину и ампициллину. В один из этих генов встраивают нужную информацию и отбирают по устойчивости к определённому антибиотику. Фаги – содержат линейную ДНК. Способен нести фрагмент ДНК 6000 – 10000 п.н. Левая область ответственна за синтез структурных единиц, средняя – за лизогенный путь развития, правая – содержит сайт инициации репликации, гены, кодирующие ферменты репликации. Космида – молекула ДНК, несущая плазмидный репликатор, уникальные сайты рестрикции, ген-маркер, cos-сайт фага. Фазмида – это линейная двуцепочечная молекула ДНК, в которой объединены участки генома фага , ответственные за литическое развитие с линеаризованной плазмидной ДНК. Идентификация. Складывается из: 1) Отбор трансформированных клеток по гену-маркеру используемого вектора. 2) Обнаружение клеток не только несущих ген, но и синтезирующих продукт. Предложено 2 группы методов. 1-я группа основана на прямом анализе ДНК или секвенировании: 1-й метод Максама-Гилберта. Используются химическая модификация нуклеотидов с последующим расщеплением по модифицированным остаткам. Вводится радиоактивная метка, делится на 4 порции и в каждую вводится химический реагент, модифицирующий только один тип нуклеотидов, затем производится расщепление по модифицированным остаткам. Полученные фрагменты ДНК наносят на пластинку с полиакриламидным гелем. Под действием электрического тока фрагменты движутся от + к - , затем делают рентгенограмму и определяют |
|
|
последовательность. 2-я группа. Методы основаны на идентификации продукта гена. Если встраиваемый ген кодирует человеческий белок, то по иммунной реакции. -галактозидаза, то клетки отбирают на среде с субстратом этого фермента (лактозой). 3-я группа. Если встраиваемый ген кодирует фактор роста – клетки отбирают культивируя совместно с ауксотрофными мутантами. Z |
ДНК – это линейная система биополимеров, имеющая пространственно сложный уровень организации. Линейными молекулами являются нуклеотиды ковалентно сшивающиеся друг с другом, с образованием фосфодиэфирных связей между 5’ – фосфатом одного нуклеотида и 3’ – OH группой сахара соседнего нуклеотида. В состав ДНК входят пуриновые и пиримидиновые основания, моносахарид пентоза и фосф. кислота.
|
|
|
18 Генно-инженерные работы с растениями Существует два способа обеспечения растений азотнмм питанием de novo; биологический (фиксация молекулярного азота живыми организмами) и химический (внесение азотных удобрений). Биологическую фиксацию осуществляют в основном симбиотические микроорганизмы, В настоящее время известны четыре главные системы симбиоза: Rhizobia - бобовые, Azolla-Anabaena - рис, Actinomyces - деревья, Spirillum - травы. Из всех известных в настоящее время азотфиксаторов лучше всего изучены ризобии, У них гены, вовлеченные в процесс азотфиксации, обозначаются индексами nif и fix. nif-гены кодируют ферменты и факторы нитрогеназного комплекса, fix-гены -все остальные гены, продукты которых участвуют в азотфиксации, Кроме того, большое значение имеют гены syin— определяют симбиоз между растением и ризобиями и формирование клубеньков. Установлено существование hsn-генов - определяют видовую специфичность взаимодействия ризобии с данным видом бобовых; и enf—генов — повышают эффективность образования клубеньков. Есть и др. гены, однако они еще мало изучены. 1.1. Гены азотфиксации них регуля ция. Область nif-генов состоит, из 17 генов, организованных в 8 единиц транскрипции (оперонов). Два регуляторных гена А и L сгруппированы в одном опероне и, кодируют белки, определяющие экспрессию всех других nif-оперонов. Продукт nif А-гена - р-фактор РНК-полимеразы - активатор транскрипции всех других генов, а продукт nif L-гена подавляет транскрипцию всех др. генов при наличии в клетках большого количества доступного азота, а также при высокой концентрации кислорода. 1.2. Генно-инженерные работы в обл. биол. фиксации N2. Основная часть генов nif-области является высоко консервативной. При трансгенозе в другие виды бактерий продукты этих генов легко "вписываются" в метаболизм гетерологического хозяина. Так, в рекомбинантной E.coli (родственной азотфиксаторам) в анаэробных условиях имела место нормальная экспрессия nif—генов и успешная азотфиксация. Наряду с трансгенозом nif-генов в бактерии разрабатывается генно-инженерный проект по переносу nif-функций в высшие растения, чтобы обеспечить связывание азота непосредственно в растительных тканях, независимо от наличия особых симбиотических организмов. Симбиотические отношения между ризобиями и их естественными бобовыми партнерами определяются сложной системой sim-генов. Перенос этих генов клеткам Agrobacterium tumefaciens (способны инфицировать широкий круг двудольных растений) привели к формированию клубеньков, но в таких клубеньках отсутствовали некоторые структуры, бактероиды, не было азотфиксации. генно-инженерной задачей доступной для решения в ближайшем будущем станет повышение эффективности существующих систем азотфиксации с помощью известных приемов, Существует генно-инженерный проект, рассчитанный на создание ре-комбинантных растений злаков либо с амплифицированными генами белков зерна богатых лизином, либо с генами этих белков, подстроенных под более сильные промоторы. Второй путь увеличения свободного лизина в зерне предполагает химический синтез генов, которые программируют неприродные полипептиды, построенные в основном из незаменимых аминокислот. Был получен ген НБНА кодирующий белок с высоким содержанием лизина. Этот белок легко деградировался в организме животных. Этот ген был встроен в плазмидную конструкцию, созданную на основе плазмид Agrobactericum rhisogenes и A. tumefaciens. В качестве селективного гена был использован ген антибиотико-резистентности. Удалось трансформировать клетки растений табака этими рекомбинантнымм,плазмидами и регенерировать химерные растения, в которых ген НБНА экспрессировался. программируя синтез искусственного белка. 4. Генно-инженерные работы по созданию растений, устойчивых к ранним заморозкам. под устойчивостью (чувствительностью) растения к заморозкам понимают способность (неспособность) противостоять механическим повреждениям их тканей кристаллами образующимися при низкой температуре льда. Существенный фактор повреждения многих растений ранними заморозками - сапрофитная микрофлора, главным образом представители, родов Pseudomonas, Erwinia, Xantomonas и др. Клетки данных микроорганизмов способны синтезировать определенный белок формирования кристалов льда, локачизующийся во внешней мембране этих бактерий и являющийся превосходным центром кристаллизации льда уже при температурах -1,5 - 1,8°С. Стерильные же растения не повреждаются заморозками вплоть до температур порядка -6-8°С. В основе генно-инженерного подхода к борьбе с повреждающим действием ранних заморозков лежит тот Факт, что БФКЛ мутанты Ps. syringae.n Ps. fluorescens как природные, так и экспериментально полученные, теряют способность повреждать сельскохозяйственные растения (цитрусовые, томаты, картофель) при низких температурах. Поэтому возникла идея получить стабильные БФКЛ мутанты названных бактерий, неспособные к реверсии к дикому типу, и вытеснить с их помощью природную микрофлору, синтезирующую БФКЛ. 5. Генно-инженерные работы по созданию растений, устойчивых к гербицидам. Недостаток многих гербицидов - способность воздействовать не только на сорняки, но также подавлять и многие |
основанных на увеличении дозы гена, усилении транскрипции генов, продукты которых образуют узкое место в каскадном механизме азотфиксации, путем введения более сильных промоторов, 2. Генно-инженерные работы в области повышения эффективности фотосинтеза. Фотосинтез, осуществляемый растениями, характеризуется в целом весьма низкой эффективностью, т.к. фотосинтетический аппарат использует лишь 3—4% падающего света. переключение С3-пути фотосинтеза (злаковые) на С4-путь (кукуруза), который более эффективный, путем трансгеноза группы генов. Первый этап представляет собой карбоксилирование, которое у Сз-растений происходит путем взаимодействия свободного углекислого газа с основным доступным акцептором - рибулозо-1,5-6ифосфатом, в результате чего образуется две молекулы 3-фосфоглицерата: СО2 Н2О С5 С6 С3+С3, Реакция катализируется карбоксилазой рибулозо-1,5-бифосфата (РБК). которая локализована на обращенной к строме поверхности мембран тила-коидов. Эта реакция - лимитирующая стадия в функционировании цикла Кальвина. У растений и фототрофов на свету идет ускорение этой стадии. Второй стадией цикла у С3-растений является восстановление 3-фосфоглицерата за счет энергии фотореакции до триозофосфата. На первой стадии у С4-растений акцептором СО2 выступает фосфоенолпируват, который в результате реакции карбоксилирования превращается в оксалоацетат, последний далее в малат и аспартат: СО2 С3 С4 Реакция осуществляется ферментом - фосфоенолпируват-карбоксилазов (ФЕПК). ФЕПК и субстрат расположены клетках, соприкасающихся с воздухом, а образовавшиеся C4 соединения транспортируются в клетки которые служат основным местом локализации фотосинтетической системы Здесь образовавшиеся С4 соединения подвергаются декарбоксилированию, в результате чего создается высокая концентрация CO2, вступающего в цикл Кальвина. Эффективность фотосинтеза у С4- растений повышается Основное внимание в генно-инженерных проектах уделяется механизму повышения концентраций СО2 и повышению сродства РБК к СО2. Более простой задачей явился бы перенос генов ФЕПК и декар-боксилазы в Сз-растения, не элиминирующий при этом собственные РБК Сз—типа3. Генно-инженерные работы в области увеличения содержания незаменимых аминокислот. Улучшение качества зерна основных злаковых культур, прежде всего изменение аминокислотного состава запасных белков. в запасном белке большей части злаковых имеется дефицит лизина и в меньшей степени треонина, что заметно снижает их пищевую и кормовую ценность культурные растения. К числу таковых относится глифосат, который подавляет синтез ряда важнейших аминокислот и поэтому убивает не только сорняки, но и культурные виды растений,. Применение гербицидо-устойчивых растений позволит существенно видоизменить тактику борьбы с сорняками, В настоящее время обнаружено большое количество ферментов, разрушающих те или иные гербициды. Целый ряд ферментов получен в очищенном виде, для ряда из них клонированы индивидуальные гены. Введение таких генов в растения, чувствительные к гербицидам, может обеспечить возникновение устойчивости при адекватной экспрессии в нужном клеточном компартменте Z |
|
|
19 Генетическая инженерия с/х животных Для трансформации используют прямые методы и методы с использованием векторов. Прямые методы: 1) микроинъекция-клетку фиксируют в микроманипуляторе, делают укол либо в цитоплазму либо в ядро ( в зависимости от того, что кодирует ген). Ген может встраиваться в хромосому или существовать сам по себе. 2) слияние протопластов-в суспензию отдельных клеток вводят чужеродную ДНК и ионы кальция, т.к. ДНК имеет фосфорные группировки кальций связывается с ними и выпадает в осадок. Он оседает на клетке и попадает внутрь. Используют крупные фрагменты ДНК или отдельные хромосомы. 3) ДЭАЭ-декстрановый метод- ДЭАЭ-декстран используют или переносчик при облегчённой диффузии. Он захватывает ДНК на клеточной поверхности и переносит через мембрану. Чаще используют для половых клеток, реже для зиготы. Для трансформации многоклеточного зародыша используют векторные методы: Используют 1) ретровирусы на основе лейкоза мышей. Это РНК-содержащий вирус. При попадании в клетку на РНК строится ДНК-копия, которая встраивается в геном. И этот геном реплицируется животной клеткой. Векторы на основе 2) летальных вирусов, вирус SV-40 – это ДНК содержащий вирус, в него встраивают чужеродный ген. 3) Челночные векторы – работают и в бактериях и в клетках животных. Для животных он был сконструирован из ДНК вируса, вызывающего доброкачественную опухоль; из плазмиды PBR 322. В случае использования методов прямого переноса получают полностью трансгенное животное (каждая клетка несёт чужеродный ген, однако не во всех животных он работает, т.к. может попасть в область молчащих генов. Если трансформации подвергается многоклеточный зародыш, то получают частично трансгенное животное. Гормон роста – соматотропин: синтезируется передней долей гипофиза, стимулирует рост скелета и мышц, воздействует на обмен углеводов и липидов. Было предположено использовать его для ускорения роста и увеличения массы с\х животных. Но эти препараты нужно было вводить ежедневно. Свиньям вводили ген гормона роста КРС, при этом ускорялся рост и происходило увеличение мышечной массы. Свиньи потребляли такое же количество корма, но усваивали его эффективнее. Но есть и минусы этого метода: многие свиньи оказывались стерильными, у других возникал сахарный диабет, у некоторых были хрупкие кости. |
Белки молока – важный белок-казеин. Цель работ-увеличить его содержание в молоке. Встраивали дополнительные копии гена, отвечающего за синтез казеина и некоторых животных удалось получить молоко с повышенным содержанием белка. Другая проблема – обсеменённость и подверженность к скисанию. Животным встраивали ген, ответственный за синтез фермента лизоцима, который повреждал бактериальные клетки и молоко долго хранилось. Присутствие молочного сахара – встраивали ген, ответственный за синтез галактозидазы, в результате получали (животные давали) безлактозное молоко. Предприняты попытки по получению молока с физиологически-активными веществами. Удалось получить интерлейкины, фактор некроза опухолей, фактор свёртывания крови VIII, ингибиторы протеолитических ферментов. Увеличение выхода и качества шерсти овец – лимитирующим фактором являются серосодержащие аминокислоты. Чем их больше в рационе и чем их больше синтезируется в рубце, тем больше выход шерсти и выше качество. Увеличение числа и активности оперонов биосинтеза серосодержащих аминокислот. Z |
|
|
20 Основы культивирования продуцентов Периодическое культивирование микроорганизмов – метод культивирование микроорганизмов, характеризующийся однократным засевом среды в начале и одноразовым получением биомассы в конце процесса, обычно после полного использования субстрата. Периодическое культивирование микроорганизмов может быть представлено статическими, динамическими и продленными способами культивирования. Статические процессы осуществляются в стационарных условиях без перемешивания. При этом аэробные микроорганизмы обычно развиваются на поверхности жидкой или твердой среды (поверхностное культивирование), например, поверхностный способ жидкофазного культивирования Aspergillus niger для получения лимонной кислоты. Периодические динамические процессы осуществляются с помощью перемешивания и аэрации: в жидких средах на качалках, в биореакторах при помощи мешалки и барботера. Твердофазное культивирование (ТФК) – это выращивание микроорганизмов в массе измельченного влажного твердого субстрата. Технологическими вариантами ТФК являются компостная куча, поверхностное культивирование, перемешиваемый слой, культивирование во вращающихся ферментерах, ТФК с перемешиванием и аэрацией и т.д. К продленным способам культивирования относятся: 1. отъемно-доливной способ, когда порциями в аппарат подается среда и производится отъем культуральной жидкости; 2. периодическое культивирование с подпиткой, когда в культуральную жидкость добавляется по специальной программе отдельные компоненты питательной среды и периодически отбирается часть культуральной жидкости; 3. диализное культивирование в гильзе, не проницаемой для клеток, но пропускающие растворенные вещества; 4. батарейный способ, когда микроорганизмы развиваются в ряду последовательно соединенных ферментеров. Z |
|
|
|
21 Гибридомные технологии моноклональных антител. (а/т) Отн к клет инженерии жив. Разраб в 1975 г. Мильштейн и Келлер. Сначала работал с опухолевыми кл (миеломными), получ гибриды миеломных кл или гибридомы, показ, что они продуц-ся иммуноглоб обоих родит форм. Это привело на мысль сливать миелом кл и антителапродуцир-е. В 1974г получ гибрид миел кл и лимфоц селезенки мыши иммуниз-ные эритроцитами барана. Получ гибрид продуц. а/т против этих эритроц. Получ. МКА. Подоп животные иммун-ют антигеном(а/г), против к-х хотят получ а/т. Напр. берут поверхн белки вир НВs. А/г ввод внутрибрушинно до 200 мкг на 1 кг веса, ч/з 2 нед 100 мкг и ч/з 3 дня у мыши удал. селез, раздел ее кл. Затем их помещ на пит ср, центриф и отбир отдельно В-лимфоциты. Пар-но с кл селез получ мутантную миелом линию, у них блокирован обходной путь биосинтеза НК. Далее проводят слияние получ миелом кл и В-лимф в присут ПЭГ, Са2+, 40С. Гибриды В-лимф, отдельн миел кл и гибриды В-лимфоц и миеломы. Далее кл помещ на пит ср с добавл в-ва аминоптерина( блокирует пямой путь биос-за НК). Погибают гибриды миелом, В-лимф, негибри-домные кл и выжив только гибриды В-лимфоц и миеломы. Отбир те из них, к-е дают а/т. В лунке иммуноклональной планшеты вносят пит ср и разводят так, чтобы в кажд лунку попало по одной кл. После размнож кл в лунке провер их на образ а/т – добавл а/г. Содержимое лунки переносят в колбу, затем в ферментер и получ требуемое нам в-во. Полученные т.о. а/т носят назв МКА. Колич-ое опред различ в-в. (ИФА, ИРА, ИфиА). Базир-ся на сендвич методе. На твердом носителе прикреп а/т первой специфичности. Ч/з носитель пропускают исследуемый р-ор. Если в р-ре присутствуют исследуемые в-ва, то они связ-ся с а/т и для его идентификации добавл а/т 2 с меткой. Служат для обнаружения инфекц забол, диагн ссс, диабета, рака, Аутоиммунных забол, контроль за уровнем гормонов, для обнар наркотиков, допингов в крови, установл беременности на ранних сроках. В животноводстве исп-ся для опред инфекц забол и фертиль ности (плодовитости). Сравн конц-цию прогестерона в теч овуляционного цикла. Во время овуляции мала, затем возраст до max. (в крови и молоке пар-но). |
Если животное стерильно, то конц постоянно высока. В растен-ве для определ вир забол. В 1982г анг учен Фарандс обнар а/г на опухолевой кл (Cal-Ag), а затем а/т. К Cal-Aт пришив I и ввод в орг пациента. Ч/з нек время проводят рентгенограмму и по ней опред истинное положение опухоли и ее метостазы. Терапия. К Cal-Aт пришив токсин (растит токсин – рицин из семян клещев, дифтерийн токсин, α-амоницин из яда бледной поганки), состоящий из двух субъединиц А и В, В отвеч за связывание с углеводами на мемб-не, а А яв-ся токсичной частью. Исп-ют А часть. Лечат рак толстой и прямой кишки. |
|
|
22 Безопасные вирусные вакцины. Препараты, полученные из бактерий, вирусов и других м/о или из их продуктов жизнедеятельности, применяемые для активации иммунитета у людей и животных, в первую очередь для профилактики конкретных инфекций. Классификация 1)вакцины, полученные от эу- и прокариот (живых и убитых); 2) из клеточных компонентов; 3) из продуктов обмена клетки; 4) вирусные: живые, инактивированные, из вирионов; 5) геномные. Живые вакцины – аттенюированные (ослабленные) получают по схеме: выращивание в ферментёре → сепарирование → ресуспендирование (смесь:желатин+сахароза, вода)→розлив во флаконы. Ослабляют нагреванием или обработкой формалином. Иммуногенность или способность образовывать антитела(АТ) от наличия на поверхности белка эпитопов, состоящих из 6-8 аминокислотных остатков. Поколения вакцин: 1 поколение: субъединичные-полноразмерные с несколькими типами эпитопов вызывают образование нескольких видов АТ; 2 поколение: на основе эпитопов. Эпитоп прикрепляют к белковому носителю, потому что он очень мал и может уничтожится в организме. Эти вакцины не вызывают заболевания, не несут генетической информации, вызывают тот же спектр реакций, что и нативные вирусы. Можно получить генно-инженерным методом; 3 поколение-на основании консервативных эпитопов. Они есть у всех вирусов, в нативных условиях себя не проявляют; 4 поколение-живые аттенюированные возбудители. Из вирусов удаляют часть генов, остаются только необходимые для размножения. Вызывают иммунный ответ, а заболевания не вызывают. Вакцины против гепатита В: вирус вызывает болезнь печени (вирус передаётся через кровь и половым путём). В плазме крови присутствует в виде сферических или нитевидных частиц; лишён ДНК; полноразмерный вирион содержит ДНК. ДНК данного вируса двухцепочечная. 1 цепь длинная и фиксированная, другая короткая с изменяющейся длиной, которая определяет подтипы. Вакцины против вируса гриппа. Вирус имеет липотропную оболочку. Главным белком является гемоглютинин. Было обнаружено 4 эпитопа (2 снаружи-А и В, 2 внутри мембраны-С и D). Их клонирование в E. coli приводит к образованию гемоглютинина. Вакцины против ВИЧ. Это РНК содержащие вирусы. РНК двухцепочечная, покрыта капсулой и липотропной оболочкой с шипами белков GP 120 и GP 41. Белок GP 120 в составе ретровирусного вектора встраивают в макрофаг. Иммунная система воспринимает этот макрофаг как чужеродное тело и уничтожает его. |
23.52 Общая характеристика пропионово-кислого брожения. Пропионово-кислые, или пропионовые, бактерии были впервые выделены из сыров в 1878 г. Фитцем, и сыроделие — самая древняя биотехнология, их использующая. Свое название они получили в связи с образованием при брожении больших количеств пропионовой кислоты. Характеризуются выделением в значительном количестве корриноидов (витамин В12) и каталазы, даже при росте в анаэробных условиях. Представлены бесспоровыми, неподвижными грамположительными палочками и объединены в семейство Propioni-bacteriaceae. Пропионово-кислые бактерии по современной классификации подразделены на четыре вида, вместо одиннадцати ранее описанных. В последние годы в род Propionibacterium предложено включить кокки, участвующие в брожении. Пропионовые бактерии содержат все ферменты цикла трикарбоновых кислот и имеют с палочковидными бактериями много общих фенотипических свойств и высокую степень гомологии ДНК. Кокки выделяют из молока и сыров на ранних стадиях созревания. В отличие от типичных пропионовых бактерий они растут на поверхности плотных сред. Использование пропионово-кислых бактерий. Пропионово-кислые бактерии давно уже используются при изготовлении твердых сычужных сыров с высокой температурой (55 — 58 °С) второго нагревания. К таким относятся сыры сортов «Советский», «Швейцарский», «Бийский», «Алтайский». В их созревании кроме P. shermanii участвуют также Streptococcus thermophilus, Lactobacterium helveticum, L. lactis. Молочио-кислые бактерии превращают лактозу в лактат, осуществляют протеолиз казеина, образуют ароматические вещества. Про-лионовые бактерии из лактозы и лактата синтезируют пропионовую, ксусную кислоты и выделяют углекислоту, которая в значительной степени обусловливает рисунок сыра. Пропионовым бактериям присуща высокая липолитическая ак-вность, способствующая образованию жирных кислот: пропионовой, хусной, миристиновой, пальмитиновой, стеариновой и олеиновой. Все л способствуют созданию аромата сыра.
|
|
|
24 Ацетонобутиловое брожениеОбщая характеристика брожения, микроорганизмы. Бутиловый спирт — продукт брожения некоторых разновидностей масляно-кис-лых бактерий — обнаружен Л. Пастером в 1862 г. Несколько позднее Бейеринк выделил палочковидную бактерию, сбраживающую глицерин с образованием в числе продуктов брожения бутилового спирта. Более подробно вопросом получения в результате брожения бутаиола занимались Фитц и Бухнер, а Шардингер (1905) установил, что некоторые бактерии при росте на средах с углеводами накапливают ацетон. Но все эти исследования сначала представляли чисто теоретический интерес. Положение, однако, изменилось в 1909 г., когда бутиловым спиртом заинтересовались как возможным исходным продуктом для синтеза каучука (через бутадиен). Первый ацетоиобутиловый завод был построен в Англии в 1914 г. В период Первой мировой войны еще большее значение приобрел ацетон, необходимый для приготовления взрывчатых веществ. Продукты брожения применяются для нужд иитроцеллюлозиой и лакокрасочной промышленности, производства фотопленок, ацетилцеллю-лозы, органического стекла и других отраслей химической и фармацевтической промышленности. Промышленное получение в СССР бутилового спирта и ацетона путем брожения явилось результатом работ коллектива ученых, руководимого Шапошниковым. Проведенные ими исследования позволили в 1935 г. наладить производство этих продуктов микробиологическим способом.
|
Бактерии, образующие в процессе своей жизнедеятельности в значительном количестве ацетон и бутиловый спирт, широко распространены в природе. Они находятся в основном в почве, откуда могут быть довольно легко выделены в виде чистых культур. Относятся к роду Clostridium, который включает большое число видов. Из различных клостридиев способных к образованию в процессе брожения бутанола и ацетона, наиболее активным их продуцентом признан Clostridium acetobutylicum, применяемый для производства этих растворителей. Рост культур происходит только в анаэробных условиях на довольно простых средах, содержащих различные углеводы. Кроме них С. acetobutylicum может сбраживать глицерин, маииит, глюконат, пи-руват и некоторые другие вещества. Нуждается в таких витаминах, как биотип и парааминобензойная кислота. Бактерия способна к фиксации молекулярного азота. Наиболее подходящая температура для роста — 37 — 38 °С, оптимальное значение рН среды — 5,1 — 6,9. Благодаря наличию амилолитических ферментов бактерия использует крахмал. Выделяет в среду протеиназы, в результате чего способна разлагать белки. Поэтому С. acetobutylicum относят к группе Протеолитических клостридиев.
|
|
|
26 ПОЛУЧЕНИЕ ПОЛИСАХАРИДОВ Полисахариды (или гликаиы) — полимеры, построенные ие менее чем из 11 мопосахаридных единиц одного или нескольких типов. Соответственно различают гомополисахариды и гетерополисахариды. Они являются обязательными компонентами всех организмов и составляют большую часть углеводов, встречающихся в природе, преобладающую долю в биомассе растений, а следовательно, и основную массу органического вещества на Земле. Полисахариды встречаются в виде самостоятельных полимеров, а также в комплексах с нуклеиновыми кислотами, белками, липидами, фосфатом. Существует множество их видов, различных по мономер-пому составу и структуре. Особым разнообразием отличаются полисахариды микроорганизмов. Некоторые из них близки или идентичны гликанам растений и животных. Но подавляющее их большинство имеет уникальную структуру, специфичную для вида или для его серологической группы. В микробных гликаиах часто обнаруживаются ранее неизвестные моносахара, которые ие встречаются ни у животных, ни у растений. О том, что слизь, образуемая многими микроорганизмами, может иметь углеводную природу, знали еще во времена Пастера. Однако особое внимание микробным гликанам стали уделять лишь с начала 20-х гг. прошлого столетия, когда узнали, что вещества, определяющие серологическую специфичность пневмококков, являются полисахаридами. В настоящее время исследование этих полимеров приобрело особое значение в связи с открывшейся возможностью широкого их применения в медицине и ряде областей народного хозяйства. Полисахариды микроорганизмов в зависимости от локализации делятся на внутриклеточные и внеклеточные. К первым относят обычно гликаиы цитоплазмы, мембран и клеточных стенок, а ко вторым — капсул стенок. У ряда микроорганизмов действительно трудно различит" границу между капсулой и клеточной стенкой. Поэтому нередко* полисахариды делят на три разновидности: внутриклеточные иштчк плазмы, мембран, периплазмы), клеточных стенок и внеклеточные (капсул, чехлов и свободной слизи). Термин «экзогликаиы» применяют в основном к полисахаридам свободной слизи. Иногда так называют также капсульиые их разновидности. Микробные полисахариды объединяют в группы и по функциям: резервные, участвующие в активном транспорте; опорные, участвующие во взаимодействии между клетками; Наиболее активные их продуценты — представители молоч-ио-кислых бактерий Leuconostoc mesenteroides и L. dextranicum. Они синтезируются также некоторыми видами Streptococcus (Str. sanguis, Str. mutans), Brevibacterium, Lactobacillus. Практически каждый продуцент синтезирует свой, несколько отличный от других видов декстран. Некоторые штаммы образуют одновременно две его структурные разновидности. Внеклеточную целлюлозу — полисахарид, распространенный в растениях, — из бактерий синтезируют некоторые представители Pseudomonas, Zooglea, Azotobacter, подавляющее число видов Rhizobium и Agrobacterium, Acetobacter xylinum. 0-(1-3)-Глюкаи, называемый курдланом, образуют Alcaligenes faecalis var. myxogenes и виды Rhizobium. Сильно разветвленный а-(1—>4)-глюкап с боковыми цепочками, присоединенными а-(1->6)-связями, — полимер типа гликогена, резервного полисахарида животных, многих бактерий и дрожжей, — можно обнаружить в культуралыюй жидкости Neisseria perflava. Нигерап — сс-глюкан с чередующимися (1-4)-и (1-3)-связя-ми — образует гриб Aspergillus niger. Разветвленные полимеры фруктозы — леваиы с (2-6)-связями — синтезируют уксусио-кислые бактерии Gluconobacter oxydans, Acetobacter. Маннаны обнаружены в культурах некоторых видов Bacillus и Corynebacterium, а также у многих дрожжей. Чаще всего микроорганизмы, способные к образованию внеклеточных полисахаридов, синтезируют капсулы и свободную слизь. Мономерный состав последних в большинстве случаев одинаковый. Не всегда можно определить, какие именно полисахариды свойственны той или иной группе микроорганизмов. Часто филогенетически близкие бактерии синтезируют внеклеточные гликаны, сходные по составу и строению. К ним относятся, например, бактериальный альгинат Pseudomonas aeruginosa и Azotobacier vinelandii, курдлан Rhizobium к A. faecalis var. myxogenes, кислые гетерогликаны Corynebacterium и Arthrobater, декстраны Streptococcus и Lactobacillus и др. Однако нередко микроорганизмы, далеко отстоящие в таксономическом отношении, образуют гликаны сходного состава или одинаковые. Обычно в этом случае полимеры проявляют и функциональное сходство. Так, очень близки по составу экзогликаиы различных фито-патогенных бактерий и возбудителей менингита. Анионные полисахариды (ксаитаи, занфло — внеклеточный rej рогликаи Erwinia tahitica, состоящий из глюкозы, галактозы, фукоз уроиовой кислоты и ацетильных групп, и др.) стабилизируют и пр дохраияют от высыхания катионные водные эмалевые краски. Нек торые гликаиы, например гетерополисахарид Corynebacterium е var. mucilagenosus, обладают высокой вязкостью и могут замен дорогие клеящие средства. Сульфаты ксантана используются как густите ли клеев. С другой стороны, способность ряда полисахариде к образованию поверхностных пленок позволяет использовать их качестве антисклеивающих веществ, например, при освобождении слеп| ков из отливочных форм. Декстран рекомендуется применять и в качестве смазочного средства.
|
защитные и др. Внеклеточные полисахариды, капсульиые или свободные или те и другие, образуют многие микроорганизмы. Пожалуй, нет такой группы последних, представители которой не обладали бы этой способностью. Однако синтез внеклеточных полисахаридов — необязательная функция клетки, и проявляется она лишь в определенных условиях. Встречаются микроорганизмы, у которых не было замечено ни капсул, ни слизи. Внеклеточные полисахариды микроорганизмов чрезвычайно разнообразны по составу и строению. К настоящему времени исследован состав около 200 экзогликаиов, установлены первичная структура и детали строения многих из них. В составе внеклеточных полисахаридов различных микроорганизмов обнаружено более 20 моносахаридов и их производных. Наиболее часто встречаются гексозы: глюкоза, галактоза, маппоза и 6-дезоксигексозы (например, рамноза). Реже выявляются пеитозы: арабиноза, ксилоза, рибоза. Распространены уро-новые кислоты: галактуроиовая, маииуроиовая и особенно глюкуро-иовая. Многие содержат амииосахара: глюкозамин, галактозамии и машюзамии. Часто в экзогликаиах присутствуют иеуглеводиые заместители — пиру ват и ацетат, встречаются также сукцииат и глицерин. Для ряда внеклеточных гликаиов характерно наличие редких мономеров: 2,6- или 3,6-дидезоксисахаров; у некоторых найдены ранее неизвестные моносахариды, например, гликолактиловые кислоты (у сапротрофных микобактерий). Иногда обнаруживаются тейхоевые кислоты, фосфатные и сульфатные ионы. Внеклеточные полисахариды большинства видов бактерий — кислые гетерогликаны разнообразного состава, построенные из 2 — 5, иногда 6 — 7 мономеров, линейные и разветвленные, имеющие регулярную структуру из повторяющихся олигосахаридиых звеньев. Так, например, Xanthomonas campestris синтезирует полианиоиит ксантан, включающий глюкозу, маинозу, глюкуроновую кислоту, О-ацетильную группу и пируват. Некоторые бактерии образуют нейтральные гетерополисахариды. Весьма распространены у микроорганизмов различные гомополи-сахариды, особенно глюканы, из которых наиболее известны декстра-иы (группа более или менее близких по строению нейтральных глю-106 капов). Они могут содержать до 200 000 остатков глюкозы, бывают линейными и разветвленными. Линейная (основная) цепь построена При участии а-1,6-связей, ветвление обусловлено а-1,2-, а-1,3- и а-1,4-связями. Молекулярная масса декстрапов колеблется от 12 до 600 млн. Полисахариды, водные растворы которых отличаются особой ста-' билы-юстыо при резких изменениях температуры и в условиях агрессивной среды, используются в нефтяной и газодобывающей промышленности как стабилизаторы и структурообразователи промывныхj жидкостей, предназначенных для бурения нефтяных и газовых скважин, и обеспечивают более полное извлечение нефти из нефтеносных пластов. В 70-х гг. прошлого века более половины нефти в США s добывали с помощью полисахаридов, главным образом ксантана. Промышленные испытания проходит склероглюкан — капсульпый линейный нейтральный глюкан, образуемый несовершенными грибами, преимущественно рода Sclerotium. В качестве стабилизатора буровых глинистых суспензий перспективен линейный внеклеточный гете-рогликаи облигатно-метилотрофных бактерий Methylobacillus methylo-philus, состоящий из глюкозы, галактозы, маниозы, рамнозы и глюку -ровой кислоты. Применение полисахаридов в нефтедобывающей промышленности является очень эффективным в техническим отношении. Полисахариды ряда микроорганизмов (пуллулан A. pullulans, гетерополисахарид бактерий рода Methylomonas и др.) являются флоккулирующими агентами и применяются в гидрометаллургии для получения металлических компонентов в виде гелей, включающих нерастворимые осадки. Процесс реализуется при очистке, разделении и концентрации металлов из растворов их солей или смесей солей. На основе декстранов получают сефадексы, широко применяемые в лабораторной практике для гельфильтрации. Полианионные гликаиы, например ксантан, хитин, рекомендуется использовать для очистки воды от тяжелых металлов, а также при промышленном синтезе полимеров для извлечения их из органических растворителей. Хитин может употребляться и для очистки сточных вод. Открытие новых микробных полисахаридов, имеющих практическое значение, обусловило успехи в области организации их производства. В настоящее время микробиологическая промышленность многих стран выпускает ряд ценных экзогликаиов: декстран (Россия и другие страны), Получение различных полисахаридов не универсально. Для каждого гликана оно имеет свои особенности, определяемые физиологией продуцента, локализацией и физико-химическими свойствами полимера, областью его применения. Производство экзополисахаридов имеет преимущества перед получением внутриклеточных, так как экзогликаны образуются, как правило, в значительно большем количестве, легче отделяются от биомассы и очищаются от примесей. Однако в этом процессе имеются и некоторые технологические трудности. Накопление полисахарида в среде приводит к ограничению доступа кислорода к клеткам. У аэробных микроорганизмов это снижает энергетический баланс и тормозит синтез гликана. Повышенная вязкость среды делает невозможным отделение последнего от клеток продуцента из нативной культуральной жидкости. Ее приходится разбавлять в несколько десятков раз, а после удаления клеток концентрировать до первоначального или меньшего объема. Решение этих проблем связано с дополнительными затратами.
|
|
|
25. Производство орг. кислот. Современное производство орг. кислот основано на использовании в качестве продуцентов различных видов плесеневых грибов – чаще всего род Aspergillus. Производят лимонную, итаконовую, фумаровую, глюконовую и некоторые другие. В качестве источников углерода – кристаллическая глюкоза и сахароза, свекловичная меласса, гидролизаты древесины. В последние годы – из непищевого сырья – этиловый спирт и жидкие парафины. Наиболее отработано промышленное получение лимонной кислоты, хотя производят в промышленности около 50 кислот. Лимонная кислота: OH H2C CCH2 COOH HOOC COOH Способность образовывать лимонную кислоту грибами Aspergillus (A. awamori, A. clavatus, A. fumaricas, A. niger), Penicillium (P. chrysogenum, P. citrinum, P. luteum), а также Mucor piriformis и так далее. В настоящее время в промышленности используется A. niger. Долго применялись природные штаммы, теперь специальные, обладающие сверхсинтезом. Лимонная кислота образуется в цикле трикарбоновых кислот (ЦТК) в результате конденсации оксалоацетата и ацетил-Co-A. Одна молекула сахарозы превращается в одну молекулу лимонной кислоты. Сверхсинтез – при лимитировании роста грибов минеральными компонентами (Fe, Mg) и избыточном содержании источников углерода. В этих условиях гриб прекращает расти, но продолжает потреблять углеводы – накапливается лимонная кислота, которая не может быть переработана. В ЦТК из-за отсутствия некоторых микроэлементов происходит ингибирование ферментов. Производство: 1) на поверхности твёрдой питательной среды, 2) на поверхности жидкой питательной среды, 3) глубинное.
Поверхностное культивирование на жидкой среде |
2) (Европа и Америка). Сначала получают посевной материал в виде спор. Выращивание гриба – в плоских кюветах (высота 20 см) в бродильной камере. В питательной среде высокая концентрация сахара, pH ~7,0. В стерильные кюветы вносят стерильную среду, t=28 – 30оС. Поверхность засевают спорами, которые прорастая образуют мицелий в виде плёнки на поверхности. В бродильной камере – система проточно-вытяжной вентилляции, т. к. гриб – строгий аэроб. Выращивание около 7 суток. pH к концу – 3,0. Концентрация лимонной кислоты в конце – 150 – 200 г/л. Глубинное культивирование: повышается эффективность, механизация стадий производства, процесс - выращивание посевного материала в среде, содержащей мелассу, освобождённой от ионов Fe, Mn, при непрерывном продувании стерильным воздухом и перемешивании, t~30оС, через 20 – 36 ч сформированый мицелий вместе с культуральной жидкостью подаётся в основной ферментатор. Основной процесс длится ~7 – 10 суток при непрерывной аэрации и перемешивании. По мере потребления сахара – подача его в виде р-ра, т. к. очень высокая начальная концентрация ингибирует биосинтез лимонной кислоты. В конце ферментации – концентрация 50 – 120г/л, культуральную жидкость освобождают от мицелия фильтрацией и подают на химическое выделение: - в виде труднорастворимой при высоких t соли Ca (добавляют ~3% Ca(OH)2 и нагревают до 100оС). Цитрат Ca промывают водой и разлагают H2SO4, лимонная кислота уходит в р-р, который очищают, упаривают и проводят кристаллизацию. Применение: пищевая, кондитерская, консервная, косметическая промышленности, фармацевтика, очистка паровых котлов, изготовление синтетических моющих средств. ЛИМОННАЯ КИСЛОТА Путём органического синтеза – относительно молодая отрасль. Способность продуцировать органические кислоты при росте на средах с углеводами: широко распространена у мицелиальных грибов родов Aspergillus (A. awamori, A. clavatus, A. fumaricus, A. niger, A. terreus) и Penicillium (P. chrysogenum, P. citrinum, P. luteum) и Rhizopus (R. nigricans, R. orisae). Широко распространена в плодах, ягодах, фруктах. Широко применяется в пищ. промышленности, винодельческой, |
|
|
безалкагольных напитков, консервной. Используется в фармацевтической промышленности, при производстве моющих средств, в косметической промышленности. Продуценты: Aspergillus (смотри выше) и Penicillium, Mucor piriformis, Bothris cinerea. Промышленное значение – Aspergillus niger. Культивирование:
Лимонную кислоту осаждают в виде соли Ca2+ при высокой t, р-р затем обрабатывают серной кислотой, р-р упаривают, кристаллизуют, сушат – получают кристаллическую лимонную кислоту. Итаконовая кислота: H2C─C═CH2 │ │ HOOC COOH Продуцент – Asp. itaconicus, Asp. terreus. Применяется в производстве высококачественных синтетических смол, волокон, ПАВ, моющих средств, красителей. Производство очень похоже на производство лимонной кислоты. Чаще используется глубинный способ. Культивируют на средах (высокая концентрация сахара, низкая pH). Это – токсичное для продуцентов в-во – его необходимо постоянно нейтрализовывать NH4OH, pH поддерживается ~ 3,8. Необходимо внесение ионов Zn2 + и Mg2+. Р-р итаконовой кислоты очищают активированным углём, упаривают и |
кристаллизуют. Фумаровая кислота: HOOC─CH═CH─COOH Это заменитель лимонной кислоты в медицинской и пищевой промышленностях. Из неё получают малеиновую кислоту – для производства смол, красок, лаков. Продуценты: роды Penicillium и Aspergillus. Промышленный продуцент – Risopus lemar. Источник углевода – глюкоза, крахмал. Поверхностный, глубинный способ, интенсивная аэрация и нейтрализация среды, кислоту выделяют методом кристаллизации – т. к. она обладает низкой растворимостью в воде. Глюконовая кислота: O OH ║ │ C─CH─CH─CH─CH─CH2 │ │ │ │ │ OH OH OH OH OH Комплексообразователь с металлами, глюконат Na – в пищевой промышленности, в изготовлении моющих средств и т. д. В виде солей Ca, K, Fe – в медицине и ветеринарии. Изготавливается в виде свободной кислоты (γ и δ), глюконата Na и Ca. Z |
|
|
27 Микробилогия получения белка. Одним из реальных путей удовлетворения потребностей животноводства в полноценном кормовом протеине является производство микробного белка - продуктов биологического синтеза микроорганизмов дрожжей, бактерий, низших мицелиальных грибов, простейших водорослей. Это производство выгодно отличается от производства белков растительного и животного происхождения высокой скоростью роста и развития микроорганизмов. В производстве кормовых дрожжей чаще всего применяют культуры родов Candida, Тrichosporon, Saccharomyces и другие Ценность дрожжевой, как и бактериальной, биомассы определяется содержанием в ней белка, витаминов, микроэлементов. Некоторые дрожжи (R. gracilis) интенсивно накапливают липиды (до 40%), каратиноиды (до 300 мкг/г) при содержании белка 30-35%. Утилизации биомассы клеток, содержащих различные биологически активные вещества, является прямое использование ее в кормлении сельскохозяйственных животных. Преимущество: способ культивирования в промышленных условиях достаточно отработан; клетки дрожжей больше клеток бактерий, что облегчает сепарацию; питательная ценность и гигиенические качества биомассы хорошо изучены. Недостатки: белок дрожжей беден серусодержащими аминокислотами и содержит сравнительно большое количество (3-6%) нуклеиновых кислот; клетки имеют прочную оболочку, что затрудняет действие пищеварительных ферментов к питательным веществам клетки. Самым высоким содержанием белковых веществ отличаются бактерии (до 70% биомассы). Преимущество – наличие в достаточно большом количестве метионина и цистина. К основным недостаткам бактерий относятся высокий уровень в белке нуклеиновых кислот (до 25%), наличие в клетках ряда компонентов, безвредность которых для животных находится пока под сомнением, более низкий коэффициент выхода биомассы, чем у других микроорганизмов, и сравнительно сложный процесс выделения ее из культуральной среды, так как и та и другая близки по плотности. Из одноклеточных водорослей наиболее подходят для массового культивирования зеленые протококковые водоросли рода Chlorella и Scenedesmus, a также сине-
|
зеленая спиралевидная водоросль Spirulina. Микроводоросли относятся к организмам с активным биосинтезом белков, витаминов и других биологически активных веществ. Содержание белка в сухой биомассе протококковых водорослей составляет 40-45%, спирулины – 75-80%. Белок микроводорослей насчитывает более 18 аминокислот (10 незаменимых). B качестве продуцентов белка, аминокислот, витаминов и других биологически активных веществ используют грибы родов Penicilium, Aspergillus, Fusarium, Trichoderma Преимущество нитевидных грибов в легкости отделения биомассы от культуральной жидкости фильтрованием, в меньшем содержании РНК по сравнению с дрожжами и бактериями. Недостатком является более жесткие требования к условиям культивирования, меньшие скорости роста. Особое место среди потенциальных продуцентов биомассы и биологически активных веществ занимают съедобные базидиальные грибы, плодовые тела которых издавна употребляются в пищу. В качестве исходного сырья м/о могут использовать не пищевое сырье – отходы сельского производства (солома, початки кукурузы, оболочки злаков), а также спиртовой, целлюлзо-бумажной и лесной промышленности. Применение отходов пищевой промышленности, богатых сахарами, витаминами, микроэлементами, способствует интенсификации процессов энергетического и конструктивного обменов, что ведет к наибольшему накоплению биомассы и синтезу ценных продуктов. Для получения кормового (дрожжевого) белка используют очищенные жидкие парафины нефти. Микроскопические грибы способны расти на средах с углеводородами. С помощью микроскопических грибов можно обогатить белком отходы целлюлозо-бумажного производства, молочной и сахарной, картофеле- и крахмал перерабатывающей промышленности. Для кормовых целей бактериальную биомассу получают, используя дешевые субстраты - молочную сыворотку, экскременты животных, растительные материалы. Для получения биомассы базидиомицетов применяют мелассу. При выращивании P. tigrinus на среде с мелассой, молочной сывороткой, на клеточном соке картофеля образует от 49 до 51% белка. Культивирование м/о, можно осуществлять как на пищ, так и тех-х отходах. Z |
|
|
28 Получение биоудобрений. В кач-ве удобр исп почвен м/о, к-е улуч стр-ру почв, накап в ней пит в-ва, минерализ-ют в ней орг и неорг соед, превращ их в легко усваемую для раст форму. Азотобактерин- Azotobacter Chorococcum. Этот м/о способ фиксир-ть до 20 мг атом азота на кажд грамм исп-го сахара. Кроме того азотобактер выд БАВ, стим-щие рост раст( никотин, пантотеновая к-та, пиридок-син, гибберилин, гетероауксин). Все виды азотобактер строгие аэробы, чувс-ны к налич в среде Р, поэт их культив провод на аэр пит ср, содер орг или неорг фосфор соед. 1) получ чистой культуры на пит ср, седер агар, отвар семян бобовых, сахарозу, сульфаты Fe, Mn, соль молибден к-ты. рН=5,7- 6,5. Усл аэрац 1 объем воздуха на 1 V ср. Сульфаты Mg, NH4, NaCl, мел и двузамещенный фосфат К входит в состав жидк пит ср. 2) Сепарирование. 3)Высуш-е. Помимо сух получ почвенный и торфян азотобактерин. Не высуш-ют, а смеш с тверд субстратом и фасуют. Исп для обр-ки семян зерновых в сух виде, в виде суспензий исп для обр картофеля. Фосфобактерин – Bacillus megaterium вариант phosphaticum. Пр соб порошок светлосер цвета (или желт), содер высуш бактер массу и компон-ты пит ср. Бакт-и спос-ны превращ слож орг соед и минер фосфаты в доступ для раст форму, выдел вит гр В, стим-е рост. Это мелк гр+ спорообр-е аэроь пал. Растут на ср содер кукур экстракт, мелассу, (NH4)2SO4, мел, в ферментере, в асепт усл при переем, 28-30 С, рН 6,5-7,5. Проц ведут до стабил-и спорообр-я. Далее сепарир-ют и высуш распылит сушкой. Исп на чернозем почвах при обр семян зерновых, картофеля и др культурн раст. Z |
|
|
|
30 Биотехнологическая энергетика. Это раздел биотехнологии, в кот. рассматриваются пути получения энергии при помощи биологических процессов, протекающих на уровне клеток и клеточных структур. современные виды топлива быстро истощаются и загрязняют атмосферу (уголь, нефть, газ), поэтому необходимы альтернативные пути получения энергии. Получение биогаза (осн. компонент-CH4)-это сложный процесс, протекающий в анаэробных условиях. Процесс идёт в спец. аппратах - метантенках. Биогаз выделяется в процессе жизнедеятельности ассоциатов бактерий (сем. Enterobacteriaceae, Lactobacteriaceae, Clostridium). Эти бактерии создают условия для образования метана другими бактериями - архебактериями, возникшими 3,5 млрд. лет назад. Большинство из этих бактерий неподвижны, в состав их клеточной стенки входит муреин. Это такие бактерии, как Methanobacterium, Methanobrevibacter. Оптимум рН=6,8-8,0. Уравнения реакций получения метана : 1)4Н2+СО2СН4+2Н2О 2)4СО+2Н2ОСН4+СО2 3)4НСООНСН4+3СО2 Технология получения метана: На первой стадии процесса происходит образование из высокомолекулярных соединений спиртов, альдегидов и др. простых веществ. Оптимальные условия: содержание 12% орг. веществ в сырье, строго анаэробные условия, рН не выше 6,5 . Собственно метаногенное брожение происходит в анаэробных условиях, при t=55С. Количество образующегося метана зависит от сырья. Из углеводов образуется много СО2 ,из жиров больше образуется метана. Сырьём служат орг. остатки бытовых отходов, новоз. Метантенк - это биореактор из железа или бетона. Образующийся в нём газ удаляется через газовый колпак. В биогазе содержится 50-80% метана, 15-50% СО2 и немного др. газов. Биогаз подаётся в газохранилище, а затем в газовую сеть. Для производства биогаза можно использовать иммобилизованные ферменты или имм. клетки бактерий, что предоnвращает унос бак. клеток вместе с не переработанным отходом – шламом. Получение Н2 и биофотолиз воды. Н2-перспективный вид топлива. Очень энергоёмкий-145 кДж/г - превосходит все известные виды топлива.Н2-экологически чистый вид |
топлива (при сгорании образуется вода) , но он очень взрывоопасен. Водород можно получить путём электролиза воды. Альтернативный способ-использование микроорганизмов - хемотрофов. Под действием микробиологических гидрогеназ образуется Н2 (RH2H2+R). Продуценты: Clostridium, Энтеробактерии. Эти бактерии образуют Н2 в малом количестве. Микроорганизмы - фототрофы также способны образовывать Н2 (пурпурные бактерии, цианобактерии, водоросли). Ключевым ферментом при образовании Н2 является нитрогеназа (N2+8e-+8H+2NH3+H2 ). Цианобактерии тоже выделяют Н2 в присутствии света (Anabena cylindrica). Здесь донором е- выступает вода - фотодеструкция воды. Разработан метод получения Н2 при помощи изолированных хлоропластов с добавлением к ним гидрогеназы. Но стабильность такой системы невелика. Получение тепловой энергии при бактериальном окислении-окисление твёрдых отходов с получением тепла. Сырьё погружают в шахту, снизувоздух.. Идут окислительные процессы, осуществляемые микроорганизмами - происходит выделение теплоты (проходящие газы нагреваются до 80С. При помощи компрессии газ сжимают-t повышается до 100-110С и получают энергию на нагрев воды , пара. Отход (шлам) – минерально-органические удобрения. Z |
|
|
29 Аминокислоты, из которых состоят белки, являются L-aк или аминокислотами. Их можно получать как из природных продуктов (главным образом при гидролизе белков растений), так и путем химическое го, микробиологического или ферментативного синтеза. Если химический синтез дает рацемат, который требует дальнейшей обработки, то последние два метода позволяют получить оптические чистые:аминокислоты. ' Основным условием протекания большинства производственных процессов с участием микроорганизмов является изменение условий среды: именно за счет этого достигается синтез избыточных количеств желаемого продукта. Дисбаланса в метаболизме можно добиться путем эмпирического изменения таких факторов, как концентрация субстрата, рН, концентрация продукта, или же путем установления критических уровней содержания других веществ (ионов металлов, органических добавок) в среде. Для получения больших количеств были выработаны новые способы изменений метаболизма у организмов-продуцентов, направленных на увеличение выхода промежуточных продуктов, образование которых в иных условиях находится под строгим метаболическим контролем. Для производства аминокислот бактерии стали использоваться с начала 50-х гг. XX в. Свойства штаммов постоянно улучшали генетическими методами, выделяя ауксотрофные мутанты и мутанты с измененными регуляторными свойствами. Чтобы обеспечить образование аминокислот в больших количествах, в любом случае необходимо изменить систему регуляции обмена. Для этого можно либо стимулировать потребление субстрата в некоторых путях биосинтеза и выделение аминокислот в среду, либо подавить побочные реакции и процессы деградации аминокислот. Производство L-глутамата, L-валина, #,£-аланинй, L-глутамина и L-пролина при участии диких штаммов бактерий основано либо на 130 использовании присущих последним особенностей метаболизма, либо на стимуляции образования аминокислот в ответ на изменение условий внешней среды. На это способны бактерии многих родов (например, Corynebacterium, Brevibacterium, Bacillus, Aerobacter, Micro-bacterium, Escherichia), причем они настолько продуктивны, что производство становится рентабельным. Так, виды Corynebacterium или Brevibacterium, выращиваемые на углеводном сырье (гидролизат крахмала, мелассы из сахарного тростника и свеклы), на этаноле или ацетате при наличии достаточного количества биотина в среде способны синтезировать до 30 г/л глутамата. Ауксотрофные мутанты не могут образовывать ингибиторы соответствующего метаболического пути, работающие по принципу отрицательной обратной связи, так как у них отсутствует определенная ключевая ферментативная реакция. Поэтому при выращивании му-тантного штамма в среде с минимальной концентрацией необходимого питательного ингредиента они способны образовывать избыточные количества вещества-предшественника или близких к нему метаболитов блокированного пути. |
31 Биогеотехнология металлов — это наука об извлечении металлов из руд, концентратов, горных пород и растворов под воздействием микроорганизмов или их метаболитов при нормальном давлении и температуре. Составными ее частями являются: 1) биогидрометаллургия, или бактериальное выщелачивание металлов; 2) обогащение руд; 3) биосорбция металлов из растворов. Бактериальное выщелачивание металлов — это извлечение отдельных химических элементов из руд, концентратов и горных пород с помощью бактерий или их метаболитов. Оно совмещается с выщелачиванием металлов слабыми растворами серной кислоты бактериального и химического происхождения, а также растворами, содержащими Fe3+, органические кислоты, белки, пептиды, полисахариды и д-гие вещества. В основе выщелачивания — процесс окисления (-створения) минералов и перевод химических элементов (цветные, ре кие) из нерастворимого в растворимое состояние. Кроме бактерий, последним данным, здесь могут принимать участие и другие микроо гаиизмы. Однако возможность их применения в технологических пр цессах изучена недостаточно. Поэтому принято обычно говорить бактериальном выщелачивании металлов.
|
|
|
|
|
|
|
32 Биотехнология и экология. Отходы деятельности в области сельского хозяйства, лесной и пищевой промышленности можно использовать в различных целях, для получения энергии с одновременным увеличением биомассы и уменьшением загрязненности окружающей среды. Их также можно при помощи микроорганизмов разлагать до сбраживаемых соединений или превратить в белки Культивирование водорослей в сточных водах, способствует не только очистке этих вод, но и получению биомассы, богатой белками и микроэлементами. Побочные продукты и отходы, содержащие углеводы, можно перерабг» тать путем традиционного микробного брожения меласса, содержащий помимо сахара сульфиты, карбонаты и соли кальция и магния. Однако при брожении мелассы используется не весь остаточный сахар. Крахмал составляет около 50% сухого веса зерен злаков, картофеля и маниока. Он легко подвергается кислотному или ферментативному гидролизу, в результате чего получаются декстрины и глюкоза. они используются для ферментационного производства спирта и фруктозного сиропа. Гемицеллюлозы охватывают группу полисахаридов, связанных с целлюлозойПри гидролизе гемицеллюлоз, в частности ксиланов, образуются пентозы, главным образом ксилозы. обнаружили анаэробную бактерию, Thermobacteroides saccharolyticum, которая при температуре выше 40° С вызывает деградацию гемицеллюлоз, Среди полученных конечных продуктов были этанол и молочная кислота. после превращения ксилозы в ксилулозу последняя может сбраживаться в спирт при участии Saccha-romyces cerevisiae. Изомеризация ксилозы в ксилулозу осуществляется ферментом ксилозоизомеразой. При введении гена, кодирующего этот фермент, в дрожжевые клетки может происходить изомеризация альдопентоз в альдо-цетозы и последующее спиртовое брожение. Что касается гидролиза целлюлозы в глюкозу, то его можно провести при помощи Trichoderma reesii, целлюлаза которой разрушает кристаллическую и нерастворимую целлюлозу. 3. Подходы к решению проблемы очистки водоемов от разливов нефти и различных углеводородов. бактериях, относящихся к роду Pseudomonas, имеются оксиредуктазы или гидроксилазы, способные разлагать |
большое число молекул углеводородов и ароматических соединений, часто высокотоксичных (бензол, толуол, ксилол). В случае некоторых штаммов Pseudomonas putida гены, кодирующие эти ферменты, находятся в составе плазмид. Известны четыре такие плазмиды: ОСТ (разложение октана, гексана и декана), XYL (разложение ксилола и толуола), САМ (разрушение камфоры) и NAH (разложение нафталина). Был получен штамм содержащий все эти плазмиды в одной клетке. Он способен быстро расти на не очищенной нефти, т к метаболизирует углеводороды активнее, чем один из штамов содержащих только одну плазмиду. разработали технологию ускоренного размножения живущих в море бактериальных видов, которые способны разлагать углеводороды. Для ускорения биоразложения загрязненная поверхность покрывалась микроэмульсией, содержащей инкапсулированную смесь углерода, азота и фосфора. Как оказалось, добавление этих веществ стимулировало размножение полезных бактериальных штаммов. Преимущество биологического процесса состоит главным образом в том, что он не вызывает появления нового загрязняющего агента в окружающей среде. Новая технология найдет применение как в морях, так и в болотах и лагунах, куда нелегко добраться, а также для контроля случайных загрязнений, например, в акваториях портов. 4. Проблема биологической деградации пестицидов. Некоторые микробы способны изменить молекулу таким образом, что она затем разлагается под действием других микробов. разрушения сильного высокотоксичного инсектицида, паратиона, под действием двух штаммов Pseudomonas (P. aeruginosa и P. stutzerij. Часто результатом химического превращения токсичной молекулы является не полное разложение, а детоксификация: фосфорилирование, метилирование, ацетилирование и т. д. Ферменты, кат-е реакции детоксификации, часто кодируются генами, находящимися в составе плазмид. удалось получить микробную культуру, способную полностью метаболизи-ровать 2,4,5-Т (2,4,5-трихлорфеноксиуксусную кислоту), которая явл сильным гербицидом. Выделили на очистных станциях несколько м/о и смешали их с др м/о, содержащими ряд плазмид с генами Е разложения орг. соединений (толуола, ксилола, хлорпроизводных и салицилатов). Z |
|
|
33 Источники ферментов. Источники – ткани животных, растений и микроорг, слизистая оболочка желудка, поджелудочная железа(пепсин, трепсин). Из высушенных растений – папаин. Локализация – внутриклеточный, внеклеточный и мембраносвязанный(если поверхносный то мембрану разрушать не надо, если интегральный то ее разрушают). Выделение и очистка. Если Е внеклеточный то процесс выделения сводится к отделению биомассы и очистке Е. если внутриклеточный или мембраносвязанный то нужно разрушать клетку. Процесс разрушения – дезинтеграция: 1 механическая-ступка с пестиком куда добавляют кварцевый песок, ткани при растирании разрушаются и Е выходят, идет при t=40C, шаровые мельницы. 2 Физическая-осмос, ультразвук, плазмолиз, сушка, замораживание. 3 Химическая-действие кислот, щелочей ПАВ. 4 Энзиматическая-действие литических Е (лизоцима). 5 Биологическая-действие фагов и антибиотиков. Выделение: экстракция огран раст-лями, высаливание (NH4)2SO4, NaCl и др солями. Сдвиг рН – каждый белок имеет свою изоэлектрическую точку, при которой он выпадает в осадок. Сдвиг t- ры для выделения термостабильных Е, при повышении t в рас-ре остаются только эти Е. диализ основан на селективной проницаемости мембраны. Очистка от НМ соединений. Осмос – процесс перехода растворителя в раствор ч/з перегородку непроницаемую для растворенного в-ва. Хроматографические методы – используют тонкослойную, ионообменную. Электрофорез – для разделения и очистки Е. Разделение основано на различной подвижности белковых молекул при действии эл тока. Активность – ед кол-ва субстрата превращенного Е в ед времени отнесенное к кол-ву самого Е. Стандартная единица Е – такое кол-во Е, которое катализирует превращение 1 микромоля S-та за 1 мин при заданных условиях: t=250C, opt pH и конц S-та. Удельная активность Е – кол-во Е отнесенное к 1 мг белка в Е-ом препарате. Отриц-ной единицей активности явл-ся |
катал. Это число Е которое превращает 1 моль субстрата в 1 секунду.
Методы определения активности. Химические – основаны на хим учете в-в которые образуются или исчезают в рез-те действия Е. Поляриметрический – измерение скорости удельного вращения рас-ра в процессе Е-ой реакции. Газометрический – по кол-ву газа, образующегося в процессе Е-ой реакции. Хроматографический. Вискозиметрический – измерение вязкости. Спектральный – использование спектрофотометра. Z |
|
|
34 Кинетика ферментативных реакций. Ферм-ая кинетика осн-ся на хим кинетике и учении о равновесии.
В kS = 1/ kP = [E] [S] / [ES] – const распада [ES] (1) Скорость р-ции по Sт = скорости по обр-ю Р если будут выполн след усл: [So]>>[Eo]. ν = - dS / dt = +dP / dt =k+2 [ES] (3) Если остановить р-цию, то весь Е будет в 2 сост: Ео = [E]+ [ES]? [E] = [ES] – кол-во соед-го Е. (2) Из (1) получаем: [ES] = [Eo] [S] / kS; подставляем (2) [ES] = ([Eo][S] – [ES][S]) / kS, [ES] = [Eo][S] / (kS + [S]) (4) Из ур-я (3) и (4) получаем: ν =k+2 Eo S / (kS + [S]) – ур-е Михаелиса-Ментен «-» не учитывается, вторая часть ферм-ой р-ции. Стандартное состояние – распад [ES] в направлении –1 +2 уравнов-ся его образ-ем в направлении k+1. K+1 [E][S] = k—1 [ES] + k+2 [ES]. ν =k+2 Eo So / (km + [S]) – ур-е Холдейна-Бригса. Оно хорошо описывает экспер-ые данные по кинетике У-ых р-ций. Чаще его применяют в дифференц форме, т.е. находят νо по начальной конц S и исходной конц Е. νо = k+2 Eo Sо / (kм + [Sо]). |
В ходе р-ции могут появл-ся дополнит эффекты тормозящие процесс р-ции и они могут искажать ход процесса. 1 νо = k+2 Eo / kм . 2) если конц S большая So >> km, то νо = k+2 Eo – max ν = νm, 3) если km = So, то νо = ½ νm km показывает сродство Е к S или меру насыщения фермента субстратом.
В основе ферментативных реа-й лежит обратимое взаимодействие фер-та с субстратом. При этом обра-ся фермент субстратный комплекс из когто-го высвобождае фермент и образу-ся готовый продукт. |
|
|
35 Методы иммобилизации ферментов. Для иммобилизации ферментов используют органические и неорганические носители, к ним предъявляют следующие требования: 1) высокая химическая и биологическая стойкость, 2) высокая механическая прочность, 3) достаточная удельная поверхность, пористость, вместимость, 4) возможность получения в удобных формах (гранул, мембран), 5) доступность и дешевизна, 6) возможность быстрой активации, 7) гидрофильность (не всегда). Органические делят на природные и синтетические. Природные дорогие, многие не устойчивы при высокой температуре, не устойчивы к м/о. Это полисахариды и белки. Полисахариды: целлюлоза, декстран, агароза, агар-агар, альгиновые кислоты и их соли, альгинаты, крахмал, каррагинаны. Белки: кератин, фибрин, миозин, коллаген, сывороточный альбумин. Синтетические – полимеры на основе акриловой кислоты: акриламид, используют ПААГ (полиакриламидный гель) (получают при сополимеризации акриламида со сшивкой – N,N,N-метилен-бис-акриламидом); носители на основе поливинилового спирта; полиуретановые носители. Для того, чтобы носитель мог удержать фермент, его переводят в активное состояние, т.е. проводят химическую реакцию, в результате которой на поверхности носителя образуются функциональные группы. Иногда используют для иммобилизации фосфолипиды. Неорганические носители: макропористые стёкла, силикагель, кремнезёмы. Физическая иммобилизация – без образования химической связи. Адсорбционная иммобилизация – фермент удерживается на поверхности носителя с помощью электростатических или водородных связей. Статический способ – носитель вносят в забуференный раствор фермента и оставляют без перемешивания. Идёт адсорбция фермента на поверхности носителя. Способ с перемешиванием – также + перемешивание и удаляют буферную жидкость центрифугированием. Метод электроосаждения – фермент имеет заряженные группировки на поверхности. В раствор фермента погружают электроды, на поверхность одного из них – слой носителя, при пропускании электрического тока будет идти осаждение фермента на носитель. Адсорбция идёт за счёт Ван-Дер-Вальсовых сил, электростатических, водородных, гидрофобных. Диаметр пор должен быть в 2 |
раза больше, чем диаметр молекул фермента. рН если сорбция идёт за счёт электростатических взаимодействий. Если носитель не является ионообменником, то иммобилизация идёт в изоэлектрической точке белка. Концентрация фермента – до насыщения, т.к. носитель имеет определённое количество центров связывания. t может усиливать адсорбцию, но с другой стороны ведёт к денатурации. Включение в гель – чаще всего иммобилизуют живые клетки, т.к. гель представляет собой систему открытых пор, через которые идёт обмен газами, поступают питательные в-ва и удаляются продукты метаболизма. Для проведения иммобилизации готовят смесь из следующих компонентов: фермент, мономер, сшивающий агент. Инициаторами иммобилизации являются радикалы, которые образуются в результате окислительно-восстановительных реакций или фотохимических реакций. Чаще используют окислительно-восстановительную пару: персульфат аммония и тетраэтил-этилен-диамид. Процесс ведут при пониженных температурах. Полисахариды могут образовать гели при охлаждении их горячих водных растворов. Фермент добавляют перед началом гелеобразования. Иммобилизация с использованием мембран – микрокапсулирование – иммобилизуется раствор, содержащий фермент, а не отдельные молекулы или клетки. Суть метода – водный раствор фермента включают внутрь микрокапсул, которые представляют собой замкнутые сферические пузырьки. Этапы этой иммобилизации: 1) готовят раствор фермента, 2) готовят органическую фазу, 3) смешивают их, 4) добавляют органический растворитель и образуются микрокапсулы, 5) удаление их. Включение в мембраны и волокна. Волокно – пористая полимерная гель-содержащая нить, в геле находится фермент. Липосомы – водный раствор липидов упаривают и вводят раствор фермента, встряхивают и идёт самопроизвольное образование липосом. Иммобилизация с использованием двухфазных систем. Фермент растворяется в одной из фаз двухфазной системы. Субстрат и продукт распределены между несмешивающимися жидкостями (продукт оказывается в той фазе, где нет фермента, а субстрат находится в фазе с ферментом). После окончания процесса фазу с продуктом отделяют и выделяют сам продукт, а фазу с ферментом |
|
|
используют вновь. Используют воду (в ней фермент) и органический неполярный растворитель (в нём продукт). Химические методы – с образованием химической связи. Существует 3 варианта: 1) фермент присоединяется непосредственно к носителю, 2) фермент присоединяется к носителю через сшивку (сшивка – посредник) (этот способ применяют, когда непосредственный контакт фермента с носителем нежелателен), 3) к ферменту присоединяется много бифункциональных сшивок, к ним в свою очередь присоединяются другие молекулы фермента с множеством сшивок по поверхности, таким образом образуются агрегаты сетчатой структуры (трёхмерная сеть) (фермент выступает одновременно и в качестве носителя). Реакция образования амидной связи:
Реакция образования карбамидной связи:
Реакция образования азометиновых связей:
Z |
|
|
|
36 Кинетика катализа иммобил. ферментов. V=Vm*S/(Km+S) – уравнение Холдейна-Бригс, где Vm=Кkat*E0(Кkat-каталитическая постоянная ферментативной реакции); Km характеризует сродство фермента к субстрату. Это справедливо, когда концентрация субстрата во всей системе одинакова. Если используют готовый иммобилизованный фермент то концентрация субстрата вблизи носителя отличается от концентрации в растворе и тогда Кm зависит от этого распределения и уравненеие имеет вид V=(Kkat*E0*S)/ (Kmиф+S). Кkat – не зависит от распределения и характеризует реакционную способность образующегося фермент-субстратного комплекса. При иммобилизации пространственная структура фермента может изменится. Это может быть вызвано разными причинами: 1) модификация функциональных групп белка, ответственных за превращение субстрата 2) неспецифичные взаимодействия фермента с носителем могут привести к денатурации фермента. Kmиф=Km*Р, где Kmиф – кажущаяся константа Михаэлиса для иммобилизаванных ферментов, Km - константа Михаэлиса для свободного фермента, Р – величина распределения субстрата. Р=[S]р/[S]н, где [S]р – концентрация субстрата в растворе, [S]н - концентрация субстрата около носителя. Если S>Kmиф, то V= Vm= Kkat*E; если S<<Kmиф, то 1) если р>1, то скорость реакции будет уменьшаться 2) если р<1, то скорость реакции будет увеличиваться по сравнению со свободным ферментом. Основная причина неравномерности распределения (р≠1) взаимодействие носителя с субстратом. Для того, чтобы произошла ферментативная реакция субстрат должен достигнуть фермента, который может быть или на поверхности носителя или внутри него. Если реакция идёт быстрее, чем субстрат подходит из раствора, то около носителя образуется зона обеднённая субстратом и скорость реакции определяется скоростью диффузии субстрата к носителю. Если перенос субстрата идёт быстрее, чем реакция, то глубинные области будут обеднены субстратом. К поверхности носителя в ферментом всегда примыкает неперемешиваемый слой жидкости, сквозь которую диффузия субстрата ограничена, следовательно субстрат должен сначала проникнуть через плёнку, а далее образовать фермент-субстратный комплекс. При переводе фермента в иммобилизованное состояние оптимальная рН его может изменится. Если носитель полианионит, то конц-я Н+ внутри ↑, а рН↓, чем в растворе; |
если поликатионит, то наоборт. Во втором случае фермент работает менее эффективно. Этого можно избежать используя высококонцентрированные буферные растворы или экранировать заряд ионами. Носитель припятствует свободной диффузии Н+ внутрь. Это особенно важно, когда Н+ образующийся в результате реакции может накапливаться в носителе и отрицательно влиять на фермент (изменять рН). Если рН до начала реакции была выше оптимальной (внутри носителя), то образующиеся протоны снизят рН и увеличат скорость ферментативной реакции и это приведёт к ещё большему снижению рН. Если рН до начала реакции была ниже оптимальной, то выделение Н+ будет замедлять реакцию. 1 свободный фермент активность 2 слабые диффузионные
2 Участки, соответствующие 1 низким значениям рН
Z |
|
|
37 Физ-хим св-ва амилаз, -галактозидазы, протеолитич. ферм-в.
Крахмал ожижают при t = 80 – 90˚С, 2 – 3 ч. Добавляют пулуназу – устраняет ветвление. Затем добавляют либо 1) -амилазу (получают мальтозный сироп), либо 2) -амилазу и глюкоамилазу (получают сироп, содержащий больше глюкозы), эти все операции проводят после ожижения и при t = 50˚С в течение 1 – 4 суток, В результате раствор будет содержать не менее 90% глюкозы. Далее раствор обрабатывают глюкозоизомеразой, которая действует только на глюкозу и превращает её во фруктозу. Иммобилизованные ферменты: -амилаза доступна и при иммобилизации она менее активна, чем свободный фермент. |
Иммобилизуют глюкоамилазу – в промышленности не применяется (недостаточно изучены). Применяется в пилотных установках. Способы иммобилизации: связывание с пористым силикагелем (поверхностная иммобилизация), захват в полые волокна 3-аце-тальдегида, осаждение на ДЭАЭ-целлюлозе, фермент работает при 50˚С (если t выше – инактивация). Сокращается время обработки крахмала до 9 минут (по сравнению со свободным ферментом – 72 часа).
Безлактозное молоко.
Молоко проходит через стерилизатор (2) (60оС, 3 сек) и охладитель. Затем через колонку с иммобилизованным ферментом (3) и в асептический резервуар (4). Проходит через колонку многократно до достижения определённого уровня конверсии. Гидролиз молочной сыворотки
|
|
|
Лактаза иммобилизуется на пористом силикагеле в колонне (3). Сыворотку деминерализуют HCl, пастеризуют и охлаждают в установке (2), пропускают сверху вниз через колонну, колонну очищают уксусной кислотой (4).
NH─CH─C─N─CH─CO -→NH─CH─COOH + NH2─CH─CO - │ ║ │ │ │ │ R O H R1 R R1 Эндопептидазы – катализирует гидролиз до пептидов, экзопептидазы – до аминокислот. Часто в неактивных формах (пепсиноген, трипсиноген). Пепсин (поджелудочная железа). Трипсин (поджелудочная железа) применяется в медицине, для смягчения мяса. Ренин (желудок телят) – молокосвёртывающий препарат. Папаин (папайя), Бромелаин (ананас) – смягчают мясо, способствуют пищеварению. Протеазы из микроорганизмов: Aspergillus orise (вкусовая добавка, сакэ); Asp. niger – производство кормов, кислотоустойчивый; субтилизин (Bacillus subtilis) – производство кормов. Сериновые протеазы – высокая протеолитическая активность, используют в производстве моющих средств; в кожевенной промышленности – для обезволашивания шкур, для смягчения кожи. В медицине – используется для удаления мёртвых тканей (дренаж ран), подавление воспалительных процессов, при болезни лёгких – исчезновение слизи. В молочной промышленности: иммобилизуют, используют для свёртывания молока: ренин, химотрипсин. Z |
|
|
|
38 Применение иммобиллизованных ферментов в медицине. В настоящее время природные физиологические в-ва белковой природы (ферменты) рассматриваются как перспективные средства медикаментозного лечения, так и обладают высокой активностью и специфичностью. Недостатки: 1) лабильность в физиологических условиях, 2) быстрое выведение из организма и разрушение под действием эндогенных протеаз, 3) антигенность, 4) токсичность, 5) малая доступность и высокая цена. Их можно устранить используя иммобилизованные ферменты. Иммобилизацию белковых лекарственных препаратов ведут на носителях, которые не должны оказывать негативного влияния и должны способствовать проникновению фермента к –желаемой цели. Они должны быть не токсичными. Если фермент иммобилизуется на нерастворимом носителе с острыми концами, то он не должен повредить клетки.
Если полимер растворим, то солюбилизирующего агента не нужно. Если высокомолекулярное соединение не может проникнуть путём диффузии, то может пройти путём эндоцитоза, если полимер имеет химические группы, специфически взаимодействующие с клеточной мембраной. Лекарственные препараты, в которых соотношение белок : полимер высокое, могут быть изготовлены с помощью искусственных клеток или липсом. Они представляют собой микросферы, с проницаемой оболочкой. Микрокапсульные препараты. Мелкие реакторы, тонкая оболочка которых проницаема для низкомолекулярных соединений. Фермент внутри и не контактирует с тканями и жидкостями организма, не ингибируется и не вызывает |
иммунного ответа организма. Создание депо инсулина путём введения микрокапсул, содержащих островки Лангерганса. Однако они могут закупоривать сосуды и образовать тромбы. В последние годы их делают из оболочек эритроцитов. Эти оболочки без внутреннего содержимого называют тенью, их заполняют ферментами. Липосомы – из фосфолипидов имеющих гидрофильные и гидрофобные участки. Прим-е иммобил-х биокатализ-ров в микроанализе Разработаны методы анализа с использованием ферментов для обнаружения разнообразных веществ. Большинство ферментных препаратов взаимосвязано, т.е. продукт одной реакции, может быть субстратом для другой ферментативной реакции. Если трудно определить продукт первой реакции, то берётся фермент, который начинает превращение первого продукта во второй, который можно легко определить. Таким образом повышается чувствительность анализа. Есть автоматические приборы для этих целей. Есть большая группа специальных ферментов. Они катализируют окисление специфических субстратов кислородом воздуха (глюкозы, холестерина). Из сахарозы под действием фермента сахараза образуется глюкоза и фруктоза. Из глюкозы под действием фермента глюкозооксидазы образуется глюконовая кислота и перекись водорода. Далее: из перекиси водорода + кровяная соль (прозрачная) под действием фермента пероксидазы образуется продукт (жёлтый), который определяют. В обоих из перечисленных случаях образуется перекись, следовательно анализ субстратов сводиться к определению перекиси водорода, который проводят полярографически, спектрофотометрически, с помощью флуорисценции и хемолюминесценции. При этом используют катализируемые пероксидазой реакции. Холинаэстераза чувствительна к фосфорорганическим соединениям. Она ими ингибируется. После пропускания анализируемого воздуха через ферментный датчик измеряют остаточную активность холинэстеразы. Зная исходную активность и активность после контакта с ингибитором находят разность А0 – А=ΔА. Строят график зависимости ΔА от известной концентрации фосфоорганических соединений и находят содержание веществ. Иммобилизованную холинэстеразу используют в автоматических датчиках. Применяют аналитически колоночные реакторы с ферментами включенными в ПААГ. С помощью глкозооксидазы определяют глюкозу, лактатдегидрогеназы- молочную кислоту. Многие фирмы выпускают проточные анализаторы с использованем иммобилизованных ферментов в виде колонок. Используют нейлоновые трубки, их внутренняя часть частично гидролизована кислтой, а затем ковалентно иммобилизовали фермент. Эти трубки вставляли в аналитический проточный |
|
|
анализатор и через такой реактор насосом прокачивали анализируемую смесь. На выходе из неё ферментная реакция заканчивалась, измеряли конц. образовавшегося продукта, которая была пропорциональна конц. исходного анализируемого субстрата. Микрокалориметрический датчик.
1
В
Электрод для определения глюкозы:
(
|
48 Чистые культуры м/о. Ч. к. – это такая культура, которая содержит м/о одного вида. Под ч.к. понимают клон одной клетки. Выделение ч.к. осуществляется в 3 этапа:
Поддержание чистоты: соблюдение правил асептики (предотвращение попадания посторонних м/о), механич. защита – удаление мех. примесей из воздуха, с оборудования, физическая защита (t, УФ, Р, ультразвук), химические – антисептики.Контроль чистоты: 1) визуальный – просмотр по штриху или по скошенной агаризованной среде (по поверхности), 2) микроскопирование (препарат фиксирован и окрашен), 3) высев на питательные среды – однородность роста м/о. Причины контаминации: источники: почва (бациллы, споры грибов, актиномицеты – эти м/о могут с пылью попасть в воду, а затем с ней и в среду, или в готовый продукт); вода – энтеробактерии, псевдомонады, цианобактерии; люди - кокки, вирусы, микоплазмы, спирохеты, дрожжи; причины: 1) заражение в лаборатории и цехе, 2) на стадии биосинтеза (среда), 3) несоблюдение асептики при приготовлении посевного материала, отборе проб, получении готового продукта, 4) недостаточная стерилизация; последствия: 1) изменение оптимальных условий биосинтеза (изменение продукта);2)затруднённость обработки культуральной жидкости;3)загрязнение продукта;4)м/о образуют ферменты, разрушающие продукт. |
|
|
39 Общая характеристика микроорганизмов Микроорганизмами принято называть мельчайшие живые существа, размеры которых меньше или немногим превышают разрешающую способность человеческого глаза (0,2 мм). Понятие «микроорганизм» не имеет таксономического значения. Оно объединяет организмы по признаку их малых размеров и специфических методов изучения. Микроорганизмы относятся к трем надцарствам (безъядерные, предъядерные, ядерные) и пяти царствам (вирусы, бактерии, грибы, растения и животные). Микробами среди растений являются микроскопические водоросли, а среди животных - микроскопические простейшие. Особенности микроорганизмов как объектов исследования и промышленного применения являются: 1). Чрезвычайно малые размеры, которые определяют специфическими методами исследования и культивирования; 2). Короткий жизненный цикл, быстрое размножение и способность давать многочисленное потомство; 3). Разнообразие физиолого-биохимических свойств; 4). Быстрая адаптация к изменяющимся условиям среды обитания. Многочисленные микроорганизмы (бактерии, грибы, простейшие, вирусы) систематизированы в определенном порядке по их сходству, различиям и взаимоотношениям между собой. Этим занимается специальная наука, называемая систематикой. Раздел систематики, изучающий принципы классификации называется таксономией. Таксон - группа организмов, обладающих заданной степенью однородности. Для микроорганизмов рекомендованы следующие таксономические категории: класс, отдел, порядок, семейство, род, вид. Все таксономические категории описываются с помощью признаков. Признаки могут быть морфологическими, культуральными, физиолого-биохимическими, иммунологическими и т.д. В последнем издании определителя Берджи все бактерии разделены на четыре основные категории: I Грамотрицательные эубактерии, имеющие клеточные стенки. Категория включает 12 групп, из которых наиболее широко используются в биотехнологии 4 группа - грамотрицательные, аэробные / микроаэрофильные палочки и кокки: Асеtоbасtег, Сlисоnоbасtеr – продуценты уксусной кислоты; Pseudomonas- продуценты аминокислот, |
витаминов, ферментов, органических кислот; Rhzobium- клубеньковые бактерии, фиксирующие атмосферный азот - получение биоудобрений; Xanthomonas- продуцент ксантана. II Грамположительные эубактерии, имеющие клеточные стенки. Категория включает 17 групп, представителей следующих родов: Streptococcus, Lactobacillus-молочная промышленность;Leuconostoc - продуцент декстрана, Bacillus продуценты ферментов; Clostridium-продуценты ацетона, бутанола, Propionibacterium- продуценты пропионовой кислоты, витамина В12, Streptomices -продуценты антибиотиков и ферментов. III Эубактерии, лишенные клеточных стенок -обычно называемые микоплазмами. IV Архебактерии - прокариоты, обладающие рядом уникальных свойств и биохимических процессов. Они обитают в средах с экстремальными условиями - высокие концентрации неорганических солей, повышенные температуры, оксид и диоксид углерода - как единственные источники углерода. К архебактериям относятся галобактерии, термоацидофильные бактерии и метанообразующие или метаногенные бактерии. Большинство бактерий имеют сферическую, цилиндрическую и спиралевидную форму. Существуют также нитчатые, ветвящиеся бактерии и бактерии образующие выросты. Сферические бактерии называются кокками. В зависимости от взаимного расположения они делятся на микрококки, диплококки, стрептококки, тетракокки, сарцины, стафилококки. Цилиндрические или палочковидные бактерии имеют форму палочек с закругленными (Е. соli), обрезанными (сибиреязвенная бацилла) или заостренными концами. Извитые бактерии бывают трех типов: 1. вибрионы - слегка изогнутые палочки, похожие на запятую (холерный вибрион), 2. спириллы - имеют несколько правильных завитков, 3. спирохеты имеют вид тонких спиралевидных клеток с многократными завитками и петлями. Z |
|
|
40 Получение биопрепаратов для защиты растений Убытки сельского и лесного хозяйства от насекомых-вредителей ежегодно исчисляются в мире в 100 млрд дол. Развившаяся у них устойчивость к ядохимикатам привела к необходимости поиска новых эффективных средств борьбы. Оказалось перспективным использование собственных природных патогенов — микроорганизмов, вызывающих гибель насекомых-вредителей в их природных условиях. В настоящее время в различных странах мира производят более 30 микробиологических энтомопатогенных препаратов. Они характеризуются высокой специфичностью поражения определенных видов насекомых и практически полной безвредностью для человека, теплокровных животных, птиц и полезных насекомых. Энтомопатогенные препараты, получаемые на основе микроорганизмов, выделенных в естественных условиях и внесенных туда вновь уже в виде микробных патогенов, не вызывают нежелательных изменений в биоценозах и не нарушают экологического состояния в регионе. Это делает их более перспективными по сравнению с традиционно используемыми химическими инсектицидами. Все микробные патогены выпускают в виде смачивающихся порошков или паст, реже дустов, гранул, инкапсулированных порошков, стабилизированной эмульсии спор и кристаллов. При непосредственном применении различных форм препаратов предполагается использование различных добавок в виде растворителей, прилипателей, эмульгаторов, способствующих повышению их эффективности. чие от образования Н2 при брожении его фотовыделепие пурпурными бактериями катализирует обычно не гидрогеиаза, а иитрогеназа — фермент, главная функция которого заключается в превращении N2 в аммиа^. Но даже при наличии N2 часть электронов, поступающих к иитрогеиазе, расходуется на восстановление протонов, что ведет к выделению Н2. Среди цианобактерий также обнаружены штаммы, выделяющие при наличии света Н2 в довольно большом количестве и со значительной скоростью (30 — 40 мл • ч-1 • г"1 сухой биомассы). К таким организмам относятся в основном нитчатые формы, образующие особые клетки — гетероцисты (например, АпаЬаепа cylindrica, A. variabilis, Mastigocladus thermophilus, М. laminosus). Продуцирование Н2 чаще всего отмечается у суспензий клеток, причем может продолжаться 30 сут и более. Такую же способность проявляют иммобилизованные клетки
|
микроорганизмов. В отличие от пурпурных бактерий для образования молекулярного водорода циаиобактериями не требуется каких-либо экзогенных доноров электронов, кроме воды. Важно также, что нитчатые формы бактерий, формирующие гетероцисты, и некоторые одноклеточные виды способны выделять Н2 не только в анаэробных, но и в аэробных условиях. Более перспективны в данном отношении цианобактерий, поскольку выделение ими Н2 связано с биофотолизом воды, которая пока остается наиболее дешевым и доступным субстратом. Не прекращаются работы и с водорослями, так как они также способны продуцировать водород при разложении воды. Предлагается, кроме того, использовать комплексные системы, образующие Н2, в которые входят разные фототрофы или фототрофы и хемотрофы. Показана также принципиальная возможность получения молекулярного водорода из воды с помощью хлоропластов при добавлении к ним гидрогеиазы и некоторых других компонентов, хотя скорость его выделения и стабильность такой системы невелики. Но исследование образования Н2 подобными модельными системами может помочь созданию аналогичных искусственных катализаторов для преобразования солнечной энергии в молекулярный водород. Таким образом, хотя микробиологический способ получения молекулярного водорода еще не реализован, работы в данном направлении развиваются и аспекты исследований водородобразующих видов микроорганизмов достаточно широки. |
|
|
41 Строение бактериальной клетки. Содержимое клетки, окруженное ЦПМ, называется цитоплазмой. В цитоплазме бактерий содержатся рибосомы, ядерный аппарат и различные включения. Ядерный аппарат бактерий называется нуклеоидом. Он представлен двунитчатой молекулой ДНК, замкнутой в кольцо, которая получила название бактериальной хромосомы. Кроме нуклеоида в бактериальной клетке имеются внехромосомные факторы наследственности – плазмиды. В цитоплазме бактерий обнаруживаются твердые, жидкие и газообразные включения и запасные вещества. Структуры, расположенные снаружи от ЦПМ называют поверхностными структурами. К ним относятся клеточная стенка, капсулы, слизистые чехлы, жгутики, ворсинки. Жгутики обеспечивают движение клеток. Капсула и слизь играют защитную роль: предохраняют бактерии от механических повреждений и высыхания, от губительного действия УФ лучей, от различных химических агентов. В зависимости от строения клеточной стенки прокариоты делятся на 2 большие группы: грамположительные и грамотрицательные бактерии. Такое деление связано со способностью бактерий окрашиваться по Граму. Сущность метода заключается в том, что при обработке клеток прокариот сначала красителем генциановым фиолетовым, а затем йодом, оброазуется окрашенный комплекс, который при последующей обработке спиртом удерживается грамположительными бактериями, вымывается из клеток грамотрицательных бактерий, которые в результате обесцвечиваются. При последующей обработке фуксином они приобретают розово-красную окраску, а Грам (+) бактерии имеют сине-фиолетовую окраску. В состав клеточной стенки прокариот входят 7 различных химических веществ: пептидогликан или муреин, тейхоевые кислоты, полисахариды, белки, липиды, липолисахариды, липопротеиды. Пептидогликан составляет основную массу вещества клеточной стенки (от 50-90 %) грамположительных бактерий. Гр(-) – содержание пептидогликана значительно меньше (1-10 %). КС Гр (+) прокариот плотно прилегает к ЦПМ. |
Для Гр (-) прокариот характерно наличие периплазматического пространства. В клеточной стенке Гр(+) бактерий полисахариды, если они есть, связаны между собой ковалентно. Содержание белков невелико. Характерная особенность – наличие тейхоевых кислот. Особенностью Гр(-) бактерий является наличие наружной мембраны, основным компонентом которой являются: фосфолипидный бислой, липополисахариды, липопротеины, белки. Функции клеточной стенки прокариот: 1. Механическая защита от воздействий окружающей среды, 2. Поддержание внешней формы, 3. Возможность существования в гипотонических растворах, 4. Антигенные функции. Z |
|
|
42 Строение и развитие дрожжей, и их применение в биотехнологии Дрожжи — внетаксономическая группа одноклеточных грибов, утративших мицелиальное строение в связи с переходом к обитанию в жидких и полужидких, богатых органическими веществами субстратах. Объединяет около 1500 видов, относящихся к аскомицетам и базидиомицетам. Дрожжи являются хемоорганогетеротрофами и используют органические соединения как для получения энергии, так и в качестве источника углерода. Им необходим кислород для дыхания, однако при его отсутствии многие виды способны получать энергию за счёт брожения с выделением спиртов (факультативные анаэробы). В отличие от бактерий, среди дрожжей нет облигатных анаэробов, гибнущих при наличии кислорода в среде. При пропускании воздуха через сбраживаемый субстрат дрожжи прекращают брожение и начинают дышать (поскольку этот процесс эффективнее), потребляя кислород и выделяя углекислый газ. Это ускоряет рост дрожжевых клеток (эффект Пастера). Однако даже при доступе кислорода в случае высокого содержания глюкозы в среде дрожжи начинают её сбраживать (эффект Кребтри).[13] Отличительной особенностью дрожжей является способность к вегетативному размножению в одноклеточном состоянии. При сопоставлении с жизненными циклами грибов это выглядит как почкование спор или зиготы. Многие дрожжи также способны к реализации полового жизненного цикла (его тип зависит от аффинитета), в котором могут быть и мицелиальные стадии. Дрожжи нашли широкое применение в хлебоперении виноделии пивоварении производстве спирта получают также пищевые и кормовые дрожжи. Высушенные пивные дрожжи используют для производства лекарственных препаратов и БАД. Дрожжи используют также в в качестве модельного объекта. Дрожжи рода Zygosaccharomyces уже долгое время являются одними из важнейших агентов порчи продукции пищевой промышленности Некоторые виды дрожжей являются факультативными и условными патогенами, вызвая заболевания у людей с ослабленной иммунной системой. |
|
|
|
43 Актиномицеты Актиномицеты – грам+ бактерии, имеющие клеточную стенкуи относящиеся к 22-27 гр. Они обладают признаками бактерий (нет ядра, малые размеры-0,2-0,5 мкм, наличие муреина в клеточной стенке, чувствительность к антибактериальным акнибиотикам) и грибов ( образование гиф, образование спор для размножения, наличие вакуолей и др.). Строение: есть двунитевая кольцевая ДНК, несвязанная с белками и предаставляющая собой одну хромосому; строение клеточной стенки такое же, как у грам+ бактерий; рибосомы 70 S типа; в цитозоле одномембранные вакуоли. Основной морфологической единицей являются мицелиальные гифы или нити, они тоньше грибных. Имеют апикальный и интеркалярный ( вставочный) рост. Существует несколько типов гиф: 1) субстратный мицелий-тонкие бесцветные нити врастающие в субстрат. Основная их функция-поглощение питательных веществ. 2) воздушный мицелий-ветвящиеся окрашенные гифы, которые тянутся вверх, участвуют во всасывании СО2 и Н2О; на нём образуются конидииносцы с конидиями. Культуральные свойства актиномицетов: при росте на плотных питательных средах они образуют разные по форме и строению колонии. Если мицелиальная стадия короткая, то колонии имеют вид гладкого или шероховатого круга не врастающего в агар и пастообразные по консистенции. Если мицелиальная стадия приобладает то плотные врастающие в агар колонии с хорошо развитым мицелием образуют пигменты. Если рост в жидкой среде, то образуются зернистые или хлопьевидные шарики. Рост: 1 стадия-прорастание споры, мицелий представлен недифференцируемыми нитями, далее образуются неполные перегородки,; последняя стадия-автолиз нитей, распад на кусочки. Вообщем можно сказать, что в процессе роста образуется одна гигантская клетка . Актиномицеты по типу питания являются хемоорганотрофами, по отношению к кислороду-облигатными аэробами, по отношению к температуре-мезофилами, устойчивы к облучению, по отношению к рН-нейтрофилы. Актиномицеты синтезируют широкий класс БАВ: витамины, антибиотики, токсины, ароматобразующие вещества.. В природе играют роль в формировании почвы и утилизации органических остатков, обитают на растительных и животных остатках, разрушают пластмассу, резину; это засухоустойчивые формы. Использование актиномицетов: 1) получение антибиотиков ( Streptomyces – нистатин) 2) получение протеолитически ферментов 3) получение витаминов гр. В 4) получение каротиноидов 5) получение гибберилиов 6) получение орг. кислот 7) получение алкалоидов. Z |
45 Питательные среды. При культ-ии м/о применяют спец-но подобранные пит ср, кот подбирают по потребностям м/о, чаще всего входят: вода т.к. все пит в-ва м/о получают в раств-ом виде. Источник С для автотрофов СО2 либо добав-ляют Na2CO2 или продувают СО2. Орг источник углеводы, полисах-ды. S в виде сульфатов. N – нитраты или соли аммо-ния, лишь отдельные м/о способны потреблять молек-ый N2. О – необходим лишь для аэробных м/о. Наиб важно подо-брать optim пит среду, кот обеспеч рост и получ-е целевых прод-в. Среды делятся на синтетические (имеют опред хим состав: ист С, соли, витамины, аминок-ты.) и естественные (сложные, не имеют опред состав: пивное сусло, дрожжи, экстракт, миласса). Пит ср делятся на жидкие (на воде) и твердые (1. Уплотненные – особые в-ва, придающие желе-образную конс-ю: агар tпл =30оС, желатин tпл =100оС; 2. Сыпучие – для их пригот-я исп природные субстраты: опилки, зерно, солома). Синтетические и природного происхождения. Z |
|
|
44 Грибы. Грибы – группа живых организмов, относящаяся к надцарству эукариот к царству Mycota. Признаки одинаковые с животными: лишены хлорофилла и по типу питания хемоорганогетеротрофы; в обмене в-в присутствует мочевина; запасной полисахарид – гликоген; в клеточной стенке присутствует хитин; при питании питательные в-ва сначала адсорбируются, а затем всасываются. Признаки общие с растениями: неподвижность, способность к неограниченному росту (он идёт за счёт верхних клеток). Всё тело – мицелий или грибница – система тонких ветвящихся нитей или гиф находится на поверхности или в толще субстрата. По типу строения мицелия различают: низшие грибы (мицелий не имеет перегородок и представляет собой гигантскую многоядерную клетку); высшие грибы (гифы септированы, т. е. разделены перегородками. Строение грибной клетки. Сверху хитиновая оболочка, в состав её входят: азотсодержащие и безазотистые полисахариды, в небольшом количестве белки, липиды, полифосфаты. Под клеточной стенкой находится цитоплазматическая мембрана, отграничивающая внутреннее содержимое. В цитоплазме ядро (или несколько ядер), рибосомы 80S типа, митохондрии, лизосомы, вакуоли с запасными в-вами (волютин, липиды, гликоген и жирные кислоты). Гифы имеют верхушечный рост и обильно ветвятся. Часто плотно переплетённые гифы образуют ложную ткань – плектенхиму. Различают кроющие гифы (наружные) и внутренние (проводящие), плодущие (на концах образуются споры). Систематика грибов. Выделяют 6 классов:
2. Оомицеты. Имеют неклеточный мицелий. В клеточной стенке основной полисахарид – целлюлоза. Размножение бесполое (зооспорами с 2-мя жгутиками), половое (оогамия). Обитают на органических остатках, но есть и |
паразиты. 3. Зигомицеты. Мицелий в незрелом состоянии неклеточный, в зрелом – септирован. Бесполое размножение спорангиоспорами (для них специальные вместилища) или конидиями (для них специальные выросты), половое размножение – зигогамия (слияние 2-х не дифференцированных на гаметы клеток). Представители – мукоровые грибы. В Азии используют в качестве компонента закваски. 4. Аскомицеты или сумчатые грибы. В результате полового процесса образуются аски или сумки. Аск – одноклеточная структура, которая в результате мейоза образует 8 аскоспор. Мицелий септирован. В клеточной стенке хитина меньше чем у других грибов. Есть глюканы и маннаны. Половой процесс – гаметангиогамия (слияние 2-х гаметангиев, т.е. специальных клеток не дифференцированых на гаметы. Представители: 1) Дрожжи – размножаются асками, одноклеточные, не образуют типичного мицелия. Клеточная стенка покрыта капсулой. Бесполое размножение осуществляется неподвижными спорами, вегетативное – почкованием (вырастают из материнской клетки), половое – слияние 2-х клеток с образованием зиготы и из неё аскоспор. 2) Трюфели – подземные грибы. 3) Сморчки. 4) Строчки. 5. Базидиомицеты. Высшие грибы с многоклеточным мицелием. Вегетативное размножение: хламидоспорами (распад гиф на отдельные клетки, каждая из которых одевается оболочкой), кусочками мицелия. Бесполое размножение – образование конидий. Половой процесс – соматогамия (2 гаплоидных мицелия сближаются, между клетками образуется мостик, по которому идёт перемещение ядер). Эти грибы – почвенные сапрофиты (например, шампиньоны). 6. Дейтеромицеты – несовершенные грибы. Мицелий септирован. Размножаются только бесполым путём – конидии. Представители – грибы рода Aspergillus (применяются в производстве БАС). Z |
|
|
46 Рост м/о и его количественные характеристики РОСТ – согласованное увеличение количества хим компонентов, из которых она построена. Рост приводит к увеличению массы и размеров. Но увеличение массы не всегда рост (накопление запасных веществ), увеличение объема – ослизнение. РАЗМНОЖЕНИЕ – воспроизведение себе подоб-ных. После достижения определенных размеров – деление. Новое поколение – новая генерация. Время от возникновения клетки до деления – время генерации. Рост и деление – два последовательных этапа, иногда их объединяют под термином – развитие. Способы деления: 1. Образование поперечных перегородок у гр (+); 2. Образование перетяжки у гр (-), 3. Почкование – неравномерное бинарное деление (дрожжи). Мицеллиальные грибы растут в виде гиф, рост апикальный, гифы растут в длину, образуются боковые выросты. Величина популяции определяется числом кл, либо биомассой (суммар-ный вес). СПОСОБЫ определения: 1 прямые - подсчет числен-ности бактерий (камера Горяева, эл/счетчики, ФЭК, нефело-метры, м-д предел. разведений), подсчет суммарного веса бакт кл (опред объем центриф, осевшие кл промывают, высуш при 1050 и взвешив 109 кл – 0,32 мг); 2 косвенные методы – связан с определением интенсивности обмен процессов. (поглащ О2 при пом кислородных электродов, инт-ть образ СО2, витами-нов, кислот, белка, ДНК, клет N). ПАРАМЕТРЫ РОСТА: 1 абсолютная скорость ν = dx/dt = (x-xo)|(t-to); удельная – изме-нение количества м/о в ед времени в пересчете на ед исходной биомассы μ = dx/dt * 1/xo 2 константа ингибирования – характ чувствительность м/о к ингибиторам роста и численно равна конц ингибитора, замедляющего скорость роста вдвое. Если удел скорость роста завис от конечного продукта (Р), т.е. они являются ее ингибиторами, то она выраж формулой неконку-рентного торможения энзиматич реакций: μ = μ max* Ki / Ki + P, Ki – конц ингибитора, 3 скорость деления: n – число делений, N – колич кл, No – нач кол кл, то через промежуток врем: N = No* 2n; lg N = lg No + n lg 2. Скорость деления ν = (lg N – lg No )/ (t-to) * lg 2. ν = 3,32 (lg N – lg No )/ (t-to) 4 Время генерации – величина обратная скорости – время, кот необходимо для 1 цикла деления: g = (t-to)/n.
|
5
Время
удвоения биомассы:
td
= ln
2/ μ = 0693/ μ. 6 Урожай
культуры
– max
количество кл или биомасса, к Кривая роста: 1 латентная ф – адаптация к усл среды, N не увелич, или увелич незначит, увелич РНК, белок. Чем старше культура, тем длиннее фаза. 2 – ускорение роста – клетки активно размножаются, 3 экспо-ненциальная ф (лагариф) – скорость деления кл постоянна и max, 4 замедление роста (уменьш пит в-в, накопл продуктов обмена). 5 число кл постоянно, гибель = размнож. 6 – отмира-ние – число жив кл уменьш.
Л
Z |
|
|
47 Хранение микроорганизмов. Задача-поддержание их жизнеспособности, сохранение стабильности таксономически важных признаков ,а также определённых свойств, предствляющих интерес для науки и практики. Методы хранения: 1) Дегидратация - (высушивание из жидкости под вакуумом, высушивание из замороженного состояния под вакуумом - лиофилизация). 2) Уменьшение доступа О2 (под минеральным маслом , в запаяных ампулах). 3) Хранение густых суспензий клеток - (в дистиллированной воде, физ. растворе, 10% растворе сахара). Периодические пересевы - (аспорогенные бактерии пересевают 1-2 раза в месяц; спорогенные бактерии, дрожжи, мицеллиальные грибы,аскомицеты-1 раз в 3 месяца). Плюсы метода: визуальный контроль, простота. Минусы метода-возможность заражения, снижение активности продуцентов. Хранение под минеральным маслом: выращивают на благоприятных питательных средах и заливают минеральным маслом (стерильным, слой в 1-2 см.). При этом замедляется метаболизм, уменьшается доступ О2.Перед использованием масло (вазелиновое) стерилизуют при 251 кПа-30 мин., для удаления влаги подсушивают в сушильном шкафу при t=150C.Температура хранения 5С. Через 1,3,6,12 месяцев определяют выживаемость микроорганизмов. Плюсы метода - длительная сохранность, минусы метода-снижение активности, изменение признаков, разбрызгивание масла ведёт к заражению персонала. Высушивание на воздухе: посредством контактной сушки м/м высушивают на воздухе до влажности 10-12%.Используют сорбенты: стерильная почва, песок. В процессе лиофилизации микроорганизмы охлаждают до –20-24С и сушат под вакуумом. Хранение при низких температурах: Для многих видов применяется глубокое замораживание при t=-70C в рефрижераторах. Для защиты от повреждения используют криопротекторы (глицерин 10%) быстро проникающие через клеточную мембрану и препятствующие замораживанию. 2-х этапный режим замораживания: сначала медленно до -30С, затем до -150С быстро (в газообразном азоте). Ампулы хранят в газообразном при -150C или жидком при -196С азоте. Для восстановления быстро оттаивают при 37С в водяной бане. Хранение в дистиллированной воде или физ. растворе - микроорганизмы смывают с поверхности скошенной |
агаризованной среды дистиллированной водой или физ. раствором. Густые суспензии разливают во флаконы, закрывают резиновыми пробками и хранят при 4-6С (E.coli, Str. aureus и др.) Бактерии существуют за счёт окисления полимеров (запасных). Коллекции типов культур - Коллекции в учебных заведениях и в разичных НИИ. Наиболее значима всероссийская коллекция микроорганизмов в институте биохимии и физиологии РАН. Каждый новый производитель - штамм депонируется в коллекцию (депонирование штаммов). Поддержка селекции включает в себя : рассев на чашки Петри (определяют жизнеспособность клеток). Определяют % нетипичных колоний (должно быть 0,1-1%). Очиска от мутантов поддерживает селекцию. Она включает в себя серию последовательных разведений ,посев на агар. среду, рост в термостате и пересев типичных колоний в пробирки со скошенным агаром. Проверяется продуктивность и отбироются низкоактивные субклоны. Субклоны с типичиой морфологией и стационарным уровнем активности – снова на хранение. Z |
|
|
49. Периодическое культивирование микроорганизмов. Периодическое культивирование микроорганизмов – метод культивирование микроорганизмов, характеризующийся однократным засевом среды в начале и одноразовым получением биомассы в конце процесса, обычно после полного использования субстрата. Периодическое культивирование микроорганизмов может быть представлено статическими, динамическими и продленными способами культивирования. Статические процессы осуществляются в стационарных условиях без перемешивания. При этом аэробные микроорганизмы обычно развиваются на поверхности жидкой или твердой среды (поверхностное культивирование), например, поверхностный способ жидкофазного культивирования Aspergillus niger для получения лимонной кислоты. Периодические динамические процессы осуществляются с помощью перемешивания и аэрации: в жидких средах на качалках, в биореакторах при помощи мешалки и барботера. Твердофазное культивирование (ТФК) – это выращивание микроорганизмов в массе измельченного влажного твердого субстрата. Технологическими вариантами ТФК являются компостная куча, поверхностное культивирование, перемешиваемый слой, культивирование во вращающихся ферментерах, ТФК с перемешиванием и аэрацией и т.д. К продленным способам культивирования относятся: 1. отъемно-доливной способ, когда порциями в аппарат подается среда и производится отъем культуральной жидкости; 2. периодическое культивирование с подпиткой, когда в культуральную жидкость добавляется по специальной программе отдельные компоненты питательной среды и периодически отбирается часть культуральной жидкости; 3. диализное культивирование в гильзе, не проницаемой для клеток, но пропускающие растворенные вещества; 4. батарейный способ, когда микроорганизмы развиваются в ряду последовательно соединенных ферментеров. Z |
|
|
|
50 Непрерывное культивирование микроорганизмов. Непрерывное культивирование микроорганизмов – это метод проточного культивирования, когда микроорганизмы растут в условиях постоянного обновления среды. Метод проточного культивирования может быть организован как процесс полного вытеснения и процесс полного смешения. Процесс полного вытеснения используется для культивирования анаэробных микроорганизмов в трубчатом ферментере без перемешивания и аэрации и аэробов в батарее аэрируемых ферментеров. С одного конца ферментера подается среда и посевной материал, популяция находится в начале своего развития. По ходу трубки или батарей культура «стареет», субстрат исчерпывается, накапливаются продукты метаболизма и вытекающая культура находится в состоянии, аналогичном стационарной фазе роста периодической культуры. В процессе полного смешения рост культур происходит в ферментере при интенсивном перемешивании. При больших потоках среды эти условия близки к быстрому экспоненциальному росту, при малых приближаются к условиям стационарной фазы роста культур. В установившемся режиме υ потока среды F (л/ч), отнесенная к единице V культуры в ферментере (л), называется коэфф-м (скоростью) разбавления–D (ч -1) Е Изменение концентрации биомассы определяется двумя противоположно направленными процессами: ростом клеток и их вымыванием из культиватора.
культивирования. |
Процесс полного смешения может быть организован по типу «хемостат» и «турбидостат». Хемостатное культивирование – это вариант проточного культивирования с заданным желаемым коэффициентом разбавления (D), к которому подстраивается скорость роста культур (μ). При этом задается лимитирующий фактор, который обуславливает ограничение роста биомассы. Хемостат – это устойчивая система, способная к стабилизации, т.е. в широком диапазоне скоростей разбавления (D) концентрация субстрата, лимитирующего рост клеток, и величина биомассы остаются по существу на постоянном уровне. Рост культуры при проточно-гомогенном культивировании характеризуется хемостатной кривой, изображающей зависимость концентрации субстрата S от разбавления D. На изменение скорости потока культура реагирует соответсвенным изменением концентрации биомассы и концентрации субстрата, не выходя из стационарного состояния. При турбидостатном выращивании микроорганизмов в культиваторе автоматически поддерживается постоянный уровень биомассы, который по оптической плотности культуры регистрируется специальным прибором, снабженным фотоэлементом. Т.е. задаваемый параметр в системе «турбидостат» - плотность популяции. Скорость накопления биомассы управляет скоростью притока питательной среды. Z |
|
|
51 Молочнокислые бактерии. Молочно-кислые бактерии – название не имеет строго таксономического признака и единственный признак отнесения к этой группе способность обра-ть в кач-ве гл продукта брожения мол к-ту. Мк бакт не подвижные, не образуют спор, Г+, не образуют пигментов. По форме палочко и кокковидные. Род Streptococus правильные кокки соединенные в цепочки разной длины. Род Leuconostoc шаровидные обр-е в цепочках, одиночные диплококки. Род Lactobacillus один-ые палочки кокковидной формы, прямые или с закругленным концами Мк бакт требовательны к пит средам, требуют около 19 а/к, ряд витаминов, некоторым нужны предшественники н/к. В природе мк бакт встречаются на сложных агаризов средах(в кишечнике человека, в почве, и др.) На агаризованных средах мелкие колонии, поверхность гладкая или шероховатая. Культ-е св-ва: строгие анаэробы или факультативные анаэробы. О2 они не используют , однако есть флавоноидные структуры, что позволяет использовать О2 для окисления субстратов. Род Lactobacillus палочковидные не ветвящиеся бактерии. Они слабо воздействуют на белки и жиры. Род Streptococcus относят мк кокки сфер-ой или овальной формы, распологаются парами или цепочками различной длины. Их делят на 4 группы: 1. пиогенные гемолитические стреп-ки, приспособленные к паразитическому образу жизни.2. зеленящие играют роль в производстве сыров. 3. энтерококки обитают в воде, на продуктах питания, явл показателями сан состояния. 4. молочнокислые Str. lactis, Str. diacetilactis – запах диацетила. Род Leuconostoc – удлиненные чичевицеобразные кокки, расположены одиночно, парами, цепочками. L. decstranicum – продуцент декстрана, L. citrovorum – сквашивание молока. Род Pediococcus – кокки, расположенные пучками или тетрадами, микроаэрофилы или аэробы. Часто требуют СО2 для роста, редко сквашивают молоко, но образуют молочную кислоту. Род бифидобактерии – они имеют булавовидную форму с утолщенными концами. Наряду с молочной кис-той обр-ют уксусную. Большинство осуществляют гомоферментативное брожение за исключением Leuconostoc, бифидобактерий. Более 90 % продуктов брожения составляет мол к-та, немного этанола, |
ацетата. Идет по гликолитическому пути, на конечной стадии из пирувата в рез-те присоединения мол Н обр-ся мол к-та. Гетероферментативное – отсутствуют ряд Е гликолиза и брожение идет по пептозофосфатному пути и образуется в равных соотношениях мол к-та и этанол или ацетат. Применяют в молочной промышленности для проз-ва кисло-мол продуктов, йогуртов – Str. termofilus, lactob. bulgaricum, сметаны – Lactob. brevis, Str. lactis, в хлебопекарном про-ве при выпечки ржаного хлеба в закваску вводят Str. diacetilactis. Силосование кормов Str. lactis, Pediococcus. При их росте образуется мол к-та, которая подавляет рост E. coli, Clostridium. В мясной промыш-ти выработка колбас солями (Str., Leucon.), при солении рыбы(Str., Leucon.), из декстрана заменители плазмы, пленки. Z |
|
|
|
|
|
|
53 Покоящиеся формы м/о. Покоящиеся формы обеспечивают выживание вида в неблагоприятных условиях. Цисты встречаются у спирохет, азотобактер, микобактерий. От вегетативных клеток они отличаются меньшим содержанием воды и наличием толстой капсулы которая придает устойчивость при нагревании, высушивании и др. физических факторов. Образование цисты у азотобактера сопровождается более существенными изменениями морфологии цитоплазмы обезвоживаются; в ней накапливаются гранулы запасающего вещества β оксимасляной кислоты клетка теряет жгутики и поверхность клетки стала покрываться внешним покровом экзином, а между клеточной стенкой и ЦПМ-внутренний покров (интин). Акинеты цианобактерий устойчивы к высыханию пониженной температуре, крупнее исходных вегетативных клеток, цитоплазма частично обезвожена. Основное отличие толстой клеточной стенки, наличие под ней чехла, а сверху накапливается слизистый слой в котором много липидов и липополисахаридов. Эндоспоры формируются экзогенно(внутри клетки). Обладает специальными структурами, повышенной устойчивостью к повреждающим факторам. Их образуют Г+ бактерии. Споры содержат все составные вещества материнской клетки, но в 10 раз меньшим объемом. Середина содержит нуклеотид, множество рибосом, большое количество ионов К, Mg, Mn, которые играют роль в состоянии покоя. Содержание воды 15 %. Сверху протопласт окружен кортексом, который представляет собой особый тип пептидогликана, в него входят белки и термостабильные полисахариды. Споры образуются при нехватке питательных веществ, при накоплении большого количества продуктов обмена. Споры образуются внутри исходной материнской клетки. 1 этап. Обособление специального участка цитоплазмы, содержащею однокольцевую ДНК. 2 этап. Окружение споровой цитопл-зы материнской. 3 этап. Споровая цитоплазма окружена 2 мембранами своей и материнской. Идет метаболизация, перестройка клетки, расходуется часть запасных веществ, расходуются белки материнской клетки и синтезируется дипикалиновая кислота. Из окружающей среды клетка поглощает Са. 4 этап. Синтез кортекса. В этом процессе участвуют внешние и внутренние мембраны 5 этап. Оставшаяся часть материнской клетки участвует в формировании внешних покровов. 6 этап. Лизис исходной материнской клетки и выход споры наружу.
|
54 Основные представления о БАС. БАВ – общее название органических соединений, участвующих в осуществлении каких-либо функций организма (биосистемы) и обладающих высокой специфичностью действия. БАВ: 1 Антибиотики; 2 Витамины; 3 Каратиноиды; 4 Алкалоиды; 5 Антиоксиданты; 6 Гибберилины; 7 Аминокислоты; 8 Нуклеотиды; 9 Ферменты; 10 Липиды; 11 Полисахариды. Незначительная часть не проявляет своей активности (балластные вещества). Некоторые БАВ работают всегда (мембраносвязанные ферменты). К белковым соединениям относят большое кол-во веществ, каждое из которых можно так или иначе отнести к БАС. Биологически активные вещества– жизненноважные и неоходимые компоненты человеческого организма . Находясь в малых количествах , они обеспечивают полноценнцую работу органов и систем. Витамины повышают устойчивость организма к различным экстремальным факторам и инфекционным заболеваниям, способствуют обезвреживанию и выведению токсических веществ и т.д. Любое функциональное проявление живого организма - дыхание, мышечное сокращение, нервно-психическая деятельность, размножение и т.д. - тоже непосредственно связаны с действием соответствующих ферментных систем. В медицинской практике гормональные препараты используют для лечения заболеваний желез внутренней секреции, при которых функция последних понижена. Так, например, инсулин применяют для лечения сахарной болезни ( диабет). Помимо лечения заболеваний желез внутренней секреции гормоны и гормональные препараты применяются также и при других болезнях: инсулин – при патологическом истощении, заболеваниях печени, шизофрении; тиреоидин – при некоторых формах ожирения; мужской половой гормон (тестостерон) – при раке молочной железы у женщин, женский половой гормон (или синэстрол и стильбестрол) – при гипертрофии и раке предстательной железы у мужчин и др. Гормоны находят применение также в зоотехнике – для повышения продуктивности сельско–хозяйственных животных. Так, гормон щитовидной железы или заменяющий его препарат иодированного белка (казеина), по некоторым данным, способствует повышению удойности коров.
|
|
|
|
|
|
|
55 Витамины Это низкомолекулярные орг. соединения различной химической природы, выполняющие важнейшие функции в живых системах. Витамины требуются организму в очень небольших концентрациях. Витамины делят на водорастворимые (B, C, H и другие) и жирорастворимые (A, D, E, K). Существуют ещё витаминоподобные соединения (флавоноиды, холин, инозит, липоевая кислота). Существует отдельная группа - антивитамины. Они могут вступать в конкурентные отношения с витаминами, занимать их место в структуре фермента. Антивитамины не могут выполнять функции витаминов. Это связано с их строением. Поэтому может возникнуть авитаминоз. К антивитаминам относят также вещества, которые связываются с витаминами или разрушают их (овидин, сульфаниламидные препараты). Авитаминоз - отсутствие витаминов. Гиповитаминоз-недостаток витаминов. Гипервитаминоз - избыток витаминов (может вызвать аллергию и другие проблемы). Витамин А – жирорастворимый витамин (ретинол-А1, ретиналь-А2, ретиноевая кислота-А3). Содержится в основном продуктах животного происхождения(печень, яичный желток, в растениях представлен провитамином- β-каротин. Функции: входит в состав зрительного пигмента – родопсина, необходим для развития эпителия, для нормального роста организма, участвует в борьбе с вирусами. Недостаток витамина приводит к кератозу, куриной слепоте, сухости роговицы глаза. Витамин В1 – тиамин (водорастворимый). Состоит из пиримидина и тиазола. Этот витамин синтезируется растениями и м/о. Участвует в обмене углеводов. Недостаток приводит к нарушениям углеводного обмена, проблемам с пищеварительной, нервной, сердечнососудистой системой. Содержится в злаковых, в хлебе, пивных дрожжах. Витамин В2 состоит из рибитола и азоаллоксазина. Синтезируется растениями, участвует в транспорте водорода, принимает участие в тканевом дыхании. Недостаток витамина приводит к проблемам с кожей, со зрением. Большое количество витамина содержится в бобовых, дрожжах, мясо-молочных продуктах. Витамин В6 (пиридоксин, пиридоксаль, пиридоксамин), синтезируется растениями, м/о. Недостаток вызывает анемию, дерматит, судороги. Участвует в реакциях переаминирования и дезаминирования. Витамин В12 |
участвуют в биохимических процессах не только, как предшественники коферментов, но и могут служить основой для биосинтеза отдельных групп соединений. Холин - донор метильных групп, участвует в биосинтезе метионина. Содержится в яичном желтке и др. Липоевая кислота - используется в медицине против атеросклероза, заболеваний печени, сахарном диабете. Карнитин - участвует в трансмембранном транспорте. Витамин U (метилметионин) - содержится в капустном соке, полезен при язве желудка, гастрите. ПАБК - является составной частью витамина фолиевой кислоты. Z |
|
|
56 Биосинтез витаминов гр В. Биосинтез В2 (рибофлавин). Техн. схема: 1. Подготовка инокулятапосев на косякижидкая средамасштабирование. Косяки содержат свекловичный сахар, агар, рН=6,8 4 сут. Время выращивания в колбах и бутылях 48 часов. При помещении в инокулятор среда должна содержать Кук экстракт, свекловичный сахар, К2НРО4, эмульгатор. В инокуляторе 24-26 часов затем в биореактор. Среда кук, соев мука, кук экстракт, К2НРО4, СаСО3, NaCl. t культивирования 28-30С и повышенное давление, аэрация 1,5-2 л мг/л. конец процесса – лизис клеток или образование спор. Конечный продукт упаривают до содержания сух в-в 30-40%. Затем массу распыляют, дробят, фасуют. Биосинтез витамина В12. Продуценты – низшие эукариоты, пропионово-кислые бактерии, актиномицеты. В промыш Nocardia rugosa. Культивир на средах с пищевым сырьем. Хим. схема производства В12: глицин сукцинил Ко-А (АЛК синтетаза), δ-аминоливулиновая кислота (АЛК дегидрогеназа), порфобилиноген ПБК (конденсация, порфириногеназа), уропорфириноген 3 УПФГ (метилирование), коррифирин (декарбоксилирование), кобириновая кислота (амидирование), кобинамид фактор В, коферментная форма фактора В (фосфорилирование ГТФ), кобаламин. Биосинтез В12 осуществляется переодическим методом в анаэробных условиях, ферментация 72 часа. В12 остается в клетках бактерий. После биомассу сепарируют и фильтруют. Витамин экстрагируют водой(рН=4,5-5,0). Экстракцию ведут 1 час. Затем производят очистку ра-ра. Кристаллизацию осуществляют охлаждением раствора, удаляют жидкость, сушка. Решение проблем промышленного производства вит В12 имеет след направления: 1.Получение витаминов и коферментов с использованием сверхпродуцентов и использования особых режимов культивирования. 2. Получен. витаминов всех форм из биомассы микроорганизмов в промышл масштабах (пивные дрожжи, белково-витаминные концентраты). 3. Применение микроорганизмов для отдельной стадии процесса хим синтеза. Z |
2. Получен. витаминов всех форм из биомассы микроорганизмов в промышл масштабах (пивные дрожжи, белково-витаминные концентраты). 3. Применение микроорганизмов для отдельной стадии процесса хим синтеза. Z |
|
|
57 Физ-хим методы очистки осточных вод. Коагуляция – слипание частиц системы при их столкновении в процессе теплового движения. При перемешивании образуются агрегаты вторичных частиц, состоящих из первичных (более мелких). Коллоиднные частицы адсорбируют на своей поверхности ионы одного знака и образуют поверхностно-ядерный или адсорбционный слой. Ядро с этим слоем образует гранулу, вокруг неё образуется слой противоионов диффузионный слой и образуется мицелла. Наличие частиц одного знака вызывает их отталкивание, одновременно между частицами действуют силы молекулярного притяжения, которые проявляются на малых расстояниях. При понижении электрического заряда частиц становится возможным их слипание. Это делают путём введения электролитов, заряд которых противоположен заряду коллоидных частиц. Хлопья образуются сначала за счёт части взвешенных частиц и коагулянтов или только коагулянтов, а за тем на них сорбируются вещества сточных вод. Применяются минеральные коагулянты: соли алюминия, магния, известь. Флокуляция – мелкие частицы под влиянием флокулянтов образуют интенсивно-оседающие рыхлые скопления. Сорбция – процесс поглощения вещества твёрдым телом или жидкостью. Поглощающее тело – сорбент; поглощаемое – сорбат. Если тело поглощает вещества всем своим объёмом, то оно называется абсорбентом (сам процесс – абсорбция); если поверхностью – адсорбентом (адсорбция). Если образуются химические связи, то процесс называется хемосорбцией. В качестве сорбентов используют различные пористые вещества (искусственные и природные)- уголь, торф, силикагель. Этот процесс обратим; при прочих равных условиях процесс сорбции и десорбции (его скорость) пропорциональна количеству вещества в растворе и на поверхности сорбента. Флотация – процесс молекулярного прилипания флот-го материлала к поверхности раздела 2 фаз (газа и жидкости), обусловленный избытком свободной энергии поверхностных пограничных слоёв. Процесс очистки промышленных сточных вод от ПАВ, нефти, масла, волокнистых материалов заключается в образовании компонентов частица-пузырёк их всплытия вверх и удаления с поверхности, образующегося пенного слоя. Прилипание частицы наблюдается, если только частица не смачивается или плохо смачивается жидкостью. Основную роль в процессе флотации играют поверхностные силы: Вадерваальсовы, электр. и силы гидратации. Изменение смачиваемости частицы достигается адсорбцией ПАВ на её поверхности (при добавлении ПАВ флотируемость увеличивается. |
По действию на процесс флотации ПАВ делят на коллекторы (изменяют смачиваемость) и пенообразователи (стабилизируют пену). Способы флотации: 1) с выделением воздуха из раствора 2) с подачей воздуха через пористые материалы (через мелкопористые трубы) 3) элекрофлотация (загрязнения оседают на поверхности резервуара). Экстракция – основана на распределении загрязняющего вещества в смеси 2-х взаимнонерастворимых жидкостях в соответствии в его растворимостью в них. Пример- орг. растворители-экстрагенты. Отношение взаимно уравновешивающихся концентраций в двух растворителях по достижению равновесия называется коэффициентом распределения. Отделяют загрязнитель от экстрагента и утилизируют. экстрагент используют повторно. экстрагент
СВ ↓
↓ ↓ → → оч. СВ отраб. эсстрагент Непрерывнопротивоточная схема.
Перекрестноточная схема. Ступенчатосточная схема.
1 Ионный обмен – это обмен между ионами, находящихся в растворе и ионами присутствующими на поверхности твёрдой фазы – ионита 1 2 Метод позволяет извлекать ценные примеси, ПАВ и радиоактивные вещества. Иониты: катиониты и аниониты, бывают природного и искусственного происхождения (алюмосиликаты, соли многовалентных ионов получают при химической обработке целлюлозы, лигнина, угля), ионообменные смолы. Восстанавливают с помощью:↓ [К]Н++Ме+↔[К]Ме++Н+ ← Н2SO4 [К]Na++Ме+↔[К]Ме++Na+ ←НСl [А] ОН-+Н2SO4↔[A]2SO4+H2O Аппараты бывают периодического и непрерывного действия. |
|
|
58 Аэробная очистка сточных вод – когда используются аэробные м/о, нормально функционирующие сооружения биологической очистки сточных вод, имеющие все признаки биологической системы: ограниченный объём с достаточно однородными условиями существования, сложившийся биоценоз и установившийся процесс превращения энергии. В биоценозе очистных сооружений всегда присутствуют бактерии и простейшие, кроме этого водоросли, грибы, черви и различные членистоногие. Не все сточные воды имеет смысл подвергать биологической очистке. Если в сточных водах отсутствуют органические в-ва или их слишком мало, то биологической очистки не требуется. Тип аэротенка, технологический режим работы, химический состав поступающих СВ оказывают большое влияние на формирование биоценоза аэротенка. На территории г. Саранска работает около 80 предприятий, которые потребляют значительное количество воды. СВ г. Саранска можно разделить на: 1) хоз-фекальные, 2) хоз-бытовые. Эти стоки относительно легко очищаются, и именно для таких стоков и предназначены очистные сооружения г. Саранска. Но ещё поступают и промышленные СВ. Они содержат высокотоксичные ингридиенты, растворители. Эти в-ва вызывают подавление жизнедеятельности м/о активного ила и в результате качество очистки снижается и плохо очищенная вода поступает в р. Инсар. Это ведёт к гибели м/о. Чтобы сохранить клетки активного ила на городских сооружениях г. Саранска на каждый аэротенк устанавливают по 2 регенератора. Наиболее активными загрязнителями являются: Приборостроительный завод, Биохимик, СИС, ЭВС (Лисма), электроламповый завод, экскаваторный завод, Электровыпрямитель, механический завод. Механизм биологического окисления: первые реакции описывают окисление исходных органических в-в и образование новой биомассы при этом. В очищенной СВ остаются не окисленными в-ва, которые находятся преимущественно в растворимом состоянии, т.к. коллоидные и нерастворимые в-ва удаляются из сточных вод за счёт сорбции. Далее эндогенное окисление клеточного в-ва, которое происходит после использования внешних источников питательных в-в. В качестве примера могут быть |
процессы нитрификации, осуществляемые бактериями рода Nitrosomonas, Nitrobacter. Эффект аэробной биологической очистки зависит от многих факторов: 1) оптимальная температура для аэробных процессов 20 – 30˚С, при этой температуре биоценоз наиболее разнообразен (много разных видов живых существ) и хорошо развиваются микроорганизмы. 2) Биологическая очистка наиболее эффективна при рН = 5,9, границы оптимальных значений рН лежат в пределах 5,5 – 7,5 (но следует помнить, что отклонение от рН = 5,9 ведёт к снижению скорости окисления). 3) Очень часто не хватает N, P, их постоянно добавляют искусственно в виде фосфата, мочевины, ортофосфорной кислоты. 4) Должно быть присутствие кислорода более 2 мг/л, но может быть и 1 мг/л. 5) Токсические в-ва – это органические и неорганические в-ва; воздействие может быть микробостатическое (когда задерживается рост и развитие организмов) и убивающее. Содержание тяжёлых металлов отрицательно влияет на процесс очистки. Технологическая схема процесса: решётка (удаление крупных загрязнений), затем песколовка (для удаления осаждением твёрдых частиц, мусора, почвы), затем преаэратор (сточная жидкость перемешивается, насыщается кислородом, в результате активный ил начинает перерабатывать загрязнения), затем первичный отстойник (осаждение крупных частиц, которые потоком воды вынеслись из песколовки). Затем аэротенк (насыщение воздухом активного ила), затем вторичный отстойник (где ил вторично отстаивается). Затем хлоратор (для дезинфекции), затем водоём. Из вторичного отстойника ил возвращают в аэротенк, это необходимо для поддержания концентрации ила.
|
|
|
59 Анаэробная очистка сточных вод. Этот способ не треб > энергозатрат, обр-ся энергоноситель- СН4. При анаэроб проц обр всего 0,1- 0,2кг ила на кажд удаленный кг ХПК. Метаногенез или СН4-брожение- проц превращ орг. в-в в биогаз (смесь СН4 и СО2). Проц открыт в 18 веке Вольтой. М/о исп-ют углерод (С) орг в-в, при этом обр сильно-вос-стан-щее С-соед – метан. В кач-ве донора е- м/о в этом проц исп С орг в-в, окисл его до СО2. СН4-брож исп для обраб орг отх (септик-тенк для перераб коммун отходов). Это многостад проц, в к-м С-С- связи постеп расщепл под действ м/о. Вкл 4 стадии: 1. гидролиз (расщепл слож биопо-лимеров – белки, угл, жиры – на более простые мономеры. Осущ экзогенными фер-ми экстрактир-ся в межкл ср разл гидролитич м/о. Обр-ся простые прод, к-е утил-ют сами гидролитики и др бакт на послед стадиях. М/о: Clast. Bacte-roides, Lactobacilus. Основ прод гидролиза: ж/к, Н2, СО2.). 2. Кислотогенная (или ферментация, расщ мономеров до еще более прот в-в, низших к-т, спиртов, обр-ся Н2СО3, Н2 М/о – слож смесь многих видов бакт – Clast, bifidobact, Bacteroides, киш пал,Str. Время генерации неск часов. Идет резкое сниж С в ср, сниж рН, увелич легких ж/к: мурав, укс.) 3. Ацетогенная (обр-ся непосредст предшеств СН4 – ацетат, Н2, Н2СО3. Разложение восстан-х орг соед, прод кисл-ной стад. Осущ облигатные Н+ -восстан-щие и обли-гатно-синтрофные бакт). 4. Метаногенная (ведет к конеч прод расщепл слож орг в-в к СН4. М/о–метаногены–облигатные анаэробы. Треб-ся анаэробиоз и нейтр или слабощел ср. 8 субстратов: СО2+Н2; формиат; ацетат; СН4; моно-, ди-, триметиламин; закись углерода. 5-10% исп на конструк-ый обмен, 80% - на энергетич). Факторы анаэробной очистки: 1. Реакц-ная способность; 2.Фазовый и хим состав;3. Размер частиц загруж-го субстрата;4.Время удержания жид-ти в реакторе;5. Конц м/о в реакт; 6. Эф-ть массообм реакц ср. 7. Скорость загрузки реактора; 8. t-ый режим (3 режима: психрофильный – 200С, мезоф – 20-45, термоф); 9. Рh (optim 7-8. Идет саморегулиров-ие. При рН=5 – работоспособность системымы резко нарушается); 10. Наличие пит и токс в-в. Образование метана по субстрату: 1) Н2+ СО2=СН4+ Н2О; |
2) НСООН=СН4+Н2О+СО2; 3) ацетат СН3СОО- + Н+ = СН4 + СO2 + Н2О; 4) СН3NH3 + H2O = CH4 + CO2 + NH4; 5) (СH3)2 NH3 + H2O = CH4 + CO2 + NH4+ 6) (CH3)3NH3 + H2O = CH2 + CO2 + NH4+ 7) CO + H2O = CO2 + CH4 В завис от усл поступ-щего водоотведения, анаэр очистка м.б. исп-на либо в кач-ве локальной внутриплощадочной с послед сбросом СВ на коммун очистные сооруж, либо как 1-ая ступень очистки в сост отдельно распол-ого комплекса очист сооруж. Эти варианты отличаются друг от друга по требовательности, предъявл к сооруж анаэр очистки. Специф треб-я для сооружений локальной очистки включают в себя: 1)Соответствие кач-ва очищ воды нормам приёма СВ в канализац сеть насел пункта 1)Компакт-ность; 3)Минимализация кол-ва обр-ся осадков, требующих обработки и удаления с тер-рии предпр; 4)Соблюдение норм сан-гигиен безопасности, предотвращ распростр-я запахов. Эти треб-я менее значимы для отдельно располож комплексов очист сооруж. Но для них возраст знач надёжности работы анаэр ступеней очистки и, к относит стабильности кач-ва обработ СВ. Напр, в случае снижения эф-ти анаэр очистки на 20% (85 до 75%) нагрузка на послед сооруж аэроб доочистки возраст вдвое, что может привести к общему ухудшению кач-ва очищ воды и к серьёзным нару-шениям в работе аэроб ступени. Сущ и др существ-ные технол-ие различия, опр-мые усл-ми применяемых анаэр биореакторов. В усл локальной внутриплощадочной очистки во многих случаях м.б. успешно использован метод разделения CВ предп с избирательным применением анаэр очистки для наиб концентр(по БПК), наименее токсич и наиболее тёплых потоков СВ. Для отдельно располож комплекса биолог очистки экологический эф-т от применения этого метода снижается. На сооружения локальной очистки за счёт использования существующей инфраструктуры предпр (наличие мощной котельной, реагентное хозяйство) часто облегчаются усл конди-ционирования стока до optim знач t, рН, и усл утилизации образ-ся биогаза. Z |
|
|
60 Реакторы для биол. очистки веществ. Аэробная очистка: жидкость в аэротенке очищают активным илом, который представляет собой сложный биоценоз различных организмов. Осн. узлом сооружения биологической аэробной очистки явл. аэротенк. 2 типа: вытеснитель и смеситель. Аэротенк вытеснитель имеет 1-4 коридора, вода и ил подаются в начале соорружения, а смесь выводится в конце. В аэротенках вытеснителях нагрузка на ил и скорость потребления О2 max в начале сооружения и min в конце. Аэротенк вытеснитель плохо справляется с залповыми выбросами и перегрузками, в них нельзя повысить рабочую концентрацию ила. В аэротенке смесителе сточная вода и активный ил подаются и отводятся равномерно по всей длине сооружения и поступающая смесь быстро смешивается с содержимым всего сооружения. В них нагрузка на ил и потребление О2 постоянна во всем объеме сооружения. Условия существования культуры близки к оптимальным, но качество сточной воды может быть хуже при прочих равных условиях, чем в аэротенках вытеснителях. Аэротенк с регенерацией – из общего процесса окисления загрязнителей, в самостоятельную стадию заключается процесс изъятия их из сточных вод. Анаэробная очистка сточных вод – использование принципа удержания биомассы явл. основным признаком отличающим анаэробные реакторы2-го поколения от 1-го. Все конструкции анаэробных реакторов можно разделить на: 1) реактор со взвешенной седиментационной массой (илом); 2) прикрепленной биомассой (биопланктон). К первой группе относятся лагуны, контактные реакторы с восходящим потоком сточных вод через слой анаэробного ила и перегородчатые реакторы. Ко 2 гр. Относят биофильтры с низходящим потоком сточных вод и неподвижной закрепленной биопленкой и реакторы с расширенным и взвешанным слоем частиц носителя. Ко 2 гр. Относят реакторы с восходящим потоком. Большинство реакторов первого поколения устоены просто и представляют собой герметичную ёмкость, в которую непрерывно или периодически загружается сбраживаемая масса. Наиболее известны контейнеры такого типа – это метантенк примен. Для сбраживания навоза. Они имеют2 и > секций отличающихся друг от друга гидравлическим режимом и способом перемешивания. |
66 Установки для приготовления питательных сред. Приготавливают пит среды в спец аппаратах разл емкостей со сферич или плоским днищем, закрытые и открытые. Они снабжены рубашкой или змеевиком для подогрева или охлаждения среды. Снабжены мешалкой и барбатером для подачи острого пара. В основном применяют аппараты из нержав-щей стали ил чугунные эммалированные. Готовые пит среды или концентраты пит среды поступают на стерилизацию. Её проводят разл методами. Для этого исп-ют нагревание, обраб УФ, рентгеновскими лучами, ультразвук, обр-ка разл антисептиками. Цель стерилизации: уничтожение всей м/флоры, кот находится в пит среде, а также навнутренних поверхностях оборуд-я и аппаратуры. Широко распространен метод стерилизации нагреванием. Можно разделить на 3 этапа: 1 нагревание среды или аппаратуры до t стерил-ции. 2 выдержка при этой t в течение опред времени., обеспеч гибель всех м/о. 3 охлаждение стерил-го объекта до t доступной для засева чистой культуры. Стерил-ю стекл посуды ведут сухим паром t=1600С 60 мин. Аппар-ру и коммуникации стер-ют острым паром t=115-120ос. Посевные боксы стер-ют облучением с помощью бактериальных ламп.
|
|
|
61 Процесс теплообмена. Теплоотдача. Основной закон теплоотдачи – закон Ньютона. Теплообмен – самопроизвольный процесс переноса теплоты от более нагретого тела к менее нагретому. Теплота – количество энергии, отдаваемое (получаемое) телом в процессе теплообмена. Теплоотдача – процесс теплообмена между поверхностью тела и окружающей средой (или наоборот). Теплоноситель – движущаяся среда, используемая для переноса теплоты. При конвективном теплообмене теплота распределяется в потоке жидкости или газа от поверхности твёрдого тела одновременно конвекцией и теплопроводностью. Нагревание – процесс повышения t материалов путём подвода к ним теплоты (нагревание горячей водой, насыщенным водяным паром, топочными газами, электрическим током). Горячую воду используют для нагревания и пастеризации при t 100˚С. Для нагревания выше 100˚С используют перегретую воду, подходящую под избыточным давлением. Обогрев водой осуществляется через отделяющую теплоноситель стенку аппарата. При нагревании жидкостью используют циркуляционный способ обогрева с естественной (разница между горячими и холодными теплоносителями) или принудительной циркуляцией (с помощью насоса). Способы нагрева паром: острым паром (пар подаётся непосредственно в аппарат), глухим паром (через разделительную стенку). Нагрев топочными газами. Они образуются при сжигании твёрдого, жидкого, газообразного топлива в специальных печах. Нагрев электрическим током. В электрических печах выделяется теплота теплопроводностью, излучением, конвекцией. Охлаждение – процесс понижения t материалов путём отвода от них тепла (используют воду, воздух и другие хладагенты (холодный рассол, фреон, аммиак, жидкий азот)). Охлаждение водой: теплоноситель от продукта отделён стенкой или непосредственным смешиванием (газы охлаждаются разбрызгиванием водой). Конденсация – процесс перехода в-ва из парового газообразного состояния в жидкое путём отвода тепла. Отводят тепло с помощью отдельно стоящего теплоносителя – поверхностная конденсация, либо непосредственным смешиванием (в мокрых и сухих конденсаторах). В мокрых – охлажд-щая вода, конденсат, несконденсировавшиеся газы |
выводятся из нижней части конденсатора с помощью насоса (мокрого воздушного). В сухих – охлаждённая вода, конденсат - из нижней части, воздух отсасывается вакуумным насосом из верхней части. Теплообменник «труба в трубе» широко распространён в промышленности, в производстве антибиотиков (для охлаждения питательной среды). Посевная среда стерилизуется в стерилизующих аппаратах при 125 – 130˚С: 1) нагрев до 135˚С, 2) выдерживание 3 минуты при 135˚С, 3) резкое охлаждение до 28˚С. Процесс теплоотдачи: от горячего тела к холодному. Недостаток этих аппаратов – громоздкость. Теплоотдача – теплообмен между поверхностью тела и окружающей средой (или наоборот). - коэффициент теплоотдачи – величина, характеризующая интенсивность переноса тепла между поверхностью тела и окружающей средой. Закон Ньютона – количество теплоты переданной от поверхности теплообменника к потоку жидкости или газа (или наоборот) прямопропорционально коэффициенту теплоотдачи, площади поверхности теплообменника и разности температур поверхности и ядра потока (или наоборот) и времени процесса. dQ = (tст – tf)F dt dQ = (tf – tст)F dt
[кДж/град час м2 Вт/град м2]. - показывает какое количество теплоты Q2 передаётся от потока к поверхности теплообмена равной 1 м2 в течение 1 часа при разности температуры поверхностей теплообменника и ядра потока в 1˚С (если = const вдоль всей поверхности теплообменника).
|
|
|
62 Аппараты используемые для нагрев-я и охл-я в биотехн.
Одноходовой кожухотрубчатый теплообменник. По кол-ву ходов – одно-, двух-, многоходовые. Пучок труб делит объём теплообменника на трубное пространство, заключённое внутри греющих труб, которое соединено с трубной решёткой сварной трубы из нержавеющей стали, меди, латуни. Греющие трубы размещаются следующим образом: 1) в шахматном порядке (по вертикали и сторонам правильного шестиугольника), 2) коридорное расположение труб (по квадрату), 3) по концентрической окружности.
|
соединение обеспечивает свободное удлинение труб при нагревании, облегчая доступ к внутренней части аппарата при осмотре и ремонте. Кожух теплообменника стальной, цилиндрической формы. Для ввода и вывода корпус и днище имеет патрубки. Теплообмен осуществляется через стенку. Для интенсификации теплообмена трубы секционируют (перегородки в верхнем и нижнем днище увеличивают коэффициент теплоотдачи). Поперечные перегородки могут быть перекрывающимися и неперекрывающимися. Продольные перегородки делают в межтрубном пространстве столько ходов, сколько имеется в трубном пространстве и обеспечивают принцип противотока рабочих тел. Перегородки делаются параллельно трубам и не достигают противоположной трубной решётки. Z |
|
|
|
|
|
|
63 Массовые процессы. Основной закон массоотдачи. М/обм. процессы – процессы, скорость протекания которых определяется скоростью переноса в-ва из одной фазы в другую конвективной и молекулярной диффузией. Адсорбция – процесс избирательного поглощения одного или нескольких компонентов из газов, парогазов или жидкой смеси твёрдыми поглотителями – адсорбентами (речь идёт о поглощении поверхностью адсорбента). Абсорбция – процесс поглощения газов или паров из газовой или паровоздушной смеси жидкими абсорбентами (речь идёт о поглощении всем объёмом абсорбента). Десорбция – процесс выделения поглотившегося в-ва поглощающей жидкостью или твёрдым телом. Перегонка – процесс однократного частичного испарения жидкой смеси и конденсации образовавшихся паров. Ректификация – разделение жидкой смеси летучих компонентов на отдельные компоненты, в результате многократного частичного испарения жидкости и конденсации паров. Экстракция – процесс извлечения экстрагируемого в-ва из одной жидкой фазы в другую с помощью экстрагента. Выщелачивание – извлечение из твёрдого тела одного или нескольких в-в с помощью расплавления, обладающего избирательной способностью. Сушка – удаление влаги из твёрдых или жидких влажных материалов путём её испарения. Кристаллизация – процесс выделения твёрдой фазы в виде кристаллов из р-ров или расплавов. Основной закон массоотдачи на примере экстракции бензилпенициллина (БП) из нативного р-ра в бутилацетат. Массоотдача – процесс перехода в-ва (нескольких в-в) из одной фазы в другую в направлении достижения равовесия. dM=KΔdτF; M – кол-во в-ва, перешедшего из одной фазы в другую, К – коэффициент массоотдачи, F – площадь поверхности массоотдачи, M=KΔF – закон массопередачи – кол-во в-ва, перенесённого из ядра одной фазы в другую пропорционально разности его концентраций в ядрах фаз, площади поверхности, фазовому контакту, продолжительности процесса. Исходный р-р (нативный) – БП, вода, минеральные в-ва. |
Экстрагент – бутилацетат. Экстрагируемое в-во – БП, экстракт – БП+ бутилацетат. Полученная в результате экстракции жидкость, содержащая экстрагируемое в-во, называется экстрактом. Переход экстрагируемого в-ва из одной фазы в другую подчиняется закону массопередачи. Требования к р-лю: 1) должен отличаться от исходного р-ра, 2) обладать малой растворимостью в нём, 3) иметь высокий коэффициент распределения и обладать максимальной избирательностью. Основное уравнение массоотдачи: dM / Fdτ = КΔ где М – кол-во в-ва, переносимого из одной фазы в другую, F – площадь поверхности массопередачи, τ - продолжительность процесса, К – коэффициент массопередачи, Δ - движущая сила. M=KΔF – основное уравнение массопередачи. Кол-во в-ва, перенесённое из ядра одной фазы в другую пропорционально разности его концентраций в ядрах фаз, площади поверхности фазового контакта, времени процесса. К – коэффициент массоотдачи – показывает, какое кол-во в-ва переходит из одной фазы в другую в единицу времени, через единицу поверхности фазового контакта при движущей силе равной единице. Коэффициент массопередачи зависит от единиц, в которых выражены движущая сила и кол-во распределяемого в-ва. М/С=кг/ед. движ. силы•м2•с~кМ/ед. движ. силы•м2•с.
|
|
|
64 Контрольно-измерительные приборы. Температура (в биотехнологической промышленности) – величина, пропорциональная средней кинетической энергии движения молекул, атомов. Приборы – термометры. Принцип их действия основан на изменении какого-либо физического свойства, зависимого от температуры, и легко поддающегося измерению (V, l, g и др.). Для разметки температурных шкал используют расширение тел при нагревании. А постоянные температуры – температура таяния льда и кипения воды при нормальном атмосферном давлении. Термометры расширения – измеряют температуру жидкостей. Измерение основано на расширении в-в. Учитывается коэффициент объёмного расширения жидкости и материала капилляра (распространены ртутные и спиртовые термометры). Шкала наносится на капилляр (пластинку из молотого стекла) и заключается в стеклянную оболочку. Манометрические термометры – основаны на изменении объёма газа (жидкости) в закрытом объёме при изменении температуры. Область измерения – 60 – 600оС при Pср = 6,4 МПа – 250 атм. При нагревании рабочего в-ва в термобаллоне его давление увеличивается, что воспринимается пружинной трубкой, воздействующей на стрелку. Термоэлектрические термометры – основаны на термоэлектрическом эффекте (в замкнутой цепи, состоящей из нескольких различных проводников, возникает ток, если места стыков различных металлов имеют разную температуру). Горячий спай термопары помещают в среду, где измеряют температуру, холодный спай свободен. Эти спаи последовательно соединены с гальванометром (измерительным прибором). Термопара преобразует тепловую энергию в электрическую. Термометры излучения – основаны на способности нагретых тел излучать энергию в виде световых и тепловых лучей. Диапазон измерений: 400 – 4000оС. Давление – основная измеряемая величина любых биотехнологических процессов. Это отношение нормали действующей силы к площади, на которую она действует. Жидкостные приборы – используются для измерения небольших избыточных давлений, разрежений, давлений атмосферы. Их применяют для градуировки и проверки приборов других систем. Они отличаются простотой |
измерения и относительно высокой точностью измерения. Поплавковый манометр – 2-х колен. (1 – расширение, помещается поплавок, связанный со стрелкой вдоль шкалы). Колокольный прибор (в сосуд с жидкостью помещают колокол на коромысле, на другом конце коромысла – уравновешивающий груз). Перемещение колокола приводит к перемещению стрелки по шкале. Вместо груза может использоваться пружина. Деформационные приборы – основан на измерении величин деформации различного вида упругих элементов (трубчатых, пружина, мембрана, сильфон). Если в трубке создаётся избыточное давление (разрежение), то кривизна трубки изменяется, её свободный конец перемещается, воздействует на передающий механизм, связанный со стрелкой. Мембранные приборы – прогиб мембраны под действием силы. Чувствительный элемент сообщает информацию о давлении. Сильфонные приборы – тонкостенные гофрированные трубки. Под действием осевой нагрузки вращается стрелка. Для увеличения жёсткости внутри помещается винтовой цилиндрический пруток. Электроманометры: 1) манометры сопротивления – основаны на изменении сопротивления проводника под действием внешнего давления. Чувствительный элемент – однослойная катушка из манганин. проволоки. Для измерений используют Ом-метры (для высоких и средних давлений). 2) тензомер – усиление или деформация в суммарном сопротивлении проводника, накладываемого на поверхность деформированного тела (тонкая проволока на изоляционном основании (бумага), к её концам припаяны выводы. Они накладываются на поверхность детали, подверженной деформации). 3) ёмкостные приборы – основано на изменении ёмкости плоского конденсатора при изменении расстояния между обкладками. 4) пьезометрические манометры – основаны на использовании св-в некоторых кристаллов создавать электрические заряды под действием внешних воздействий. Приборы для измерения уровня материала: по принципу действия приборы, применяемые для получения информации об уровне оборудования и технологических сред в ёмкостях
|
|
|
и аппаратах делятся на группы: 1) линейные, действие которых основано на принципе сообщающихся сосудов (указательная трубка оснащена шкалой в единицах длины). 2) поплавковые (буйковые), основаны на преобразовании изменения положения уровня контролируемого продукта в перемещении плавающего поплавка (к одному концу гибкого троса подвешивается поплавок, к другому груз, к которому прикрепляется стрелка, передвигающаяся по шкале и показывающая положение уровня в единицах длины). Буйковый уровнемер – измерение выталкивающей силы, действующей на буёк, погружённый в жидкость и удерживаемый в заданном положении внешней силой.
5. Аккустические уровнемеры – для измерения в ёмкостях уровней жидких продуктов, в том числе вязких, кристаллизующихся. Температурный диапазон измерений - -50 – 120оС. Действие прибора основано на испускании звуковых импульсов через контролируемую среду и на их отражении от поверхности раздела фаз между воздухом и контролируемым продуктом. Мера уровня – время распространения звуковых колебаний от источника излучения до контролируемой границы раздела сред и обратно до приёмника. 6. Радиоизотопные приборы – основаны на поглощении или ослаблении средой потока γ-лучей, пронизывающего контролируемую среду. Состоит из 2 частей: источника и приёмника излучений. Радиоактивные элементы – Cs137. Контролируют уровень сыпучих материалов, щелочных, кислых, взрывоопасных жидкостей при рабочих давлениях до 25 Мпа. Приборы для измерения количества и расхода. Кол-во в-ва выражают в единицах объёма или массы. Для их контроля и учёта служат весы, весоизмерительные устройства, счётчика и расходомеры. |
Весы: коромысловые (рычажные), квадрантные, пружинные, комбинированные и др. Весовой дозатор (ленточный транспортёр, приводимый в движение при помощи электродвигателя) подача сырья до наступления равновесия. Расходомеры – для измерения объёмного расхода в м3/ч (электромагнитные, турбинные, тахометрические (шариковые), ультразвуковые). Электромагнитные – основаны на явлении электромагнитной индукции. Для отражения информации по расходу продукта служит цифровой индикатор. Z |
|
|
65 Оборудование для культивирования м/о. Поверхностным способом можно выращивать аэробные культуры м/о на твёрдых сыпучих питательных средах или на поверхности тонкого слоя жидкой питательной среды Кюветный способ: требуется ручной труд и большие помещения. Кюветы изготовляют из оцинкованного железа, S =0,25 – 0,5 м2, h = 20 – 50 мм, кюветы открыты или с крышкой, дно перфорировано узкими щелями длиной 20 мм и шириной 1,5 – 2 мм (в шахматном порядке или рядами). Кюветы заполняют засеянной увлажнённой питательной средой (2 – 2,5 см), помещают в растильные камеры, их располагают на многоярусных подвесных этажерках или стеллажах. Между ярусами 10 – 12 см, 20 – 25 см от пола. Перед загрузкой и после выгрузки камеры моют и стерилизуют формалином. Порядок работы в камере: 1) стерилизация, 2) загрузка, 3) культивирование (20 – 72 ч), 4) подсушивание культуры сухим паром 140 – 145 оС, Wвоздуха – 25 – 30% 3 – 4 часа, 5) выгрузка, 6) уборка, 7) мойка камеры, 8) обработка формалином, 9) проветривание 3 часа. Технологический цикл 36 – 90 часов. Камеры имеют 2 выхода: 1) загрузка, 2) транспортировка кювет с готовым продуктом. Механизированный способ. Камера с многоярусным цепным транспортёром с подвешенными к нему лотками. При движении они заполняются засеянной питательной средой. Затем лента останавливается, камера поднимается к кондиционерам – это начало культивирования. После окончания роста включается транспортёр, лотки поочерёдно опрокидываются, культура попадает в бункер. Затем производится разгрузка камеры, затем мойка лотков, затем стерилизация. После этого цикл можно повторять. Производительность: 400 кг/сут. Установки для выращивания в толстом слое: вертикальный цилиндр секционирован перфорированными пластинами, укреплёнными на поворотных осях. Внутри перемешивающий аппарат. Верх герметично соединён со стерилизатором. Стерильный воздух для аэрирования поступает снизу в каждую секцию с заданной t, w, v. Выхлопной воздух подвергается бактериальной очистке. Отвод биол. тепла – установка в корпусе. Выращенная культура поступает в нижнюю часть аппарата и выгружается в приёмный бункер сушилки. Выращивают культуру в герметичных условиях. -> |
Лабораторные и промышленные ферментёры. Ферментёр – герметичная цилиндрическая ёмкость со сферическими днищем и крышками. При глубинном культивировании сокращаются производственные площади, исключается ручной труд. Лабораторные ферментёры малой ёмкости (до 30 л), корпус аппарата стеклянный, внутренние детали (мешалка, барботер, отбойники) – из нержавеющей стали. Лабораторные металлические ферментёры малой ёмкости: батарейные, переносные (до 10 л). Батарейные – одновременно на большом количестве аппаратов проверяют влияние факторов на процесс биосинтеза. Стационарные – имеют рубашку (змеевик) для поддержания температурного режима подачи пара (воды) при стерилизации (охлаждении). В промышленности используют стальные ферментёры: закрытые цилиндрические сосуды со сферическим днищем, снабжены мешалками (лопасти устанавливают на разном уровне), барботерами, отбойниками, змеевиками, рубашками, запорной арматурой, контрольно-измерительными приборами. Используют аппараты различной ёмкости (0,5 – 200 м3). Конструкция ферментёра предотвращает проникновение посторонних м/о, унос пены и брызг, аэрацию, перемешивание, регулирование t. На крышке имеются смотровые стёкла, люк, датчики дистанции, контроль ввода питательной среды, воздуха, посевного материала, пеногасителя, реагента для регулирования pH. В аппаратах меньшей ёмкости – рубашки, большей ёмкости – змеевики. Существуют ферментёры типа барботажной колонны (h>>d), перемешивание за счёт потока восходящего газа (подаётся под давлением). Равномерное распределение газовых пузырьков, биомассы, твёрдых взвешенных в-в в питательной среде, массопередача О2, вывод продуктов метаболизма обеспечивают мешалки (лопастные, дисковые, закрытые, турбинные). Сальниковые уплотнения для герметичности аппарата. В качестве уплотнителя используется фторопласт. Во время культивирования необходима аэрация. По принципу действия: 1) воздух подаётся в жидкость через пористый материал (керамика), 2) воздух подаётся в жидкость через барботеры, 3) вихревая система, 4) воздух подсасывается жидкостью через специальные приспособления. Барботажное аэрирование – трубка устанавливается под мешалками на |
|
|
уровне начала кривизны днища (увеличивается кол-во всплывающих пузырьков). 3 типа барботеров: 1) лучевой, 2) открытая труба под мешалкой, 3) квадратный. 1. 8 – 12 радиальноперфорированных труб-лучей, крепящихся на резьбе к небольшому кольцу для чистки отверстий. 2. применяются в сочетании с дисковыми мешалками, создающими интенсивное перемешивание. 3. перфорированные трубы на болтах (для чистки). Аэраторы инжекторного типа: образуют высокоразвитые поверхности фазового контакта. Интенсивное перемешивание воздуха и жидкости производится за счёт кинетической энергии жидкой фазы. Инжектор может быть помещён на линии подачи воздуха или в небольшом вспомогательном аппарате (где жидкость смешивается с воздухом). Пеногашение. При аэрационном перемешивании образуется пена. При сильной пене возможен выброс культуральной жидкости из аппарата через трубопровод для выхода воздуха. Для снижения пенообразования используют: растительные (соевое, касторовое, подсолнечное) масла и животные жиры (свиной, говяжий, костный, китовый). Синтетические пеногасители: п/эфировый пропенол 5400 (расход 0,02 – 0,3%) – не токсичен, не взрывоопасен. Адсорбенты (активированный уголь, ионит, коллоидная глина). Механическое пеногашение: лопасти, укреплённые на верхней части вала мешалки, вращают над поверхностью жидкости перфорированные диски. Пеногасители: конструкции с вращающимися лопастями, разбивающими пену. Комбинированные методы пеногашения: жиры + механический способ. Ввод пеногасителей и периодическая их подача регулируются автоматически. Распространено устройство контакта пены с электродами, в результате электрическая цепь замыкается, реле приводит в действие соленоидный клапан (на линии трубопровода) соединённого с ёмкостью пеногасителя. Если пена продолжает нарастать, то мешалка автоматически выключается и процесс останавливается. Z |
|
|
|
67 Оборудование для выделения и очистки. Фильтры (Ф)в многотонаж пр-ве широко примен нутчатые Ф. Это апп-т период дейст, изгот из нержав стали в виде прямоуг или кругл резерв с плоск или дном. На нек расст-и от дна укрепл гориз-ая фил-ая перегор с распред-ой в ней ф/тканью–бязь, фланель, лавсан. В практ есть штуцера для заливки сусп-зии и подачи сжат возд. Жид фаза сусп пройдя ч/з фильт ткань слив-ся в отстойники, осадок снимается однолопаст мешал. В пищ и ферм пром примен фильтр-прессы пер действ. Они сост из одинак черед-ся рам и плит одинак размера. М/д соприк-ся поверхн рам и плит распред ф/ткань или солфетка. Плиты им по краям гладк пов-ть, а в серед рефленную с желобками. Литые рамы им клапаны для подвода сусп, для промыв жид-ти и для стока фильтрата. Осн детали изгот из нержав стали. Проц ф-ции осущ след обр: сусп ч/з отверст стенки рамы поступ во внутрь. Она раздел на осадок и фильтрат, кот стекает по клапанам в плитах в трубопров. При заполн осадком ф-пресса отключ, раздвиг плиты и рамы, осад снимают. В м\биол пром исп-ют барабанные вакуум-ф период действ, имеют высок степень механ-ции. Оборуд предст собой барабан , погруж на половину своей пов-ти в емкость, в кот непрер подается культур-ая жид. Пов-ть барабана перфори-рованна и обтянута фильт тканью. Бар-н вращ медл и проход зону фильт-я, выщелач-е, промывки осадка, отдувки и регенер ткани. К ф период действ отн ленточные ф, работ под ваккумом, в этом ф резин лента с прорезями и бортами перемещ по замкн пути при пом привода. Фильт-ая ткань в виде бесконеч ленты прижим-ся к резин ленте при пом роликов. Сусп поступ на фильт ткань из лотка, фильт-ся под вак-ом и отвод в сборник. Центрифуги (Ц) и сепараторы (С) примен для плохо поддающ фильт-ции сусп для отдел взвеш частиц (биомассы) и удаления взвесей. Различ Ц и сверхЦ. Первые для раздел сусп с малой конц тверд фазы и для удал влаги из сыпуч матер. СверхЦ и С для раздел эмульсий и тонкодисп суспензий. Осн элемент вращ-ся полый цилиндр, ротор или барабан, в кот с опред скоростью подается из смесителя сусп. Скорость вращ обычно 7т об/мин. У сверхЦ 13-17т об/мин. В верх части сверхЦ имеются 2 приемника жид-тей, ч/з кот непрер отвод-ся тяж и легк фракции раздел смесей. По способу выгрузки осадка Ц быв период и непрер |
действ. Период: ручн и гравитац, непрер: пульсир-ие и центробеж. В гравит Ц нижн часть бараб ротора делается конусной и п/л ее остановки осадок под дейст силы тяжести сполз с перфор стенок и удал ч/з люк. С по принц действ не отлич от Ц. Барабан у С по диаметру >, чем у сверхЦ, по высоте < и он снабжон разделит-ми тарелками. Они изгот из нерж стали, на тарелк им выступы. Тарел раздел массу движ в бараб жид-ти на ряд тонк слоев, что повыш степ эф-ти сепар-ции. Эмульс под-ся в С сверху, спуск в нижн часть, поступ в камеру бараб, где наход комплект раздел-ых тарел. Для выщелач-я примен разл типы экстракторов период, полунепр и непрер действ. По направл движ экстраг-та и экстр-их частиц бывают: противоточн, прямоточн, с замкнут период проц. По виду циркул-ции бывают с однократн прохожд-ем эктраг-та, с рецир-кул-ей и оросительные. По св-вам тв частиц, уч-их в проц экстр-ции на крупнозернистые, мелкозер-нистые и тонкодисперсн и др. По виду корпуса: колоночные, камерные. По виду пусков устр: шнековые, ротацион, ленточн. Сушка явл обязат операц предшест выпуску гот прод. Удаление влаги придает необ св-ва. Влагу можно удалить из матер механ способ: отстаив, фильтр, центр-е. При выборе метода сушки и типа необх учитывать св-ва матер-ла. Разл неск видов сушки. По способу подвода тепла к высуш матер: конвективный или воздушн – осущ с пом непоср соприкосн высуш матер с сушил агентом. Контактная – путем передачи тепла от теплоносит к матер ч/з раздел стенку. Радиационная сушка – путем передачи тепла инфракрас лучами. Сублимац сушка – из замор матер при глубок ваккуме. Барабанные сушилки – влажн матер загруж в полый цилиндр, устан на лотках под небольш углом и к горизонту. Его привод во вращ эл/двигат. Высуш матер пересып и движ-ся к разгруз люку. Антибиот сушат под вак в стерил усл. Z |
|
|
|
|
|
|
|
|
|
|
87 Исследованиями по использованию озона при холодильном хранении мяса специалисты начали вплотную заниматься с начала 30-х годов XX века. По данным Каеса, оптимальная концентрация О3 для хранения охлажденного мяса равна 10 мг/м3 (τ = 2...3 ч/сут). Кэффорд отмечает, что эффект от действия озона (С= 10 мг/м3) достигается тогда, когда применение его начинается в период лаг-фазы развития бактерий и когда поверхность мяса имеет корочку подсыхания. По результатам Эльфорда и Ван ден Энде благоприятной концентрацией О, применяемой при созревании мяса, является 0,02...0,2 мг/м3, Евелл указывает на то, что охлажденное мясо хорошо сохраняется при С=4...6 мг/м3 и τ=3 ч в сутки. По данным Хайнеса, озон (С= 20 мг/м3) не предотвращает ослизнения мяса. Тухшнайд применял озон на ленинградских холодильниках в камерах хранения яиц, мяса, используя концентрацию 3...6 мг/м [1]. Выявлено также, что озон практически не оказывает влияния на качественный состав свободных жирных кислот липидов мяса при исследуемых условиях озонирования, а также на скорость гидролитических и окислительных процессов при концентрациях 10...11 мг/м3. После окончания цикла озонирования достаточно применять озон концентрацией 4,0...6,0 мг/м3 по 3 ч в день через двое суток. В камере с температурой 273,5...275,0 К при хранении охлажденного мяса в атмосфере озона, генерируемого озонатором (1,5 мг/ч), начало порчи баранины отмечено на 6-е сут (вместо 3 сут для контрольных образцов), свинины - на 10-е сут (вместо 6 сут для контрольных образцов). Применение озона может способствовать решению проблем улучшения качества мяса при переработке. В ряде стран тушки птицы перед упаковкой, реализацией и хранением проходят санитарную обработку, заключающуюся в орошении тушек хлорсодержащим раствором. Данный способ не всегда вписывается в технологическую линию по переработке тушек птицы (например, в систему с воздушным охлаждением). Санитарная обработка мяса птицы с применением озонируемой среды характеризуется высокой эффективностью и хорошо сочетается с остальными технологическими операциями. Наилучший эффект озонирования проявляется, когда действие озона совпадает с периодом лаг-фазы развития
|
бактерий и созревания мяса. Хранение мяса птицы при постоянном и периодическом воздействии (3 ч в сутки) озоном концентрацией 8...12 мг/м3 способствует предотвращению плесневения, порчи и лучшему сохранению питательных и вкусовых свойств. Продолжительность хранения мяса в охлажденном или замороженном состоянии возрастает в 2...3 раза. Среди продуктов мясной промышленности особое место принадлежит колбасным изделиям, производство которых в нашей стране непрерывно возрастает. Из колбасных изделий, поступающих на холодильное хранение распределительных холодильников, значительную часть (примерно 60...70%) составляют полукопченые колбасы. Ограниченные сроки хранения полукопченых колбас заставляют разрабатывать новые, более совершенные методы хранения, в частности с использованием озона. В процессе хранения полукопченых колбас соотношение классов липидов меняется особенно заметно в неозонируемых и озонируемых камерах при концентрации озона 15...20 мг/м3. Качественный жирнокислотный состав липидов полукопченых колбас в процессе хранения их в неозонируемой и озонируемой камерах остается постоянным, а количественное содержание липидов уменьшается, причем в меньшей степени - липидов колбас, обрабатываемых озоном концентрацией 3...5 и 8...10 мг/м3, по сравнению с контрольными образцами и образцами, обрабатываемыми озоном концентрацией 15...20 мг/м3. Количественные изменения в липидах периферийного слоя фарша колбас более существенны, чем в липидах внутреннего слоя, независимо от режима хранения. Остаточное содержание фенолов в полукопченых колбасах, обрабатываемых озоном концентрацией 3...5 и 8...10 мг/м3, в процессе всего периода хранения их (до 120 сут) выше, чем в не обработанных озоном колбасах, что обусловливает их стойкость, а также аромат и вкус копчения. В процессе хранения полукопченых колбас уменьшается содержание белкового азота и увеличивается небелкового. В большей степени эти изменения протекают в колбасах, хранившихся в неозонируемых и озонируемых (концентрация озона 15...20 мг/м3) камерах. Установлено также, что в процессе хранения полукопченых колбас интенсивность окраски батонов снижается. Более значительное обесцвечивание колбас наблюдается при хранении их в озонируемых камерах (концентрация озона 15...20 мг/м3) и в неозонируемых.
|
|
|
82 Кровь пищевая и техническая (производство продуктов). Кровь является важным источником белка. Кровь и её компоненты используют в колбасном производстве, при производстве лечебных препаратов (гематоген). Используют кровь от здоровых животных. Для сбора крови оглушённому животному в яремную вену вводят полый нож, через который идёт сбор крови для пищевых и лечебных целей. Кровь, стекающую с туши называют технической. Количество выделившейся крови зависит от пола, возраста, упитанности, вида, породы животного. При сепарировании кровь разделяется на плазму и форменные элементы. При дефибринировании плазмы образуется сыворотка и белок фибрин. Стабилизация крови – предотвращение её свёртываемости. При этом сохраняются все белки, уменьшается вероятность гемолиза и м/б загрязнения. В качестве стабилизаторов применяют пирофосфат натрия, поваренная соль, цитрат натрия, фибризол. При этом учитывается расход, стоимость, токсичность стабилизатора. Его вводят в процессе обескровливания в сонную артерию. Дефибринирование крови – удаление фибрина, образующегося в процессе свёртывания крови. Если фибрин идёт на пищевые и лечебные цели, то интервал между сбором и дефибринированием не должен быть больше 1 мин. На технические цели дефибринируют после образования сгустка путём разрыва нитей фибрина. Процесс идёт в дефибринаторах 5-10 мин. Коагуляционное осаждение белков. Термическое осаждение - при t=90-95°C; при этом свойства белка изменяются из-за денатурации, но снижается бак. обсеменённость. Химическое осаждение – осаждение в кислой среде (рН=3,5-4,5); применяют полифосфат натрия, трихлорид железа. При этом осаждается до 97% белка. Консервирование крови . Если используется поваренная соль-10%, то кровь можно хранить при t=4°С 2 сут. Можно в качестве консерванта исползовать NH3, CO2, молочную кислоту. При консервировании крови на технические цели применяют антиокислители: крезол, фенол, холодом(0-2°С-2-4 сут.). Замороженную кровь(-10°С) хранят до 6 месяцев, но размораживание сопровождается гемолизом. Обесцвечивание крови. На долю гемоглобина приходится до 60% всех белков, но он имеет тёмный (красный) цвет. Существуют хим. методы удаления гема в кислой среде в присутствии ацетона, но снижается устойчивость белка к денатурации. Иногда используют перекись водорода, под |
действием которой идёт гемолиз этитроцитов, а для её удаления используют каталазу. Существуют ферментационный метод отделения гема от глобина. Сушка крови облегчает её транспортировку. Сушат кровь методом распылительной сушки. Основная масс воды удаляется за несколько секунд, поэтому белки могут сохранится (из-за непродолжительности сушки). Сушка проводят при t=100°С. Концентрирование плазмы крови осуществляют посредством ультрафильтрации через полупроницаемые мембраны, которые пропускают НМС и воду. Это ведёт к увеличению конц. белка до 20%. Криоконцентрирование крови – увеличение концентрации белка в результате выделения кристаллов льда. Z |
|
|
86, 89-91, 117,118 Обработка рыбы.. Рыба является скоропортящимся продуктом. Её реализуют в свежем, охлажденном, мороженном видах, а так же в солёном, копчёном видах, в виде консервов, прессервов и других рыбных продуктов. Для предотвращения порчи рыбу сразу после вылова перерабатывают, а если переработка нежелательна, то её охлаждают или замораживают. Для этого используют лёд, снег, холодную воду. Часто при охлаждении и замораживании добавляется соль. Высококачественная мороженная продукция может быть получена только при использовании свежего сырья. Посмертные изменения в рыбе: 1) Гиперемия, 2) Окоченение, 3) Автолиз. После смерти количество гликогена в рыбе быстро убывает. В процессе посмертных изменений повышается температура. Чем больше температура, тем быстрее окоченение. Регулирование физико-химических и биохимических процессов начинается с прижизненного периода (уменьшение предсмертного периода). Идеальным состоянием рыбы для замораживания является состояние до наступления посмертного окоченения и в стадии посмертного окоченения. Технологическая схема обработки: Выгрузка на холодильник осмотр, сортировка по размеру и качеству разделка в зависимости от последующего использования (крупную рыбу обезглавливают, потрошат, обесшкуривают) мойка скороморозильные аппараты глазирование блоков (предотвращение усушки) взвешивание, упаковка, хранение. Филе: срезают с позвоночника 2 симметричных половинки мяса с удалением хребтовой кости (филе бывает с кожей и без неё). Затем филе ненадолго опускают в солевой раствор (3 – 15%), затем дают стечь рассолу, упаковывают и замораживают. Для предотвращения порчи рыбу иногда обрабатывают антиоксидантами (аскорбиновая кислота, бутилокситолуол, бутилоксианизол) и антибиотиками. В производстве продуктов речного и морского промыслов принципиальных различий нет. Рыбные продукты: мороженые (неразделанная, потрошённая рыба, филе, рыбные палочки), сушёные, варёно-сушёные, жарено-сушёные, солёно-сушёные, копчёные, сушёные холодной сушкой, солёные, продукты с приправами (ферментированные), пастообразные продукты, варёные с |
приправами, консервы (натуральные, с приправой из соевых бобов, в томатном соусе). Продукты используемые в промышленности: жиры рыб и млекопитающих, кожа и мех, рыбий клей, украшения. Используемые в сельском хозяйстве: рыбные отходы, рыбная мука (белая и коричневая), рыбные гидролизаты. Используемые в медицине: печёночный жир, печень трески и минтая, инсулин (из трески и китов). Признаки доброкачественности рыбы. Свежая, охлаждённая и мороженная рыба: поверхность чистая, окраска естественная (у рыбы мокрого контактного замораживания допускается потускневшая поверхность), нет побитостей, слизи на поверхности тела немного, она прозрачная, без запаха, глаза выпуклые, прозрачные, жаберные крышки плотно прилегают к жабрам, жабры ярко-красные, консистенция мяса плотная (у мороженной рыбы может быть ослабевшей, но не дряблой), запах свежий, без посторонних привкусов (у морской рыбы допускается морской характерный запах). Рыба пониженного качества, но пригодная в пищу: поверхность потускневшая, слизь мутная (толстый слой (иногда тонковатый)), глаза помутневшие и опавшие, жабры бледно-розовые или слегка бурые, жаберные крышки порозовевшие, неплотно прилегающие, консистенция несколько размягчена, после нажатия ямка выравнивается медленно, запах выраженный, может быть кисловатым, запах поверхностной слизи и в жабрах. Рыба непригодная в пищу: глаза мутные, глубоко запавшие, рот открыт, жаберные крышки сильно приподняты и обнажают жабры, цвет жабр бурый или серый, поверхность рыбы и жабр покрыта мутной слизью с неприятным запахом, брюшко рыбы сероватого или красного цвета, после нажатия остаются следы, мясо дряблое, расслаивается, запах его кисловатый, гнилостный, цвет серый. Консервирование рыбы в консервы. На консервных заводах плавники, голову, внутренности, слизь, сгустки крови и плёнки удаляют. Затем мойка, зачистка и порционирование на куски по размеру банок. Затем укладка в банки, добавление соли, взвешивание, осмотр, закатка банок, стерилизация паром под давлением (t = 116 – 118˚С, 80 – 90 ми-нут). Затем мойка и сушка банок, проверка на герметичность, этикетировка и упаковка. |
|
|
Консервирование в томатном соусе: рыбу обезвоживают (сушка, обработка паром) охлаждение закладка в банки, добавление в них горячего томатного соуса закатка стерилизация (115˚С, 80 – 90 мин). Консервирование в масле: промывка и погружение в солевой р-р (15 – 20%) на 30 минут промывка стекание 1 час обжаривание в растительном масле 3 – 4 мин (t = 104 – 115˚С) укладка в банки, заливка маслом закатка стерилизация 60 мин 104˚С. Вырабатывают консервы с различными добавками и специями. Классификации посолки: 1) По способу обработки солью: А) Сухой (простой, экономичный). Может быть ящичный, столовый, чердачный. Б) Мокрый. В) Смешанный (сначала сухой, а затем мокрый). 2) По температуре посола: А) Тёплый (температура выше 5˚С). Б) Охлаждённый (температура ниже 5˚С, но выше криоскопической). В) Холодный (температура ниже криоскопической). 3) По насыщенности раствора соли: А) Насыщенный (не менее 20% поваренной соли в тузлуке на протяжении всего посола). Б) Средней насыщенности (концентрация соли в конце посола в тузлуке 15 – 20%). В) Слабой насыщенности (концентрация соли в конце посола в тузлуке 10 – 15%). 4) По окончанию диффузии соли в рыбу: А) Законченный (концентрация соли в рыбе равна концентрации соли в тузлуке, соль больше не идёт в рыбу). Б) Прерванный (посол прекращают, когда концентрация соли в рыбе и в тузлуке ещё не стала равной). 72Сушка и вяление рыбы. Сушёная рыба – полуфабрикат, требующий дополнительной кулинарной обработки перед употреблением в пищу. Продолжительность сушки определяется: t, влажностью воздуха, скоростью его движения, химическим составом и способом разделки рыбы. Для жирной t и v меньше. Виды сушки: 1) Холодный (t≤40oC). 2) Горячий (t>100oC). 3) Сублимацией. Вяленая рыба – готова к употреблению в пищу и не требует дополнительной кулинарной обработки. Под вялением понимают медленное обезвоживание рыбы при t не выше 35оС. |
Процесс идёт в естественных условиях под действием солнечного света. Во время вяления – созревание рыбы. Перед сушкой и вялением рыбу обязательно солят, а затем вымачивают в воде. Производство копчёной рыбы. Перед копчением рыбу обязательно солят. Копчение бывает холодное (при t не выше 40˚С) (для рыбы жирной и средней жирности), полугорячее (при t = 40 – 80˚С), горячее (при t = 80 – 170˚С). Копчение бывает дымовое, бездымное (с коптильным в-вом), и смешанное. Коптильные препараты – «Вахтоль» и другие. Производство рыбных колбас – колбасы готовят по той же схеме, что и мясные. Производство паштетов. Они бывают рыбными и из печени тресковых. Стадии приготовления рыбных паштетов: разделка, обжарка, удаление костей, мелкое измельчение на волчке, добавление обжаренного лука, протирка, добавление добавок (соль, пряности) и перемешивание, фасовка, закатка, стерилизация (112оС). Стадии приготовления паштетов из печени: промывка, варка, стечка, измельчение на волчке, добавка солей, специй, перемешивание, закатка, стерилизация (112оС) Производство рыбной кормовой муки: 1) Измельчение. 2) Варка, 3) Прессование, 4) Сушка. Способы получения: 1) Прессовой (жирное сырьё). 2) Прямой сушки (тощая рыба). 3) Экстракционный. Мука входит в состав кормов сельскохозяйственных животных. Мука может быть смешана с другими объектами морского промысла для добавления в корм. Производство рыбьего жира. Вырабатывается при нагревании паром или в воде. Вырабатывается сырой, пищевой, высокогидрогенизированный рыбий жир. Производство биологически активных соединений на основе рыбопереработки. Инсулин: 1) формирование на основе пикриновой кислоты и экстр., 1) измельчение поджелудочной железы, экстракция смесью спирт - . Осаждение белков (инсулин гидрохлорид). Рафинация щёлочью. Кроме того из рыбного сырья получают медицинские и ветеринарные жиры, витамины А и D. |
|
|
101 Рубленые полуфабрикаты - порционные изделия из фарша, составленного в соответствии с рецептурой, основой которой является рубленое (измельченное) мясо. В торговлю поступают в основном полуфабрикаты из мяса убойного скота: бифштекс рубленый, котлеты и фрикадельки. Основным сырьем для рубленых полуфабрикатов является котлетное мясо, которое может заменяться жилованным мясом. В качестве дополнительного сырья для бифштексов используют шпик, для котлет -жирсырец, лук, пшеничный хлеб, замоченный в воде, и др. Вспомогательными материалами для всех изделии являются соль (1,2% массы фарша), перец черный (0,04—0,00%) и вода (6,7—20,8%), добавляемая в фарш котлет для повышения его сочности. Введение в фарш рубленых полуфабрикатов казеппата натрия, изолированного соевого белка, копрецппптата (высокобелкового молочного концентрата) в количестве 10—20% позволяет заменить до 10% мяса, улучшить их органолептпческне качества, повысить пищевую и биологическую ценность, увеличить водосвязывающую способность, снизить потери при жарке. При производстве рубленых полуфабрикатов мясо и дополнительное сырье измельчают на волчке, последовательно загружают в мешалку, куда добавляют соль в виде раствора, перец, а если предусмотрено рецептурой, то яйца и другое сырье. Фарш перемешивают до образования однородной массы. Для понижения температуры массы при перемешивании в мешалку добавляют лед вместо 20 % предусмотренной по рецептуре воды. Фарш формуют в автоматах высокой производительности. Форма изделий округлая, фрикаделек — цилиндрическая (диаметром 28 мм и высотой не более 15 мм). Изделия укладывают на лотки, котлеты панируют при этом панировочной мукой из пшеничных сухарей. Фрикадельки подвергают затем замораживанию до температуры не выше — 10°С и расфасовывают в коробки по 350 г. Натуральные полуфабрикаты из рубленого мяса вырабатывают сравнительно редко по технологическим причинам, в частности, из-за плохой связуемости фарша и возможного разваливания изделия во время приготовления, а также по экономическим соображениям. Применяемые при изготовлении рубленых полуфабрикатов другие компоненты обычно дешевле мяса, и за счет этого уменьшаются себестоимость конечного продукта и его оптовая цена либо значительно увеличивается прибыль производителя, если цену оставить без изменения. Как уже отмечалось, фасование рубленых полуфабрикатов в лотки и пакеты выполняют вручную. Некоторые решения и приемы позволяют увеличить производительность труда на операциях фасования. В частности, при большом объеме
|
производства целесообразно устанавливать систему конвейеров, по которым полуфабрикаты доставляются от места разделки и формования к участку упаковывания. При большом количестве полуфабрикаты одного наименования могут доставляться отдельным конвейером к месту упаковывания.Для получения хорошо связанной структуры фарша к мясу добавляют белый хлеб, картофель, соевый или молочный белок, рис. панировочные сухари. Из подготовленного фарша формуют: котлеты в виде лепешки овальной формы толщиной 2—2,5 см; биточки в виде лепешек округло-приплюснутой формы толщиной 1,5—2 см; шницели в виде лепешек плоско-овальной формы толщиной 1 —1,5 см; другие изделия, форма которых оговорена в нормативно-технической документации. Формование котлет даже при небольших объемах производства можно осуществлять на простой по конструкции и, следовательно, надежной в работе машине. Рубленые полуфабрикаты фасуют вручную в пакеты из полимерной пленки или на лотки из полимерных материалов. В пакет обычно помещают полуфабрикаты, внешний вид которых не является определяющим для потребителя, — наборы для бульона, супа, студня и т. п. С появлением на рынке электронных весов с чекопечатающими устройствами на порции заданной массы, например 500 ± 5, 1000 + 15 г, полуфабрикаты не фасуют, так как для доведения точной массы почти к каждой упаковке нужно добавлять мелкие кусочки — довески. Это и трудоемко, и ухудшает внешний вид продукта. На электронных весах автоматически точно определяют массу продукта и наклеивают на упаковку (или выдают) этикетку с указанием массы, цены за 1 кг (100 г) и стоимости полуфабриката. Рубленые полуфабрикаты, фасованные на лотки, хорошо сохраняют форму, и внешне такая упаковка выглядит современной и привлекательной. Укладывать полуфабрикаты на лоток лучше плотно, один к другому — тогда упаковка хорошо сохраняет форму. Лотки с полуфабрикатами затем помещают в пакет из полимерной пленки или заворачивают в полимерную пленку. На пакеты и пленку можно нанести цветную типографскую печать. Часто рубленые полуфабрикаты, упакованные в пленку или лотки, помешают в прямоугольные картонные коробки, которые удобнее укладывать в ящики, т. е. транспортную тару. За счет более плотной укладки они занимают меньше места на единицу объема холодильника. Кроме того, во время перевозок и погрузочных работ в торговой сети упаковочная пленка часто повреждается, и покупатель отказывается брать такой товар. В картонной коробке полимерная упаковка не повреждается, но потребитель не видит товара и поэтому охотнее покупает полуфабрикаты в прозрачной упаковке. Хотя продукцию известных производителей лучше покупают, если она упакована в картонные коробки.
|
|
|
100 Технологический процесс производства замороженных полуфабрикатов в тесте должен осуществляться в соответствии с санитарными правилами и с инструкцией по мойке и профилактической дезинфекции для предприятий мясной промышленности. Технологический процесс начинается с подготовки сырья: муки, мяса, ингредиентов. Муку, просеянную на мукопросеивателе с магнитоуловителем и очищенную от металлических и прочих примесей, выдерживают на складах не менее одной недели для созревания при температуре 20-250С и относительной влажности 75-85%. Мясо, охлаждённое и размороженное, зачищают от загрязнений, кровяных сгустков и оттисков клейм и направляют на обвалку и жиловку для отделения от костей и жил. Жилованное мясо измельчают на мясорубке с использованием решетки с диаметром отверстий 2 - 3 мм.Готовят остальные ингридиенты согласно рецептуре. Мясной фарш готовят в фаршемешалке. При приготовлении фарша мясное сырьё, лук, пряности, воду отвешивают в соответствии с рецептурой. Замешивание теста. Мука, подаваемая для приготовления теста, должна иметь температуру 18-200С. Замешивание теста происходит в тестомесе. Согласно рецептуре производится добавление яиц, соли, воды. Формовка осуществляется на автоматах. Принцип действия различных агрегатов одинаков: аппарат формует из готового теста непрерывную трубку, внутрь которой непрерывно подаётся подготовленный фарш. На последнем этапе по этой “фаршированной” трубке прокатывается барабан, имеющий фигурные вырезы, отформованные полуфабрикаты попадают на подносы – примерно по 2 кг на поднос. Чтобы тесто не прилипало к штамповочному барабану, ручьи теста автоматически посыпаются мукой. Перед замораживанием отштампованные полуфабрикаты не должны находиться при плюсовой температуре более 20 минут. Замораживание производится до температуры в фарше минус 18оС. Подносы размещают на стеллажной тележке, которая вкатывается в холодильную камеру. Холодильные низкотемпературные камеры обеспечивают заморозку и хранение продуктов при температуре до минус 18оС при температуре окружающего воздуха от 12оС до +40оС. Упаковка и маркировка з производится на полуавтоматах или автоматах фасовочно-упаковочных (У-031, или У-03, или РТ-ПМ-11 и др.) Хранение в упакованном виде осуществляется в холодильных камерах при температуре не ниже минус 10оС в течение не более одного месяца со дня выработки.
|
|
|
|
Спонтанные и индуцированные мутации. Мутации – наследуемые изменения генетического материала. О них появлении судят по изменениям признаков. До 1925-27гг. имели дело только со спонтанными мутациями. Думали, что мут. процесс не зависит от окр. среды. Впервые повышение частоты наследственной изменчивости под влиянием внешних агентов обнаружили в 1925г. Надсон и Филлипов. Им удалось получить мутацию плесневых и дрожжевых грибов под воздействием радия и рентгеновских лучей. В 1927г. Меллер предложил методику количественного учета рецессивных летальных мутаций в Х-хромосомах дрозофилы, за что получили Нобелевскую премию. Стадлер (1928г.) описал влияние рентг. лучей на мутационный процесс у ячменя. В 30-х годах открыт химический мутагенез у дрозофилы: Сахаров (1932), Лобашов и Смирнов (1934) показали, что йод, уксусн. к-та, аммиак индуцируюр регрессивные летали в Х-хромасоме. Мощные хим. мутагены открыты в 1946г. Раппопортом (этиленин) и Ауэрбах и Робсоном (азотистый иприт). С тех пор в арсенал мутоген. факторов вошли разные хим. соединения: аналоги оснований, включающихся в ДНК (этиленметансуфат и др.) и мн. др. Одна из первых попыток объяснить причины спонтанных мутаций сводилась к тому, что их индуцирует естеств-й фон радиации. Но таким путем можно объяснить возникновение ~0,1% всех спонтанных мутаций у дрозофилы. Современная точка зрения на причины спонтанных мутаций сформировалась в 60-е гг. благодаря выяснению механизмов воспроизведения, репарации, рекомбинации генов. Генные мутации стали объяснять как ошибки в работе ферментов матричного синтеза ДНК. Эта гипотеза позволяет рассматривать и индуц-й мутац-й процесс, как результат вмешательства внешних факторов в нормальное воспроизведение носителей генетич. информации, т.е. дает единое объяснение причин спонтанных и индуц-х мутаций. Были открыты гены мутации, которые могут повышать или понижать частоту спонтан. или индуц. мутаций. Первое объяснение мутац-х изменений (генных мутаций в хромосомах аберрации) предложил в 1935г. Тимофеев-Рисовский, Циммер на основании анализа радиац-го мутагенеза у высш. организмов (прежде всего дрозофилы) мутация - результат мгновенной перестройки атомов в сложной молекуле гена, причиной перестройки |
считали попадание в ген кванта или ионизирующ. частицы (принцип попадания) или же случ-е колебания атомов. В 1946г. Лобашов высказал гипотезу физиологич-го мутац-го процесса. Согласно ей, появлению мутации должно предшествовать потенциальное изменение, которое может быть устранено (тождественная репарация), либо реализуется в виде мутации (не тождеств. репарация). Для док-ва этой гипотезы Лобашова, его ученики Тихомиров и Ватти в опытах с дрозофилой, облученной рентг-ми лучами дополнительно воздействовали высокой температурой, которая сама по себе мутаций практически не вызывала. Мухи, подвергнутые такому комбинир-му воздействию, обнаруживали более высокую мутабельность, чем после возд-я только рентг-ми лучами. Исслед-е мутац-го процесса как часть генетич-го анализа ставит 2 задачи: 1.изучение мех-мов спонтанного и индуц-го мутагенеза и 2.получение мутантов для маркирования генетич. материала или для получения полезных форм организмов. Частота мутац-го процесса служит критерием присутствия в окр. среде генетически активных факторов. Осн. метод изучения мутац-го процесса – опред-е его частоты. При этом следуют правилам сформулир-м Тихомировым-Рисовским:1) Работа возможна только с чистыми линиями, гомозиготными по исследуемым генам;2) Большая численность как в контроле, так и в опыте;3) Анализировать полученные изменения, чтобы установить наследственны ли они (цитоплазматич. или ядерные или генные).;4) Требуется знание способа действия мутагена на зародышевые кл. обраб-го организма. Эти правила касаются изучения индуц. мутац. процесса, и его частоту опред-ют вычитая частоту мутаций, возникающих в контроле, из частоты мутаций в опыте. Метод Меллера, открывший действие рентг-х лучей на мутац процесс у дрозофилы наиболее удобный. Мутации делят: 1)физиологические;2)морфологические;3)мутации стерильности. Макромутации затрагивают внутри видовые признаки, но иногда из-за них появл-ся признак, который нет у рода, вида, семейства – это системные мутации. Малые мутации – в фенотипе вызывают незначит-е отклонения от нормы. Баур обнаружил, что они затрагивают колич-е признаки урожайности и др. По признаку фенотипич. выраж-ти провести четкую грань между макро- и микромутациями невозможно, между ними есть все степени перехода. |
|
|
Репарация ДНК. ДНК постоянно подвергается различным мутационным воздействиям, как спонтанными, т.и. индуцированными мутагенами. Большинство происходящих с ДНК изменений не допустимо. Они или блокируют репликацию ДНК или приводят к мутациям, вызывающих гибель клеток. Все клетки имеют специальные системы исправления повреждений. Этот процесс называется репарацией ДНК. Типы повреждений ДНК: 1)Дезаминирование : цитозин преобразуется в урацил, аденин- в гипоксантин, гуанин- в ксантин. 2)Алкилирование – метилирование оснований ДНК.3) Размыкание пуринового кольца осуществляется за счёт разрыва ковалентной связи. 4) Апуринизация - отщепление азотистого основания от нуклеотида. 5) Образование пиримидиновых димеров из двух соседих пиримидинов цепи ДНК. Прямая реактивация повреждений осуществляется посредством ферментов метилтрансфераза (переносит метил) и фотолиаза (репарирует пиримидиновые димеры). Фермент переходит на ДНК пиримидинового димера и прочно связывается с ним. При обучении такого комплекса видимым светом происходит фотохимическая реакция разрушения пиримидинового димера. После того, как нормальная структура ДНК восстановлена фермент теряет сродство к ДНК. Эксцизионная репарация включается, если невозможна прямая репарация (основана на удалении из ДНК нарушенных участков). На каждое аномальное основание существует свой фермент (ДНК-N-гликозилаза), который вырезает аномальное основание с разрывом N-гликозидной связи, в ДНК образуется АР-сайт. Это тоже аномалия и должна быть исправлена. Этот процесс может идти 2-мя путями: 1) фермент пришивает к дезоксирибозе азотистое основание в соответствии с компактностью цепи ДНК; 2) фермент разрывает сахарофосфорный остов ДНК в АР-сайте. В этом отношении существует 2 типа ферментов: один делает разрыв с 3/-конца, другой с 5/-конца АР-сайта. Образуется разорванная цепь ДНК. Далее действует фермент экзонуклеаза, которая удаляет поверхностный участок. Образуется протяжённая брешь, которая застраивается заново с использованием комплементарной цепи в качестве матрицы с помощью ДНК-полимеразы I и II. Далее действует ДНК-лигаза, которая сшивает остающийся разрыв. Система |
SOS-репарации включается в том случае, когда значительно увеличивается количество повреждённых ДНК, что угрожает клетке гибелью. Степень индукции определяется количеством повреджения в ДНК. При неболшом количестве повреждений возрастает уровень некоторых репликативных белков, работавших и до индукции – uvr A, В, С, D. При большом количестве повреждений блокируется деление клеток и индуцируется синтез белка, он необходим для репарации; при ещё большем количестве повреждений образуются белки umu CиD. При помощи белка umu C ДНК полимераза способна копировать нарушенный участок матрицы. Мезанизм индукции SOS-системы основан на взаимодействии белков REC А и Lex A. Lex A, являющийся репрессором подавляет свой собственный синтез, синтез белков uvr A, В, С, D и umu C и D. REC А способен связаться с повреждёнными участками ДНК и может связаться с Lex A. Такое связывание изменяет конформацию REC А и активизируется его автопротеазная активность, в результате Lex A репрессор расщепляется пополам и начинается работа всех подавляемых им генов. Когда повреждения ДНК исчезают REC А перестаёт связываться с Lex A, идёт возрастание концентрации Lex A репрессора и все гены SOS-системы подавляются. Z |
|
|
Определение нуклеотидн. последовательности ДНК Секвениравание – определение нуклеотидной последовательности. Метод Максама-Гилберта: 1) при момощи фермента полинуклеотидкиназы в 2-ух цепочечный фрагмент ДНК к 5’ концу каждой цепи вводится радиоактивная метка (фосфор). После чего производят разделение цепей и секвенирование каждой из них по отдельности 2) образец секвенируемой цепи ДНК делят на 4 порции и подвергают химической модификации. Пуриновые основания метилируют по 7 атому диметилсульфатом, а пиримидиновые – гидразином. 3) модификацию ведут в таких условиях, когда в каждой молекуле ДНК модифицируется только один мономолекуляный остаток, с равной веоятностью и не зависимо от его положения в цепи. 4) там, где в цепи ДНК появляется модифицированный остаток происходит разрыв цепи. Определив длину появившегося меченого фрагмента (радиоактивным фосфором) можно определить позицию модифицированного остатка. 5) длину фрагментов определяют при помощи элекрофореза в ПААГ и последующей радиоавтографии. Измерение длины фрагмента осуществляют путём сравнивания его подвижности со стандартом. Метод Сенгера: основан на копировании анализируемого участка ДНК с помощью ДНК-полимерной реакции. Анализируемую последовательность ДНК предварительно встраивают в вектор на основе фага М 13. Далее производят разделение кольцевых цепей векторной молекулы ДНК и каждую из цепей по отдельности подверкают секвенированию. В качестве праймера используют короткий фрагмент ДНК, комплементарный участку ДНК вектора, который предшествует анализируемой последовательности. Праймер обычно метят по 5’ концу радиоактивным фосфором. Проводят 4 типа полимерных реакций по числу типов нуклеотидных остатков. В каждом из 4 случаев полимерную реакцию осуществляют в присутствии смеси 4 типов обычных дезоксинуклеозидтрифосфатов и одного терминаторгого нуклеозида дидезоксинуклеозидтрифосфата. У них при 3-м атоме углерода дезоксирибозы отсутствует гидроксильная группа, это делает невозможным образование 3’-5’ фосфодиэфирной связи и обрыв синтеза комплементарной цепи попадении на 3’ конец терминаторного остатка. Далее осуществляют разделение меченых синтезируемых фрагментов ДНК (электрофорез в ПААГ ) и измерение их длин. |
74- 78 Подкислители Подкислители применяют в основном как вкусовые добавки для придания продуктам «острого» вкуса. Самый популярный подкислитель – лимонная кислота, которую получают при участии Aspergillus niger, сбраживая мелассу и содержащие глюкозу гидролизаты. Ее широко используют в производстве безалкогольных напитков и кондитерских изделий. При консервировании помидоров широко используют яблочную кислоту, ее образует A. flavus. К числу других кислот, широко применяемых в пищевой промышленности, относятся уксусная, молочная, итаконовая (продуцент – A. terreus), глюконовая, используемая в форме глюконолактона (продуцент - A. niger), и фумаровая (микроскопический гриб рода Rhizopus). Усилители вкуса Вещества, усиливающие оттенки вкуса, содержатся в природных пищевых продуктах. Главным усилителем вкуса считается натриевая соль глутаминовой кислоты (глутамат натрия): ее можно получать при помощи Micrococcus glutamicus. Расщепляя с помощью фермента нуклеазы микроскопического гриба Penicillium citrinum нуклеиновые кислоты, в промышленном масштабе получают 5´-нуклеотиды (содержащие главным образом инозин и гуанин), которые находят применение как усилители вкуса. Красители Основные потребности в этих соединениях удовлетворяются за счет природных источников и продуктов химического синтеза, но два из них традиционно получают методами биотехнологии. В качестве красителей и усилителей цвета используются некоторые витамины, такие как В2(рибофлавин), β-каротин, окрашивающие пищевые продукты в оранжево-желтые цвета. -каротин применяют при изготовлении колбас с целью замены нитрита натрия, кондитерских изделий, сливочного масла, макаронных изделий. Некоторые аминокислоты при температуре 100-120 С и сильнощелочной реакции взаимодействуют с сахарами с образованием красителей. Загустители Ксантан был первым микробным полисахаридом, который начали производить в промышленном масштабе (1967 г.). Синтезируется микроорганизмами Xanthomonas campestris при выращивании на глюкозе, сахарозе, крахмале, кукурузной декстрозе, барде, творожной сыворотке. Это вещество обладает высокой вязкостью в широком диапазоне рН, не зависящей от температуры и присутствия солей. Ксантаны безопасны для человека, вследствие чего с 1969 г. используются в пищевой промышленности для производства консервированных и замороженных пищевых продуктов, приправ, соусов, продуктов быстрого приготовления, заправок, кремов и фруктовых напитков. В сочетании с растительным полисахаридом из семян лжеакации водные растворы ксантана образуют стабильные гели, что используется в производстве кормов, например, |
|
|
68-73.80 Технология колбасного производства Подготовка сырья: включает размораживание (при использовании замороженного мяса), разделку, обвалку, и жиловку. Разделка. Это операции по расчленению туш на более мелкие отруби. Мясные туши (полутуши) разделывают на отрубы в соответствие со стандартными схемами. При специализированной разделке в колбасном производстве всю полутушу (тушу) используют на выработку колбас. Говяжьи полутуши разделывают на 7 частей на подвесном пути или на специальном разделочном столе (лопаточная, шейная, грудная, спинно-реберная, поясничная, тазобедренная, крестцовая части). Говяжьи полутуши рационально разделывают по комбинированной схеме, согласно которой поясничную, спинную, тазобедренную части и грудинку направляют в реализацию или для изготовления полуфабрикатов, а остальные части – в колбасное производство. Свиные полутуши разделывают на стационарных столах, подвесных путях и свиноразделочных конвейерах. От полутуши отделяют задний окорок с крестцовой частью, затем крестцовую часть от окорока. Лопаточный и шейный отрубы отделяют от средней части между 4-м и 5-ым ребрами. Из полученных частей выделяют отрубы для изготовления из свинины полуфабрикатов. А остальное мясо направляют на обвалку. Обвалка. Так называется процесс отделения мышечной, жировой и соединительной тканей от костей. Обвалку лучше производить дифференцированным методом, когда каждый рабочий обваливает определенную часть туши, однако на предприятиях малой мощности применяют потушную обвалку, когда всю тушу обрабатывает дин рабочий. Обвалку производят на стационарных и конвейерных столах. На обвалку и жиловку поступает охлажденное и размороженное сырье с температурой в С; для выработки вареных колбас – парное мясо столще мышц 1 – 4 С, или остывшее с температурой не вышетемпературой не ниже 30 12° С. В связи с трудоемкостью процесса обвалки мяса и сложной конфигурацией скелета животных на костях после обвалки остается значительное количество мелких тканей. Допустимое содержание мякотных тканей на костях после обвалки без дифференцирования по видам кости до 8%. Для увеличения выхода сырья проводят дообвалку - отделение мякотных тканей остающихся на костях после ручной обвалки. Распространены два способа дообвалки кости: в солевых растворах и прессование. Жиловка. Это процесс отделения от мяса мелких косточек, остающихся после обвалки сухожилий, хрящей, кровеносных сосудов и пленок. При жиловке говядины вырезают куски мяса массой 400 – 500 граммов и сортируют в зависимости от содержания соединительной ткани и жира на 3 сорта. К высшему сорту относят чистую мышечную ткань без жира, жил, пленок и других включений, видимых невооруженным глазом; к первому - мышечную ткань, в которой соединительная ткань в виде пленок составляет не более 6% массы; ко второму сорту относят мышечную ткань с содержанием соединительной ткани и жира до 20% с наличием мелких жил, сухожилий, пленок, но без связок и грубых пленок. Свинину в процессе жиловки разделяют на нежирную (содержит не более 10% межмышечного и мелкого жира), полужирную (30-50% жировой ткани) и жирную (более 50% жировой ткани). При жиловке обваленной свинины выделяют шпиг, мелкие кости, хрящи, становые жилы и крупные сухожилия. Колбасный шпиг выделяют из боковой и спинной частей свиных туш. На поверхности кусков и пластин хребтового шпига допускается не более 10% массы шпига прирезей мяса, на боковом шпиге – не более 25%. После разделки шпиг в зависимости от его дальнейшего использования направляют либо в посол, либо на охлаждение или замораживание. Измельчение и посол мяса. Мясо для производства колбас после жиловки подвергают измельчению и посолу. При посоле мясо приобретает соленый вкус, липкость (клейкость), устойчивость к воздействию микроорганизмов, повышается его влагоудерживающая способность при термической обработке, что важно при производстве вареных колбас, формируется вкус (9). При посоле мяса, предназначенного для вареных колбас, вносят 1,7 – 2,9 кг соли на 100 кг мяса. В результате термической обработки концентрация соли в готовых изделиях повышается до 4,5 – 6,0 %. Для быстрого и равномерного распределения посолочных веществ мясо перед посолом измельчают. Мясо, предназначенное для вареных колбас, перед посолом (в процессе жиловки) нарезают на куски массой до 1 кг или измельчают на волчках с диаметром отверстий решетки 2 – 6, 8 – 12 или 16 – 25 мм. Мелко измельченное мясо (для вареных колбас) перемешивают с рассолом, а более крупно измельченное мясо – с сухой поваренной солью. Продолжительность перемешивания мяса с рассолом 2 – 5 мин. (до равномерного распределения рассола соли и полного поглощения его мясом), с сухой солью мелкоизмельченного мяса 4 – 5, мяса в кусках или в виде шрота – 3 – 4 мин. При посоле мяса добавляют нитрит натрия в количестве 7,5 г на 100 кг сырья в виде раствора концентрацией не выше 2,5% (или его вводят при приготовлении фарша). Посоленное мясо помещают в емкости и направляют на выдержку при температуре 0 – 4° С (10). Температура посоленного мяса, поступающего на выдержку в емкостях вместимостью до 150 кг, С. С, в емкостях свыше 150 кг – 8не должна превышать 12 Для охлаждения мяса, предназначенного для выработки вареных колбас, при посоле сухой солью, допускается добавление пищевого льда в количестве 5 – 10 % от массы сырья. Мясо, измельченное на волчке с диаметром отверстий решетки 2 – 6 мм, при посоле концентрированным рассолом выдерживают 6 – 24 часа, при посоле сухой солью 12 – 24 часа. При степени измельчения мяса 8 – 12 мм выдержка длится 12 – 24 часа. Мясо в виде шрота для вареных колбас выдерживают в посоле 24 – 48 часов. Мясо в кусках массой до 1 кг, предназначенное для вареных колбасных изделий выдерживают 48 – 72 часа. Эмульсию, полученную из парной и охлажденной говядины для вареных колбас, раскладывают в тазики слоем не более 15 см и выдерживают 12 – 48 часов при 0 – 4°С. Приготовление фарша. Фарш – смесь компонентов, предварительно подготовленных, в количествах, соответствующих рецептуре для данного вида и сорта колбасных изделий. Мясо для вареных колбас измельчают сначала на волчке, затем на кутере или других машинах тонкого измельчения. Мясо с большим содержанием соединительной ткани, свиную шкуру и сухожилия измельчают на коллоидных мельницах. Перед загрузкой в коллоидную мельницу мясо измельчают на волчке с диаметром отверстий решетки 3 мм и добавляют не менее 30% воды. Приготовление фарша производится в куттерах (для одно-структурных колбас) и в фаршемешалках, (для колбас содержащих кусочки шпига). В соответствии с рецептурой к измельченному мясу добавляют шпиг, специи, пряности и другие ингредиенты. При измельчении разных видов сырья в куттер вначале загружают говядину или нежирную свинину, затем – полужирную и нежирную свинину, шпиг загружают в конце куттерования. Воду добавляют при куттеровании говядины и нежирной свинины. Все ингредиенты тщательно перемешиваются с добавлением воды или льда в течение 10 – 15 минут. Новейшие конструкции фаршемешалок работают с созданием вакуума. Отсасывание воздуха в фаршемешалках повышает качество фарша. Если мясное сырье не было засолено, то в начальный период куттерования добавляют соль. На начальной стадии куттерования вносят фосфаты, увеличивающие водосвязывающую способность фарша. После тщательного измельчения нежирного сырья добавляют специи, красители, сухое молоко. Если при посоле мяса не вносили нитрит, то его 25 %-ный раствор разливают по поверхности при составлении. Аскорбиновую кислоту, способствующую увеличению интенсивности и устойчивости окраски вареных колбас, вносят также во второй половине куттерования. Формование батонов. Процесс формирования колбасных изделий включает: Подготовку колбасной оболочки Шприцевание фарша в оболочку Вязку и штриковку колбасных батонов, их навешивание на палки и рамы. Шприцевание (т. е. Наполнение колбасной оболочки фаршем) осуществляется под давлением в специальных машинах-шприцах. Фаршем вареных колбас оболочки наполняют наименее плотно, иначе во время варки, вследствие объемного расширения фарша оболочка может разорваться. Фарш вареных колбас на пневматических шприцах рекомендуется шприцевать при давлении 0,4-0,5 мПа, на гидравлических – при 0,8-1,0 мПа. Для уплотнения, повышения механической плотности и товарной отметки колбасные батоны после шприцевания перевязывают шпагатом по специальным утвержденным схемам вязки. При выпуске батонов в искусственных оболочках, где напечатаны наименование и сорт колбасы. Поперечные перевязки можно не делать. После вязки батонов для удаления воздуха, попавшего в фарш при его обработке, оболочки прокалывают в нескольких местах (штрикуют) на концах и вдоль батона специальной металлической штриковкой, имеющей 4 или 5 игл. Батоны в целлофане не штрикуют. Перевязанные батоны навешивают на петли шпагата на палки так, чтобы они не соприкасались между собой. Термическая обработка колбасных изделий. Это заключительная стадия производства колбасных изделий; она включает осадку обжарку, варку, охлаждение. 62Осадка. Операция осадки (выдержки) фарша после формования батона предусматривается для всех видов колбасных изделий. Кроме ливерных колбас. Кратковременную осадку при получении вареных колбас, она длится 2-4 часа. На большинстве предприятий осадку вареных колбас проводят по пути их прохождения из шприцовочного отделения в обжарочное при температуре в помещении не выше 12° С . Обжарка. Является разновидностью копчения, ее проводят дымовым газом при 90(+10)° С . В зависимости от вида колбасной оболочки, ее газопроницаемости, размеров и диаметра батонов обжарка длиться от 30 минут до 2,5 часов. При этом батоны прогреваются до 45 (+5)° С , т. е. До температуры, при которой начинается денатурация мышечных белков. Оболочка упрочняется и становится золотисто-красного цвета, а фарш приобретает розово-красную окраску вследствие распада нитрита натрия. Варка. Ее проводят при температуре 71 (+1)° С. Колбасные изделия варят в универсальных и паровых камерах, а также в водяных котлах при температуре 75-80° С. При варке в универсальных и паровых камерах колбасные изделия на рамах или тележках загружают в камеру, куда через трубу поступает острый пар. При варке в водяных котлах колбасу погружают в горячую воду и варят при 85-90° С. Варка острым паром менее трудоемка и более экономична. Температуру контролируют термометрами и термопарами. Продолжительность варки зависит от вида и диаметра колбасы. Охлаждение. Колбасные изделия после варки направляют на охлаждение. Эта операция необходима потому, что после термообработки в готовых изделиях остается часть микрофлоры, и при достаточно высокой температуре мясопродуктов (35-38° С) микроорганизмы начинают активно развиваться. Колбасные изделия быстро охлаждают до достижения в центре батона 0-15° С. Чтобы снизить потери, охлаждение вареных колбасных изделий в оболочке проводят сначала водой. Затем воздухом. Охлаждение водой под душем длиться 10-15 минут, при этом температура внутри батона снижается до 30-35° С. Для охлаждения колбас используют холодную водопроводную воду (10-15° С). После охлаждения водой колбасные изделия направляют в помещения с температурой 0-8° С, где они охлаждаются до температуры не выше 15° С. Влажность готовой продукции 55-75%. Вареные колбасы хранят не более 2-5 суток при температуре до 8° С и не более 6-12 часов при температуре 20° С. |
консервированных кормов для домашних животных. Широко используется в кондитерской промышленности и при производстве мороженого в качестве стабилизатора полисахарид декстран (α-D-глюкан) из Leuconostoc mesenteroides, выращиваемого на сахарозе. Альгинаты из растительных источников широко используются в пищевой промышленности в качестве загустителей или гелеобразующих агентов. Их применяют для стабилизации йогурта, для предотвращения образования кристаллов льда при получении мороженого и т.д. Источником альгинатов служат морские водоросли (например, Laminaria spp.), однако по своей природе этот источник непостоянен. В промышленном масштабе получают альгинаты, выращивая бактерии Azotobacter в условиях избытка углерода. Причем тип получаемого альгината можно изменять, варьируя различные параметры культивирования (содержание фосфора, кальция).
112 Молочнокислые микроорганизмы в технологии мясопродуктов Одним из перспективных направлений следует признать создание и использование для производства мясных изделий биологически активных веществ на основе продуктов жизнедеятельности микроорганизмов. В качестве стартовых культур в основном используются нитратвосстанавливающие микрококки, гомоферментативные молочнокислые бактерии и педиококки, дрожжи и нетипичные молочнокислые бактерии в виде чистых или смешанных культур. Состав микрофлоры зависит от сырья, условий и режима посола. С течением времени в рассоле возрастает доля молочнокислых в общем количестве бактерий, а среди молочнокислых – число штаммов, адаптированных к условиям посола, в частности Lactobacillus plantarum и Streptococcus lactis. Молочнокислые бактерии являются биологической основой формирования колбасы как пищевого продукта, важнейшим консервирующим фактором. Посредством молочнокислых бактерий происходит осуществление биохимических превращений основных компонентов мяса с образованием соединений, обуславливающих вкус и аромат, консистенцию; изменение физико-химических параметров мясного фарша в направлении, неблагоприятном для развития микробов, которые способны вызвать порчу мяса; подавление развития технически вредной и патогенной микрофлоры путем образования различных веществ, обладающих антимикробным действием. Из представителей молочнокислых микроорганизмов к наиболее активным видам (по степени образования 3-methylbutanal) относится Lactobacillus casei. Большое количество летучих жирных кислот образуется в результате влияния на активизацию биохимических и физико-химических процессов, связанных с дезаминированием аминокислот, окислением углеводов и карбонильных соединений, а также сами культуры продуцируют летучие жирные кислоты. Молочнокислые бактерии обладают исключительно лабильным метаболизмом и способны приспосабливаться к изменению среды благодаря вариабельному приспособительному обмену. При внесении в колбасный фарш в виде бактериальных заквасок их продукты метаболизма играют важную роль в формировании аромата. Микроорганизмы и их ферментативные комплексы осуществляют деструкцию основных компонентов мяса и трансформацию их во вкусовые, ароматические и физиологически активные соединения, определяющие органолептические свойства готового продукта, его усвояемости в организме человека, биологическую ценность и безопасность для потребителя. Бифидобактерии, имея низкую непредельную кислотность, выступают мощным регулятором активной кислотности фарша в период осадки без ухудшения его качества. В период осадки происходит интенстивный рост молочнокислых палочек и бифидобактерий, сокращается процесс осадки. Основным продуктом метаболизма бифидобактерий при сбраживании углеводов является молочная кислота, накопление которой благоприятно влияет на консистенцию. Бифидобактерии обладают способностью связывать кислород воздуха и резко понижать окислительно-восстановительный потенциал, что, вероятно, предохраняет липиды от окисления. Известно, что с устойчивостью липидов мяса к окислению тесно связана окраска колбас. При внесении бифидобактерий в мясной фарш окислительно-восстановительный потенциал резко снижается, создавая восстановительные условия для образования окиси азота. При изучении ведущей микрофлоры при производстве мясопродуктов исследователями было установлено, что микрофлора исследованных сырокопченых, сыровяленых колбас, копченых окороков, рассолов представлена главным образом молочнокислыми бактериями. Преобладание молочнокислых бактерий в готовом продукте дает основание отводить им важную роль в ферментации сырых колбас и соленых мясопродуктов. В связи с этим последующий поиск велся с целью выделения психрофильных молочнокислых микроорганизмов. Так были выделены атипичные молочнокислые бактерии: Lactobacillus sake (Lactobacillus sakei) и Lactobacillus curvatus, совместное использование которых с типичными лактобактериями ускоряло процесс созревания и повышало показатели качества ферментированных мясных изделий. Характерным признаком этих видов молочнокислых микроорганизмов является наличие каталазы и нитритредуктазы. Молочнокислые палочки Lactobacillus acidophilus, Lactobacillus bulgaricus имеют большое промышленное значение. Их применяют при производстве многих молочных продуктов и полусухих сырокопченых колбас. Устойчивость их к кислоте и соли, способность развиваться при различных температурах, наличии и отсутствии воздуха способствуют распространению молочнокислых палочек. Эти микроорганизмы – активные кислотообразователи. Культурам Lactobacillus acidophilus и Lactobacillus bulgaricum свойственен гомоферментативный тип молочнокислого брожения. Установлено, что высокая ацидофильность молочнокислых палочек, рН 3,0-3,5, зависит от накопления в клетках бактерий большого количества рибофлавина, способствующего процессам дыхания клетки. Lactobacillus acidophilus и Lactobacillus bulgaricum обладают высокой протеолитической активностью. По степени гидролиза казеина молочнокислые палочки выстраиваются в ряд в сторону уменьшения: Lactobacillus bulgaricum, Lactobacillus acidophilus, Lactobacillus helveticum, Lactobacillus lactis, Lactobacillus casei, Lactobacillus plantarum и т. д. В отличие от молочнокислых стрептококков молочнокислые палочки обладают более выраженной ферментативной протеолитической системой, имеют развитый комплекс пептидаз и протеиназ. В результате они могут переводить до 25-30% казеина в растворимую форму.
|
|
|
81,88 Ферменты - это высокоактивные соединения белковой природы, являющиеся специфическими катализаторами реакций. Ферменты катализируют миллионы химических превращений в клетках животных, растений, микроорганизмов и воздействуют на соответствующие субстраты вне клетки. Достоинством применения ферментов перед химическими катализаторами является то, что они действуют при нормальном давлении, при диапазоне температур от 20 до 70 С, рН от 4 до 9, в большинстве случаев имеют высокую субстратную специфичность, что позволяет в сложной смеси биополимеров направленно воздействовать на определенные соединения. При помощи ферментов получают ряд пищевых продуктов. Ферменты используют в пищевой, фармакологической, биохимической промышленностях и во многих областях деятельности человека. Следует различать два понятия: ферменты и ферментные препараты. Ферменты находятся практически во всех живых объектах: растениях, животных и микроорганизмах. Ферментные препараты могут представлять собой смесь ферментов или фермент одного вида, иметь различную степень очистки, могут быть добавлены в сырье или продукт, или использоваться закрепленными на носителе (иммобилизованные ферменты). В качестве источника получения ферментных препаратов биотехнологическим способом используют ткани и органы растений, животных и микроорганизмы. Производство ферментных препаратов является одним из перспективных направлений развития биотехнологии. Из ферментов растительного происхождения наиболее широко в пищевой промышленности используют амилазы и папаин. Источником ферментов могут быть пророщенные зерна различных злаков. Условно ферментным препаратом можно считать и ячменный солод, в котором содержится до 1 % амилаз. Растительная протеаза – папаин – содержится в плодах дынного дерева. Только в США ежегодно расходуют около 1 т папаина для обработки (размягчения) мяса. Папаин, а также протеазы фицин и бромелаин при контакте с мясом в течение 2 ч при комнатной температуре расщепляют белки соединительной ткани – коллаген и эластин. Из растительного сырья получают также фосфатазы, пероксидазы, уреазы, гемицеллюлазы и другие ферменты. Органы и ткани животных (поджелудочная железа, слизистые оболочки желудков и тонких кишок свиней и т.п.), содержащие ферменты, на мясоперерабатывающих комбинатах консервируют и используют для получения ферментов. Из слизистой желудка свиней и крупного рогатого скота получают препарат пепсина. Из поджелудочной железы свиней получают панкреатин, смеси трипсина, химотрипсина, липаз и амилаз. Пепсин, трипсин и химотрипсин применяют для размягчения мяса, однако бόльший эффект получен при обработке мяса панкреатином. Из желудка (сычуга) молодых телят выделяют сычужный фермент (реннин), широко используемый в сыроделии. Сычужный фермент осуществляет процесс превращения жидкого молока в гель (сгусток), а кроме того участвует в протеолизе, происходящем в сыре при созревании. Протеолитические ферменты продуцируются грибами рода Aspergillus, Penicillium, бактериями рода Bacillus, дрожжами рода Saccharomyces. Эти ферменты используют при переработке животного сырья в мясной, молочной и рыбной промышленности. Они применяются как размягчители мяса, ускорители созревания мяса и рыбы. При проведении слабого протеолиза с использованием набора специфических ферментов происходит незначительное изменение структуры мяса, но оно становится качественно лучше, значительно мягче. Особенно важным является действие ферментов на белки соединительной ткани. В этом случае оказывается возможным значительно полнее использовать все части туши.
108 Охлаждение мяса и мясопродуктов Мясо и мясопродукты направляют на охлаждение, как правило, в парном состоянии (30-37°С), реже — в остывшем (не выше 12°С). При медленном охлаждении мясо всех видов охлаждают при 2°С в течение 26-28 ч и скорости охлаждающего воздуха 0,16-0,2 м/с. Кроме медленного охлаждения применяют интенсивное (ускоренное и быстрое) охлаждение мяса. Быстрый метод охлаждения мяса имеет ряд принципиальных достоинств: обеспечивает хороший товарный вид (в частности, цвет), получение корочки подсыхания, резкое снижение потерь массы мяса и достаточно высокую стойкость при хранении. При нем на поверхности туши корочка небольшая, проницаемая и прозрачная, обеспечивает поглощение кислорода, что способствует стабилизации красного цвета мяса в течение длительного времени. При ускоренном охлаждении температуру в камерах снижают до 0°С, продолжительность охлаждения до 20-24 ч, при быстром — до -3...-5°С, продолжительность охлаждения 12-16 ч (для говядины), 10-13 ч (для свинины), 6-7 ч (для баранины и козлятины). Температура охлажденного мяса на глубине 6см должна быть равна 0-4°С. Масса охлажденного мяса меньше, чем парного, в результате испарения влаги с его поверхности. Степень усушки мяса зависит от вида, категории упитанности животных и способа обработки мяса. Чем больше и упитаннее туша, тем меньше потери, чем выше температура и ниже относительная влажность воздуха, тем больше усушка. Для говядины и баранины усушка составляет 0,82-2,28%, для свинины - несколько меньше, для субпродуктов всех видов - 1,63, тушек кур - 0,5, цыплят, уток - 0,6, индеек - 0,3%. Хранят охлажденное мясо при относительной влажности воздуха 85-90%, скорости движения воздуха 0,2-0,3 м/с и температуре -1,5°С (для говядины), -2-0°С (для свинины), -1-0°С (для баранины). Говядину хранят 10 суток, свинину и баранину -7суток. Мясо птицы хранят не более 5 суток при температуре 0-2°С и относительной влажности воздуха 80-85%, субпродукты — не более 3 суток. Подмораживание мяса Увеличение сроков хранения мяса может быть достигнуто понижением температуры. Под подмораживанием понимают понижение температуры на 1-2° ниже криоскопической (минус 2-3°С). Подмораживают мясо в камере при температуре -25°, говядину в течение 6-10ч, свинину — 4-8ч, баранину —2-3 ч. При -18° длительность процесса увеличивается в 1,5-2 раза. После подмораживания мясо выдерживают сутки при -2°С. Продолжительность хранения подмороженного мяса в 2-3 раза больше охлажденного. Хранят подмороженное мясо при температуре -2.. -3°С, говядину — до 20-30 суток, тушки птицы — до 40 суток. Для увеличения сроков хранения охлажденного мяса его обрабатывают углекислым газом, озоном, ультрафиолетовыми лучами, облучением, которые вызывают гибель или замедляют развитие микрофлоры. Замораживание мяса Замороженное мясо в толще должно иметь температуру -8°С и ниже. Различают одно- и двухфазный методы замораживания мяса (табл. 1). Однофазный метод предусматривает замораживание парного мяса, а двухфазный — предварительно охлажденного. Двухфазное замораживание во многом уступает однофазному, так как при этом способе снижаются товарные и пищевые качества мяса. Предпочтительнее однофазное замораживание, поскольку оно не вызывает таких изменений в тканях, как двухфазное. В мясе, замороженном в парном состоянии, резко тормозятся ферментативные, гидролитические и окислительные реакции, процесс созревания продолжается 3-4 месяца. Поэтому однофазным методом замораживают мясо, которое предполагают хранить не менее 6 мес. Замораживают мясо в специальных морозильных камерах при температуре от -23 до -35°С в зависимости от вида мяса, относительной влажности 90-92% и скорости циркуляции воздуха 2-5м/с, Продолжительность замораживания при однофазном способе зависит от температуры и циркуляции воздуха в камере. Так, при температуре -23°С и естественной циркуляции воздуха продолжительность замораживания составит 36-44 ч, а при принудительной -29-35 ч; при температуре -35°С продолжительность замораживания будет соответственно 22-27 и 19-23ч. Температуру замороженного мяса определяют на глубине 7-10см (термометр в металлической оправе вводят до замораживания). Потери массы мяса при однофазном замораживании составляют 1,48-2,48%. Хранят мясо в специальных камерах. В соответствии с видом и категорией упитанности мясо укладывают на стеллажи. Оптимальная температура хранения -18°С (при этом исключается развитие плесени). При упаковывании замороженного мяса в полимерные материалы продолжительность хранения возрастает. Мясо и субпродукты можно замораживать в блоках, что более рационально по сравнению с замораживанием в тушах, полутушах и четвертинах. Туши расчленяют на отрубы и плотно укладывают в алюминиевые формы. Мясо, предназначенное для производства колбас, отделяют от костей и в блоках по 20-30кг замораживают в морозильных камерах при -23...-27°С в течение 12-24 ч, укладывая штабелями в шахматном порядке. Хранят плотно уложенные блоки при температуре в камере -18°С и относительной влажности воздуха 90-98% в течение 12 мес. Кроме традиционных способов обработки мяса и мясопродуктов холодом разработаны и рекомендованы к внедрению новые технологии, позволяющие повысить эффективность холодильников и сократить усушку мяса.
5) экранирование камер хранения и укрытие штабелей замороженного мяса тканью. Применение ледяных экранов, укрытие мяса тканями с нанесенным на них слоем ледяной глазури, использование чистого снега или дробленого льда (под штабеля) снижают усушку и сохраняют первоначальные качества замороженного мяса. |
81 88 Применение ферментных препаратов С целью размягчения мяса, облегчения его обработки широко применяются ферментные препараты протеолитического действия. Использование ферментных препаратов в промышленных масштабах связано с технологическими задачами равномерного распределения ферментов при внесении их в мясо. Применяются следующие способы обработки мяса протеолитическими ферментами: прижизненное введение препарата путем инъекций; внутримышечное шприцевание мясной туши; обработка поверхности мяса путем разбрызгивания раствора фермента или нанесения порошкообразных препаратов на поверхность мяса; погружение мяса в раствор ферментов после механического рыхления; восстановление дегидратированного сублимацией мяса в растворе ферментов. Каждый из этих способов имеет свои преимущества и недостатки.
Используемые протеолитические ферментные препараты должны отвечать определенным требованиям: иметь высокий температурный оптимум действия; осуществлять эффективный гидролиз в кисло-нейтральной области рН; обладать специфичностью к гидролизу миозина и особенно белков внутримышечной соединительной ткани – коллагена и эластина (то есть иметь сходность действия с катепсинами, коллагеназой и эластазой); быть безвредными для организма человека. Для обработки мышечной ткани применяют ферментные препараты животного, растительного и микробного происхождения. Из ферментов животного происхождения высокой коллагеназной и эластазной активностью обладает фермент панкреатин, получаемый из поджелудочной железы свиньи. Иногда его применяют в смеси с ферментами трипсином, химотрипсином, пепсином. Однако ферменты животного происхождения имеют весьма ограниченные сырьевые источники. Среди группы ферментов растительного происхождения для обработки мышечной ткани используют папаин, фицин, бромелаин и другие. Например, папаин применяют как размягчитель жесткого мяса. Он используется при созреваниия мяса, изготовлении полуфабрикатов, получении гидролизатов. Следует отметить, что эти протеазы также не могут полностью удовлетворить запросы промышленности ввиду дефицита сырья для их получения, малого выхода при переработке растений, а, следовательно, высокой стоимости. Протеиназы микробного происхождения имеют ряд преимуществ по сравнению с другими источниками: неограниченность сырьевой базы, относительно простая технология получения, невысокая стоимость и др. Кроме того, микробные протеиназы, как правило, способны к более глубокой деструкции белков, в том числе многих фибриллярных, а также обладают широким спектром действия на различные субстраты.
107 Общая характеристика изменений, происходящих в мясе после убоя животных . При жизни животного соединения мяса находятся в состоянии распада, но уравновешенного их синтезом. После убоя животного характер и направленность этих процессов изменяются вследствие прекращения поступления к клеткам кислорода и растворенных в крови питательных веществ. Синтез затухает, и начинает доминировать автолиз. Общее направление автолиза — упрощение сложных соединений и накопление ряда недоокисленных продуктов. Весь комплекс послеубойных изменений можно условно подразделить на три периода. Первый период длится около 3 ч — до наступления посмертного окоченения и заканчивается после 1-2 сут хранения туши; Мышцы находятся в состоянии нарастающего окоченения. Третий период характеризуется разрушением окоченения и последующим размягчением мяса. В первом периоде мышечная ткань мягкая и эластичная. Величина рН мяса близка к нейтральной. В мясе содержится значительное количество гликогена, креатинфосфата и АТФ. Отдельные белки экстрагируются водой или солевыми растворами из мышечной ткани, наблюдаются значительная развариваемость коллагена и высокое содержание связанной воды. Продукты распада нуклеотидов содержатся в минимальных количествах. Мясо в парном состоянии вполне пригодно для изготовления вареных колбасных изделий и замораживания. Второй период характеризуется развитием посмертного окоченения. Мышцы теряют эластичность, уплотняются и твердеют. Интенсивность окоченения зависит от температуры, вида, возраста, упитанности и состояния животного перед убоем. Жесткость мяса и сопротивление его разрезающему усилию возрастают примерно в 2 раза. Уменьшаются содержание связанной воды и способность мяса к гидратации, увеличивается его устойчивость к действию про-теолитических ферментов. Процесс окоченения является итогом многочисленных изменений систем мяса. В этот период происходит анаэробный распад гликогена с образованием молочной кислоты, редуцирующих полисахаридов и глюкозы. От уровня накопления молочной кислоты зависят стойкость мяса при хранении, его влагоудерживающая способность и активность тканевых ферментов. Нарастание посмертного окоченения обусловлено образованием актомиозинового комплекса по мере снижения уровня АТФ. Уменьшение гидратации белков влияет на жесткость мяса, поскольку рН мышечной ткани приближается к рН изоэлектрической точки основных белков. Наибольшая жесткость мяса наблюдается при рН = 5,5. При смешении рН в любую сторону от изоэлектрической точки белков увеличивается нежность мяса. Смещение рН приводит к расклиниванию полипептидных цепей отдельных белков, увеличению гидрофильных центров и соответственно росту влагопоглощающей способности мяса. Третий период характеризуется размягчением мяса в связи с распадом актомиозина при наличии легкогидролизуемого фосфора. Продолжаются автолитические процессы, обусловленные действием протеолитических ферментов. Наблюдаются накопление свободных аминокислот, распад нуклеотидов, растворение мукополисахаридов, увеличение развариваемости коллагена. Одновременно улучшаются вкусовые свойства мяса и бульона. Ароматические и вкусовые вещества, как правило, имеют низкомолекулярную природу. К этим веществам относят весьма многочисленную группу карбонильных соединений, серосодержащие вещества. Среди них можно назвать аминокислоты, низкомолекулярные жирные кислоты, альдегиды, фенолы, спирты, эфиры, из нуклеотидов — адениловую, гуаниловую, цитидиловую, инозиновую и уридиловую кислоты. Из азотсодержащих экстрактивных веществ — креатин, креатинин, ансерин, карнозин, карнитин.
|
|
|
106 Схемы сертификации Номер схемы Испытания в аккредитованных испытательных лабораториях и другие способы доказательства соответствия Проверка производства (системы качества) Инспекционный контроль сертифицированной продукции (системы качества, производства) 1 Испытания типа - - 1a Испытания типа Анализ состояния производства - 2 Испытания типа - Испытания образцов, взятых у продавца 2a Испытания типа Анализ состояния производства Испытания образцов, взятых у продавца. Анализ состояния производства 3 Испытания типа - Испытания образцов, взятых у изготовителя 3a Испытания типа Анализ состояния производства Испытания образцов, взятых у изготовителя. Анализ состояния производства 4 Испытания типа - Испытания образцов, взятых у продавца. Испытания образцов, взятых у изготовителя 4a Испытания типа Анализ состояния производства Испытания образцов, взятых у продавца и изготовителя. Анализ состояния производства 5 Испытания типа Сертификация производства или системы качества Контроль системы качества (производства). Испытания образцов, взятых у продавца и/или у изготовителя 6 Контроль сертифицированной системы качества Рассмотрение заявки-декларации с прилагаемыми документами - Сертификация системы качества 7 Испытания партии - - 8 Испытания каждого образца - - 9 Рассмотрение заявки-декларации с прилагаемыми документами - - 9a Рассмотрение заявки-декларации с прилагаемыми документами Анализ состояния производства - 10 Рассмотрение заявки-декларации с прилагаемыми документами - Испытания образцов, взятых у изготовителя или у продавца 10a Рассмотрение заявки-декларации с прилагаемыми документами Анализ состояния производства Испытания образцов, взятых у изготовителя или у продавца. Анализ состояния производства ПОРЯДОК СЕРТИФИКАЦИИ МЯСА, МЯСНОЙ ПРОДУКЦИИ, МЯСА ПТИЦЫ, ЯЙЦА И ПРОДУКТОВ ИХ ПЕРЕРАБОТКИ 1. Обязательная сертификация мяса, мясной продукции, мяса птицы, яйца и продуктов их переработки (далее - продукции) проводится после проведения ветеринарно - санитарной экспертизы, клеймения (мяса) государственной ветеринарной службой и простановки маркировки в установленном порядке. Необходимым условием для выдачи сертификата соответствия на партию продукции является ветеринарное свидетельство, а на серийно вырабатываемую продукцию - наличие ветеринарного заключения (акта или регистрационного ветеринарного удостоверения), выданных государственной ветеринарной службой в установленном порядке. 2. Обязательная сертификация продукции проводится по схемам 2а, 3, 3а, 4, 4а, 5, 7, 9а, 10, 10а. Обязательная сертификация продуктов детского питания - по схемам 3а, 4а, 5, 7. По решению Органа по сертификации испытания могут быть проведены по сокращенной номенклатуре показателей при условии, что остальные показатели подтверждены документами о состоянии почв, воды, кормов, скота и др., выданными соответствующими государственными службами конкретного региона. 4. Перед проведением сертификационных испытаний проводят идентификацию продукции на соответствие указанному наименованию по органолептическим и физико - химическим показателям, предусмотренным нормативными документами (НД) на продукцию. При отрицательных результатах идентификации продукция не подлежит сертификации (по заявленному наименованию) на соответствие требованиям безопасности. Отбор образцов (проб) и подготовка к испытаниям осуществляется в соответствии с нормативными документами. 6. Порядок и периодичность инспекционного контроля определяется органом по сертификации в соответствии с действующими методическими документами, утвержденными в установленном порядке. 7. Перед реализацией продукции длительного хранения с холодильников, торговых баз и других организаций, осуществляющих хранение этой продукции по решению Органа по сертификации в порядке инспекционного контроля за сертифицированной продукцией, могут контролироваться показатели, которые при нарушении режимов хранения могут превысить допустимые уровни, установленные нормативными документами.
110Электрофизические методы при холодильном хранении пищевых продуктов Совершенствование процессов холодильной обработки пищевых продуктов осуществляется также с помощью импульсной подачи напряжения на генерирующие электроды. В этом случае ионы потерявшего электронейтральность хладоносителя (воздуха) осаждаются на поверхности продукта, который при этом приобретает электрический заряд, имеющий знак, одноименный с ионами хладоносителя. Интенсификация охлаждения и замораживания происходит до того момента, пока сила, определяемая величиной заряда продукта и препятствующая осаждению ионов, не станет равной сумме движущих сил, определяемых значением коэффициента диффузии и подвижностью ионов. На поверхности продуктов будет образовываться так называемый "запирающий слой". С этого момента следует подавать ионизированный хладоноситель противоположной полярности. Так как продукт и ионы хладоносителя имеют разноименные заряды, вновь возникает электроконвективное движение ионов хладоносителя к поверхности продукта и интенсифицируется процесс холодильной обработки продуктов. Вследствие сокращения продолжительности процесса достигается снижение энергозатрат. На основе описанного принципа разработан ряд способов холодильной обработки мяса и мясопродуктов, позволяющих При этом происходит максимальная интенсификация процесса сублимации льда, так как межэлектродное расстояние минимально, что обусловливает предельно возможную скорость электроконвективного воздушного потока. В этих условиях относительная влажность воздуха в камере составляет 98,5...99,5%. Кроме того, использование данного варианта исключает интенсивную циркуляцию воздушной среды в объеме камеры, что нежелательно при хранении определенных видов неупакованных продуктов, например мяса.
|
109 Физиологические и биохимические основы разрешения посмертного окоченения Процессы, происходящие в мышечной ткани после убоя животного, можно условно подразделить на три следующие фазы: послеубойное окоченение, созревание и автолиз. Послеубойное окоченение в туше развивается в первые часы после убоя животного При этом мышцы становятся упругими и слегка укорачиваются Это значительно увеличивает их жесткость и сопротивление на разрезе. Способность такого мяса к набуханию очень низкая. При температуре 15—20"С полное окоченение происходит через 3—5 ч после убоя животного, а при температуре 0—2°С—через 18—20 ч. Процесс послеубойного окоченения сопровождается некоторым повышением температуры в туше в результате выделения тепла, которое образуется от протекающих в тканях химических реакций. Окоченение мышечной ткани, наблюдающееся в первые часы и сутки после убоя животных, обусловлено образованием из белков актина и миозина нерастворимого актомиозинового комплекса. Предпосылкой его образования являются отсутствие аденозинтрифосфорной кислоты (АТФ), кислая среда мяса и накопление в нем молочной кислоты. Биохимические изменения в мясе создают эти предпосылки. Уменьшение и полное исчезновение АТФ связано с ее распадом в результате ферментативного действия миозина Распад АТФ до аденозиндифосфорной (АДФ, аденозинмонофосфорной (АМФ) и фосфорной кислот сам по себе приводит к появлению кислой среды в мясе. Более того, уже в этой фазе начинается распад мышечного гликогена, что приводит к накоплению молочной кислоты, так же способствующей образованию в нем кислой среды. Кислая среда, которая является закономерным явлением распада АТФ и началом необратимого процесса гликолиза (распада мышечного гликогена), усиливает мышечное окоченение. Замечено, что мышцы животных, погибших при явлениях судорог, окоченевают быстрее. Окоченение без накопления молочной кислоты характеризуется слабым мышечным напряжением и быстрым разрешением процесса. Однако уже задолго до завершения фазы окоченения в мясе развиваются процессы, связанные с фазами его собственного созревания и аутолиза. Ведущими для них являются два процесса — интенсивный распад мышечного гликогена, приводящий к резкому сдвигу величины рН мяса в кислую сторону, а также некоторые изменения химического состава и физико-коллоидной структуры белков. В связи с тем что мышцы мяса кислорода не получают и окислительные процессы в них заторможены, в мясе накапливаются избытки молочной и фосфорной кислоты. Так, например, при мышечном утомлении организма (при его жизни) достигается максимум 0,25% молочной кислоты, а при посмертном окоченении ее накопляется до 0,82%. Активная реакция среды (рН) при этом изменяется от 7,26 до 6,02. От накопления молочной кислоты наступает быстрое сокращение (окоченение) мускулатуры, сопровождающееся коагуляцией белка (Саксль). При этом актомиозин теряет свою растворимость, белки стабилизируются, а кальций выпадает из коллоидов белка и переходит в раствор (мясной сок). Вследствие избыточного содержания молочной кислоты вначале наступает набухание коллоидоанизотропного вещества (темного диска) мышечных волокон (оно сопровождается укорочением— окоченением мышц); затем по мере увеличения концентрации молочной кислоты и коагуляции белка происходит размягчение этого вещества. Свернувшиеся белки теряют свои коллоидные свойства, становятся неспособными связывать (удерживать) воду и в известной степени лишаются своей дисперсной среды (воды): вместо первоначального разбухания наступает сморщивание (съеживание) коллоидов клеток, и мышцы становятся мягкими (разрешение окоченения). В результате накопления молочной, фосфорной и других кислот в мясе увеличивается концентрация водородных ионов, вследствие чего к концу суток рН снижается до 5,8—5,7 (и даже ниже). В кислой среде при распаде АТФ, АДФ, АМФ и фосфорной кислоты происходит частичное накопление неорганического фосфора. Резко кислая среда и наличие неорганического фосфора считается причиной диссоциации актомиозинового комплекса на актин и миозин. Распад этого комплекса снимает явления окоченения и жесткости мяса. Следовательно, фазу окоченения от других фаз обособить нельзя и ее необходимо считать одним из этапов процесса созревания мяса. Схему биохимических изменений в процессе созревания мяса можно представить следующим образом. Кислая среда сама по себе действует бактериостатически и даже бактерицидно, а поэтому при сдвиге рН в кислую сторону в мясе создаются неблагоприятные условия для развития микроорганизмов. Наконец, кислая среда приводит к некоторым изменениям химического состава и физико-коллоидной структуры белков. Она изменяет проницаемость мышечных оболочек и степень дисперсности белков. Кислоты вступают во взаимодействие с протеинатами кальция и кальций отщепляют от белков. Переход кальция в экстракт ведет к уменьшению дисперсности белков, в результате чего теряется часть гидратно связанной воды. Поэтому из созревшего мяса центрифугированием можно частично отделить мясной сок. Высвободившаяся гидратносвязанная вода, воздействие про-теолитических ферментов и кислая среда создают условия разрыхления сарколеммы мышечных волокон, и в первую очередь разрыхления и набухания коллагена. Это в значительной степени способствует изменению консистенции мяса и более выраженной его сочности. Очевидно, с набуханием коллагена, а затем частичной отдачей влаги с поверхности туши в окружающую среду следует связывать образование на ее поверхности корочки подсыхания.
|
|
|
82 Производство мясокостной кормовой муки При получении мясокостной муки не производят сортировку жирового сырья, при загрузке в котлы к мякотному сырью добавляют 20—25 % сырой кости. При использовании вываренной кости ее количество изменяют с учетом коэффициента пересчета на сырую. Мякотное сырье без сортировки измельчают на силовом измельчителе и загружают в горизонтальные вакуумные котлы. Жирную влажную шквару после разварки и подсушки выгружают в шнековый приемник и из него с помощью наклонного шнека подают в накопитель, расположенный над центрифугами. Для обезжиривания шквары используют центрифуги дискретного действия с нижней механизированной выгрузкой и полуавтоматическим управлением Продукт поступает в ротор по лотку, закрепленному на кожухе. Рабочая частота вращения ротора центрифуги 24,16 с" . По окончании процесса центрифугу останавливают с помощью тормоза, электродвигатель переключают на вращение в обратном направлении с частотой 1,6 с" и срезают осадок с помощью ножевого устройства. Осадок из ротора ссыпается в транспортирующее устройство через сегрегатор. Жир отводится из ротора центрифуги непрерывно через фильтрующую ткань, закрепленную над перфорированным бортовым кольцом, и собирается в приемнике, откуда насосом перекачивается в отстойник вместимостью 0,85 м куб. В процессе отстаивания жир 2 или 3 раза отсаливают мелкой сухой поваренной солью (2—3 % массы жира), через каждый час после отсолки из отстойника сливают образовавшуюся фузу. Отстаивание длится 5—7 ч при температуре 60—70 "С. Очищенный жир насосами сливают в специальные цистерны. Обезжиренная влажная шквара, коагулят крови и костный полуфабрикат скребковым конвейером подаются на распределительный шнек, установленный над бункерами для сбора обезжиренной шквары. Из бункеров обезжиренная шквара ссыпается в горизонтальные вакуумные котлы для сушки, снабженные открывающимися днищами. При загрузке котлов необходимо исключить контакт обезжиренной шквары, коагулята крови и костного полуфабриката с нестерильным сырьем. Высушенная обезжиренная шквара выгружается из горизонтальных котлов на шнековый, из него — на ленточный конвейер, на котором установлен магнитный уловитель металломагнитных примесей. Далее шквара измельчается и просеивается на вертикальном дробильно-просеивающем агрегате и с помощью шнека мука подается на норию и на бестарное хранение в бункер. Производство кормовых и технических продуктов на непрерывных линиях Высококачественные сухие животные корма вырабатывают из мякотного сырья, смешанного с костью. Кишечные конфискаты и желудки предварительно освобождают от содержимого. Коагулированную кровь и шлям в количестве до 15 % массы сырья добавляют при загрузке в силовой измельчитель или обезвоживатель. Смесь мякотного и костного сырья измельчается до размера 50 мм. Для лучшего измельчения загружают 2 части мякотного сырья и 1 часть кости. Измельченное сырье элеватором подается в шнековый обезвоживатель. В нем сырье подвергается тепловой обработке при давлении пара внутри рубашки и в шнековом валу аппарата 0,35—0,4 МПа в течение 20 мин. Температура продукта на выходе из аппарата не менее 90 °С. В процессе варки выделяются до 3 % жира, 20 % воды в виде бульона и до 25 % сокового пара. Вода и жир через решетку в днище аппарата непрерывно отводятся в жироловку, над которой установлена сетка с отверстиями диаметром не более 3 мм. Потери белка с бульоном составляют около 0,6 % массы сырья. Сваренное сырье поступает в молотковую дробилку, где измельчается до частиц размером менее 25 мм, и далее по обогреваемому элеватору подается в трехсекционную сушилку. Сушка длится 40—45 мин. Выделяющийся вторичный пар отводится в конденсатор, а сухой продукт с массовой долей влаги 9—10 % элеватором подается в шнековый охладитель. Охлажденная кормовая мука измельчается в молотковой дробилке (диаметр отверстий решетки 4 мм). Кормовую муку просеивают через сито с отверстиями диаметром 4 мм, очищают от металлопримесей на магнитном уловителе, упаковывают в крафт-мешки или передают на бестарное хранение. Выход готовой продукции из смеси, содержащей 70 % мякотного сырья и 30 % кости, составляет до 28 %. Если в составе линии нет пресса для обезжиривания шквары, то жировое сырье рекомендуется добавлять в количестве не более 25 % массы перерабатываемых непищевых отходов. Бульон, выходящий из обезвоживателя, разделяется в жироуловителе на два слоя: верхний жировой слой в виде жировой массы непрерывно отводится в отстойник на очистку, а нижний слой — водный — направляется в канализацию. Сырье поступает в приемный бункер, разделенный на две зоны: для кости и мягкого сырья. Приемный бункер расположен ниже уровня пола и снабжен тремя шнеками, которые продвигают сырье к наклонному шнеку, подающему сырье в дробилку. Измельченное сырье самотеком поступает в бункер промежуточного хранения. Из бункера сырье наклонным шнековым конвейером подается в горизонтальный обогреваемый шнек закрытого типа, по которому сырье загружается в стерилизационный аппарат (эквакокер) с паровой рубашкой. Эквакокер представляет собой горизонтальный цилиндрический котел. В котле имеется горизонтально установленная мешалка с вертикальными лопатками и трубами, укрепленными на двух полых перегородках, расположенных на полом валу и разделяющих емкость на три зоны. В перегородках имеются отверстия для движения сырья из одной зоны в другую. Сырье поступает в нижнюю часть эквакокера и непрерывно продвигается в сторону выгрузки; в течение 2—3 мин жир нагревается до 130—150 °С от паровой рубашки и обогреваемой паром мешалки. В результате соприкосновения сырья с горячим жиром испаряется влага, образующиеся пары проходят через циклон, где твердые частицы отделяются от капель жира. В хвостовой части эквакокера установлен лопастный регулятор, напоминающий колесо-черпалку; с его помощью смесь горячего жира и нагретого материала из последнего отсека эквакокера удаляется и направляется в дренажное устройство. Дренажное устройство представляет собой корыто с отверстиями диаметром 2 мм, через которые жир стекает в приемный бак. В корыте установлен шнек, который продвигает шквару по корыту в сторону магнитного сепаратора. Далее шквара шнековым конвейером подается на пресс. Отжатая шквара по одному из шнековых конвейеров поступает на повторную обработку или на получение кормовой муки. Шквара, направляемая на производство муки, загружается в промежуточный бункер-охладитель шнековым конвейером и далее цепным ковшовым элеватором — в роторную дробилку производительностью 2 т/ч. Полученная в дробилке мука размером 0,5—1 мм поступает в вибросито для отделения неразмолотых частичек. Отсеянная мука шнековым конвейером и ковшовым элеватором направляется в бункер, и с помощью шнека, расположенного в нижней части, выгружается в тару. Жир из сборника-накопителя насосом перекачивается в горизонтальную центрифугу и после очистки поступает в емкость для хранения; твердые частицы из центрифуги возвращаются шнеком в эквакокер.
|
103 Мясными баночными консервами называют мясо и мясные продукты, уложенные в тару (банку), герметически закупоренные и обработанные при высокой температуре (100 °С и выше). При таком изготовлении мясопродуктов происходит гибель микроорганизмов в самом продукте (в том числе споровых форм) и исключается их проникновение извне при сохранении герметичности тары. Правильно простерилизованный и герметически упакованный продукт может сохраняться очень долго; этот метод консервирования продуктов считается наиболее надежным. Мясные консервы классифицируют по ряду признаков. По виду сырья их делят на мясные (из говядины, свинины, баранины, конины, мяса поросят, мяса птицы и др.), субпродуктовые (языков, печени, почек, рубца, смеси субпродуктов и др.), из мясных продуктов (сосисок, колбасного фарша, свинокопченостей), мясо-растительные (из мясного сырья или субпродуктов в сочетании с крупами, изделиями из муки, бобовыми, овощами и другим растительным сырьем), жиро-бобовые (из свиного топленого жира, шпика в сочетании с фасолью, чечевицей, горохом). По составу различают консервы в натуральном соку (с добавлением только соли и пряностей), с соусами (томатным, белым и др.) и в желе (в желирующем соусе). Консервы могут быть изготовлены из сырья без предварительного посола или выдержанного в посоле, из кускового, грубо- и тонкоиз-мельченного сырья, прошедшего тепловую обработку (бланшировку, варку, обжаривание), или полученные без предварительной тепловой обработки. Консервы упаковывают в металлическую тару (из белой и черной жести, покрытой пищевым лаком, алюминием и др. или без покрытия), сборную и цельноштампованную, в стеклянную и полимерную комбинированную тару. По режиму тепловой обработки различают стерилизованные консервы (температура тепловой обработки выше 100 °С) и пастеризованные (температура тепловой обработки ниже 100 'С, в центре банки 65—75 *С); по назначению — закусочные (деликатесные), обеденные (для первых и вторых блюд), для детского питания и диетические.В зависимости от продолжительности хранения консервы бывают длительного хранения (3—5 лет) и с ограниченным сроком хранения. Перед употреблением одни консервы не надо подогревать, другие используют в нагретом либо в охлажденном состоянии. СЫРЬЕ И МАТЕРИАЛЫ Мясо. Для производства мясных консервов используют говядину 1-й и 2-й категорий упитанности, свинину беконную, мясную и жирную, а также обрезную (2-й категории), мясо поросят, баранину, конину и оленину 1-й и 2-й категорий, мясо - кроликов, потрошеных или полупотрошеных кур, цыплят и уток (1-й и 2-й категорий), индеек, гусей (2-й категории). Мясо должно быть свежим, доброкачественным, от здоровых животных. Не допускается использовать мясо некастрированных и старых животных (старше 10 лет), дважды размороженное мясо и свинину с желтеющим при варке шпиком. Мясо применяют в остывшем, охлажденном и размороженном виде. Консервы повышенного качества получают из охлажденного и выдержанного 2—3 сут сырья. Парное мясо в консервном производстве используют ограниченно, так как в первые часы после убоя в процессе посмертного окоченения накапливается молочная кислота и разрушает бикарбонатную буферную систему, что способствует выделению свободного диоксида углерода. Образование в банке этого газа вызывает вздутие крышек и донышек (бомбаж), т. е. имитирует микробиологическую порчу. Парное мясо используют в основном при изготовлении ветчинных, фаршевых и. других консервов, технология которых предусматривает выдержку сырья в посоле. Ветчинные пастеризованные консервы нельзя изготавливать из мяса опоросившихся, подсосных или супоросных маток, а также хряков и самцов, кастрированных после четырехлетнего возраста, а также свиней с пестрой пигментацией кожи. В банки закладывают мясо без костей (за исключением случаев, предусмотренных рецептурой), хрящей, грубых сухожилий, кровеносных сосудов, нервных сплетений и желез. Мясные консервы высшего сорта изготавливают с использованием говядины 1-й категории. При производстве некоторых видов консервов с разрешения ветеринарно-санитарной экспертизы можно использовать условно годное мясо. Во избежание обезличивания условно годного мяса, нуждающегося в специальной переработке, на туше кроме клейма, удостоверяющего прохождение ветеринарно-санитарной экспертизы и обозначающего категорию упитанности, должен быть прямоугольный штамп «На консервы». При переработке условно годного мяса на консервы разделку, обвалку, жиловку и другие технологические операции производят на отдельных столах в обособленных помещениях или в отдельную смену при обязательном контроле со стороны ветеринарной службы. Консервы, изготовленные из условно годного мяса, стерилизуют при особых режимах. Субпродукты. В консервном производстве используют субпродукты 1-й и 2-й категорий остывшие, охлажденные и размороженные. Субпродукты должны быть свежими, доброкачественными, без повреждений и кровоподтеков, от здоровых животных. Консервы изготавливают преимущественно из субпродуктов крупного и мелкого рогатого скота, свиней и лошадей. Растительное сырье. В консервном производстве применяют бобовые (горох, фасоль, соя), крупы (гречневая, перловая, овсяная, рисовая, пшено), мучные изделия (мука, крахмал, вермишель, макароны), картофель и овощи (морковь, капуста, томат-паста). При получении мясных консервов применяют картофельный и пшеничный крахмал высшего, 1-го и 2-го сортов, а также рисовый крахмал высшего и 1-го сортов, массовая доля влаги в картофельном крахмале 20 %, в пшеничном, кукурузном и рисовом— 13 %. Растительные жиры. Допускается при обжаривании использовать рафинированные подсолнечное высшего и 1-го сортов и оливковое 1-го и 2-го сортов масла. Они должны быть прозрачными, в масле более низких сортов допускается наличие осадка. Желатин. Пищевой желатин 1, 2 и 3-го сортов, применяемый в консервном производстве, должен быть без посторонних запаха и вкуса, иметь светло-желтый цвет. Температура плавления 10 %-ного студня должна быть 27—32 "С, массовая доля влаги—не более 16 %. Общая микробиальная обсемен-иость не должна превышать 2 • 10 бактерий в 1 г; присутствие патогенной микрофлоры не допускается. Прочее сырье. Помимо перечисленного сырья при изготовлении некоторых консервов применяют кровь и ее фракции, жировое животное сырье (жир-сырец, топленый жир, шпик), молоко и молочные продукты, яйца и яйцепродукты. Эти виды сырья, а также посолочные ингредиенты и специи должны отвечать таким же требованиям, что и при производстве колбас. Однако, следует учитывать, что в некоторых специях содержится большое количество сапрофитных и спорогенных микроорганизмов, поэтому перед введением в консервы специи рекомендуется дополнительно стерилизовать.
|
|
|
104 ТЕХНОЛОГИЯ КОНСЕРВОВ Производство мясных консервов включает: подготовку сырья [приемку, размораживание, разделку, обвалку, жиловку, наре-1ание мяса и субпродуктов на куски), порционирование [фасование), закатку, стерилизацию, охлаждение, сортирование i упаковывание. Каждый вид консервов отличается специфическими операциями, такими, как посол, приготовление фарша (для фаршевых консервов), подготовка бобовых и круп (для мясо-растительных консервов), предварительная тепловая обработка (бланширование, варка, обжаривание) и др. Для производства консервов «Мясо тушеное» из говядины, свинины, баранины и конины мясо нарезают на куски массой 50—120 г (при выпуске консервов в банках № 14 допускается нарезание мяса на куски массой до 200 г). Жир-сырец измельчают на волчках с диаметром отверстий решетки 4—6 мм, топленый жир предварительно растапливают в котлах и подают в дозатор. Идя консервов «Гуляш» мясо измельчают на куски массой до 60 г. Для консервов «Фарш колбасный» используют сырье в виде шрота (16—25 мм) или мелкоизмельченное (2—6 мм). При куттеровании сырья добавляют чешуйчатый лед в количестве 5 % массы основного сырья (говядины, свинины, шпика). Для консервов «Завтрак туриста» мясо измельчают на куски массой 30—70 г на волчке с двумя приемными решетками и ножом между ними или на мясорезке, перемешивают в мешалке с поваренной солью, 2,5 %-ным раствором нитрита натрия, сахаром, молотым черным и красным перцем. Посоленное мясо выдерживают для созревания при 2—4 "С в течение 2—4 сут, затем перемешивают в мешалках с измельченным клейдающим сырьем и направляют на фасование в банки. При производстве мясо-растительных консервов мясо измельчают на волчке с диаметром отверстий решетки 12—15 мм, перемешивают в мешалках с растительным сырьем (крупами,капустой, картофелем), топленым жиром, поваренной солью, специями, питьевой водой и направляют на фасование. При производстве паштетов мякотные субпродукты бланшируют, мясокостные — варят, отделяют от костей и хрящей и куттеруют с полученным при бланшировании субпродуктов бульоном, добавляют обжаренный лук, поваренную соль и специи. Для улучшения консистенции паштетную массу пропускают через коллоидную мельницу или другие машины тонкого измельчения. После этого паштетную массу немедленно передают на фасование. Изготовление консервов из мяса птицы предусматривает более сложную подготовку сырья. Она включает опаливание, потрошение и инспекцию тушек. При изготовлении консервов «Курица в собственном соку» подготовленные тушки птицы разрубаются на куски и направляются на порционирование. Для производства консервов «Мясо куриное в желе» и «Рагу куриное в желе» подготовленные тушки кур обваливают. Очищенное белое и красное мясо направляют для приготовления консервов «Мясо куриное в желе», кости — для варки бульона, который используют в консервах «Рагу куриное в желе». Оставшиеся после обвалки спинку и шею разрубают на части, кожу режут на куски и используют для выработки консервов «Рагу куриное в желе». Подготовленное мясо птицы, поваренную соль и желатин фасуют в банки и заливают горячим бульоном (75—80 °С).
|
Подготовка тары Банки и крышки тары, подготовленной; к подаче на фасование, должны быть чистыми, без загрязнений, остатков флюса от пайки, смазки, металлической пыли и мелких Опилок, наплывов припоя на внутренней поверхности. Прокладки на крышках, размягченные в результате тепловой обработки, не применяют. Соединительный шов корпуса и донышка должен быть герметичен. Тара проходит предварительную санитарную обработку, цель которой — снижение микробиальной обсемененности. Стеклянные банки моют 2—3 %-ным раствором гидроксида натрия (каустической соды), фосфатом натрия и др., банки обрабатывают острым паром и горячей водой (95—98 ). Металлические крышки, предназначенные для укупорки стеклянной тары, шпарят кипящей водой 2—3 мин. Мойка должна обеспечивать удаление не менее 99 % микроорганизмов; остаточная мик-робиальная обсемененность внутри вымытых банок не должна превышать 500 клеток. Санитарную обработку стеклянной и жестяной тары и последующее обсушивание проводят на специальных устройствах конвейерного типа, которые состоят из секций мойки (замачивания), шпарки, ополаскивания и подсушивания. В банках, поступающих на порционирование, не должно быть остатков воды. Порционирование и закатка банок Заполнение продуктом подготовленной тары осуществляют в мясопорционном отделении. После фасования проводят контрольное взвешивание консервов, закатывают крышки, одновременно их маркируют и проверяют герметичность банок. При порционировании необходимо обеспечить соотношение основных компонентов по рецептуре. При фасовании, как правило, вначале закладывают твердые компоненты, после чего заливают жидкие (бульон, соус). Наполненные взвешенные банки по конвейеру подают на закатку. На бортах банок, поступающих на закатку, не должно быть кусков мяса, так как это может стать причиной негерметичности консервов. Крышки перед прифальцовкой маркируют путем штамповки с помощью маркировочных машин ударного и ротационного действия или с помощью типографской печати. При типографской печати на крышку наносят однострочную маркировку, где указывают номер смены, дату выработки и ассортиментный номер, остальная информация уже обозначена на банке. При выработке консервов для экспортных поставок независимо от наличия этикетки маркировку наносят полностью, в две строчки; дополнительно во второй/ строчке выбивается шестой знак, соответствующий сорту консервов (В — высший сорт).Закатку осуществляют при вращающейся или неподвижной банке на закаточных машинах различного типа. Консервированные продукты могут длительно храниться без порчи только в том случае, если в них полностью подавлена жизнедеятельность микроорганизмов. Процесс воздействия на продукт различных факторов с целью уничтожения в нем микроорганизмов называют стерилизацией.
|
|
|
84 Безотходная технология мясоперераб-щей пром-ти К кишечному сырью относят кишки, пищевод, мочевой пузырь. Кишки, полученные от одного животного составляют комплект. Комплект КРС: тонкие и толстые кишки, пищевод, мочевой пузырь. Комплект молодняка: толстые кишки. Комплект МРС: тонкие и толстые кишки. Комплект свиней: тонкие и толстые кишки, мочевой пузырь. Лошади: тонкие кишки. Комплект делят на части. Тонкие кишки: двенадцатиперстная, тощая, подвздошная. Толстые кишки: слепая, ободочная, прямая. Стенка кишок состоит из 4 слоёв: серозный, мышечный, подслизистый, слизистый. Серозный пластичен и прочен. Подслизистый состоит из переплетиния коллагеновых и эластиновых волокон. Слизистый всегда удаляют. Хим. состав кишок: белок-9-10%, жир-1-2%, мин. соли-1%, вода-85-88%, витамины, ферменты. Техносхема обработки кишок: 1) разборка комплекта на части (отделяют прямую кишку с мочевым пузырём и т.д.) 2) освобождение от содержимого (освобождают в ручную немедленно с помощью воды или вальцов) 3) очистка от жира (жировая ткань может окисляться и предавать неприятный запах и вкус) 4) освобождение от лишних слоёв (удаляют слизистый слой, серозную и мышечную оболочку, мышечную иногда оставляют, для удаления слизистого слоя кишки выворачивают и обрабатывают на специальных машинах) 5) охлаждение (для предотвращения действия м/о и ферментов кишки помещают в ванну с холодной водой) 6) сортировка и вязка (сортируют по качеству и диаметру, объединяют в пучки) 7) консервирование и упаковка (сухой посол: собственно посол, стекание рассола и подсолка; мокрый посол: выдерживают в чанах с рассолом 4-5 сут; сушка - в естественных условиях, высушивают до влажности 8-10%). Дефекты: присутствующие( язвы), технические дефекты ( порезы, надрывы), дефекты хранения (краснуха-на соленых кишках (может быть на поверхности и втолще, кишки можно промыть раствором маргенцевокислого калия), ржавчина-посол солью с примесями солей железа и др. , поверхностную ржавчину смывают водой, а въевшеюся вырезают; при хранении кожа может также поражаться лечинками жука-кожееда. Клей костевой и мездровый получают из тканей содержащих коллаген. Желатин получают пищ. и технический. Сырём |
служат ткани, органы и части туш богатые коллагеном, кости. Техносхема: 1) Подготовка сырья: а)сортировка сырья ( мягкое сырьё сортируют по степени свежести, анатомическому строению, свежести, степени загрязнённости, размеру кусков, костное сырьё б) измельчение сырья ( кость дробят, мякгое сырьё режут на куски 50-60 см в) обезжиривание кости г) полировка кости (удаление посторонних тканей и загрязнений с поверхности кости-кость должна быть белой) д) калибровка и повторное дробление-размер не должен превышать более 25 мм е) мацерация кости-обработка подкисленной водой.Для желатина используют НСl. Идёт деминерализация кости, набухание коллагена. Концентрация кислоты -5%, температаура-15°С, время-5-15 сут. Для производства клея используют серную кислоту, время выдержки-1-2 сут. ж) золка – разрушение морфологических и структурных элементов ткани. Сырьё обрабатывают щелочью. з) обеззоливание – удаление остатков щелочи нейтрализацией соляной кислотой, затем промывка. 2) Извлечение путём обработки горячей водой ( 24-36 ч.) до содержания сухих веществ в бульоне до 6% . 3) Отстаивание, фильтрование и осветление активированным углём, упаривание и обработка сернистым газом. Желатинизация –переход из золя в гель. Бульон охлаждают воздухом, водой, рассолом. 4) Сушка желатина и клея. Её проводят в туннельных или иных сушилках. Далее дробление и упаковка. Кератин содержащее сырьё используют для производства товаров широкого потребления. К нему относя производные кожи, волосяной покров шкуры, рога, копыта, перья. Это сырьё содержит белок кератин. Он устойчив к действию кислот и ферментов. Его гидролизуют при повышенной температуре и давлении. При этом разрушаются S-S связи. Ферментный гидролиз идёт медленно и никогда не бывает полным. Техносхема рогокопытной муки: 1) Промывка в центрифуге 5-8 мин при температуре 40-60°С 2) разварка в воде 3) Сушка под вакуумом 3-5 ч. 4) Измельчение, просеивание и упаковка. Обработка волос и щетины. Хвосты и уши промывают в проточной воде, обезвоживают, состригают волос, сушат до содержания влаги 12%, связывают в пучки и упаковывают. Щетину получают дёрганую с луковицей, стриженную без луковицы, щетину-шпарку. Z |
|
|
119 Вторичное сырье и отходы мясоперерабатывающей промышленности, их использованиие. В процессе переработки промышленных животных значительный удельный вес имеют вторичные продукты: кость, хрящевая и нервная ткани, субпродукты, а также кератин содержащее сырье. Химический состав этих продуктов богат белками, ферментами, гормонами, витаминами, жирами, углеводами и минеральными солями. В связи с этим обоснована перспектива их использования на пищевые и медицинские цели. Рациональная утилизация вторичных продуктов мясоперерабатывающей промышленности основана на использовании различных физико-химических и биологических способов предварительной обработки с целью повышения их пищевой ценности и эффективности производства. Современные технологии производства пищевых продуктов построены таким образом, что полученные продукты зачастую обеднены такими полезными веществами, как белок, клетчатка, минеральные компоненты. Основная масса вторичных сырьевых ресурсов, образуемых пищевой промышленностью используется в качестве кормовых добавок, значительно меньше – в качестве пищевых. В качестве кормовых добавок широко используются такие вторичные сырьевые ресурсы мясной промышленности, как кровь и кость, имеющие высокое содержание белков, макро- и микро- элементов (особенно железа), для получения кровяной, костной и мясокостной муки. Особое место занимает кровяная мука, наиболее простая по способу получения. В отличие от остальных видов муки животного происхождения она имеет высокое (до 81 %) содержание протеина, коэффициент переваримости которого достигает 96-99 %, и содержит незначительное количество жира, что делает ее стойкой при хранении и транспортировке. Применение кровяной муки в рационах животных и птицы позволяет значительно повысить продуктивность и выживаемость молодняка. Установлено, что при введении коагулянта крови в мясокостную муку повышается среднесуточный прирост живой массы поросят на 7 % по сравнению с контрольной группой. Рогокопытное и шкуросырье также используется для получения кормовых добавок. Из каныги - содержимого желудков крупного рогатого скота вырабатывают белково-растительный обогатитель, добавляемый в корма. Широко применяется в сельском хозяйстве заменитель цельного молока для выпойки телят, получаемый на основе вторичных сырьевых ресурсов молочного производства – обезжиренного молока, пахты, молочной сыворотки и других ценных ингредиентов. В состав заменитель цельного молока входит 70% обезжиренного молока, 18-22% растительных и животных жиров, 0,5% минеральных солей и микроэлементов, витамины А, D, Е, К, В1, В2, В12, РР и антибиотики. Замена молочного белка в составе заменитель цельного молока другими источниками протеина, в частности кровью и ее фракциями, является одной из актуальных задач. Выработаны рецептуры с применением кровяного альбумина в количестве 6-12 %, а также с применением кормового полуфабриката, в состав которого входят форменные элементы крови, гидролизат кератинсодержащего сырья и костный жир. Разработаны биодобавки в комбикорма на основе альбуминного молока и пермеатов. Пермеаты, получаемые при ультрафильтрации молочного сырья, содержат значительные количества лактозы и минеральных веществ и используются для получения добавок, содержащих лактат аммония и др. Особенно важным направлением использования вторичных сырьевых ресурсов является применение их в качестве пищевых и биологически активных добавок, так называемых биокорректоров. |
Так, в мясной промышленности в качестве пищевых добавок в колбасные и мясные изделия, консервы используется кровь убойных животных. На эти цели идет до 33 % ее ресурсов. В основном на пищевые цели применяют плазму и сыворотку крови. Одним из важных направлений расширения ее применения в качестве пищевых добавок является приготовление кроветворных эмульсий. Введение в состав эмульсий казеината натрия устраняет дефицит изолейцина и метионина. Кровежировые эмульсии применяются при производстве колбас, заменяя до 15% мяса в фарше. Их можно использовать в количестве до 20% для повышения биологической ценности мясных паштетов, кровяных колбас, продуктов детского питания, котлет. Черный пищевой альбумин используется как компонент сырья для выработки продуктов питания лечебно-профилактического назначения антианемического действия (детский гематоген, экструген). Вырабатываемый из плазмы крови светлый пищевой альбумин можно использовать при приготовлении мясных паштетов, в качестве заменителя яичного белка при изготовлении печенья, пирожков, тортов. Кроме того, мясная промышленность располагает значительным количеством шквары, получаемой при перетопке говяжьего и свиного жиросырья. Анализ химического состава шквары свидетельствует о значительном содержании в ней белковых веществ и подтверждает целесообразность её использования как в колбасном, так и ряде других производств. Общее содержание белка в шкваре колеблется в пределах 65 – 80%. В состав белков входят 22 – 44% коллагена и 19 – 30% эластина. Однако использование шквары ограничивалось из-за большого содержания соединительной ткани. В настоящее время соединительную ткань рассматривают не как балластное вещество, а как необходимый компонент питания. В связи с этим возрастает практический интерес к рациональному и полному использованию шквары на пищевые цели, разработке путей повышения её биологической ценности. При переработке кости для пищевых целей используется мясная масса и костный жир, т.е. около 25% ее состава. Разработана технология получения комбинированного продукта питания лечебно-профилактического действия на основе использования белок - и крахмалсодержащего сырья и минеральной части кости. Его применение обеспечивает профилактику и различных заболеваний, лечение переломов и остеопороза и т.д. Субпродукты II категории используются для повышения биологической ценности колбасных изделий.
|
|
|
85 116 Расщепление коллагенсодержащего сырья и его применение Перспективное направление обработки коллагенсодержащего сырья – его ферментация. Показано, что употребляемые для улучшения качества мяса ферментные препараты должны иметь следующие свойства: - вызывать изменение соединительной ткани; - слабо действовать на мышечную ткань; - иметь возможно более высокий температурный оптимум действия, сохраняя способность частично изменять ткани при тепловой обработке; - действовать в слабокислой или нейтральной среде с максимальной активностью; - быть безвредным для человека. Практика применения ферментных препаратов показывает, что не все ферменты, обладающие высокой протеолитической активностью, при обработке мяса дают должный эффект. При этом имеет большое значение оптимум действия ферментов, природа их активаторов и ингибиторов, специфичность к разрыву пептидных связей при гидролизе животных белков. Известно несколько способов обработки мяса ферментами: инъекции раствора в кровеносную систему животных, шприцевание раствора фермента в шею, поверхностная обработка мяса ферментами, добавление ферментного раствора к мясному фаршу. Наиболее приемлемым методом для современного производства оказалось шприцевание ферментного раствора в шею. В состав шприцуемого раствора кроме ферментного препарата входит поваренная соль и пищевые добавки. Характер и глубина изменений внутримышечной соединительной ткани под действием протеолитических ферментов зависит от специфичности протеиназ содержащихся в препаратах. Наиболее глубокие изменения соединительнотканных прослоек происходили под действием фицина, т. к. этот фермент способен гидролизовать нативный эластин при естественном рН мяса. Что касается пищевых ферментных препаратов микробного происхождения, не обладающих коллагеназной и эластазной активностью, то их действие на внутримышечную соединительную ткань ограничивается освобождением коллагеновых волокон от «цементирующего» их основного вещества. Это способствует снижению устойчивости коллагеновых волокон к гидротермическому воздействию и более быстрому размягчению мяса в процессе тепловой обработки. Направленное изменение исходных свойств сырья с помощью ферментативной обработки наиболее перспективно в колбасном производстве при сокращении сроков посола и использования сырья с большим содержанием соединительной ткани. Предложен способ созревания мясного сырья, предварительно обработанного раствором протеолитических ферментов микробного происхождения (протосубтилин, протомезентерин, прототерризин) методом инъецирования. Такая обработка позволила увеличить выход натуральных полуфабрикатов на 11% за счёт использования для этих целей жёстких частей говяжьих туш. профилактических. Применение ферментных препаратов при обработке кожевенного сырья является одним из перспективных методов совершенствования технологических процессов кожевенного производства. Присутствие в шкуре растворимых и нерастворимых компонентов различной химической природы, многоступенчатая структурная организация основного белка шкуры – коллагена – определяют сложный характер реакций при ферментативной обработке. Применение специфических ферментных препаратов и клеток позволяет осуществить принципиально новые технологии глубокой и комплексной переработки основного, вторичного сырья и не пищевых отходов с реализацией режимов в естественных диапазонах температуры, рН среды и давления, минимальными энергозатратами, без дополнительных капитальных вложений и нежелательных экологических воздействий. |
Ферментирование сырья с высокой массовой долей соединительной ткани способствует повышению скорости диффузионно-фильтрационного распределения посолочных ингредиентов при посоле такого сырья. Доказано увеличение равномерности распределения хлорида натрия при обработке сырья протеолитическими ферментами. Анализ гидролизатов указывает на богатый набор и высокое содержание свободных аминокислот: пролина, цистина, валина, аланина, изолейцина, лейцина, фенилаланина, лизина, серина, глутаминовой и аспарагиновой кислот. При этом перевариваемость сырья увеличивается в 2,0 – 2,5 раза. Такие гидролизаты являются прекрасной основой для получения пищевых добавок, модифицированных продуктов и кормовых концентратов. Ряд методов получения ферментативных гидролизатов предложен французскими исследователями, которые использовали ферменты животного (панкреатин, трипсин, химотрипсин), растительного (фицин, бромелаин, папаин) и микробного (B. subtilis Str. fradiae Str. griseus) происхождения. Для более эффективного гидролиза белков животного происхождения предлагается ряд комбинированных способов. При этом применяется предварительная кислотная или щелочная обработка, а затем – ферментативный гидролиз. Конкретные условия гидролиза, определённые с помощью методов математической статистики, легли в основу нового способа получения белково-жировой добавки – заменителя основного сырья в рецептурах фаршевых мясных изделий. Способ заключается в следующем: промытые свежие ноги и головы сухопутной птицы измельчают, а затем гомогенизируют с добавлением воды. Это необходимо для разрушения тканевых структур и частичной механической деструкции особенно прочных белков – коллагена и кератина. Измельчённое сырьё (гомогенаты) нагревают до 80 – 90оС для частичной деструкции упроченных белков. Затем сырьё подвергают ферментативной обработке. Аспекты применения на пищевые цели специфического коллагенсодержащего сырья – шквары, получаемой в виде отхода при вытопке жиров и содержащей 22 – 44% белков (в основном коллагенов), известны. Гомогенизированная шквара – ценное белковое сырьё. В её составе присутствуют такие незаменимые аминокислоты, как валин, лизин, фенилаланин. Для улучшения функционально-технологических свойств шквары также целесообразно применение ферментов, специфичных к гидролизу фибриллярных белков. В нейтральной зоне рН при умеренных температурах наиболее эффективными оказались протеолитические препараты глубинной культуры микромицета Penicillium wortmannii. Полученный гидролизат отличается следующими показателями: значительная доля свободных аминокислот и общие изменения во фракционном составе белков. В результате нарушения белково-липидных комплексов создаются условия для дополнительного получения жира.
|
|
|
115 Зависимость цветообразования мясопродуктов от различных факторов Естественная окраска мяса обусловлена наличием в мышечной ткани пигмента миоглобина - хромопротеина, состоящего из белкового компонента (глобина) и простетической группы (гема), и составляющей около 90% общего количества пигментов мяса. 10% представлено гемоглобином крови - белке крови (эритроцитов). Гем – пигментная группы, содержащая атом двухвалентного железа (этот пигмент очень хороший источник железа, необходимого человеческому организму) и присоединенной белковой части. Когда к атому железа присоединена молекула кислорода, миоглобин имеет ярко-красный цвет (оксимиоглобином- двухвалентное железо), а когда он отдает кислород, становится темно-пурпурным. Если же атом железа окислить до трехвалентного, то миоглобин приобретает цвет от зеленовато-серого до коричнево-серого цвета (метмиоглобин). Все эти соединения имеют сложное строение и содержат атомы железа в степенях окисления +II и +III. При варке и обжаривании миоглобин и метмиоглобин переходят в глобингемихромоген коричневого цвета. Именно железо гема гемоглобина ответственно за формирование различного оттенка поверхности мяса в зависимости от внешних условий (свет, воздух, время выдержки, изменения температуры). Все эти три вида миоглобина присутствуют в сыром мясе. Их пропорции зависят от наличия кислорода и активности различных ферментов, кислотности, температуры и т.п. Поэтому ярко-красное свежее мясо на воздухе под действием кислорода темнеет («заветривается»), а завернутое в полиэтилен, при отсутствии кислорода, приобретает неаппетитный синеватый оттенок (впрочем, этот процесс обратим – если развернуть кусок мяса и дать ему полежать на воздухе несколько минут, оно краснеет).1 Мышцы состоят из двух типов волокон – белых и красных (соотношение между ними зависит от задач мышц). Красные волокна получают энергию в основном за счет окисления глюкозы и содержат много миоглобина – связывающего кислород белка, по строению и функциям похожего на гемоглобин крови. Белые мышечные волокна – быстрые, предназначенные для «спринтерских» движений (например, куриные грудные мышцы) – содержат меньше миоглобина, но больше ферментов, обеспечивающих анаэробное окисление глюкозы – гликолиз. При этом в мышцах накапливается молочная кислота, что ограничивает их выносливость, поэтому для долгой работы эти волокна не подходят. На цвет мяса влияют и содержащие атомы железа пигменты – цитохромы. Чем лучше натренированы мышцы, тем больше требуется кислорода, тем выше содержание миоглобина и цитохромов и тем темнее их цвет. Кроме того, быстрые мышечные волокна больше нуждаются в кислороде – соответственно, в них больше капилляров, из-за чего красные мышцы выглядят еще темнее. Мясо молодняка - светло-красное с почти белым жиром, его обработка не создает для повара никаких проблем. Мясо старых животных - темно-красное, причем жир - желтого цвета; чтобы успешно приготовить из него еду, требуется терпение и опыт. Доброкачественное мясо дает прозрачный алый сок; если нажать на мясо пальцем, а потом отпустить, образовавшаяся ямка быстро выравнивается. На мороженом мясе прикосновение пальца оставит красное пятно, а если мясо замораживали повторно, такого пятна уже не будет, жир будет розового цвета, а сухожилия - ярко-красные. Размороженное мясо выделяет мясной сок, который наряду с
102 Быстрозамороженные вторые блюда Производство быстрозамороженных мясных готовых блюд имеет тенденцию к быстрому развитию. Это связано с тем, что эти продукты являются наиболее подготовленными для потребления без дополнительной кулинарной обработки. Их необходимо перед употреблением только разогреть. Особенностью их технологии является максимальная сохранность пищевой ценности и массы используемого сырья, получение продуктов высокого качества, минимальные потери сырья и готовой продукции. Ассортимент быстрозамороженных готовых блюд постоянно расширяется. В настоящее время отечественная промышленность выпускает говядину тушеную, гуляш из говядины, бефстроганов, мясо по-домашнему, тефтели, биточки «Здоровье» (все с соусом и гарниром или только с соусом), крокеты и бифштекс с бульоном и гарниром, котлеты крестьянские с соусом и гарниром (или с соусом); сардельки, сосиски, колбасу вареную с гарниром, блинчики (по-крестьянски, кавказские и др.). В качестве гарнира используют кашу гречневую, рис, капусту тушеную, зеленый горошек, морковь и картофель отварные. Технологическая схема производства быстрозамороженных блюд из натурального мяса включает процессы изготовления полуфабрикатов, тепловую обработку, фасование, замораживание и групповую упаковку. Изготовление сырых мясных полуфабрикатов сводится к получению порций или кусочков мяса (путем нарезания). Сырые полуфабрикаты солят, перчат, опрыскивают растительным маслом и обжаривают до образования румяной корочки. Затем их тушат до кулинарной готовности. Мясо, отделенное от бульона и охлажденное до 50°С, соус и гарнир фасуют в формочки из алюминиевой фольги, которые укупоривают. Продукт замораживают при —35—40°С в течение 1,5— 2 ч (или при — 25°С—3 ч) до достижения температуры внутри изделия —18°С. Замороженные готовые блюдаупаковывают в коробки из гофрированного картона массой не более 20кг. Мясное сырье, процессы приготовления фарша и формование полуфабрикатов аналогичны тем, которые применяют при изготовлении полуфабрикатов из рубленого мяса. В процессе тепловой обработки полуфабрикаты жарят во фритюре при 110—120°С или варят на пару до готовности 8—10 мин до 75°С в центре (тефтели, крокеты, котлеты крестьянские) или 15—20 мин обжаривают без жира или в небольшом его количестве при 150—160°С 20—25 мин до готовности (бифштексы). Быстрозамороженные готовые блюда из рубленого мяса фасуют и замораживают аналогично тем же процессам при производстве быстрозамороженных готовых блюд из натурального мяса. |
цитоплазмой повреждённых дефростацией клеток, в большом количестве содержит остаточную кровь в капиллярах и тонких сосудах мяса после обескровливания. Свежесть мяса можно определить и химическим способом (по кислотности мясного сока): свежий мясной сок окрашивает лакмусовую бумажку в красный цвет, среда кислотная, а сок несвежего мяса нейтральный или слабощелочной. Цвет варёной колбасы должен быть таким же серо-коричневым, как у куска вареного мяса. Такой и получается домашняя колбаса без всяких добавок. Если же мы захотим добиться аппетитного светло-розового цвета домашней ветчины (копченой или соленой), колбас и прочих деликатесов, придется ввести добавку пищевой селитры - нитрата натрия. Она образует ярко-красные пигменты нитрозметметмиоглобин, нитрозилмиоглобин и нитрозилгемохромоген, которые, присутствуя в продукте в ничтожном количестве, придают ему приятный цвет. Фарш будет иметь розовый или красный цвет, если нитрит натрия вносится в требуемой дозе непосредственно к мясу и бледно-розовый или серый – если нитрит натрия вносится в фарш в уменьшенной дозе или после внесения жира или жирного мяса. Это объясняется тем, что внесенный нитрит натрия разлагается и взаимодействует с пигментами и восстанавливающими веществами мяса, что, в конечном итоге, приводит к образованию нитрозметмиоглобина, который окрашивает его в красный цвет. При недостающем количестве нитрита натрия получается менее интенсивная окраска. Предварительное внесение в фарш жира или жирного мяса создает вокруг мышечной ткани жировую оболочку, которая препятствует его проникновению и взаимодействию. Таким образом получается серый или бледно-розовый цвет. Фарш может иметь бледно-розовый или серый цвет и при изготовлении продукта из подмороженного мяса. В этом случае проникновению и взаимодействию нитрита натрия с пигментами мяса противостоят кристаллы льда и низкая температура. Бледно-розовый цвет с коричневыми и зелеными пятнами можно получить при изготовлении фарша из мяса и жира с признаками порчи. В этом случае продукты разложения белков, жиров и жизнедеятельности микроорганизмов окисляют ферменты мяса. В связи с этим фарш приобретает коричневый или зеленоватый цвет. Серый или бледно-розовый цвет может возникнуть и в случае изготовления фарша с значительным количеством немясных компонентов (крахмал, мука, соя, молоко, меланж и др.). Серый цвет может быть и при недоваренном фарше. Это обусловлено неполным химическим преобразованием нитрита натрия. Учитывая, что в говядине содержится значительно больше метмиоглобина, фарш из говяжьего мяса всегда будет интенсивнее окрашен. Фарш, выдержанный на свету с доступом воздуха, через некоторое время приобретает серый цвет с коричневым оттенком. Это обусловлено окислением с образованием пигментов различного цвета. Несвежие мясопродукты нетрудно распознать по серо-зеленоватому цвету и по неприятному запаху. При долгом хранении в неподходящих условиях белки мяса разлагаются, выделяя сероводород, а он образует зеленый пигмент сульфмиоглобин. Существует два принципиальных механизма порчи сырого красного мяса – это микробиологический рост и окисление красного оксимиоглобинового пигмента. Когда красное мясо содержится в правильных температурных условиях, единственный и наиважнейший контролируемый параметр увеличения срока хранения продукта – уровень окисления оксимиоглобинового пигмента, его переход в коричневую окисленную форму – метмиоглобин. 111 Формы связи воды Перед рассмотрением отдельных свойств следует уделить внимание одному из важных компонентов всех пищевых продуктов воде. Воду нельзя рассматривать как просто инертный компонент или универсальный растворитель для пищевых веществ. Она является не только преобладающим компонентом большинства пищевых продуктов, но и оказывает предопределяющее влияние на многие качественные характеристики. Вода, являясь основным компонентом в пищевых продуктах, может находиться в самых разнообразных формах связи. При этом энергия связи имеет решающее значение. Связь влаги осуществляется межмолекулярными силами (Ван-дер-Ваальсовы силы), которые обусловлены тремя эффектами: ориентационным (электростатическим), преобладает в веществе с полярными молекулами; индукционным (деформационным), преобладает в веществе с квазиупругими диполями; дисперсионным, когда молекула поляризуется в поле соседней молекулы. Особым видом межмолекуляриого заимодействия является водородная связь. Она проявляется между ковалентно связанным атомом водорода и электроотрицательными атомами (кислород, фтор, азот), которые принадлежат к той же или другой молекуле. В процессе удаления влаги нарушается ее связь с телом, на что затрачивается определенная энергия. По величине и энергии связи различает в общем виде четыре формы связи влаги с телами (в порядке убывающей связи): химически связанная, адсорбционно-связанная, осмотически связанная, капиллярно-связанная. Химически связанная влага представляет воду гидрата, связанную в виде гидроксильных ионов, и конструкционную воду кристаллогидратов, связанную значительно слабее. Химическое связывание влаги в строго определенных молекулярных соотношениях происходит при химической реакции (гидратации).При этом вода входит в состав новообразованного вещества. При кристаллизации из раствора вода входит в структуру кристалла целыми молекулами. Адсорбционно-связанная влага обусловлена взаимодействием молекул, адсорбента и молекул воды. Большую часть адсорбционно-связанной влаги в животных тканях мясопродуктов составляет влага, которая образует сольватную оболочку молекул белковых веществ и гидрофильных коллоидов. Часть адсорбционной влаги входит в состав сольватных оболочек гидрофобных коллоидов. Осмотически связанная влага является свободной в том смысле, что ей соответствует весьма малая энергия связи. Влага поглощается без выделения тепла и сжатия системы. Осмотически связанная влага диффундирует внутри тела в виде жидкости через стенки клеток благодаря разности концентрации внутри и вне клеток. К капиллярно-связанной относится влага макрокапилляров. Эта часть воды находится в капиллярах. Капиллярная влага перемещается в теле, как в виде жидкости, так и в виде пара. Различают два состояния капиллярной влаги: стыковое состояние, когда влага разобщена в виде манжеток (защемленная вода), и канатное состояние, когда клинья жидкости соединены между собой (защепленный воздух), образуя непрерывную жидкую пленку, обволакивающую дисперсные частицы тела. Таким образом, роль воды необычайно важна и многообразна, и именно она во многом предопределяет состояние мяса и мясопродуктов в процессах переработки и хранения.
|
|
|
99 Сырье и материалы, используемые в производстве мясных полуфабрикатов Основным сырьем для выработки мясных полуфабрикатов являются: мясо всех видов скота и птицы, животные и растительные жиры, яйца и яйцепродукты, мука, приправы, овощи и др. Мясо используют мясо животных в тушах, полутушах или четвертинах, мясо птицы и кроликов в тушках. Мясо должно быть доброкачественным, от здоровых животных, признанных пригодными на пищевые цели. Среди мяса наиболее удельный вес занимает говядина и свинина. Говяжье мясо темно-красного цвета, с малиновым оттенком, интенсивность окраски зависит от пола и возраста животного. Для говядины характерны ярко выраженная мраморность, наличие прослоек жировой ткани на поперечном срезе мышц хорошо упитанных животных, имеет плотную консистенцию, соединительная ткань грубая, трудноразвариваемая. Жировая ткань светло-желтого цвета, крошливой консистенции. Сырое мясо обладает специфическим запахом, вареное мясо – приятным, ярко выраженным и вкусом и запахом. Свиное мясо розово-красного цвета. Соединительная ткань легко разваривается. Для свинины характерна нежная консистенция, поверхность поперечного разреза тонко- и густозернистая. Жировая ткань белого цвета, с розоватым оттенком, почти без запаха. Кроме свинины и говядины в некоторых регионах применяют козлятину, баранину, конину, мясо буйволов, яков, оленей и птицы. Субпродукты. Субпродукты по пищевой ценности подразделяют на две категории. К субпродуктам 1 категории относятся языки, печень, почки, мозги, сердце, диафрагма, мясокостные хвосты говяжьи и бараньи. К субпродуктам 2 категории относятся мясная обрезь, головы без языков и мозгов, легкие, мясо пищевода, калтыки, селезенка, вымя говяжье, ноги свиные и говяжьи, уши, желудки свиные, сычуги, трахеи говяжьи и свиные. Жировое сырье. В качестве жиросодержащего сырья используют шпик, свиную грудинку, жир-сырец говяжий, свиной и баранины, пищевые топленые жиры, масло коровье и маргарин. Основную часть этого сырья составляют жиры – смесь сложных эфиров глицерина и жирных кислот. В зависимости от температуры плавления жиры бывают твердые (говяжий, бараний) и мазеобразные (свиной). Температура плавления и консистенция жиров зависят от качественного и состава жирных кислот: чем больше насыщенных жирных кислот и выше их молекулярная масса, тем выше температура плавления жира. В жировом сырье присутствуют так же липазы и жирорастворимые витамины A, D, E и К. В наибольшем количестве используется шпик – это свиной подкожный жир со шкуркой или без нее. Минимальная толщина шпика 1,5 см. поверхность шпика должна быть чистой, без щетины, без кровоподтеков, пятен и загрязнений. На разрезе шпик белого цвета или с розоватым оттенком. Шпик подразделяют на хребтовый и боковой. Хребтовый снимают с хребтовой части свиных туш вдоль всей длины, с верхней части лопаток и окороков. В нем нет мясных прослоек, его используют в основном для изготовления колбас высших сортов. Боковой шпик более мягкий, его срезают с боковых частей туши и грудины. В боковом шпике имеются прослойки мышечной ткани, придающие ему приятный вкус и аромат. Боковой шпик используют при производстве колбас 1 и 2 сортов. Яйцо и яичные продукты (меланж, желток и белок яйца, яичный порошок) используют в колбасном производстве в основном с целью улучшения функционально-технологических свойств мясных систем и в меньшей степени – для повышения пищевой и биологической ценности изделий. Белок яйца обладает высокой растворимостью, пено- и гелеобразующими свойствами, имеет хорошие адгезионные характеристики, повышает стабильность и вязкость эмульсий. Молочные продукты. Молочные продукты используют как в свежем виде (цельное молоко, сливки), так и в концентрированном виде (сухое молоко, сухие сливки) для оптимизации функциональных характеристик (водосвязывающей способности; эмульгирования; улучшения прочностных характеристик) и для повышения пищевой и биологической ценности готовых изделий. Пшеничная мука и крахмалы относятся к функционально-технологическим наполнителям. Они обладают водосвязывающей способностью, которая проявляется после термообработки в результате процесса клейстеризации. Наиболее эффективно применение муки и крахмала в технологии низкосортных колбас, содержащих значительное количество соединительной ткани. В этом случае наполнители будут связывать свободную (избыточную) влагу, выделяющуюся после нагрева в желе.
Жиры, входящие в состав мяса, жиросырья, различных мясопродуктов, подвергаются биохимическим и химическим изменениям в процессе технологической обработки и хранения. Гидролитическое расщепление. Процесс гидролиза жира приводит к накоплению свободных жирных кислот. Сложные эфирные связи разрушаются ступенчато с постепенным образованием ди- и моиоглицеридов. Полного расщепления молекул в обычных условиях ие происходит. При гидролизе фосфолипидов наряду с указанными веществами образуются фосфорная кислота и амииоспирт. Гидролитический распад липидов в тканях катализируется липолитическими ферментами, и его скорость зависит от степени контакта липидов с водой, величины рН, температуры. Хотя оптимальная температура для действия липазы 35—40 °С, этот фермент обнаруживает активность и в условиях низких температур. Наряду с действием тканевых липаз гидролиз липидов мо жет быть обусловлен липолитическими ферментами, продуцируемыми микроорганизмами. Инактивация ферментов и уд. леиие влаги в процессе выделения жиров делают их устойчивыми к гидролитическому распаду. Накопление свободных высокомолекулярных жирных кис лот ие приводит к изменению органолептических показателей, однако может повлиять иа развитие окислительных процессов. Окисление. В отличие от гидролиза, окислительные изменения жиров влияют иа пищевую ценность продукта. В зависимости от уровня и характера развития процесса окислительные превращения могут сопровождаться понижением биологической ценности продукта благодаря снижению содержания полинена сыщеиных жирных кислот и жирорастворимых витаминов, ми грации двойных связей, ухудшением органолептических пою зателей. Окисление жиров, входящих в состав мясопродукте; способствует разрушению витаминов группы В. Продукты окисления жиров при взаимодействии с белками могут образовывать комплексы, устойчивые к гидролизу протеолитичесьими ферментами. В результате окисления жиров могут возникать вещества, обладающие токсическим и канцерогенным действием. Указанные обстоятельства предопределяют значение технологических процессов обработки, направленных иа торможение развития окислительных процессов при производстве и хранении продуктов. Цепные реакции характеризуются разрывом ковалентных связей, в результате чего образуются промежуточные продукты с высокой реакционной способностью — радикалы. Их высокая химическая активность обусловлена содержанием неспареииых электронов иа внешних атомных или молекулярных орбитах. Свободные радикалы возникают в результате фотохимических реакций под действием тепла, ионизирующего излучения, элек грического разряда. Реакции органических соединений с кислородом протекают по типу медленных разветвленных цепных, или, как их называют, вырожденно-разветвленных реакций, в которых активными компонентами, приводящими к разветвлению цепи, служат не атомы или свободные радикалы, а промежуточные молекулярные продукты. Молекула кислорода содержит два неспаренных электрона и рассматривается как бирадикал с низкой реакционной способностью. При наличии в системе свободного радикала, возникшего на стадии зарождения цепной реакции, кислород активно с ним взаимодействует, что приводит к образованию пероксидного радикала. Его превращение в гидропероксид за счет атома водорода исходного вещества сопровождается появлением нового радикала, т. е. продолжением цепи. Гидропероксид является первым кинетически стабильным продуктом реакции. Он служит инициатором развития последующих стадий цепной реакции. Распад гидро-пероксида сопровождается образованием двух активных частиц, что приводит к разветвлению цепи. Обрыв цепи возникает вследствие рекомбинации свободных радикалов, которая приводит к появлению неактивных продуктов. При окислении насыщенных кислот и их глицеридов в реакцию окисления в первую очередь вступают метиленовые группы, находящиеся рядом с 113,114 Влияние технологических факторов на структурно-механические свойства колбасного фарша Механическое воздействие. При посоле с применением шприцевания процесс распределения посолочных веществ протекает в две фазы, из которых первой является шприцевание, второй -последующая обработка прошприцованного продукта. Выдержка продукта в рассоле или вне его является экстенсивным методом посола. Существенное ускорение второй фазы происходит при использовании интенсивных методов механических воздействий, когда проявляется эффект губки. Возникающий при переменном механическом воздействии градиент давлений (напряжений) вызывает в прошприцованиом мясе интенсивное перемещение посолочных веществ, происходящее по фильтрационному закону. При небольшом определяющем размере мяса (в пределах 20—30 мм) накопление в нем (впитывание) рассола и равномерное распределение посолочных веществ могут происходить даже в результате механического воздействия без предварительного шприцевания. Наиболее распространенными методами механической обработки являются тумблирование, массирование, вибрация (часто с применением вакуума), электромассирование. Под тумблирование м понимают процесс обработки продукта в тумблерах-емкостях (в большинстве случаев цилиндрических) с горизонтальной осью вращения, имеющих выступы (лопасти) на внутренней их поверхности. При вращении емкости куски мяса трутся друг о друга, внутреннюю поверхность и выступы, участвуя в сложном планетарном движении. Достигнув верхней точки, они падают с высоты, равной диаметру емкости. В результате соударений сырье подвергается механическим деформациям, приводящим к повышению давления (напряжения) в местах контакта. Наблюдаемый эффект сжатия-расширения мышечной ткани, сопровождающийся возникновением переменных внутренних напряжений, обеспечивает интенсивный фильтрационный перенос (перераспределение) рассола. Продолжительность тумблирования может быть различной в зависимости от вида, состояния мяса, конструктивных особенностей тумблера. В большинстве случаев для кусков мяса небольших размеров (25- 30 мм) она составляет 10—40 мин, для образцов больших размеров в циклическом варианте доходит до 4—6 ч. Массирование является разновидностью процесса перемешивания, вследствие чего при отсутствии специального оборудования (массажеров) для массирования иногда применяют лопастные мешалки. Массажер представляет собой емкость, в которую после ее заполнения мясом опускается вертикальный вал с лопастями. Обработка в массажерах протекает менее интенсивно, чем в тумблерах, поскольку отсутствуют ударные воздействия. Поэтому продолжительность массирования значительно больше, чем тумблирования. Рассол можно вводить либо полностью шприцеванием, либо при значительных количествах добавляемого рассола (выше 20% к массе мяса) частично шприцеванием, а частично (5—7% к массе мяса) в массажер (тумблер). Обработку в массажерах (тумблерах) выполняют непрерывно или циклически. В период механических воздействий происходит фильтрационно-диффузи-оипый перенос посолочных веществ, в период покоя — диффузионный. Эффект массопереноса при массировании (тумблировании) дополнительно усиливается в связи с возникновением при механических воздействиях микроразрывов в ткани и повышением ее проницаемости. При массировании скорость переноса многократно возрастает и становится выше скорости развития микробиологических процессов, что открывает широкие возможности для быстрого посола при повышенных температурах без опасения, что в этих условиях может возникнуть бактериальная порча соленых продуктов. Это обстоятельство особенно важно, если учесть, что повышение температуры одновременно интенсифицирует ферментативные процессы, обеспечивая тем самым более быстрое достижение необходимой консистенции, вкуса и аромата соленых мясопродуктов. мясе зависит от величины рН сырья: оно выше при более высоком рН. Мясо PSE (рН ниже 5,6) и после посола имеет пониженную влагосвязывающую способность. В случае недостаточной водосвязывающей способности мяса вводят компоненты, повышающие ее. Наибольшее распространение получили фосфаты, чаще соли пирофосфорной кислоты. Рекомендуется добавлять 0,3% фосфатов к массе мяса. Хлорид натрия, взаимодействуя с мышечными белками, по вышает количество адсорбционно-связанной влаги в результате увеличения заряда белка. Хлорид натрия, накапливающийся в мясе в результате посола (2—3% к массе), способствует созданию концентрации тканевой жидкости, близкой к растворяющей белки актомнозиновой фракции. Количество адсорбционно-связанной влаги тем больше, чем быстрее достигается контакт посолочных вешеств с белками: для мяса, посоленного через кровеносную систему, а также при струйном инъецировании оно выше, чем при инъекции рассола уколами. Механическая обработка прошпрнцованного рассолом мяса и виброперемешивание вызывают повышение влагосвязывающей способности в связи с разрыхлением сырья и увеличением поверхностей контакта рассола с белковой системой. Изменение массы. Накапливание посолочных веществ и веществ, являющихся составной частью многокомпонентного рассола, возможная потеря веществ, входящих в состав мяса, изменение его влажности вызывают соответствующие изменения массы соленого продукта, его выхода. Масса соленого продукта варьирует в широких пределах в зависимости от способа посола, группы изделия (вареные, сырокопченые и др.), сырья (из свинины, говядины и т. п.), вида продукта (корейка, окорок и т. п.). Изменение белков, липидов и других веществ. В присутствии хлорида натрия изменяется состояние белковых веществ. Характер изменения зависит от концентрации соли в тканях. При мокром посоле, если концентрация соли выше растворяющей, около 75% белков переходит в нерастворимое состояние. В результате непрекращающейся деятельности тканевых ферментов н ферментов, выделяемых микроорганизмами, некоторое количество белковых веществ мяса подвергается гидролитическому распаду. Таким образом, при посоле количество белковых веществ снижается не только в результате перехода в рассол, но н вследствие их распада. Уровень распада зависит от времени выдержки в посоле: через 10 сут в системе рассол — мясо при посоле мелких кусков гидрализуется около 8% белков, через 25 сут — около 11%. Соответственно уменьшению количества белкового азота возрастает количество азота полипептидов и низкомолекулярных азотистых соединений. Из числа низкомолекулярных азотистых соединений большая часть приходится на долю свободных аминокислот. Характер изменения количественных соотношений свободных аминокислот в рассоле и мясе свидетельствует о том, что в ходе посола происходит не только их дезаминирование и декарбоксилированне, но и переаминирование. Изменение количества свободных аминокислот в соленом мясе показывает замедленное их накопление в сравнении с несоленым мясом, что связано со снижением активности протеолитических ферментов в присутствии соли. Струйное инъецирование в сочетании с массированием вызывает повышение эффекта действия тканевых ферментов мяса. Это связано с повреждением ткани на клеточном уровне (нарушение целостное!'»! лнпопротеидных мембран, лизосом), выходом ферментов из мест локализации. При сочетании механических и биохимических воздействий (введение ферментных н микробиологических препаратов) наблюдается наибольшее накопление свободных аминокислот. Качественный состав образующихся аминокислот мало зависит от вида подвергаемого посолу мяса (свинина, говядина, конина, баранина и др.). Однако суммарное их содержание находится в определенной зависимости от вида мяса. Так, в идентичных условиях посола в свинине свободных аминокислот накапливается примерно на 28% больше, чем в конине. Некоторые свободные аминокислоты (например, глютамиповая кислота) обладают определенным вкусом даже в разбавленных |
При производстве используют вспомогательные материалы, такие как пищевые кислоты и посолочные ингредиенты, пряности, приправы, овощи и корнеплоды, а также бактериальные и коптильные препараты. Из пищевых кислот используют уксусную, лимонную и аскорбиновую кислоты. Они способствуют улучшению вкуса и аромата продукта, кроме того аскорбиновую кислоту или ее натриевую соль используют в колбасном производстве для ускорения образования окраски мясопродуктов, улучшения внешнего вида и устойчивости цвета при хранении колбас. Аскорбиновую кислоту или ее соль вводят в количестве 0,03% от массы сырья в виде 3% водного раствора. Лучший эффект окраски достигается при совместном применении аскорбиновой кислоты, ее соли и препарата гемоглобина. Поваренная соль (хлорид натрия) – применяется как вкусоформирующее вещество, ингибирует окисление жиров, обладает бактериостатическим действием к микрофлоре, является белокрастворяющим реагентом по отношению к миофибриллярным белкам, что имеет важнейшее значение в процессе производства мясных эмульсий. Сахар – применяют для улучшения вкуса (смягчения солености) мясных изделий, как синергист окислительно-восстановительных реакций в процессе цветообразования мяса, а также в качестве питательной среды молочно-кислой микрофлоры в технологиях мясных изделий с длительным циклом посола и созревания. Нитрит натрия. Представляет собой мелкокристаллический порошок белого или слегка желтого цвета. В колбасном производстве применяют только химически чистый нитрит натрия в виде раствора концентрацией не более 2,5% в строго регламентированных дозах в соответствии с требованиями нормативно-технической документации, так как это ядовитое вещество. Нитрит натрия выполняет роль консерванта и формирует цвет и аромат мясных изделий, но наряду с полезными свойствами, нитрит натрия, при копчении колбасных изделий, взаимодействует с содержащимися в коптильном дыме оксидами азота с образованием N-нитрозаминов. Нитрозамины обладают высокой токсичностью по отношению к печени и почкам. Наиболее токсичным является диметилнитрозамин. Приправы. К приправам относят ингредиенты, добавляемые в мясные продукты с целью улучшения или модификации вкуса и аромата готовых изделий. К приправам относятся: - стандартные специи и пряности (черный, белый, красный, душистый перец, гвоздика, мускатный орех, кардамон, корица, лавровый лист, тмин, чеснок, лук и т.д.); - травы, корнеплоды, овощи (укроп, майоран, петрушка, сельдерей, пастернак, картофель, томаты, паприка, огурцы, морковь, горох, фасоль и т.п.); - подсластители и усилители вкуса (патока, глутаминат натрия).
карбоксильной группой или сложно-эфирной связью. Скорость окисления ненасыщенных жирных кислот с уве личением количества двойных связей в молекуле возрастает. При прочих равных условиях интенсивность развития окислительных процессов зависит от жириокислотиого состава, наличия ингибиторов и катализаторов процесса. Устойчивость жиров характеризуется индукционным периодом, в пределах которого ие обнаруживается присутствие продуктов окисления. Последующий контакт жира с кислородом приводит к образованию гидронероксидов, а затем и вторичных продуктов окисления. На скорость окислительной порчи жиров влияют свет,- особенно в ультрафиолетовой области, температура, давление кислорода, металлы переменной валентности — железо, медь и др. Сильными катализаторами окисления являются миоглобин и гемоглобин. При высоком содержании катионов железа их взаимодействие со свободными радикалами приводит к обрыву цепи. Скорость окислительных процессов может повышаться благодаря действию ферментов микроорганизмов. Принимая во внимание негативные последствия окисления жиров для качества продукции, важным вопросом является торможение развития процесса, которое достигается понижением температур, уменьшением концентрации кислорода, защитой от действия света. Эффективным способом предотвращения порчи выделенного жира и липидиой фракции мясопродуктов является применение ингибиторов окисления и вакуумирование. Торможение окислительных изменений жира при одновременном повышении биологической ценности продуктов можно достигнуть, вводя в них каротин, витамины А, Е. Увеличение стабильности липидов достигается при обработке мясопродуктов коптильными веществами, содержащими фенолы. Положительно влияют иа устойчивость жиров некоторые пряности, в состав которых входят аитиоксидаиты. Иигибирующий эффект обнаруживают молочные и соевые белковые концентраты, используемые при производстве комбинированных продуктов.
Вибрационное воздействие используют самостоятельно или в сочетании с другими видами механической обработки.Положительный эффект массопереноса, получаемый в результате перемешивания сырья, дополняется эффектом, достигаемым при одновременно выполняемом вибрационном воздействии. Сущность процесса виброперемешивания заключается в том, что частицы мяса, непосредственно соприкасающиеся с источником колебаний, периодически получают ударный импульс, который передается болееотдаленным соседним слоям. Таким образом, в системе возникают механические колебания частиц, вызывающие их фильтрацию под действием градиента знакопеременных напряжений. Применение вакуума увеличивает эффект, достигаемый при механической обработке сырья. Он возрастает с уменьшением остаточного давления (примерно до 50 кПа — метод МТИММПа). Дальнейшее снижение остаточного давления не оказывает существенного влияния. Повышение интенсивности распределения посолочных веществ (до 7%) связано с суммированием полей давлений, возникающих при механическом и ва: куумном воздействиях. Электромассирование мяса в парном состоянии — метод заключающийся в воздействии электрических импульсов на предварительно инъецированное мясо в парном состоянии. Возникающие периодические сокращения и расслабления парных мышц (пульсации) влияют на процесс перераспределения посолочных веществ так же, как при механическом воздействии. Сокращение длительности периода после убоя и повышение величины напряжения тока увеличивают продолжительность достаточно сильных пульсаций и эффективность электромассирования. Посолочные вещества в основном перераспределяются во время электромассирования. При дальнейшей выдержке в посоле перенос идет медленнодиффузионно, но несколько быстрее, чем в мясе, не подвергнутом электромассировапию. Потери растворимых веществ мяса. Наряду с проникновением в продукт посолочных веществ в процессе мокрого, смешанного и сухого посола в рассол из мяса диффузионно переходят белковые, экстрактивные, минеральные вещества, витамины. Количество потерь зависит от условий посола (концентрации рассола, жидкостного коэффициента, продолжительности посола и др.). Потери увеличиваются с повышением концентрации рассола до 10—12%, а затем уменьшаются. Количество белкового азота в рассоле возрастает с повышением температуры до 40 °С, после чего снижается (в связи с денатурацией белков в тканях). Белковые вещества неспособны диффундировать через стенки клеток, поэтому их потери с рассолом обусловлены переходом в него белков, заполняющих кровеносную систему, и белков разрушенных клеток. В связи с этим величина белковых потерь при посоле зависит от полноты обескровливания мяса и степени разрушения тканей. При правильно проведенном посоле некоторая потеря питательных веществ не снижает пищевой ценности соленых продуктов. Изменение влажности и влагосвязывающей способности. При посоле одновременно с перераспределением посолочных веществ перераспределяется-вода, что сопровождается изменением влажности и влагосвязываюшей способности соленого мяса. Эти изменения имеют важное технологическое значение, так как влияют как на количество (выход), так и качество (сочность, консистенцию, цвет, вкус, аромат) готовых колбасных изделий и соленых мясопродуктов. Влагопроводность так же, как и проницаемость, для посолочных веществ неодинакова для различного сырья и зависит от метода посола. Влагосвязывающая способность мяса перед посолом определяется его морфологическим и химическим составом, исходными свойствами с учетом рН (PSE, N, DFD), степенью автолиза, видом холодильной обработки, режимом и характером предварительной механической обработки, фермептирования, электростимуляции и др. В процессе посола изменяются все формы связи воды с мясом: адсорбционная, осмотическая, капиллярная. Наибольший интерес представляют изменения адсорбционной формы связи воды с белками, поскольку она является наиболее прочной. Количество адсорбционно-связанной влаги в соленом растворах. Однако аминокислоты прямо не влияют па аромат мяса. Изменения липидной фракции мышечной ткани носят преимущественно гидролитический характер. В ходе гидролиза липидов накапливаются свободные жирные кислоты, в том числе нелетучие. В результате сложных химических изменений низкомолекулярных азотистых и безазотистых веществ в мясе и рассоле накапливаются многочисленные летучие соединения, среди которых много летучих жирных кислот, азотистых и карбонильных соединений. К последним относят альдегиды, кетопы, альдегидо-N кетокислоты. Очевидно также и влияние нитрита натрия — в его присутствии специфический оттенок аромата и вкуса усиливается. Роль процессов, протекающих в период посола, несомненна: специфические аромат и вкус соленых изделий появляются уже на стадии посола, усиливаются при увеличении длительности посола и проявляются особенно сильно после тепловой обработки. В связи с такой закономерностью при ускоренных способах посола возрастает роль и значение вкусовых веществ и ароматизаторов, которые необходимо вводить в состав посолочных веществ для получения колбас и соленых продуктов с хорошими вкусо-ароматическими показателями. Изменение микроструктуры. Несмотря на отчетливо выраженный распад белковых веществ при мокром и смешанном посолах охлажденного мяса, заметного разрушения мышечных волокон не происходит. Тем не менее соленое мясо размягчается и нем больше, чем больше длительность посола. Наблюдается уменьшение межволоконных пространств. Диаметр мышечных волокон иа вторые сутки посола сокращается, но после 4—5 сут начинает возрастать, к концу процесса достигая величины, превышающей начальную. При игольчатом шприцевании вводимый рассол распределяется преимущественно в соединительнотканных прослойках и между мышечными волокнами, раздвигая их. Структура тканей при этом становится менее прочной. При струйном способе инъекции рассол проникает не только в соединительнотканные прослойки, но и непосредственно в мышечные волокна, наблюдается сильное их набухание, гомогенизация структур. Внутрь волокна при струйном методе проникают не только минеральные вещества, но и молекулы более значительных размеров. Посол в условиях механических воздействий на прошприцованное мясо сопровождается фрагментацией мышечных волокон. Электронно-микроскопические исследования охлажденной свиной мышечной ткани, посоленной в условиях механических воздействий, показывают, что в результате таких воздействий происходит разрыхление миофибрнллярных структур, сближение миофибрилл друг с другом, набухание миофибриллярной субстанции. Одновременно происходит деструкция актомпозиновых протофибрилл. При этом преобладает образование крупных обломков миофибрилл, а сарколемма имеет локальные нарушения. Массирование значительно усиливает липкость мяса (образование па поверхности кусков мяса липкого слоя, содержащего водосолерастворимые белки и служащего связующим материалом между кусками мышечной ткани при последующей тепловой обработке).
|
|
|
13 Вектор и ферменты исполь-е в техно-и рекомбина-х ДНК. Особе-ти трансформации про-и эукариотических клеток. Генная инженерия целенапрправленная перегонка генома живого организма. Для того что бы трансформировать геном используются прямые методы трансформации (когда ген переносится непосредственно в клетку)и векторные методы (rulf чужеродный ген переносится в клетку в составен специального вектора). Вектор-молекулы переносчики в которые встраивают чужеродные гены, группы:1 вектогоры на основе плазмид.Плазмиды –это саморегулируещиеся молекулы ДНК, они отвечают за выживание в чужих условиях. Для того что бы в плазмиду встроить чужеродный ген, ее предварительно разрезают с попмощью фер-та по типу ножниц. В место разреза встраивают чужер.фер-т ДНК-лигаза. Далее плазмиду вносят в клетки и уже там чужер ген действует как свой собственный, накапливаются продукты этого гена(инсулин чело-ка).2 Вирусные векторы – созданы на основе вирусов, бактерий… Вирусы удобнее использовать в качестве вектора т.к. ими используют природный механизм проникновегния в клетку. Для того чтобы встроить чужеродный ген у него иудаляют часть собственных генов при помощи фер-та рестриказ и вместо удаленной части встраивают чужеродн гены. Именно поэтому векторы на основе вирусов наз-т векторы замещения, на основе плазмид- векторы вставки. Создаются трансгенные растения |
27 приминение м/о для получения биотоплива. Совр. Энергетика яв-ся топливной .около 98% производимой в мире и потребляемой энергии дают уголь,нефть, природ. Газ, и только 2% - атомная и гидро энергетика. Постоянно растущие темпы добычи и расхода ископаемых органич. Топлив приводят с одной стороны к резкому сокращению их запасов и с др. стороны к тепловому и углекислотному загрязнению биосферы в следствии выведения в атмосферу дополнительных количеств тепла и СО2угл. Газа. С проблемами совр. Энергетики тесно связано решение задач по охр. Окр. Среды. Необходимо разработать научные методы и технол. Получения энергии при одновременном сокращении выбросов в атмосферу. Получение биогаза- это сложный бактериальный процесс протекающий в анаиробных условиях. Про-с идет в специи-х аппаратах.- метантенках Технология получ метана: на первой стадии про-са прои-т образование из высокомолекулярных соединений спиртов, альдегидов простых ве-в. Метанногенное брожение прои-т в анаиробных усло-х при тем-ре 55гр. Количе-во образующегося метана зависит от сырья. Сырьем служат органические остатки бытовых отходов . метантенк –это биореактор из железа или битона. Образую-ся в нем газ удаляется через газовый колпак. В биогазе содержатся 50-80% метана. Биогаз подается в газохранилище, а затем в газовую сеть. Для прои-ва биогаза можно исполь-ть иммобилизованные фер-ты или имобилизирующие клетки бактерий, |
|
|
60 сырье и вспом мат. В пр-ве колб изд. Сырье сл-т все виды мяса: гов, свин, птица, с/пр. .жиры, молоко, яйца, крахмал, мука. Сырье испо-т от здопровых животных без признаков микроб порчи прогоркания жира, загрязнен, побитостей, кровоподтеков, клейма должны быть удалены. Туши без запаха в глубине но си поверхнстным ослизнением зачищают промывают гор и холл водой. Шпик до-н быть белого цвета с темпер -1оС в противном случае он будет деформироваться при измельчении. При изготовлении вареных колбас применяют гов и свин впарном, охл, и разморож состояниях и замор виде (блоки). К использованию не допускается мясо хряков. Растит. сырье: коахмал картоф, кукурузный, рисовый в виде клейстера; мука соевая, горох, пшеничная мука, гречневая. Вспомог. Матер: соль, сахар, нитирит натоия в виде р-ра, фосфаты, соли фосфороной к-ты, оптимизируют рН фарша, повышает влагоемкость, эмульгируют жиры, увеличивают гидратацию белков - повышается выход колб. Изд. , глютамат натрия – усиливает аромат и вкус колбас, особенно при использовании замор мяса, увеличиваются сроки хранения продукта, препятствует прогорканию и окислению. Аскорбинат натрия – использ для ускорения образования окраски. Сокращаются сроки обжарки, улучшается внеш вид, более устойчивый цвет при хранении, улучшается вкус и аромат. Специи – перец, мускат орех, кардамон, кориандр, гвоздика, тмин, имбирь, лавров лист, чеснок… Оболочки – натур и искусствен. Должны обладать прочностью, выдерживать большое давление, тепл обработку. Тепловые материалы- опилки, дрова – при сгорании выделяют тепло и идымовые газы с ароматическими в-вами, к-рые обуславливают вкус и запах колб изд. Нельзя употреблять смолистые породы деревьев, березу только без коры. Лучше всего ольха, бук, можжевельник. |
64 Копчение и сушка колб изд. Копчение- пропитывание про-в коптил ве-ми получ-ми в виде коптильн дыма в резу –те неполн сгор древесины. Одновременно с коптил ве-ми протекают и др. про-сы. Копчение обеспечивает устойчивость к действию м/о. ве-ва проника-е в кол-су придают ей своеобра-й острый, но приятный запах и вкус. При горячем копч. 35-50 гр., при запеканиии 70-120 гр происходит сваривание коллагена и частичная денатурация белков. При холо-м копч 18-20гр –развивают ферментативные пор-сы структурообразование. Биохимические изменения . основая масса коптиль-х ве-в накапливается во внешнем слое. В период копчения про-т 2 пр-са 1 обезвоживание 2 насыщение коптильными ве-ми. Эти про-сы зависят от тем-ры структуры фарша, П\К и В/к коптят при теп 35-50 гр, П/К от 12 до 24 ч.в холодном копчении удаляется до 15-20 % влаги. СУШКА. : с/к , сыровялен,(до 30 сут.) в\к п/к. |
|
|
77 влияние предубойных факторов на качество мяса птицы Предубойные факторы можно разделить по времени воздействия на 2 категории: кратковременное и продолжительное. 1Продолжительно воздействуующие факторы возд-ют на птицу постоянно в течение всей жизни, ее генетические и физиологические особенности, рационы, режимы питания, условия содержания и перенесенные болезни. 2Кратковременные факторы влияющие на качество мяса птицы действуют в течение последних 24ч жизни птицы. К ним относят: сбор, предубойная выдержка, отлов, транспортировка, содержание на предприятии. Предубойная выдержка. под кормовым голоданием понимается общий промежуток времени в течение которого птица находится без корма вплоть до ее переработки. Рекомендуемая продолжительность 8-12 ч. Кормовое голодание влияет на выход продукции, безопасность и качество. При отлове и сборе птица может получить травмы и повреждения. Повреждениями явл-ся: кровоподтеки, вывихи, и переломы костей. эти факторы оказывают влияние на выход тушек. Стрессовые ситуации возникают при сборе, влияют на посмертное функциональное cd-во мышц. |
||
|
65 Вкусоароматические добавки и усилит вкуса 1Ароматизаторы:делят на природные(натур ве-ва) синтетические(искусст-е). пищевые ароматич добавки могут сосчтоять из одного вкусоароматического ве-ва или смеси ве-в. Источники получения аром ве-в : эфирные масла, душистые ве-ва, натура-е соки,, сухие концентраты, настои, химич и микробиологич синтез. Напр. Жидкий дым – аромат применяют при про-ве свинокопченостей рыбных консервов, сыров. Пищевые ароматизаторы код Е не пишу. 2 усилители вкуса и аромата- вносят для уселения восстановления вкуса и аромата утраченногот при прои-ве пищ про-та а также для коррекции нежелательных составных частей вкуса и аромаиа(глютамат натрия 3 подсластители и сахарозаменители. подсла-ли-это ве-ва сахарной природы, которые придают пищ. Про-ту сладкий вкус. В наст время выделено более 80 посластит. Испо-т в пищу те люди ко-м рекомендуется ограничевать сахар. Пример: туаматин, моленин, сахарин 4 соленые ве-ва- исполь-ся в диетич-х лечебн целях, соль 5 регуляторы кислотности- испо-т для придания кислого вкуса рН меньше 4,5. Уксусная ки-та получ путем уксусно-кислого брожения, выпускается в виде иссенции.лимонная к-та –полу-т путем лимоннокислого брожения сахаров.
69. Харак-ка послочной смеси, используемой в мясной пром-ти. Посолочные смеси используют в при приготовлении колб изд , деликатесов, продуктов из птицы для ускорения процесса посола и образования вкусоароматических в-в, повышает выход гот продукта. В сотав посолочных смесей входят: соль, нитрит натрия, фосфаты, сахар, вкусоаромат добавки. В состав могут входить эфирные масла, бактериальные препараты для ускорения процесса созревания. В качестве усилителя вкуса можно использовать натрий, аскорбин к-ту, ускорители созревания. Используют в виде порошка , жидкости или р-ра, послочной смеси. Придают продукту опред вкус, запах, аромат, внешний вид, вызывает гибель нежелательной микрофлоры. Обеспечивают продукту хороший срок хранения. Позволяют получить гот продукт с высокими органолептич и стабильными микробиологическими показателями.
81 Технол про-в из мяса птицы в панеровке Значительно более широкий ассортимент п/ф и возможности более рационального использования сырья обеспечивается пр выработке рубленных п/ф напр котлет. Технол схема про-ва рубле-х п/ф из мяса птицы 1Размораживание тушек(темп 5-15 до темп в толще 2-5 гр)2 подготовка потрашенных тушек( опалка, удален пеньков, устранение дефектов, мойка, стекание воды) 3 обвалка neitr вручную или механи-ки) 4 измельчение на волчке диам решетки 2-3 мм) 5 приготовление фаршаА) подготовка компонентов по реце-ре (замачи-е хлеба, очистка овощей, грибов.)—подготовка пряностей В) разморажи-е говя-ны, сви-ны, с/б ; подготовка мяса:зачистка, мойка; обвалка и жиловка; измельченгие 2-3 мм 6 Формование, панирование, фасование, упаковывание в потребит-ю тару, охлаждение( при темп 0-1гр до темп 0-4гр) заморажи-е при темп -18-35 до темп -8гр.; упаковка в транспортную тару.
Панировка либо сухарями либо жидкостью.
82 механип-я сепарация мяса птицы и ее приминение в про-ве про-в Механич сепарация пред-т возможность получения функциональных белков, ко-е могут быть использованы при про-ве разнообр-х про-в перера-ки мяса. Механи-я сепарация мяса птицы широко используется в продуктах глубокой переработки , таких как колбасы, сосиски,Ю рудеты из индейки суповые наборы. Это источник дешового мясного сырья Технол схема: 1 тушкиразделы-т на части разделанные или цельномышечные про-ты подверга-ся обвалке(ручная или механич) 1): механическая сепарация А) механически сепарируемое мясо птицы;эмульгированные про-ты В) костный остаток (исполь-ся в кормах для живо-х) явл-ся отличным ингридиентом изолята белка. Часть механически сепарированного мясча испо-ся при про-ве разнообр колбасных про-в в сочетании с др видами мяса(говядины, сви-ны) использу-ся в про-х детского питания. Механич сепарация закл-ся в размельчении исходгого сырья и последующим отделением кости соеденит ткани сухожилий путем пропускания размельченного сырья через сито под высоким давлением. Сущее-т 2 типа механич-х сепара-в 1 мясо продавлдивается через ячейки перфорированного барабана из внешней камеры при этом костные ткани задерживаются и остаются вне барабана. 2 тип. Мясо продавливается из нутрии перфарированного цилиндра и костный остаток остается внутри этого цилиндра. Это обору-е позволяет выробатывать от 200-1ё0000 кг /ч 87 Техноло-я про-ва п/ф из мяса птицы Сырьем для про-ва п/ф из мяса птицы яв-ся в основном молодая птица –это цыплята, цыпл-бройлеры, утята , реже мясо кури уток. Лучшем сырьем считается охлажденное мясо темп 0-4 гр продол-ть хранения охла-го мяса птицы до разделки не должно превышать 6 сут. . Для приготовления п/ф испо-т не всю тушку, а только ценные куски( окорочка грудную часть) ассортимент: филе куриное с костью , акарачок, набор для бульона, кури-я тушка использу-ся патрашенные тушки. ТЕХНОЛ схема 1 поступление потрашенной птицы 2 дополнительная обра-ка(опаливание, устранение дефектов, обработка, мойка, стикание воды 3 разделка, фасование, упаковывание, замораживание темп -18-35гр. До темп -8. , хранение транспортировка, реализация.
88Понятие и цели сертификации мясной про-и . основные закономерные акты, регулирующие про-с сертификации мясной про-и. Сертифи-я –это единая система контроля объекта сертификации на соответствие требования нормативной документации. К объктам серти-и от-ся: проду-я про-ва системы управления качеством. Серти-я прод-и – это процедура подтверждения соответствия по средством ко-й независимая от изготовителя и потребителя органи-я удостоверяет в письменной форме, что проду-я соответству-т установленным требованиям. Сертифи-я систем качества- это действие третий стороны доказывающеечто обеспечивается необходимая уверенность в том что должным образом идентифицированная система качества соответствует выбранной модели или др нормативным документом определяемым заявителем..центральный орган серти-и управляет системой, проводят надзор за ее деятельностью и может передавать право на проведение серти-и др-м органам, правило и порядок проведения серти-и, нормативные доку-ты на соответствие. Организационная структура системы серти-и пищ про-в включ 5 уровней организаций, осуществляющие работы по серти-и.1 ГС –госстандарт России 2 ЦОС- центральный орган системы- управление продукции с/х про-ва пищевой легкой и химии-й промы-ти. 3 ОС-органы по сертификации проду-и 4 испытательные лаборатории 5 изготовители, исполнители, продавцы
97Стартовые культуры в техноло-и мясопро-в. Стартовая культура – это чистые культуры живых м/о молочно-кислых , пропионово-кислых бактерий. Бактерии должны обладать рядом сво-в: 1 хорошая способность к образованию кислоты 2 гомогенная ферментация 3 устойчивость в процессе всего ферментации и созревания 4снижение кол-ва нитрата 5 образование хорошего аромата 6 антогонизм к гнилостным бактериям Среди молочно-кислых бак.прим.-лактобацилюз - ледикокус;- ацедилактис; -лактис;- стефелаккоки;- некоторые дрожжи Стартовые культуры бывают 1 живые культуры 2 замороженные концентраты 3 сухие преператы Замороженные концентраты хара-ся укороченным временным кислотообразования, но это может привести к проблемам при сушке и цветообразовании. Самые лучшие сухие – хорошо перевозить конечная влажность -6%транспортировать можно в герметичных пакетах. Роль стартовых культур: 1 образование кис-ты за счет сбраживания сахара обр. молоч кис-та –сниж рН актив-ся тканев ферменты, стабилиз. Цветообразование, усто-ть к гнилостным м/о 2 уменьшение ол-ва нитритов 3 цветообразование. При наличии спонтанной микрофлоры может преобразов перекись водорода(на цвет, вкус). С помошью катализа стартовых культур перекись расщипляется 4 образование вкуса и аромата Ингибирование стартовых культур 1 сырье(остатки веет лекарств, антибиотики) 2 М/О антогонисты-заселение дрожжами могут быть фаги – кото-е приводя к гибели м/о 3 технологич про-сы-низкое начальное свободной воды 4 производственные причины-остатки дезонфицирующих сво-в
99 изменение мяса при термообработке Цель тепловов обработки мясопродуктов - доведение продукта до состояния кулинарной готовности. При этом процессе повышается стойкость продукта к микробиальпой порче, и часто тепловую обработку применяют как один из методов коисрвирования. В этом случае прибегают к пастеризации и стерилизации. В результате тепловой обработки мясо приобретает новые характерные вкусовыс и ароматические свойства, плотную консистенцию и обычно лучше усваивается организмом. Изменения свойств продукта, вызываемые нагревом, обусловлены изменением свойств их составных частей и потерями частей продукта в окружающую среду. Мясо и мясопродукты обычно нагревают от 60 до 180 °С. Поэтому в замаль- висимости от условий процесса и конечной температуры нагрева изменения соругие ставных частей и свойств готовых продуктов существенно различаются. Изменение белков Наиболее характерным изменением белков всех тканей при тепловой обработке является тепловая денатурация. При этом изменяются характерные свойства белков - уменьшаются их растворимость, гидратацвя. Белки, денатурированные нагреваяием, легко агрегируют и коагулируют. Скоагулированные белслки уплотняются с выделением воды. Денатурирующее действие тепла на белки мяса существенным образом зависят от условий, в которых происходит нагрев.от температуры нагрева, продолжительности теплового воздействия, присутст вия или отсутствия достаточного количества воды в греющей среде или самом продукте, рН среды, взаимосвязи между белками и другими соединениями и структуре ткани животного При тепловой обработке мышечной ткани очень важное значение имеют изменения миоглобина, отчего зависит окраска мясаПри варке мяса в воде теряются не только вода, но и водорастворимые вещества мяса. Если мясо, предназначенное для варки, погрузить в холодную воду и нагревать, то водорастворимые вещества мяса переходят в окружающую среду. Водорастворимые белки из наружных слоев мяса переходят в воду в количестве до 0,2 % массы мяса, коагулируют, образуя пену, всплывающую на поверхность. В процессе варки из мяса в бульон переходит значительная часть водорастворивiых витамивов, экстрактивных и минеральных веществ. При таком способе варки получаются крепкий мясной бульон и довольно малоценное по вкусовым качествам вареное мясо. При погружении мяса в кипящую воду на него сразу же воздествует высокая температура. Происходит быстрая коагуляция белков поверхностного слоя—”уплотнение” поверхности мяса. Выделение воды, так же как и вкусовых веществ, затрудняется. Этот способ дает более сочное и более вкусное мясо и слабый бульон Изменениизм Изминение липидов При парке мяса жир плавится и значительная часть его переходит в воду. Выплавленный жир всплывает в основном на поверхность бульона, небольшая часть его эмульгируется, что придает мутность бульону. Изменение витаминов Тепловая обработка мяса и мясопродуктов приводит к уменьшению содержания некоторых витаминов в результате их химических изменений, а также потерь в окружающую среду. Изменение содержания витаминов в мясе при нагревании зависит от их устойчивости к тепловому воздействию, а также от условий обработки мяса, главным образом от рН и присугствия кислорода. Тепловая обработка мяса и мясопродуктов даже при умеренных температурах приводит к некоторому снижению их витаминной ценности, а при нагреве выше 100 ос витамины значительно разрушаются (от 40 до 70 %).Из водорастворимых витаминов наименее устойчивЫи витамины В1 и аскорбиновая кислота (вис), из жирорастворимых витаминов—витамин D. Витамин А практически выдерживает температуру до 130 0С. Однако сухой нагрев в контакте с воздухом, например жарение мясопродуктов, сопровождается интенсивным разрушением витамина А и других витаминов, в особенности тех, которые легко окисляются (Е, С).
Образование компонентов вкуса и аромата В создании специфического “букета” вкуса и аромата мяса и различных мясопродуктов участвуют многочисленные вещества. Они появляются в процессе автолиза из белков, липидов, углеводов и других составных частей мяса и в процессе тепловой обработки. В результате нагревания мяса происходят сложные реакции, приводящие к образованию новых продуктов, обладающих вкусовымми и ароматическими свойствами. Эти вещества либо освобождаются из связанного состояния, в котором они находились в мясе, либо появляются в результате преобразования предшественников, либо образуются в результате взаимодействия веществ одного с другим. Решающую роль в образовании вкуса и запаха вареного мяса играют экстрактивные вещества. Тщательно отмытое от растворимых в воде веществ мясо после варки безвкусно и обладает очень слабым запахом. Экстрактианые вещества мяса накапливаются в результате распада высокомолекулярных соединений, и в то же время количество их уменьшается в результате собственного распада под влиянием нагрева. Важную роль в образовании вкуса вареного мяса играют L-глутаминовая кислота и ее натриевая соль.
66. Вещества, регулирующие консистенцию и их применение в мясной пром-ти. Пищевой добавкой яв-ся пищевое или синтезирующее ве-во, кот-е намерено вводится в пищевой продукт в целях придания ему необходимых свойств: органолептических, технологических и не употребляется самостоятельно. Фосфаты используют при различных технологиях производства продуктов как из красного, так и из белого мяса для повышения влагосвязываемости и стабилизации эмульсии. Даже при использовании минимальной дозы функциональных фосфатов можно достигнуть положительного результата. Важнейшие преимущества использования фосфатов: - великолепное удержание влаги внутри продукта путем эффективной диссоциации актомиозина; - ограничение потерь веса при дефростации, термической обработке и хранении продуктов; - сохранение натуральных свойств продукта; - улучшение текстуры продукта, сочность и нежная консистенция; - замедление процессов окисления в период переработки и хранения путем изоляции ионов окисляющих металлов; - снижение потенциальной возможности прогоркания продукта и нежелательных изменений цвета. Фосфаты Целесообразность применения фосфатов при производстве мясопродуктов подтверждена многолетней практикой их использования. Фосфатные соли и их смеси включают в рецептуры посолочных рассолов колбасных и других изделий из мяса с целью повышения его влагоудерживающей способности, связности, увеличения выходов готовой продукции, а также улучшения цвета, вкусо-ароматического букета и консистенции мясных продуктов. Каррагинан Каррагинан представляет собой сложный полисахарид, гидроколлоид, представленный в основном Д-галактозой. Производят его из красных морских водорослей. Каррагинан обладает высокой гелеобразующей и водосвязывающей способностью. Введение каррагинана в мясное сырье осуществляют в сухом (порошкообразном) либо гидратированном (растворенном) виде. При изготовлении эмульгированных мясных изделий (вареные колбасы, сосиски, сардельки) каррагинан вносят в сухом виде на этапе перемешивания или в ходе первой фазы куттерования предварительно посоленного (нежирного) сырья. Пектины - желирующие вещества, выделяемые из фруктов, обладающие высокой водо-связывающей способностью. Количественные пределы использования - до 1,5% к массе сырья. Альгиновая кислота и альгинат натрия - продукты, получаемые из водорослей и применяемые в качестве связующих, гелеобразующих и эмульгирующих веществ. Альгиновая кислота хорошо связывает воду, но сама в воде не растворяется в связи с чем лучше всего её использовать при производстве реструктурированных мясопродуктов. Альгинат натрия - растворимая соль; может применяться в виде водного раствора.
Жиры – сложные эфиры, глицерины жирных кислот.(по количеству жирных кислот делят на низкомолекулярные и высокомолекулярные).
|
67 ве-ва способству-е увелич. Срока годности мясных про-в Консерванты-это ве-ва увеличи-е сроки хранения пищ про-в и защищают от порчи вызванной м/о. они до-ны обеспечивать длительное хранение продуктов, не оказывать отрицательного влияния на его органолептич сво-ва. Эффективность консервантов зависит от рН и концентрации кислоты при консервировании мясопродуктов, нитрит натрия, кальция- в качестве антимикробных средств в мясной промы-ти. В колб про-ве нитрит натрия доба-т в коли-ве не более 50 мг на 1 кг гот изд. Наиболее используемые косеванты: повар соль, ‘nk спирт, уксусная ки-та, сернистая ки-та, углекисл газ, сахар конценр-и не более 55 %, эфирные масла. Консерванты делят на собственные- ве-ва обладающие консервир-ми дейст-ми – нитриты, нитраты, лизин-природный антибиотик, кото-й вырабатывае молочно-кис-е бакте-и использу-е для поверхнстной обра-ки про-в. Пищевые имульсии с высоким содержание жироа консервируют солями или смесь соль+кис-та.антиокислители защищают жиры и жиросоде-е про-ты от прогоркания.природные антиокислители это витамины:витамин Е, аскорбат натрия. |
|
|
68 ве-ва ускоряю-е ведение технол. про-в в мясопро-х Технол добавки можно разде-ть на 3 гр. 1 вспомог. Мате-лы- не вступают в химич-е реакции с проду-м и после удаления своих функций уда-ся из него: осветлители , осушители, катализаторы. 2 ускоряющие и облегчающие ведение технол про-в и остающиеся в про-те до его использования(средство капсулирования. 3. Технологические добавки – разрушающиеся в процессе изготовления продукта (разрыхлители). Регуляторы кислотности – в-ва устанваливающие и поддерживающие в пищ прод опред-е значение рН, использование в с/к – они предотвращают развитие нежелательной микрофлоры. При обработке кишок использ-т уксус. Или лимонную к-ту, в кол-ве 2-4 % ; замедляет развитие м/о , устраняют неприятные запахи. Для увеличения сроков хр-ия ямса после убоя скота его поверх-ть обрабатывают раствором смеси6 уксусная-молочная,- лимонная-аскорбиновая к-ты. Полифосфаты – используют в качестве вспрмрг средств при измельчении продукта, улучшает его нарезание, облегчеат переработку морож мяса. Разрыхлители – в-ва, спосбные выделять при опр. Условиях газ (СО2 углексил газ). Охлаждающие и замораживающие агенты - понижают темпер при прямом контакте с ним. Фермнеты и ферментные преапраты – позволяют ускорить технол процесс и увеличиватьвыход гот продуктов,. Ферментные препараты отличаются от ферментов тем, что помимо активного белка содержат балансное в-ва. Ферменты используются в пищев пром-ти – липаза- глюкоизмераза.
|
||
|
78 функциональны сво-ва мышечных белков в проду-х из мяса птицы. Фун-е сво-ва- это физиче-е и химии-е сво-ва белков, ко-е определяют их поведение в пищ прод-х в проце-е пере-ки, хранения и потребления. Фун-е сво-ва белков оказывают влияние на многие показатели качества и органолептические показатели ощущаемые и воспринимаемые потребителем наиболее важные для конечного тпро-та функц суво-ва классифицируются на категории взаимодействия: белок-вода(экстрагируемость, растворимость, влагоуде-я спо-ть, вязкость), белок-жир(имульгирование, жироудерживающая способность), белок-белок(гелеобразование). Степень влажности какого-либо функцион сво-ва может меняться в зависимости от вида про-та, мясного сырья, вида и концентрации не мясных добавок, условий, степени переработки. Мясо птицы соде-т около 20-23% белков. Мышечные белки по их растворимости можно разд на 3 гр: миофибриллярные(актин, миозин), саркоплазматические(гликолитические фе-ты, миоальбумин, миоглобулин, миоглобин), белки стромы (каллаген, эластин, ретикулин) |
||
|
79 Тех-я эмульгированных продуктов из мяса птицы При приготовлении эмульгированных про-в из мяса птицы: мясо, вода, соль, фосфаты и др ингридиенты измельчают до образования пенообразной массы-мясной эмульсии. Мясн. Эму-я пред-т собой сложную систему сос-ю из гедратированных мышечных белков, волокон, жировых клеток, воды, солди, фосфатов и др. компо-в. Эмульгированные(измельче-е) про-ты из мяса птицы такие как сосиски, колбасы, мясн хлеба обычно изготавливают из охл. Или замор. мяса птьицы мех обвалки. Эмулгиро-е про-ты произ-ся путем измельчения мяса механич обвалки в куттере с ледяной водой, солью, щелочными фосфавтами, крахмалом, специями до достиж темпер –р 10гр ( темп выше приводит к перегреву жира, кот-й в проц-се последующей тепловой обработки может привести к технологическим дефектам – жировым отекам. Для получения колб изделий фарш шприцуют под вакуумом в целлюлозную оболочку (сосиски) или водонепрониц вескозную оболочку, Копч. Кол-сы подверг многостадийной, тепловой обработке до полной готовности. Копчен про-та может произво-ся сл спосо-ми:1 через оболочуку при погружении в каптильн жид-ть. 2 распылением жидкого дыма в каптильн камере 3 введением каптильн препарата 4 натуральным дымом, образующимся из опилок твердой древесины. |
||
|
80 техно-я кусковых и реструктурированных про-в из мяса птицы. Технол схема про-ва натура-х п/Ф из мяса птицы 1 размора-е тушек(темп5-15гр, до темп в толще мышц 2-5гр) 2подготовка потрашенных тушек (опалка, удал пеньков, устранение дефектов, технол обработки, мойка и стекание воды) 3 разделка(расчленение тушек) 4обработка поверхности полуьтушек пряностями, приправами или тестом 5фасование 6упаковывание в потреби-ю тару 7 охлаждение(при темп 0-1гр до в толще про-та 0-4гр 8 замораживание(при темп -18-35 гр до темп в толще про-та не выше минус 8гр 9 упаковывание в травнспортную тару РЕСТРУКТИРОВАНИЕ-измельчение про-та, потом склеивание их напр желатином.
89Принцыпы и формы подтверждениям соответ-я Серти-я –это единая система контроля объекта серти-и на соответствие требованиям нормативной документации . орган по серти-и имеет право привлекать на договорной основе для работы в управляющем совете для проведения аттестации про-ва сертифицированной прод-ии и экспертизы результатов испытаний наиболее компетентных в области защиты информации специалистов; устанавливать договорные цены на сертифи-ю прод-ии; принимать участие в проведении испытаний конкретных видов проду-и в заявленной области аккредитации в испытательных центрах(лабораториях) по серти-ии; устанавливать испытательному центру методы испытаний формой протаколов испытанй и др документов: осуществлять надзор за деятельностью испытате-х центров(лаборат) по сертификации конкретных видов прод-и; отказать заявителю сертифи-и прод-и, указав при этом мативы отказа и возможные альтернативные варианты серти-и; Отмен\ять или приостанавливать действие выданных ранее сертиф-в соответ-я и лицензий на применение знака соответствия в случае нарушения изготовителем требований стандартов и иных Норм док. Орган по серти-и обязан: соблюдать в полном объеме все правила и порядок серти-и; выдавать или признавать серти-ты соотве-я на ту прод-ю для кото-й доказано ее соответствие конкретным нормативным документом; в установленные договором с заявителем сроки проводить серти-ю проду-и; своевременно регестрировать сертифицированную проду-ю ; предоставлять в государственные органы по серти-и информацю о своей деятельности. ФОРМЫ ПОДТВЕРЖДЕНИЯ СООТВЕТСТВИЯ 1 обязательное подт-е соответствия а) декларирование соот-я ; декларация о соответ-и; знак обращения на рынке Б) огбязательная серти-я; серти-т соответ-я; знак обращения на рынке 2 добровольное подтверждение соотве-я; добровольн сертиф-я; серти-т соотве-я; знак соответ-я
95Состояние воды в мясе, методы его оценки и спорсобы регуляции при про-ве м/п Водосвязывающая способность определяет свойства мяса на при его технологической обработки и влияет на водоудерживающую способность готовых мясопродуктов, на их качество и выход. Водосвязывающая способность мяса в первую очередь зависит от состояния белков, жиры лишь, в незначительной степени способны удерживать влагу. Основная часть воды мышечной ткани (около 90 %) содержится в волокнах:больше ее находится в составе миофибрилл, меньше—в саркоплазме Водосвязывающая способность мышечйой ткани поэтому в первую очередь ,,зависит от свойств и состояния белков миофибрилл (актина, миозина и актомиозина). В составе соединительной ткани воды меньше, в основном она связана с коллагеном. Формы и прочность связи воды с мясом различны. Существует адсорбционно связанная, осмотически связанная и капиллярно связанная влага. Адсорбционная влага — это часть воды, которая удерживается в мясе за счет сил адсорбции главным образом белками. диполи воды фиксируются гидрофильными центрами белков. Адсорбционная влага — это часть воды, которая находитсяд мясе в наиболее прочно связанном состоянiи. Осмотическая влага удерживается в неразрушенных клетках за счет разности осмотического давления по обе стороны клеточных оболочек (полупроницаемых мембран), и внутриклеточньтх мембран. В межклеточньтх пространствах, так же как и в тканях с неклеточной структурой, роль полупроницаемой перегородки выполняет структура каркаса белковьтх гелей, в ячейках которого удерживается вода. Кроме того, более высокое осмотическое давление и увеличение количества осмотически связанной воды возникают в результате концентрирования ионов электролитов вблизи полярных групп белка. Осмот ическая влага удерживается структурой мяса тем больше, чем больше остаются неразрушенными полупроницаемьте мембраны или структурные образования, выполняющие их роль. Она частично выходит из мяса при погружении его в раствор с более высоким осмотическим давлением (посол), при тепловой денатурации белков. Количество осмотической влаги влияет на упругие свойства тканей. Капиллярная влага заполняет поры и капилляры мяса и фарша. Количество капиллярной влаги зависит от степени развития капиллярной сети в структуре материала. В технологической практике влагу по форме ее связи с мясом часто разделяют на прочно связанную, слабосвязанную полезную и слабосвязанную избыточную. К влаге, прочно связанной с продуктом, относят в основном адсорбционную влагу, влагу микрокапилляров, а также часть осмотической влаги. Слабосвязанная полезная влага размягчает (пластифицирует) продукт, создавал благоприятную консистенцию, способствует усвоению пищи. Слабосвязанная избыточная -влага—это та ее часть, которая может отделяться в процессе технологической обработки в виде бульона при варке колбас, при размораживании—в составе мясного сокаЧем больше прочно связанной влаги, тем меньше испарение. Так, при обжарке колбас Потери за счет испарения могут составлять от 7 до 8 %.
МИКРООРГАНИЗМЫ (микробы), мельчайшие, преимущественно одноклеточные, организмы, видимые только в микроскоп: бактерии, микроскопические грибы и водоросли, простейшие.
АМИНОКИСЛОТЫ, класс органических соединений, содержащих карбоксильные (-COOH) и аминогруппы (-NH2); обладают свойствами и кислот, и оснований. Участвуют в обмене азотистых веществ всех организмов (исходное соединение при биосинтезе гормонов, витаминов, медиаторов, пигментов, пуриновых и пиримидиновых оснований, алкалоидов и др.).(заменимые и незаменимые).
Белок является питательным веществом, которое строит ткань, обеспечивает энергию и состоит из 20 различных аминокислот. Восемь из них, так называемые основные аминокислоты, не синтезируются организмом человека, поэтому должны поступать с пищей. Белок не может храниться в теле и должен поступать ежедневно, причем в достаточных количествах. Белок- сложные высокомолекулярнын соединения, состоящие из аминокислот, связаные полипептидными связями. Белок также играет важную роль в строительстве, восстановлении и поддержании мышечной ткани.
ГЕН (от греч. genos - род, происхождение) (наследственный фактор), единица наследственного материала, ответственная за формирование какого-либо элементарного признака. У высших организмов (эукариот) входит в состав хромосом. Совокупность всех генов организма составляет его генетическую конституцию - генотип. Каждый ген ответствен за синтез определенного белка (фермента или др.). Контролируя их образование, гены управляют всеми химическими реакциями организма и определяют таким образом его признаки.
АНАЭРОБЫ (анаэробные организмы), способны жить в отсутствии атмосферного кислорода; некоторые виды бактерий, дрожжей, простейших, червей.
АЭРОБЫ — микроорганизмы, для жизнедеятельности которых необходим свободный кислород в окружающей среде.
Прокариоты — микроорганизмы, не обладающие истинным ядром. Ядерное вещество у них организовано в виде нуклоидов. Прокариоты — организмы, клетки которых не имеют оформленного, ограниченного мембраной ядра.
Эукариоты — организмы, клетки которых содержат оформленные, ограниченные оболочкой ядра («эукариоты» буквально означает «ядерные»). К эукариотам относятся животные, растения и грибы.
НАСЛЕДСТВЕННОСТЬ, явление передачи потомству материальных факторов, определяющих развитие признаков организма в конкретных условиях среды.
УГЛЕВОДЫ (сахара), обширная группа полигидроксикарбо-нильных соед., входящих в состав всех живых организмов. принято делить на моносахариды , олигосахариды и полисахариды.
Ферменты- высокоактивные соединения белковой природы, являющиеся специфическими катализаторами реакций. Они катализируют химичкеские превращения в клетках животных, растений, микроорганизмов и воздействуют на соответствующие субстраты вне клетки.
Дезоксирибонуклеи́новая кислота́ (ДНК) — один из двух типов нуклеиновых кислот, обеспечивающих хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов.
Молекула РНК (рибонуклеиновая кислота) представляет собой одиночную полинуклеотидную цепь, образованную нуклеотидами.
Клеточная инженерия включает реконструкцию жизнеспособной клетки из отдельных фрагментов разных клеток.
ГЕННАЯ ИНЖЕНЕРИЯ , генетическая инженерия, раздел молекулярной биологии и генетики, занимающийся целенаправленным конструированием новых, несуществующих в природе сочетаний генов с помощью генетич. и биохимич. методов.
Мясо - мышечная ткань, состоящая из поперечнополосатых мышечных волокон.
Автолиз - (от авто … и греч. lysis - разложение, распад), саморастворение тканей и клеток под действием их собственных гидролитических ферментов. Происходит в организме при ряде физиологических процессов (метаморфоз, автотомия и др.), в очагах омертвения, а также при разложении трупов. Автолиз микроорганизмов наблюдается при старении микробной культуры, повреждении клеток различными агентами.
Клетка - это элементарная единица строения, функционирования и воспроизведения живой материи.
Актиномицеты - , порядок бактерий, образующих ветвящиеся клетки, или гифы. К актинимицетам относят собственно актиномицеты, микобактерии, стрептомицеты и др., всего ок. 700 видов. Распространены в почве, водоемах, в воздухе и на растительных остатках; некоторые - паразиты животных, человека (вызывают болезни - актиномикоз, туберкулез, дифтерию и пр.) и растений.
Лигазы (синтетазы) – ферменты, катализирующие присоединение друг к другу двух молекул с использованием энергии высокоэнергетических связей АТФ. |

 ac-оперон
состоит из 3-х генов: Z,
Y,
X
и участка ДНК перед этими генами
(регуляторная зона). Z
– кодирует фермент -галактозидазу,
X
– галактозид-пермеазу, Y
– ацетилтрансферазу. Продукты генов
X,
Y,
Z
участвуют в утилизации лактозы.
Галактозид-пермеаза
транспортирует лактозу внутрь клетки.
Ацетилтрансфераза
превращает лактозу в форму, в которой
она служит субстратом для расщепления
-галактозидазой.
Жакоб и Моно установили, что если
содержание в среде лактозы большое,
то усиливается действие ферментов
lac-оперона.
Это объясняется присутствием общего
регуляторного элемента на уровне
инициации транскрипции. РНКpol
присоединяется к промотору (Р), а
lac-репрессор
к оператору
(О). Транскрипция генов lac-оперона
может идти только в том случае, если
операторная область свободна, т.е. не
занята lac-репрессором.
Иначе РНКpol
не может присоединиться к промотору.
Если лактозы нет: lac-репрессор
присоединён к репрессорной области
и РНКpol
не может занять промотор.
Если лактозы много: lac-
репрессор образует комплекс с ней
(белок – сахар). Он изменяет свою
конформацию и не связывается с
оператором, в результате на промотор
садится РНКpol.
Это негативная регуляция, а индуктором
является лактоза.
ac-оперон
состоит из 3-х генов: Z,
Y,
X
и участка ДНК перед этими генами
(регуляторная зона). Z
– кодирует фермент -галактозидазу,
X
– галактозид-пермеазу, Y
– ацетилтрансферазу. Продукты генов
X,
Y,
Z
участвуют в утилизации лактозы.
Галактозид-пермеаза
транспортирует лактозу внутрь клетки.
Ацетилтрансфераза
превращает лактозу в форму, в которой
она служит субстратом для расщепления
-галактозидазой.
Жакоб и Моно установили, что если
содержание в среде лактозы большое,
то усиливается действие ферментов
lac-оперона.
Это объясняется присутствием общего
регуляторного элемента на уровне
инициации транскрипции. РНКpol
присоединяется к промотору (Р), а
lac-репрессор
к оператору
(О). Транскрипция генов lac-оперона
может идти только в том случае, если
операторная область свободна, т.е. не
занята lac-репрессором.
Иначе РНКpol
не может присоединиться к промотору.
Если лактозы нет: lac-репрессор
присоединён к репрессорной области
и РНКpol
не может занять промотор.
Если лактозы много: lac-
репрессор образует комплекс с ней
(белок – сахар). Он изменяет свою
конформацию и не связывается с
оператором, в результате на промотор
садится РНКpol.
Это негативная регуляция, а индуктором
является лактоза. ыло
обнаружено 5 ферментов, участвующих
в биосинтезе триптофана,
они кодируются 5-ю стр-ми генами, которые
сгруппированы в триптофановый оперон.
Триптофановый
репрессор
присоединяется к оператору когда
триптофана много. Если триптофана
мало: триптофановый репрессор свободен
и не способен присоединяться к
оператору, РНКpol
присоединяется к промотору. Если
триптофана много: идёт блокирование
синтеза ферментов. Триптофан соединяется
с триптофановым репрессором и занимает
оператор.
ыло
обнаружено 5 ферментов, участвующих
в биосинтезе триптофана,
они кодируются 5-ю стр-ми генами, которые
сгруппированы в триптофановый оперон.
Триптофановый
репрессор
присоединяется к оператору когда
триптофана много. Если триптофана
мало: триптофановый репрессор свободен
и не способен присоединяться к
оператору, РНКpol
присоединяется к промотору. Если
триптофана много: идёт блокирование
синтеза ферментов. Триптофан соединяется
с триптофановым репрессором и занимает
оператор.
 Транскрипция
– ключевой фермент – РНКpol.
У прокариот – 1, состоящий из 2
компонентов: 1) min
pol
– кор фермент, 2) сигмасубъединица,
кор фермент, состоящий из 4 субъединиц
(2β и 2β’ содержат по атому Zn).
Эти субъединицы контактируют с ДНК,
содержат каталитические центры. У
эукариот – 3 РНК pol
1) А участвует в синтезе 18s
и 23s
рибосом в ядрышке, 2) B
– участвует в синтезе иРНК, 3) С – в
синтезе тРНК. Состоит из 2 субъединиц.
Большая субъединица выполняет
аналогичные функции β и β’, Кроме того
у эукариот есть РНК pol
участвующая в транскрипции в хлоропластах
и в митохондриях. Ген, кодирующий
митохондриальную РНК pol
находится в ядре. Стадии транскрипции:
1) Связывание с ДНК; 2) Инициация цепи
РНК; 3) Элонгация или рост цепи РНК; 4)
Терминация цепи РНК
Транскрипция
– ключевой фермент – РНКpol.
У прокариот – 1, состоящий из 2
компонентов: 1) min
pol
– кор фермент, 2) сигмасубъединица,
кор фермент, состоящий из 4 субъединиц
(2β и 2β’ содержат по атому Zn).
Эти субъединицы контактируют с ДНК,
содержат каталитические центры. У
эукариот – 3 РНК pol
1) А участвует в синтезе 18s
и 23s
рибосом в ядрышке, 2) B
– участвует в синтезе иРНК, 3) С – в
синтезе тРНК. Состоит из 2 субъединиц.
Большая субъединица выполняет
аналогичные функции β и β’, Кроме того
у эукариот есть РНК pol
участвующая в транскрипции в хлоропластах
и в митохондриях. Ген, кодирующий
митохондриальную РНК pol
находится в ядре. Стадии транскрипции:
1) Связывание с ДНК; 2) Инициация цепи
РНК; 3) Элонгация или рост цепи РНК; 4)
Терминация цепи РНК ля
хар-ки влияние t
на V
польз-ся коэф-том Вант-Гофа, показ-ет
во сколько раз ускор-ся р-ция при
увелич-ии t
на 10оС
(Q10)
Е =0,46Т1Т2lgQ10.
Для ферм-ых реакций Q10
= 1,7; хим: 2-3, физ 1,1. При исслед-нии можно
сказать какой пр-с лежит в основе
р-ции. При повышенных t
начин денат-ция (>80оС),
optim
40-60о,
многие ферм рабо-тают при отрицат t.
Зав-ть активности от рН, зависит от 1.
ля
хар-ки влияние t
на V
польз-ся коэф-том Вант-Гофа, показ-ет
во сколько раз ускор-ся р-ция при
увелич-ии t
на 10оС
(Q10)
Е =0,46Т1Т2lgQ10.
Для ферм-ых реакций Q10
= 1,7; хим: 2-3, физ 1,1. При исслед-нии можно
сказать какой пр-с лежит в основе
р-ции. При повышенных t
начин денат-ция (>80оС),
optim
40-60о,
многие ферм рабо-тают при отрицат t.
Зав-ть активности от рН, зависит от 1. а
поверхности много ионизир-их групп,
рН изменяет их сост-е и заряд белковой
пов-ти. 2. Если S
имеет заряды, то сродство к Е будет
зави-сить от рН. 3. Превращение ES
в EP
происх при опред-ом рН. 4. В некот
ок-восст р-циях Н или ОН непоср-но уч-ют
в р-ц
а
поверхности много ионизир-их групп,
рН изменяет их сост-е и заряд белковой
пов-ти. 2. Если S
имеет заряды, то сродство к Е будет
зави-сить от рН. 3. Превращение ES
в EP
происх при опред-ом рН. 4. В некот
ок-восст р-циях Н или ОН непоср-но уч-ют
в р-ц ии.
5. От рН зависит V
денат-ции и инактивации Е. Зав-ть от
рН измен-ся в присут-ии в среде металлов.
Специфичность
Е катал-ют строго опред-ые в-ва, т.е.
они обладают спец-тью: 1 абсолютная
(только 15) 2. Только к опред-му типу
р-ций. 3 стереохимическая или
пространственная. Механизм
действия Е. При
связ S,
Е вызывает в нем напряжение или
деформирует ее в конформацию переходного
сост-я. Глав-ные условия: 1. Сближение
активного центра (а.ц.)Е с S
2 их правильная ориентация. «индуцированное
соответст-вие» - у многих Е в отсутствии
S
функц-ые группы а.ц. ориентированны
т.о., что optim-го
вз-ия их с комплимен-тарными группами
S
не происходит. Вхождение S
в а.ц. Е вызывает конформац изменение
Е, при кот функц-ые гр Е занимают полож-е
optim
для катал-го пр-са.В ЕS
свобода движения S
огран-ся, возраст упорядаченность,
сниж-ся энтропия, возраст вер-ть
протекания хим р-ции. В ЕS
возникают слабые связи. Кислотно-основной
катализ.
Н им небольш неэкранир-ый заряд, и
легко поляризует др. функц гр. При
общем кисл-осне катализе слабая к-та
индуцирует поляризацию путем связывания
Н, действуя как протон. Роль общего
кисл-осн кат-за закл в подготовке
реагирующих
ии.
5. От рН зависит V
денат-ции и инактивации Е. Зав-ть от
рН измен-ся в присут-ии в среде металлов.
Специфичность
Е катал-ют строго опред-ые в-ва, т.е.
они обладают спец-тью: 1 абсолютная
(только 15) 2. Только к опред-му типу
р-ций. 3 стереохимическая или
пространственная. Механизм
действия Е. При
связ S,
Е вызывает в нем напряжение или
деформирует ее в конформацию переходного
сост-я. Глав-ные условия: 1. Сближение
активного центра (а.ц.)Е с S
2 их правильная ориентация. «индуцированное
соответст-вие» - у многих Е в отсутствии
S
функц-ые группы а.ц. ориентированны
т.о., что optim-го
вз-ия их с комплимен-тарными группами
S
не происходит. Вхождение S
в а.ц. Е вызывает конформац изменение
Е, при кот функц-ые гр Е занимают полож-е
optim
для катал-го пр-са.В ЕS
свобода движения S
огран-ся, возраст упорядаченность,
сниж-ся энтропия, возраст вер-ть
протекания хим р-ции. В ЕS
возникают слабые связи. Кислотно-основной
катализ.
Н им небольш неэкранир-ый заряд, и
легко поляризует др. функц гр. При
общем кисл-осне катализе слабая к-та
индуцирует поляризацию путем связывания
Н, действуя как протон. Роль общего
кисл-осн кат-за закл в подготовке
реагирующих 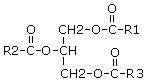 ейтральные
жиры
– триацилглицерины Ж/к входят в сост
раст и жив, имеют четн число ост сод
ненас > насыщ. Гидролизацией в присут
катализатора превращают ненас в насыщ
(маргарин) Триацилглицерины м.б. прост
и смешанными. Кислотное число – кол-во
мг КОН для нейтр-ии своб ж/к в 1 г жира.
Йодное число – кол-во гр J,
связ-ое 100 г жира (сод-е ненас ж/к).
Гидролиз нейтр жиров щелочами –
омыление , получ глицерин и соли ж/к –
мыла, КОН – жидкие мыла, NaOH
– тверд. Присоед-е кислорода по двойной
св – окисление, получ альдегиды и к-ты
с коротк цепями (масл), неприят вкус.
ейтральные
жиры
– триацилглицерины Ж/к входят в сост
раст и жив, имеют четн число ост сод
ненас > насыщ. Гидролизацией в присут
катализатора превращают ненас в насыщ
(маргарин) Триацилглицерины м.б. прост
и смешанными. Кислотное число – кол-во
мг КОН для нейтр-ии своб ж/к в 1 г жира.
Йодное число – кол-во гр J,
связ-ое 100 г жира (сод-е ненас ж/к).
Гидролиз нейтр жиров щелочами –
омыление , получ глицерин и соли ж/к –
мыла, КОН – жидкие мыла, NaOH
– тверд. Присоед-е кислорода по двойной
св – окисление, получ альдегиды и к-ты
с коротк цепями (масл), неприят вкус.
 осфолипиды
сост из глицерина (сфингозина), ж/к,
фосф к-ты, соед
сложноэфирной св с какой-либо полярной
группировкой. В осн мол-фосфотидазная
к-та (глицер 2 спирт гр замещ ж/к, а 1
фосфор к-той). Обр поляр хвост и неполяр
головка, нераств в ацетоне, в др –
избират. В завис от строения полярн
гр делятся на 1)фосфатиидилхолины, 2)
фосфотидилэтаноламины, 3)фосфатидилсерины,
4) ф/инозиты, 5) ф/сахара, 6)ф/глицерины,
7)фосфатидали. Фосфохолины сод в кач-ве
полярн гр – аминоспирт холин –явл
сильным основ. Сод в желтках яиц птиц,
мозг тк чел и жив, в соев бобах, семянах
подсолн. Сущ 2 формы α и β (крайн и
средн). Фосфотидали им в С1 положении
не ж/к, а α и β ненасыщ спирты, образ-ий
простую эфирную связь.
осфолипиды
сост из глицерина (сфингозина), ж/к,
фосф к-ты, соед
сложноэфирной св с какой-либо полярной
группировкой. В осн мол-фосфотидазная
к-та (глицер 2 спирт гр замещ ж/к, а 1
фосфор к-той). Обр поляр хвост и неполяр
головка, нераств в ацетоне, в др –
избират. В завис от строения полярн
гр делятся на 1)фосфатиидилхолины, 2)
фосфотидилэтаноламины, 3)фосфатидилсерины,
4) ф/инозиты, 5) ф/сахара, 6)ф/глицерины,
7)фосфатидали. Фосфохолины сод в кач-ве
полярн гр – аминоспирт холин –явл
сильным основ. Сод в желтках яиц птиц,
мозг тк чел и жив, в соев бобах, семянах
подсолн. Сущ 2 формы α и β (крайн и
средн). Фосфотидали им в С1 положении
не ж/к, а α и β ненасыщ спирты, образ-ий
простую эфирную связь.  следствии спец св-в ферментов Е они
несколько видоизм-ся А+В=С, ν = - ∆А / ∆t
= - ∆В / ∆t
= + ∆С / ∆t
= - ∆S
/ ∆t
Чтобы знать скорость ферм реакции
нужно знать ∆S
за малый промеж времени. Это можно
опр-ть в интервале, где завис-ть между
измен-ем конц S
и временем линейная. Это начальн
скорость р-ции. Согласно хим кинетике,
скорость р-ции при пост t
пропорц произведению конц реагир в-в
взятой в положит степени. nA
+ mB
= cP.
ν = k
[A]n
[B]m
Если [A]=
[B]=!,
то ν = k.
Следов-но const
скорости р-ции при конц реагир в-в = 1,
т.е. она не зависит от конц реаг в-в.
Анри и Браун высказали мысль о том,
что ферм р-ции идут за счет вз-ия Е с
субстратом S
с обр-ем комплекса, в рез-те кот обр-ся
Р-m
и высвоб-ся Е-m.
[E]
+ [S]
[ES]
[P]
+ [E]
В первой р-ции устан-ся равновесие
и оно наруш-ся высвобожд-ем Е из
комплекса [ESo]
в направлении k+2.
следствии спец св-в ферментов Е они
несколько видоизм-ся А+В=С, ν = - ∆А / ∆t
= - ∆В / ∆t
= + ∆С / ∆t
= - ∆S
/ ∆t
Чтобы знать скорость ферм реакции
нужно знать ∆S
за малый промеж времени. Это можно
опр-ть в интервале, где завис-ть между
измен-ем конц S
и временем линейная. Это начальн
скорость р-ции. Согласно хим кинетике,
скорость р-ции при пост t
пропорц произведению конц реагир в-в
взятой в положит степени. nA
+ mB
= cP.
ν = k
[A]n
[B]m
Если [A]=
[B]=!,
то ν = k.
Следов-но const
скорости р-ции при конц реагир в-в = 1,
т.е. она не зависит от конц реаг в-в.
Анри и Браун высказали мысль о том,
что ферм р-ции идут за счет вз-ия Е с
субстратом S
с обр-ем комплекса, в рез-те кот обр-ся
Р-m
и высвоб-ся Е-m.
[E]
+ [S]
[ES]
[P]
+ [E]
В первой р-ции устан-ся равновесие
и оно наруш-ся высвобожд-ем Е из
комплекса [ESo]
в направлении k+2.
 )
при малых конц S
когда km
> [So]
)
при малых конц S
когда km
> [So]


 ограничения
ограничения

 3
3, 4 усиленные диффузион
3
3, 4 усиленные диффузион 4
ные огрничения
4
ные огрничения
 опт
рН соврадают, а выше рНопт
шире. Значительные ограничения в
диффузии Н+
могут привести к плато 3. Носители
вносят свою специфику в действие
ингибиторов и активаторов. Действие
НМ ингибиторов определяется
распределением ингибитора между
раствором и носителем. Если заряды
ингибитора и субстрата одинаковы
степень ингибирования уменьшается,
если разные – увеличиватеся. Если
есть сильные ограничения (диффузионные)
для субстрата, то фермент может не
реагировать на ингибитор. При слабых
диффузионных ограничения ингибитор
подавляет фермент. Некоторые ферменты
ингибируются ВМС ингибиторами. Здесь
играют роль диффузионные ограничения.
Ингибирование продуктами: увеличение
концентрации продуктов в окружении
фермента ингибирует его; при
внутри-диффузионном ограничении
концентрация продукта увеличивается
к центру, и концентрация субстрата
уменьшается и ингибирование увеличивается
в центре.
опт
рН соврадают, а выше рНопт
шире. Значительные ограничения в
диффузии Н+
могут привести к плато 3. Носители
вносят свою специфику в действие
ингибиторов и активаторов. Действие
НМ ингибиторов определяется
распределением ингибитора между
раствором и носителем. Если заряды
ингибитора и субстрата одинаковы
степень ингибирования уменьшается,
если разные – увеличиватеся. Если
есть сильные ограничения (диффузионные)
для субстрата, то фермент может не
реагировать на ингибитор. При слабых
диффузионных ограничения ингибитор
подавляет фермент. Некоторые ферменты
ингибируются ВМС ингибиторами. Здесь
играют роль диффузионные ограничения.
Ингибирование продуктами: увеличение
концентрации продуктов в окружении
фермента ингибирует его; при
внутри-диффузионном ограничении
концентрация продукта увеличивается
к центру, и концентрация субстрата
уменьшается и ингибирование увеличивается
в центре.



 ,
2 – колонки с иммобилизованным ферментом
(1 – измерительная, 2 – сравнения).
Фермент иммобилизуют на сефадексе.
Через колонки проходит буферный
раствор. Если реакции нет, то Δt°C=0.
Если через одну колонку идёт раствор
субстрата, то будут происходить
изменения температуры. Ферментные
электроды –
в них фермент и электрод образуют
единую конструкцию, которая не требует
дополнительных реагентов кроме
буферного раствора. Основа датчика –
электрод, который генерирует потенциал
фермента, значение которого
пропорционально конц. ионов.
,
2 – колонки с иммобилизованным ферментом
(1 – измерительная, 2 – сравнения).
Фермент иммобилизуют на сефадексе.
Через колонки проходит буферный
раствор. Если реакции нет, то Δt°C=0.
Если через одну колонку идёт раствор
субстрата, то будут происходить
изменения температуры. Ферментные
электроды –
в них фермент и электрод образуют
единую конструкцию, которая не требует
дополнительных реагентов кроме
буферного раствора. Основа датчика –
электрод, который генерирует потенциал
фермента, значение которого
пропорционально конц. ионов.
 раствор фермента помещают уреазу,
которая изменяет количество мочевины:
CO(NH2)2
(мочевина) →NH4+
+ HCO3-
раствор фермента помещают уреазу,
которая изменяет количество мочевины:
CO(NH2)2
(мочевина) →NH4+
+ HCO3- электрод
сравнения, находится во внутр. буф-м
р-ре)
электрод
сравнения, находится во внутр. буф-м
р-ре) оторая
м.б. получена при задан усл в ед V
(кол кл в 1 мл среды, вес биомассы в 1 л
среды). 7 Экономический
коэффициент
– использ для описания эф-ти процессов
роста: y
(%) = Δx/ΔS;
где x
– измен биомассы, мг СВ/мл, S
– конц пит в-в в среде. КУЛЬТИВИРОВАНИЕ
– выращив м/о в исх среде в лаб усл.
оторая
м.б. получена при задан усл в ед V
(кол кл в 1 мл среды, вес биомассы в 1 л
среды). 7 Экономический
коэффициент
– использ для описания эф-ти процессов
роста: y
(%) = Δx/ΔS;
где x
– измен биомассы, мг СВ/мл, S
– конц пит в-в в среде. КУЛЬТИВИРОВАНИЕ
– выращив м/о в исх среде в лаб усл.
 ИМИТИРОВАНИЕ
–
иногда рост с экспоненц скоростью
обрывается, т.к. в среде исчерп источ
С, хотя др компон в избытке. Это лимит-е
источника С. При внесении рост возобновл.
Можно лимитир О2
(для восст-я роста продувают возд или
чистым О2).
ИНГИБИРОВАНИЕ
–а) избыт субстрата (м. наблюд в
лаг-фазе), б) продукт обмена, в) посторонние
ингиб. ДИАУКСИЯ
- двухфазный рост на средах, содерж
смесь пит в-в (у Е. Coli
на среде с 2 ист С).
ИМИТИРОВАНИЕ
–
иногда рост с экспоненц скоростью
обрывается, т.к. в среде исчерп источ
С, хотя др компон в избытке. Это лимит-е
источника С. При внесении рост возобновл.
Можно лимитир О2
(для восст-я роста продувают возд или
чистым О2).
ИНГИБИРОВАНИЕ
–а) избыт субстрата (м. наблюд в
лаг-фазе), б) продукт обмена, в) посторонние
ингиб. ДИАУКСИЯ
- двухфазный рост на средах, содерж
смесь пит в-в (у Е. Coli
на среде с 2 ист С).



 .св>э;
2.э>св
.св>э;
2.э>св =
dQ/(tст
– tf)Fd,
=
dQ/(tст
– tf)Fd,