
Литература / учебное пособие
.pdfФедеральное Государственное образовательное учреждение высшего профессионального образования Военно-медицинская акадения имени С.М. Кирова
А.М. Иванов, Г.И. Элькин, Р.А. Грашин
ОСНОВЫ БИОХИМИИ
Учебное пособие
Санкт-Петербург 2016
|
|
|
|
|
СОДЕРЖАНИЕ |
|
|
|
|
1. |
АМИНОКИСЛОТЫ, ПЕПТИДЫ И БЕЛКИ |
4 |
|
||
|
|
1.1. |
Структура и классификация аминокислот |
4 |
|
||
|
|
1.2. |
Пептиды |
8 |
|
||
|
|
|
1.3. |
Уровни структурной организации белковых макромолекул |
8 |
|
|
|
|
|
1.4. |
Биологические функции белков |
11 |
|
|
|
|
1.5. |
Классификация белков |
12 |
|
||
|
|
|
2. |
ФЕРМЕНТЫ |
13 |
|
|
|
|
2.1. |
Свойства ферментов |
14 |
|
||
|
|
|
2.2. |
Номенклатура и классификация ферментов |
15 |
|
|
|
|
|
2.3. |
Строение ферментов |
16 |
|
|
|
|
|
2.4. |
Механизм действия ферментов |
17 |
|
|
|
|
3. |
ВИТАМИНЫ |
19 |
|
||
|
|
3.1. |
Классификация витаминов |
19 |
|
||
|
|
3.2. |
Коферментная функция витаминов |
20 |
|
||
|
|
|
3.3. |
Краткая характеристика некоторых витаминов |
21 |
|
|
|
|
|
4. |
УГЛЕВОДЫ |
25 |
|
|
|
|
4.1. |
Функции углеводов |
26 |
|
||
|
|
4.2. |
Классификация и свойства моносахаридов |
27 |
|
||
|
|
4.3. |
Олигосахариды |
33 |
|
||
|
|
4.4. |
Полисахариды |
34 |
|
||
|
|
5. |
НУКЛЕОТИДЫ И НУКЛЕИНОВЫЕ КИСЛОТЫ |
37 |
|
||
|
|
|
5.1. |
Нуклеозиды и нуклеотиды |
37 |
|
|
|
|
|
5.2. |
Первичная структура нуклеиновых кислот |
39 |
|
|
|
|
|
5.3. |
Вторичная структура ДНК |
40 |
|
|
|
|
5.4. |
Третичная структура ДНК |
41 |
|
||
|
|
6. |
ЛИПИДЫ (ЖИРЫ) |
42 |
|
||
|
|
6.1. |
Классификация липидов |
42 |
|
||
|
|
6.2. |
Глицериды |
42 |
|
||
|
|
6.3. |
Воска |
43 |
|
||
|
|
6.4. |
Фосфолипиды |
44 |
|
||
|
|
6.5. |
Гликолипиды (гликосфинголипиды) |
45 |
|
||
|
|
6.6. |
Стероиды |
46 |
|
||
|
|
|
|
|
Список рекомендуемой литературы |
47 |
|
3

1.АМИНОКИСЛОТЫ, ПЕПТИДЫ И БЕЛКИ
Из всех химических соединений белки, вероятно, наиболее важн
с |
кольку они являются основой всего живого. Белки не тольк |
с |
твенную часть каждой клетки всех живых организмов, но |
жиз |
недеятельность. С химической точки зрения белки представля |
с |
окополимерные вещества, для синтеза которых исходным |
жа |
т a-аминокислоты. |
|
1.1. Структура и классификация аминокислот |
Г |
етерофункциональные соединения, молекулы которых содержат |
в |
ременно амино– и карбоксильную группы, называются ам |
щ |
ее число встречающихся в природе аминокислот достигает |
орг |
анизме человека найдено около 70 аминокислот, из которых |
с |
тав белков. Они относятся к α–аминокислотам и называют |
м |
и (табл. 1). Некоторые из них, отмеченные «звёздочкой» *, |
ним |
ыми. Эти аминокислоты не могут синтезироваться в организ |
из |
других веществ, поэтому должны содержаться в пище. |
a O H2N CH C
|
|
|
|
OH |
|
||||||
|
|
R |
|
||||||||
|
|
|
|
|
|
|
|
|
|
Таблица 1 |
|
|
П |
|
|
|
|
|
|
|
|
ротеиногенные α – амин |
|
Н |
С |
|
|
|
|
|
|
|
|
окращенное название |
|
|
междуна- |
|
Формула |
азвани |
|||||||
а |
|
|
ми |
||||||||
|
родное |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
||
1 |
2 |
3 |
|
4 |
|
|
|
|
|
|
|
Г лицин |
Гли |
|
Gly |
H2N |
|
CH |
|
COOH |
|
||
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|||
|
|
|
H |
|
|||||||
|
|
|
|
|
|
|
|||||
Аланин |
Ала |
Ala |
H2N |
|
CH |
|
COOH |
|
|||
|
|
|
|||||||||
|
|
|
|
|
|
|
|
||||
|
|
CH3 |
|
||||||||
|
|
|
|
|
|
|
|||||
Валин* |
Вал |
Val |
H2N |
|
CH |
|
COOH |
|
|||
|
|
|
|||||||||
|
|
|
|
|
|
||||||
|
|
CH |
|
CH3 |
|
||||||
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
CH3 |
|
||
|
|
|
|
|
|
|
|
||||
Лейцин* |
Лей |
Leu |
H2N |
|
CH |
|
COOH |
|
|||
|
|
|
|||||||||
|
|
|
|
CH2 |
|
||||||
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
||||
|
|
CH |
|
CH3 |
|
||||||
|
|
|
|
|
|
|
|
||||
CH3
4
1
Изолейцин*
Серин
Треонин*
Цистеин
Метионин*
Аспаргиновая
кислота
Аспаргин
Глутаминовая
кислота
Глутамин
Лизин*
2 3
3
Иле Ile
Сер Ser
Тре Thr
Цис Cys
Мет Met
Асп Asp
Асн Asn
Глу Glu
Глн Gln
Лиз Lys
Продолжение таблицы 1
4
H2N CH COOH
CH CH3 CH2 CH3
H2N CH COOH
CH2
OH
H2N CH COOH
CH CH3 OH
H2N CH COOH
CH2
SH
H2N CH COOH
CH2 CH2 S CH3
H2N CH COOH
CH2
COOH
H2N CH COOH
CH2
C O
NH2
H2N CH COOH
CH2
CH2
COOH
H2N CH COOH
CH2
CH2
C O
NH2
H2N CH COOH
CH2 (CH2)2 CH2 NH2
5
1 |
2 |
3 |
4 |
|
Окончание таблицы 1 |
||||||
|
|
|
|
|
|
|
|
||||
Аргинин* |
Арг |
Arg |
H2N |
|
CH |
|
COOH |
||||
|
|
||||||||||
|
|
|
|
CH2 |
|||||||
|
|
|
|||||||||
|
|
|
|
CH2 |
|||||||
|
|
|
|||||||||
|
|
|
|
CH2 |
|||||||
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
NH |
||||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
C |
|
NH |
||||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
NH2 |
||||
|
|
|
|
|
|
||||||
Фенилаланин* |
Фен |
Phe |
H2N |
|
CH |
|
COOH |
||||
|
|
||||||||||
|
|
|
|
CH2 |
|||||||
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
H2N CH COOH
CH2
Тирозин Тир Tyr
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
||||||||||
Триптофан* |
|
Три |
Trp |
H2N |
|
|
CH |
|
|
COOH |
|||||||||
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
CH2 |
|||||||||||
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
HN |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Гистидин* |
|
Гис |
His |
H2N |
|
|
CH |
|
|
COOH |
|||||||||
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
CH2 |
|||||||||||
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
HN |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|||
|
Пролин |
|
Про |
Pro |
|
|
|
|
|
||||||||||
|
|
|
COOH |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
NH |
|||||||||
|
Высокая температура плавления, легкость кристаллизации, высокие ди- |
||||||||||||||||||
поль |
ные моменты и хорошая растворимость аминокислот в воде объясняются |
||||||||||||||||||
их |
ионным характером: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
H2N |
|
CHR |
|
COOH |
|
H3N |
+ |
CHR |
|
COOH- |
||||||||
|
|
|
|
|
|
||||||||||||||
|
|
|
|||||||||||||||||
|
|
|
|
||||||||||||||||
6
Способность a-аминокислот растворяться в воде является важным фактором обеспечения их биологического функционирования – с ней связаны всасываемость a-аминокислот, их транспорт в организме и т. п.
В твёрдом состоянии a-аминокислоты существуют в виде диполярных ионов; в водном растворе – в виде равновесной смеси диполярного иона, катионной и анионной форм (обычно используемая запись строения a-амино- кислоты в неионизированном виде служит лишь для удобства). Положение равновесия зависит от рН среды. Общим для всех a-аминокислот является преобладание катионных форм в сильнокислых (рН 1-2) и анионных – в сильнощелочных (рН 13-14) средах.
Положение равновесия, т.е. соотношение различных форм аминокислоты, в водном растворе при определённых значениях рН существенно зависит от строения радикала, главным образом наличия в нём ионогенных групп, играющих роль кислотных и основных центров.
Значение рН, при котором концентрация диполярных ионов максимальна, а минимальные концентрации катионных и анионных форм a-аминокислоты равны, называется изоэлектрической точкой (pI). Значение pI в общем случае вычисляется по формуле:
pI = |
p Kn +pKa n 1 |
, |
a+ |
|
|||
2 |
|
|
|
г |
|
де n – |
|
a |
|
-амино |
|
И |
|
з таблицы 1 |
|
т |
|
орые |
|
г |
|
лутам |
|
б |
|
оксам |
|
Н |
|
екотор |
|
рой |
|
может |
|
з |
|
ольна |
|
т |
|
ами. Н |
|
с |
|
истем |
|
лог |
|
енов. |
|
Х |
|
имическая п |
|
ос |
|
уществ |
|
в |
|
осстан |
|
э |
|
териф |
|
г |
|
руппа |
|
ров |
|
ания по |
|
( |
|
|
по O |
цик |
|
лически |
|
7

вых организмах (солеобразование, окисление, восстановление, ацилирование, этерификация, амидирование, фосфорилирование).
1.2. Пептиды
Одновременное присутствие в молекулах α–аминокислот аминной и карбоксильной групп обусловливает их способность вступать в реакции поликонденсации, которые приводят к образованию пептидных (амидных) связей между мономерными звеньями.
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
O |
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
OH |
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H+ |
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|||||||||||||||
H2N CH C |
OH |
HHN CH C |
|
OH |
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
HN CH C |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
R1 |
|
|
|
|
|
R2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Rn |
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
H2N |
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
... |
|
HN |
|
|
CH |
|
C |
|
|
|
OH |
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
C |
|
NH |
|
|
CH |
|
|
C |
|
NH |
|
|
CH |
|
|
C |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
R1 |
|
|
|
|
R2 |
|
|
|
R3 |
|
|
|
|
|
|
|
|
|
|
|
Rn |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
В результате такой реакции образуются пептиды, полипептиды и белки
(протеины). Последние содержат свыше 100 аминокислотных остатков и имею
молекулярную массу от 10000 до нескольких миллионов. Чередование амино-
кислотных остатков в молекуле белка неповторимо и строго специфично. Спе-
циф |
ичность белков определяется аминокислотным составом и аминокислотной |
пос |
ледовательностью. |
|
Согласно данным рентгеноструктурного анализа аминокислот и дипепти- |
дов, вся амидная группа является плоской: углерод карбонильной группы, азот
ичетыре связанных с ними атома лежат в одной плоскости. Связь углерод –
а |
зот носит в значительной степени характер двойной связи. |
|
Структуры полипептидов изображают, как правило, при помощи стан- |
дартных сокращений (см. таблицу 1). N-концевой аминокислотный остаток
(имеющий свободную аминогруппу) пишут с левой стороны формулы, а С-кон
це |
вой аминокислотный остаток (имеющий свободную карбоксильную группу) - |
справой стороны. Ниже показан пример такой записи для трипептида глицила-
ла |
нилфенилаланина: |
|
|
|
|
||
|
+ |
|
|
- |
|
||
|
H3NCH2CONHCHCONHCHCOO |
|
|||||
|
|
|
C |
|
|
CH2C6H5 |
H3 |
|
|
|
|||||
|
Gly-Ala-Phe |
|
|
|
|
||
|
1. |
|
|
|
|
|
3. Уровни структурной ор |
|
П |
|
|
|
оследовательность распол |
||
или |
|
|
|
|
|
|
нескольких полипепти |
пе |
|
|
|
|
|
|
рвичная структура бе |
8
|
Кроме первичной в белковых молекулах выделяют вторичную, третич- |
ную |
и четвертичную структуры. |
|
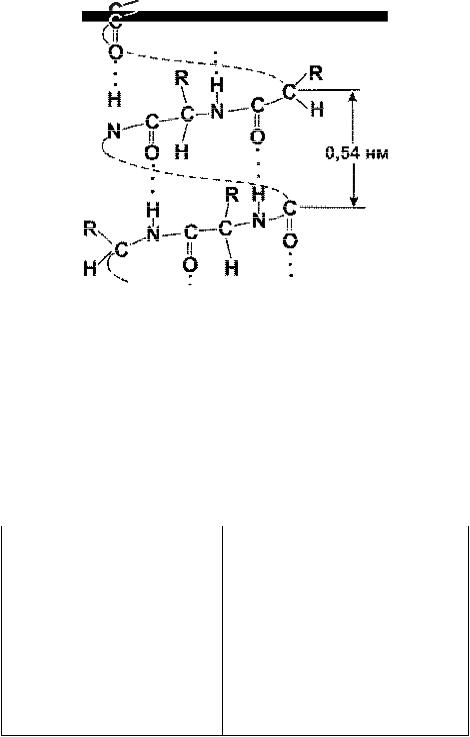
Под вторичной структурой белка подразумевают конформацию полипеп- |
тидной цепи, т. е. способ её скручивания или складывания в соответствии с
прог раммой, заложенной в первичной структуре, в α–спираль или β–структуру.
Ключевую роль в стабилизации этой структуры играют водородные связи, ко-
торые в α–спирали образуются между карбонильным атомом кислорода каждо-
го первого и атомом водорода NH–группы каждого пятого α–аминокислотных
ос татков (рис.1).
|
Рис.1. Вторичная структура белка (a-спираль) |
|
В |
отличие от α–спирали β–структура образована за счёт межцеп |
|
в |
одородных связей между соседними участками полипепт |
|
О |
собенности вторичной структуры белка во многом определяют |
|
нок |
ислотным составом (табл. 2). |
|
|
|
Таблица 2 |
|
Некоторые аминокислоты, определяющие тип |
|
|
вторичной структуры белка |
|
|
α–спираль |
β–структура |
А |
ланин |
Валин |
Г |
лутаминовая кислота |
Изолейцин |
Г |
лутамин |
Треонин |
Л |
ейцин |
Тирозин |
Л |
изин |
Фенилаланин |
М |
етионин |
|
Г |
истидин |
|
9
Р
П
с
ра
лич
α
з
из
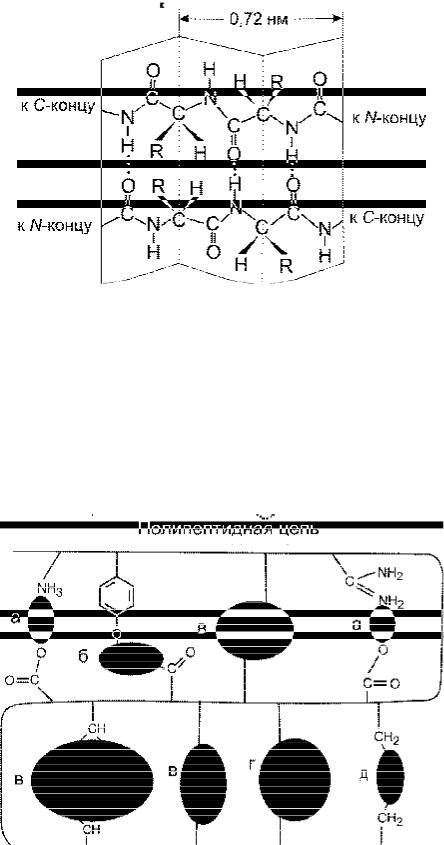
Рис. 3. Типы взаимодействий, стабилизирующие третичную структуру белка
Под четвертичной структурой белка подразумевают ассоциированные м ежду собой две или более субъединиц, ориентированных в пространстве. Чет-
10

вертичная структура поддерживается за счет водородных связей и гидрофобных взаимодействий (рис. 4). Она характерна для некоторых белков (гемоглобин).
Р
пос |
тро |
П
под
с
е
нос
т
1. |
4. |
1.
ос
2.
3.
к
4.
пид
б
5.
6.
7.
8.
или
11
