
ПАВ_курс лекций
.pdfМИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Российский химико-технологический университет имени Д. И. Менделеева
СВОЙСТВА И ПРИМЕНЕНИЕ ПОВЕРХНОСТНО-АКТИВНЫХ ВЕЩЕСТВ Курс лекций
Утверждено Редакционным советом университета в качестве учебного пособия
Москва
2016
1
УДК 661.185 (075) ББК 35.785я9
С20
Авторы: К. И. Киенская, М. В. Сардушкин, О. В. Яровая, Г. В. Авраменко
Рецензенты:
Доктор химических наук, доцент кафедры физической и коллоидной химии Федерального государственного бюджетного образовательного учреждения высшего образования «Казанский национальный исследовательский технологический университет»
С. В. Шилова
Кандидат химических наук, доцент кафедры физической химии Российского химико-технологического университета имени Д. И. Менделеева
В. В. Белик
Свойства и применение поверхностно-активных веществ. Курс
С20 лекций: учеб. пособие/ К. И. Киенская, М. В. Сардушкин, О. В. Яровая, Г. В. Авраменко. – М.: РХТУ им. Д. И. Менделеева, 2016. – 136 с.
ISBN 978-5-7237-1411-3
Рассмотрены особенности строения и коллоидно-химического поведения поверхностно-активных веществ (ПАВ), способы их получения и анализа, а также ряд дисперсных систем, существование которых невозможно без помощи ПАВ. Материал условно разделен на две части. первая касается поведения ПАВ на границе раздела раствор-воздух и включает лекции по определению поверхностного и межфазного натяжения, адсорбции на границе раствор-воздух, образованию пленок ПАВ, пенообразованию. Вторая часть посвящена поведению ПАВ в объеме: мицеллообразованию, солюбилизации, образованию организованных ансамблей, а также способности ПАВ стабилизировать различные дисперсные системы.
Предназначено для студентов дневного и заочного отделения, выбравших курс «Свойства применение ПАВ» для дополнительного изучения.
УДК 661.185 (075) ББК 35.785я7
ISBN 978-5-7237-1411-3 © Российский химико-технологический университет им. Д. И. Менделеева, 2016
2
ОГЛАВЛЕНИЕ |
|
Введение…………………………………………………………………... |
6 |
Лекции 1−2. Межфазная поверхность. Методы определения |
|
поверхностного и межфазного натяжений…………………………........ |
7 |
1.Понятие о межфазной поверхности………………………………... 7
2.Определение поверхностных и межфазных натяжений………….. 10
2.1.Определение поверхностных и межфазных натяжений на границах жидкость-газ и жидкость-жидкость (σж-газ и σж-ж)……... 10
2.2.Определение межфазного натяжения на границе жидкость-
твердое (σж-тв)……………………………………………………….. 19
2.3.Определение поверхностного натяжения на границе
|
твердое-газ (σтв-газ). Метод Цисманна…………………………….. |
20 |
Лекция 3. Адсорбционные равновесия………………………………….. |
26 |
|
Лекции 4−5. Поверхностные пленки. Пленки ПАВ. Растекание одной |
|
|
жидкости по поверхности другой……………………………………….. |
35 |
|
1. |
Критерии растекания жидкостей…………………………………… |
36 |
2. |
Виды изотерм поверхностного (межфазного) натяжения………... |
38 |
|
2.1. Изотермы поверхностного натяжения………………………… |
38 |
2.2.Изотерма межфазного натяжения на границе жидкость-
жидкость……………………………………………………………... 41
3.Поверхностные (адсорбционные) пленки ПАВ…………………… 42
3.1.Газообразные пленки…………………………………………… 42
3.2.Жидкообразные пленки………………………………………… 44
3.3.Твердые пленки…………………………………………………. 47
Лекция 6. Пены и их основные коллоидно-химические характеристики……………………………………………………………. 50
1. |
Строение пен………………………………………………………… |
50 |
2. |
Основные характеристики пены…………………………………… |
53 |
3. |
Зависимость пенообразующей способности от различных |
|
факторов…………………………………………………..……………. |
53 |
|
|
3.1. Зависимость пенообразующей способности от строения |
|
|
ПАВ. Ионные ПАВ………………………………………………….. |
53 |
|
3.2. Зависимость пенообразующей способности от строения |
|
|
3 |
|
ПАВ. Неионные ПАВ……………………………………………….. 55
3.3.Зависимость пенообразующей способности от температуры.. 56
3.4.Зависимость пенообразующей способности от концентрации ПАВ……………………………………………………………........... 57
3.5.Зависимость пенообразующей способности от величины поверхностного натяжения…………………………………………. 58
3.6.Влияние величины рН растворов ПАВ на пенообразование... 58
4.Способы получения и разрушения пен……………………………. 58 Лекция 7. Гидрофильно-липофильный баланс (ГЛБ). Параметр упаковки………………………………………………………………….. 60
1. Понятие о гидрофильно-липофильном балансе. Шкалы ГЛБ…… 60
1.1.Метод Гриффина………………………………………………... 60
1.2.Метод Дэвиса…………………………………………………… 62
1.3.Метод Лин………………………………………………………. 64
1.4.Метод Шиноды…………………………………………………. 66
1.5.Метод Круглякова−Корецкого………………………………. 67
2.Параметр упаковки молекул ПАВ. Расчет параметров упаковки... 68 Лекции 8−11. Мицеллообразование в растворах ПАВ. Критическая концентрация мицеллообразования. Везикулы. Мицеллярная масса и
методы ее определения…………………………………………………… 72
1.Элементы термодинамики мицеллообразования…………………. 72
2.Методы определения ККМ…………………………………………. 77
3.Зависимость величины ККМ от различных факторов……………. 79
3.1.Зависимость растворимости ПАВ от температуры. Точка Крафта. Температура помутнения…………………………………. 79
Влияние температуры на растворимость ионных ПАВ. Точка Крафта……………………………………………………………... 79
Влияние температуры на растворимость неионных ПАВ. Тем-
пература помутнения……………………………………………... 80
3.2.Влияние длины и строения углеводородного радикала на ККМ………………………………………………………………….. 83
3.3.Влияние степени оксиэтилирования неионных ПАВ на ККМ………………………………………………………………….. 85
4
3.4. Влияние ионной группы на ККМ……………………………… 85 3.5. Влияние низкомолекулярных электролитов на ККМ………... 86
3.6. Влияние спиртов на ККМ……………………………………… 86
4.Особенности мицеллообразования в неводных средах…………... 87
5.Понятие о солюбилизации. Емкость солюбилизации. Изотермы солюбилизации…………………………………………………………. 88
6. Везикулы. Строение и основные свойства………………………… 96
7.Мицеллярная масса. Методы ее определения……………………... 99
7.1.Метод светорассеяния………………………………………….. 99
7.2.Комбинированный метод измерения диффузии и вязкости…. 100
7.3.Метод ультрацентрифугирования…………………................... 102 Лекции 12−13. Эмульсии. Классификации эмульсий. Основные коллоидно-химические характеристики макро- и микроэмульсий….. 105
1.Классификации и типы эмульсий………………………………….. 105
1.1.Определение типа эмульсии…………………………………… 106
1.2.Обращение эмульсий…………………………………………… 107
2.Получение и стабилизация макроэмульсий……………………….. 109
2.1.Стабилизация макроэмульсий при помощи ПАВ……………. 109
2.2.Стабилизация эмульсий полимерами и высокодисперсными порошками…………………………………………………………… 111
3.Микроэмульсии. Строение и свойства…………………………….. 114
4.Принципы подбора ПАВ для получения микроэмульсий………... 117 Лекция 14. Новые типы поверхностно-активных веществ.
Экстремальное снижение межфазного натяжения……………………... 120
1.Экстремальное снижение межфазного натяжения при помощи ПАВ……………………………………………………………………... 120
2.ПАВ-близнецы (Gemini-ПАВ). Строение, синтез и основные свойства………………………………………………………………… 122
2.1.Синтез димерных ПАВ……………………………………….… 123
2.2. Коллоидно-химические свойства димерных ПАВ…………… 124 3. Экологически безопасные ПАВ……………………………………. 127
Лекция 15. Анализ ПАВ………………………………………………….. 131 Заключение………………………………………………………………... 135
5
ВВЕДЕНИЕ
Данный конспект лекций представляет собой основу курса «Свойства и применение ПАВ», предназначенного для студентов дневного отделения, выбравших этот предмет для дополнительного изучения. По своей сути этот курс представляет собой дополнительные главы коллоидной химии, в которых более глубоко и детально рассмотрены поверхностноактивные вещества (ПАВ) – особенности их строения и коллоиднохимического поведения, способы их получения и анализа, а также ряд дисперсных систем, существование которых невозможно без помощи ПАВ.
Материал проиллюстрирован необходимыми схемами и рисунками, уравнениями и таблицами, в конце каждой лекции приводится список использованной литературы. Этот список позволит заинтересовавшемуся студенту ознакомиться с первоисточником и изучить материал более глубоко и детально.
Представленный курс разделен на две части. Первая часть (лекции с 1 по 6) касается поведения ПАВ на границе раздела раствор-воздух, т.е. на поверхности. Сюда включены разделы по определению поверхностного и межфазного натяжения, адсорбции на границе раствор-воздух, образованию пленок ПАВ и пенообразованию. Вторая часть (лекции 7−14) посвящена поведению ПАВ в объеме – мицеллообразованию, солюбилизации, образованию организованных ансамблей, а также способности ПАВ стабилизировать различные дисперсные системы. Заключительная лекция кратко касается основных методов анализа ПАВ.
В заключение можно отметить, что представленный материал может быть полезен и для студентов заочного отделения, которым в течение семестра выдается письменное домашнее задание по курсу «Свойства и применение ПАВ».
6
ЛЕКЦИИ 1−2. МЕЖФАЗНАЯ ПОВЕРХНОСТЬ. МЕТОДЫ ОПРЕДЕЛЕНИЯ ПОВЕРХНОСТНОГО И МЕЖФАЗНОГО
НАТЯЖЕНИЙ
1. Понятие о межфазной поверхности
Многие вещи из этого раздела будут Вам уже знакомы, однако, мы постараемся посмотреть на них несколько с другой стороны, учитывая то, что уже известно, и продвинуться немного далее.
Итак, ПАВы – это поверхностно-активные вещества, молекулы которых имеют дифильное строение и состоят из углеводородного радикала (одного или более) и полярной части (одной или нескольких). Схематично
1 молекула ПАВ обозначается так:  , где палочка представляет собой углеводородный радикал, а кружочек – полярную группу.
, где палочка представляет собой углеводородный радикал, а кружочек – полярную группу.
Одним из основных свойств ПАВ является их способность снижать межфазное натяжение σ на различных границах раздела в результате адсорбции молекул ПАВ на этих границах раздела. Чтобы установить, насколько сильно уменьшилась величина межфазного натяжения, надо знать основные способы его определения. Остановимся на этом поподробнее, поскольку корректно измерить величину межфазного натяжения не так легко. Здесь необходимо напомнить о том, что существует 2 термина – межфазное и поверхностное натяжение, обозначаемые одной и той же буквой σ. Как правило, термин «поверхностное» натяжение применяется тогда, когда речь идет о границах раздела жидкостей или твердых тел с газовой фазой (часто с воздухом). В этих случаях вводятся следующие обозначения σж-газ и σтв-газ, соответственно. Во всех остальных случаях (на границах раздела жидкость-жидкость σж-ж, жидкость-твердое σж-тв и твердоетвердое σтв-тв) правильнее говорить о межфазном натяжении. Вообще, термин «межфазное натяжение» наиболее полный, и для описания общих случаев пользоваться им более удобно, что и будет сделано ниже. Когда же речь пойдет непосредственно о поверхностном натяжении, об этом будет сказано дополнительно.
Существуют прямые и косвенные методы определения межфазного натяжения. Прямые методы позволяют определять величины межфазных
7
натяжений непосредственно из экспериментальных данных; косвенные же методы, помимо эксперимента, требуют дополнительных расчетов и допущений. Прямые методы отработаны для случаев определения σж-газ и σж-ж. «Жидкая» (на границе раздела жидкость-жидкость) поверхность раздела отличается от твердой поверхности раздела тем, что она 1) подвижная; 2) энергетически эквивалентная и 3) идеально гладкая. Поэтому в любой точке жидкости σж-газ и σж-ж являются величинами постоянными и независящими от формы сосуда, в которых они находятся.
Рассмотрим «жидкую» границу раздела фаз поподробнее, в частности, чистую жидкость на границе с воздухом. Как известно, возникновение поверхностного натяжения в данном случае есть результат несбалансированности межмолекулярных сил на поверхности раздела жидкость-воздух. Чем полярнее жидкость, тем выше величина ее поверхностного натяжения.
Вспомните из общего курса коллоидной химии – какая жидкость имеет самое высокое поверхностное натяжение?
При обсуждении этой темы возникает вопрос – какова глубина поверхностного слоя или этой области заметно несбалансированных сил? Прежде всего, эта область зависит от радиуса действия межмолекулярных сил. Если на поверхности жидкости не присутствуют ионы, взаимодействие между молекулами обусловлено, в основном, силами Ван-дер- Ваальса. Эти силы ослабевают пропорционально седьмой степени расстояния между молекулами, и, следовательно, для данной молекулы имеет значение только взаимодействие с 1–2 слоями ближайших соседей. Таким образом, силы, действующие на молекулу, симметричны уже на расстоянии нескольких молекулярных диаметров от поверхности. Толщина поверхностного слоя имеет тот же порядок.
Следует также помнить, что тонкий поверхностный слой находится в турбулентном состоянии. Поскольку жидкость равновесна со своим паром, то существует двусторонний сбалансированный перенос молекул из газовой фазы на поверхность и последующая конденсация, так и обратно – испарение. В частности, для воды это составляет около 1,2 1022 молекул/см2 с, т.е. на каждом квадратном сантиметре поверхности воды ежесекундно принимается и отдается 1,2 1022 молекул. На площадку в 10 Å2, со-
8
ответствующую площади, занимаемой 1 молекулой воды, за одну секунду падает 1,2∙107 молекул, и, следовательно, время жизни молекулы на поверхности должно быть порядка десятой доли микросекунды.
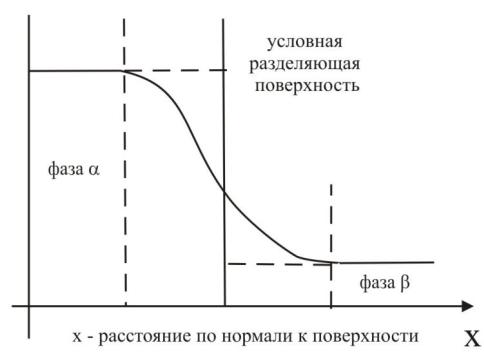
Рассмотрим жидкость, находящуюся в равновесии с ее паром. На границе раздела объемные фазы жидкости (фаза α) и пара (фаза β) переходят друг в друга не резко, а постепенно, как показано на рис. 1. Поскольку межфазный слой не имеет четко определенных границ, при математическом анализе целесообразно ввести некоторую условную разделяющую поверхность. Принимая, что объемные фазы остаются однородными вплоть до разделяющей поверхности, можно определить экстенсивные параметры, такие как G – энергию Гиббса, S − энтропию, U − внутреннюю энергию и т.д.
Тогда:
(1)
(2)
(3)
и т.д.
Рис. 1. Схема образования разделяющей поверхности
9

Верхний индекс σ использован для обозначения поверхностных величин, рассчитанных при условии, что объемные фазы остаются неизменными вплоть до выбранной математической разделяющей поверхности.
Для внутренней энергии обобщенное уравнение 1 и 2 начал термодинамики может быть записано так:
∑ |
, |
(4) |
где c1 и c2 – две кривизны разделяющей поверхности, а C1 и C2 – некоторые константы. Очень часто принимают, что C1 + C2 = 0; в таком случае разделяющую поверхность называют поверхностью натяжения.
Рассмотрим некоторые прямые методы определения конкретных межфазных натяжений.
2.Определение поверхностных и межфазных натяжений
2.1.Определение поверхностных и межфазных натяжений на границах
жидкость-газ и жидкость-жидкость (σж-газ и σж-ж)
Метод капиллярного поднятия
Данный метод позволяет экспериментально определять поверхностное натяжение жидкостей − σж-газ. Метод капиллярного поднятия базируется на известном уравнении Лапласа:
(5)
ds
где σ – межфазное натяжение; dV − кривизна поверхности. Жидкость в капилляре образует сферический мениск (вогнутый или выпуклый в зависимости от смачивания или не смачивания, соответственно). Тогда уравнение Лапласа принимает следующий вид:
(6)
где rм – радиус мениска. Радиус мениска связан с радиусом капилляра rк через угол смачивания :
(7)
10
