
диссертации / 27
.pdfТаблица 4.6
Распределение частот генотипов и аллелей по G20210A полиморфному
локусу гена F2 у мужчин в группах пациентов молодого возраста и
контроля
Варианты |
|
МИ |
|
контроль |
|
генотипов |
и |
|
|
|
|
N=72 |
Частота, |
N=44 |
Частота, |
||
аллелей |
|
% |
% |
||
|
|
|
|||
|
|
|
|
|
|
F2(G/G) |
|
68 |
94,4 |
43 |
97,7 |
|
|
|
|
|
|
F2(G/A) |
|
4 |
5,6 |
1 |
2,3 |
|
|
|
|
|
|
F2(A/A) |
|
0 |
0 |
0 |
0 |
|
|
|
|
|
|
F2(G) |
|
140 |
97,2 |
87 |
98,9 |
|
|
|
|
|
|
F2(A) |
|
4 |
2,8 |
1 |
1,1 |
|
|
|
|
|
|
Таблица 4.7
Распределение частот генотипов и аллелей по G20210A полиморфному
локусу гена F2 у женщин в группах пациентов молодого возраста и
контроля
Варианты |
|
МИ |
|
контроль |
|
генотипов |
и |
|
|
|
|
N=19 |
Частота, |
N=45 |
Частота, |
||
аллелей |
|
% |
% |
||
|
|
|
|||
|
|
|
|
|
|
F2(G/G) |
|
19 |
100 |
44 |
97,8 |
|
|
|
|
|
|
F2(G/A) |
|
0 |
0 |
1 |
2,2 |
|
|
|
|
|
|
F2(A/A) |
|
0 |
0 |
0 |
0 |
|
|
|
|
|
|
F2(G) |
|
38 |
100 |
89 |
98,9 |
|
|
|
|
|
|
F2(A) |
|
0 |
0 |
1 |
1,1 |
|
|
|
|
|
|
91
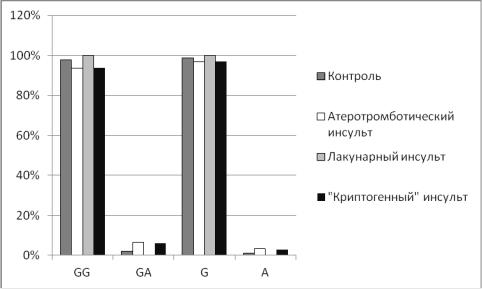
На следующем этапе был проведен анализ возможной ассоциации гена
F2 с патогенетическими вариантами ишемического инсульта в молодом возрасте (Рис. 4.5).
Рисунок 4.5 Сравнительный анализ распределения частот генотипов и аллелей по G20210A полиморфному локусу гена F2 в группе пациентов с различными патогенетическими вариантами ИИ и в контрольной группе
При атеротромботическом варианте G/G генотип был выявлен у 29 (93,5%) больных, G/A генотип – у 2 (6,5%) больных. Частота аллеля G
составила 96,8% в группе пациентов молодого возраста, частота аллеля A –
3,2%. При сравнении пациентов молодого возраста, имеющих атеротромботический вариант ишемического инсульта, с контрольной группой статистически достоверных различий в распределении частот генотипов и аллелей по исследуемому полиморфному локусу гена F2 между этими двумя группами получено не было (p = 0,27).
При лакунарном патогенетическом варианте G/G генотип встречался у
27 (100%) пациентов; генотип G/A в данной группе больных не встречался.
При сравнительном анализе частот генотипов и аллелей в группе пациентов с лакунарным патогенетическим вариантом ИИ и контрольной группе
92
достоверных различий в распределении частот, как генотипов, так и аллелей между этими двумя группами не получено (p =1,0).
При анализе «криптогенного» инсульта G/G вариант выявлен у 31 (93,9%) пациента, G/A – у 2 (6,1%) больных. Частота аллеля G составила
97%, A аллеля – 3%. Статистически достоверных различий в распределении частот генотипов и аллелей между данной группой больных и контрольной группой также получено не было (p = 0,29).
Таким образом, статистически достоверных различий в распределении частот генотипов и аллелей по G20210A полиморфному локусу гена F2
между пациентами с различными патогенетическими вариантами ишемического инсульта и контролем не получено.
G20210A полиморфизм гена F2 приводит к повышению уровня протромбина в крови в 1,5-2 раза по сравнению с нормальными значениями
[210]. Многие исследования посвящены изучению влияния G20210A
полиморфизма гена F2 на риск развития тромбоза вен нижних конечностей
[74,185]. Результаты этих исследований свидетельствуют о том, что аллель А по G20210A полиморфному локусу гена F2 является фактором повышенного риска развития венозного тромбоза в различных популяциях [185].
Результаты исследований, в которых были найдены положительные ассоциации между G20210A полиморфизмом гена F2 и риском развития тромбоза вен нижних конечностей, позволяют предположить, что замена G
на A в 3'-фланкирующей области гена может также быть фактором, который способствует образованию тромбов и в сосудах головного мозга.
В связи с вышесказанным была проанализирована группа пациентов с ишемическим инсультом, вызванным тромбозом каротидных или позвоночных артерий.
Группа пациентов с тромбозом магистральных артерий головы составила 20 человек (14 пациентов с атеротромботическим инсультом и 6 –
с «криптогенным»), из них 17 мужчин (85%) и 3 женщины (15%). Получено
93
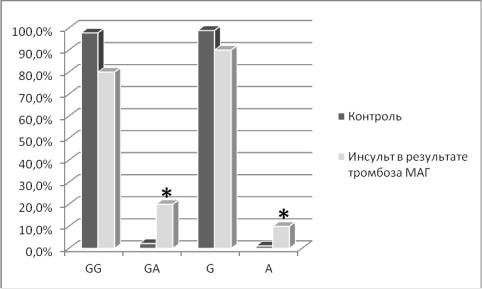
следующее распределение частот генотипов: G/G генотип встречался у 16
пациентов (80%), G/A – у 4 (20%) больных. Частота встречаемости G аллеля составила 90%, A аллеля – 10%. При сравнении данной группы пациентов с контролем получено статистически достоверное различие в распределении частот генотипов (p = 0,01; OР = 10,9; ДИ [1,8; 64,5]) и аллелей (p = 0,01; OР
= 9,8; ДИ [1,7; 55,4]) по исследуемому полиморфному локусу (Рис. 4.6).
Рисунок 4.6 Сравнительный анализ распределения частот генотипов и аллелей по G20210A полиморфному локусу гена F2 у пациентов с инсультом
в результате тромбоза церебральных артерий и контрольной группе (*-
различия достоверны, p < 0,05)
На следующем этапе мы сравнили пациентов с наличием тромбозов сосудов головного мозга и без них. В группе пациентов без тромбозов получено следующее распределение частот генотипов: G/G генотип встречался у 71 пациента, а носители G/A генотипа в этой группе больных отсутствовали. Соответственно, аллель G встречался в 100% случаев.
Результаты сравнения двух групп больных представлены на Рис. 4.7.
94
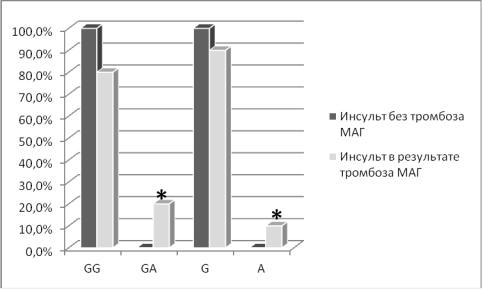
Рисунок 4.7 Сравнительный анализ распределения частот генотипов и аллелей по G20210A полиморфному локусу гена F2 в группе пациентов с тромбозами церебральных артерий и без них (*-различия достоверны, p < 0,05)
Выявлено статистически достоверное различие в распределении частот генотипов (p =0,002; ОР = 39,0; ДИ [1,9; 761,03]) и аллелей (p = 0,002; OР =
35,1; ДИ [1,8; 667,9]) по исследуемому полиморфному локусу между пациентами с тромбозом МАГ и больными без тромбоза. Таким образом,
аллель A и генотип G/A ассоциированы с повышенным риском развития ишемического инсульта у лиц молодого возраста в результате тромбоза МАГ.
В результате проведенного исследования можно сделать вывод о том,
что G20210A полиморфизм гена F2 ассоциирован с риском развития ишемического инсульта, вызванного тромбозом магистральных артерий головы, и не влияет на риск развития других патогенетических вариантов инсульта.
95
4.3Анализ вклада G1691A полиморфизма гена F5 в развитие ишемического инсульта у пациентов молодого возраста
G1691A полиморфизм (мутация Лейдена) гена F5 определен у 91
пациента с ишемическим инсультом молодого возраста и у 90 здоровых добровольцев.
Результаты генотипирования G1691A полиморфизма гена F5
представлены в Табл. 4.8
Таблица 4.8
Распределение частот генотипов и аллелей по G1691A полиморфизму
гена F5 в группах пациентов молодого возраста и контроля
Варианты |
|
МИ |
|
контроль |
||
генотипов |
и |
|
|
|
|
|
N=91 |
Частота, |
N=90 |
Частота, |
|||
аллелей |
|
% |
% |
|||
|
|
|
||||
|
|
|
|
|
|
|
F5 |
(GG) |
|
86 |
94,5 |
89 |
98,9 |
|
|
|
|
|
|
|
F5 |
(GA) |
|
5 |
5,5 |
1 |
1,1 |
|
|
|
|
|
|
|
F5 |
(AA) |
|
0 |
0 |
0 |
0 |
|
|
|
|
|
|
|
F5 |
(G) |
|
177 |
97,3 |
179 |
99,5 |
|
|
|
|
|
|
|
F5 |
(A) |
|
5 |
2,7 |
1 |
0,5 |
|
|
|
|
|
|
|
Достоверных различий в распределении частот генотипов и аллелей по
G1691A полиморфному локусу гена F5 между группой пациентов молодого возраста и контрольной группой не получено (для генотипов р = 0,210, для аллелей p = 0,215).
Нами также был проведен сравнительный анализ распределения частот генотипов и аллелей по G1691A полиморфизму гена F5 между пациентами и контрольной группой в зависимости от гендерной принадлежности.
96

Достоверных различий в распределении частот генотипов и аллелей между сравниваемыми группами у мужчин не получено (для генотипов p = 0,65, для аллелей p = 0,65, соответственно) (Табл. 4.9).
Таблица 4.9
Распределение частот генотипов и аллелей по G1691A полиморфизму
гена F5 у мужчин в группах пациентов молодого возраста и контроля
Варианты |
|
МИ |
|
контроль |
||
генотипов |
и |
|
|
|
|
|
N=72 |
Частота, |
N=45 |
Частота, |
|||
аллелей |
|
% |
% |
|||
|
|
|
||||
|
|
|
|
|
|
|
F5 |
(GG) |
|
68 |
94,4 |
44 |
97,8 |
|
|
|
|
|
|
|
F5 |
(GA) |
|
4 |
5,6 |
1 |
2,2 |
|
|
|
|
|
|
|
F5 |
(AA) |
|
0 |
0 |
0 |
0 |
|
|
|
|
|
|
|
F5 |
(G) |
|
140 |
97,2 |
89 |
98,9 |
|
|
|
|
|
|
|
F5 |
(A) |
|
4 |
2,8 |
1 |
1,1 |
|
|
|
|
|
|
|
При сравнении женщин в исследуемых группах достоверных различий в распределении частот генотипов и аллелей не получено (для генотипов p = 0,46, для аллелей p = 0,30, соответственно) (Табл. 4.10).
Таблица 4.10
Распределение частот генотипов и аллелей по G1691A полиморфизму
гена F5 у женщин в группах пациентов молодого возраста и контроля
Варианты |
|
МИ |
|
контроль |
||
генотипов |
и |
|
|
|
|
|
N=19 |
Частота, |
N=45 |
Частота, |
|||
аллелей |
|
% |
% |
|||
|
|
|
||||
|
|
|
|
|
|
|
F5 |
(GG) |
|
18 |
94,7 |
45 |
100 |
|
|
|
|
|
|
|
F5 |
(GA) |
|
1 |
5,3 |
0 |
0 |
|
|
|
|
|
|
|
F5 |
(AA) |
|
0 |
0 |
0 |
0 |
|
|
|
|
|
|
|
97
F5 |
(G) |
37 |
97,4 |
90 |
100 |
|
|
|
|
|
|
F5 |
(A) |
1 |
2,6 |
0 |
- |
|
|
|
|
|
|
На следующем этапе сравнивали частоты распределения аллельных вариантов G1691A полиморфизма гена F5 у лиц с разными патогенетическими вариантами ишемического инсульта.
У молодых больных с атеротромботическим вариантом ИИ G/G
генотип был выявлен у 31 человека (100%), G/A генотип не встречался ни у одного пациента. Частота встречаемости аллеля G составила 100%. При сравнении со здоровым контролем статистически достоверных различий в частоте встречаемости генотипов и аллелей не получено (для генотипов и аллелей p = 1,00) (Рис. 4.8).
При лакунарном патогенетическом варианте: G/G генотип встречался у
24 больных (88,9%), G/A – у 3 человек (11,1%). Частота встречаемости G
аллеля составила 94,4%, A аллеля – 5,6%. При сравнении со здоровым контролем у молодых больных с лакунарным инсультом наблюдается достоверное преобладание генотипа G/A (p = 0,038, ОР = 11,1, ДИ [1,11; 111,88]). При анализе распределения частот аллелей у больных с данным патогенетическим вариантом также получено достоверное увеличение частоты встречаемости аллеля A по сравнению с контролем (p = 0,039, ОР =
10,5, ДИ [1,07; 103,46]) (Рис. 4.8).
При «криптогенном» инсульте G/G вариант встречался у 31 пациента
(93,9%), G/A – 2 (6,1%). Частота встречаемости G аллеля составила 97%, A
аллеля – 3%. Между данной группой больных и контролем статистически достоверных различий в распределении частот генотипов и аллелей не выявлено (для генотипов p = 0,175, для аллелей p = 0,176, соответственно)
(Рис. 4.8).
98

Рисунок 4.8 Сравнительный анализ распределения частот генотипов и аллелей по G1691A полиморфизму гена F5 между пациентами с различными патогенетическими вариантами и контрольной группой (* – достоверность
различий между частотой генотипов и аллелей р<0,05)
Таким образом, по результатам проведенного исследования G1691A
генотип и 1691A аллель гена F5 ассоциированы с развитием лакунарного ишемического инсульта у пациентов молодого возраста.
Мутация Лейдена ассоциирована с устойчивостью к активированному протеину С – ингибитору фактора V и является причиной гиперкоагуляционной активности FV, что может способствовать развитию тромбозов. В связи с этим, данный полиморфизм был проанализирован в группе инсульта, вызванного тромбозом магистральных артерий головы.
Получено следующее распределение частот генотипов: G/G генотип встречался у 19 пациентов (95%), G/A – у 1 (5%). При сравнительном анализе распределения частот генотипов между пациентами и группой контроля статистически значимых различий в распределении частот генотипов между этими двумя группами получено не было (p = 0,33).
Таким образом, по результатам проведенного исследования G1691A
генотип и 1691A аллель гена F5 ассоциированы с риском развития
99
лакунарного ишемического инсульта у пациентов молодого возраста.
Однако, ассоциации с риском развития тромбоза мозговых артерий получено
не было.
4.4Анализ вклада C677T полиморфизма гена MTHFR в развитие ишемического инсульта у пациентов молодого возраста
Полиморфизм гена MTHFR определен у 90 пациентов с ишемическим инсультом молодого возраста и у 90 здоровых добровольцев.
Результаты генотипирования C677T полиморфного локуса гена MTHFR
представлены в Табл. 4.11.
Таблица 4.11
Распределение частот генотипов и аллелей по C677T полиморфному
локусу гена MTHFR в группах пациентов молодого возраста и контроля
Варианты |
МИ |
|
контроль |
||
генотипов и |
|
|
|
|
|
N=90 |
Частота, |
N=90 |
Частота, |
||
аллелей |
% |
% |
|||
|
|
||||
|
|
|
|
|
|
MTHFR(C/C) |
50 |
55,6 |
47 |
52,2 |
|
|
|
|
|
|
|
MTHFR (C/T) |
30 |
33,3 |
35 |
38,9 |
|
|
|
|
|
|
|
MTHFR(T/T) |
10 |
11,1 |
8 |
8,9 |
|
|
|
|
|
|
|
MTHFR (C) |
130 |
81,25 |
129 |
71,7 |
|
|
|
|
|
|
|
MTHFR(T) |
50 |
18,75 |
51 |
28,3 |
|
|
|
|
|
|
|
Достоверных различий в распределении частот генотипов и аллелей по
C677T полиморфному локусу гена MTHFR между группами больных и контроля получено не было (р = 0,7 и p = 1,0, соответственно).
При анализе распределения частот генотипов и аллелей отдельно у мужчин и женщин получены следующие результаты (Табл. 4.12 и Табл. 4.13).
100
