
Лекция №5. Ионная связь. Кристаллы
.docxИонная связь
Ионная связь образуется между гетероядерными атомами, которые сильно отличаются по электроотрицательности. В этом случае условно допускают, что валентные электроны электроположительного атома полностью переходят к электроотрицательному атому, в результате атомы превращаются в заряженные частицы, − ионы. Связь при этом будет осуществляться за счет взаимного притяжения противоположно заряженных ионов.
Так, при образовании NaCl атом электроположительного элемента натрия, характеризующийся сравнительно невысокой энергией ионизации, легко теряет внешний электрон и приобретает при этом устойчивую конфигурацию инертного газа (неона)
Na 1s22s22p63s1 → Na+ 1s22s22p6 + ē
Атом электроотрицательного элемента хлора, обладающего значительным сродством к электрону, способен принять на внешний уровень дополнительный электрон, приобретя также устойчивую конфигурацию инертного газа (аргона)
Cl 1s22s22p63s23p5 + ē → Cl− 1s22s22p63s23p6
За счет электростатического притяжения между образовавшимися ионами и возникает ионная связь
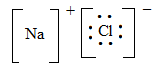
В отличие от ковалентной связи, ионная связь не обладает направленностью, т.к. создаваемое ионом электрическое поле имеет сферическую симметрию и сила притяжения к данному иону других ионов противоположного заряда зависит только от зарядов этих ионов и расстояния между ними.
Также ионная связь не обладает насыщаемостью, т.к. к одному иону может притягиваться неограниченное число ионов противоположного знака. Таким образом, понятие валентности к ионной связи не применимо.
Экспериментальные данные показывают, что идеальная ионная связь с полным переходом валентных электронов от одного атома к другому не осуществляется даже в случае пары щелочной металл – галоген. В NaCl связь лишь на 80% ионная. Четкую границу между ионной и ковалентной связью провести нельзя. Можно говорить лишь о степени ионности или ковалентности связи.
Металлическая связь
Межмолекулярное взаимодействие
Данные темы выносятся на самостоятельное рассмотрение (распечатка прилагается).
Строение твердых веществ
В зависимости от расстояния между частицами и от сил взаимодействия между ними вещество может находиться в твердом, жидком и газообразном состояниях. При изменении давления и температуры одно состояние может переходить в другое. Твердое и жидкое состояние часто называют конденсированным.
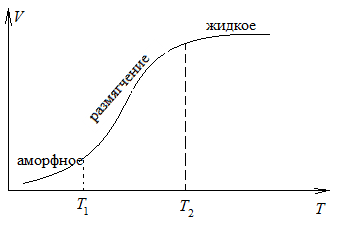
Твердое вещество может находиться в аморфном и кристаллическом состоянии. Аморфное состояние является метастабильным (с течением времени превращается в кристаллическое с выделением энергии), характеризуется изотропностью (одинаковостью значений свойств в любом направлении внутри вещества) и неупорядоченностью расположения частиц. Аморфные тела при нагреве размягчаются в большом температурном интервале, становятся вязкими, а затем переходят в жидкое состояние. Так, температурный интервал плавления силикатных стекол составляет 200°.
Кристаллические же тела остаются твердыми до определенной температуры, при которой они переходят в жидкое состояние
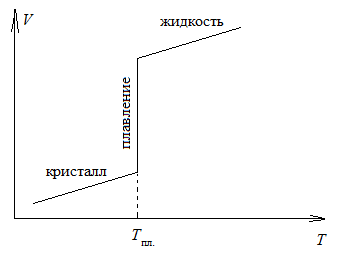
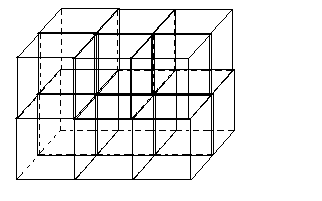
Они характеризуются упорядоченным расположением в пространстве частиц, образующих кристаллическую решетку. В кристалле частицы сближены до соприкосновения
Для упрощения пространственное изображение заменяют схемами, отмечая точками центры тяжести частиц
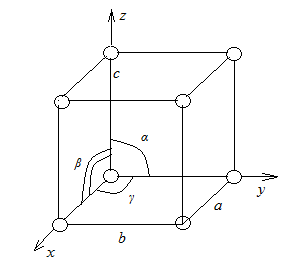
Если в кристалле провести три направления x, y, z, не лежащие в одной плоскости, то расстояния между частицами, расположенными по этим направлениям, в общем случае не одинаковы и соответственно равны a, b, c. Плоскости, параллельные координатным плоскостям, разбивают кристалл на множество таких одинаковых параллепипедов.
Наименьший параллепипед называют элементарной ячейкой. Для описания элементарной ячейки кристаллической решетки используют шесть величин: три отрезка, равные расстояниям a, b, c до ближайших частиц по осям координат, и три угла α, β, γ между этими отрезками. Соотношения между этими величинами определяются симметрией, согласно которой все кристаллы подразделяются на семь систем: триклинная, моноклинная, ромбическая, ромбоэдрическая, гексагональная, тетрагональная и кубическая. В большинстве случаев решетки имеют сложное строение, так как частицы находятся не только в узлах, но и на гранях или в центре решетки.
К основным характеристикам элементарной ячейки относятся:
-
Число частиц, приходящихся на одну элементарную ячейку (n)
-
Кратчайшее расстояние между частицами, образующими данный тип элементарной ячейки (l)
-
Координационное число,− число одинаковых частиц, расположенных на кратчайшем расстоянии от данной частицы (K)
-
Коэффициент компактности,− отношение объема всех частиц, приходящихся на одну элементарную ячейку, ко всему объему элементарной ячейки.
Все характеристики кубической элементарной ячейки связаны друг с другом соотношениями:
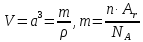
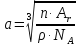
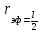
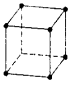
Рассмотрим следующие элементарные ячейки
|
Примитивный куб ПК |
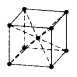
Объемно-центрированный куб ОЦК |
Гране-центрированный куб ГЦК |
Алмазоподобная
|
|
n
=
l = a (ребро куба) K = 6
|
n
=
l
=
K = 8
|
n
=
l
=
K = 12
|
n
=
l
=
K = 4
|
Для ионных кристаллов элементарная ячейка характеризуется еще и числом формульных единиц (молекул) z
z = n/2, n = n(Kat+) + n(An−)
l = r(Kat+) + r(An−)
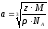
|
Тип CsCl |
Тип NaCl |
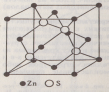
Тип ZnS (сфалерит) |
|
n(Cs+)
=
n(Cl−) = 1 n = n(Cl−) + n(Cs+) = 2 z
=
l
=
K = 8 |
n(Cl−)
=
n(Na+)
=
n = n(Cl−) + n(Na+) = 8 z
=
l
= K = 6
|
n(S2−) = 4
n(Zn2+)
=
n = n(S2−) + n(Zn2+) = 8
z
=
l
=
K = 4
|
В зависимости от частиц, образующих кристалл, и характера связи между ними различают четыре типа кристаллических решеток:
-
Атомные – в узлах кристаллической решетки находятся нейтральные атомы, соединенные прочными ковалентными связями. Вещества с атомной кристаллической решеткой (алмаз, карбид кремния, кварц) химически инертны. Имеют высокие температуры кипения и плавления, высокую твердость.
-
Молекулярные – в узлах кристаллической решетки находятся молекулы, связанные слабыми водородными связями или межмолекулярными силами. Вещества с молекулярной кристаллической решеткой (кристаллы льда, кислорода, азота, галогенов, СО2, фенол, CrO3, Mn2O7) имеют низкую механическую прочность, низкие температуры плавления и кипения, а следовательно, высокую летучесть. Обычно такие вещества растворимы в неполярных растворителях, а в расплаве плохо проводят электрический ток.
-
Ионные – в узлах кристаллической решетки находятся положительно и отрицательно заряженные ионы, между которыми действуют электростатические силы притяжения. Энергия связи ионного кристалла по своему значению близка к энергии связи атомного кристалла. В связи с этим вещества (NaCl, NaNO3, Na3AlF6 и др. соли), имеющие ионную кристаллическую решетку, имеют высокие температуры кипения и плавления, обладают низкой летучестью и высокой твердостью.
-
Металлические – в узлах кристаллической решетки находятся атомы и катионы металлов, между которыми находятся валентные электроны. Такое строение решетки обусловливает у веществ (металлы) большую электро- и теплопроводность, высокую пластичность, блекс.
Среди кристаллов распространено явление полиморфизма – способность в твердом состоянии при различных температурах или давлении иметь различные типы кристаллических структур. Эти кристаллические структуры называются полиморфными модификациями. Например, для SiO2 известны три модификации: кварц, тридимит, кристобалит.
Полиморфизм элементов (аллотропия) – способность химических элементов существовать в виде двух и более простых веществ, различающихся по строению и свойствам. Например, С: графит, алмаз, карбин, фуллерен.
Способность различных веществ существовать в одной и той же кристаллической форме (например, KMnO4 и BaSO4 имеют одинаковую кристаллическую решетку), называется изоморфизмом.

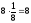
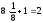
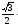 a
(половина
диагонали куба)
a
(половина
диагонали куба)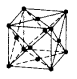
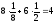
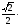 a
(половина
диагонали грани куба)
a
(половина
диагонали грани куба)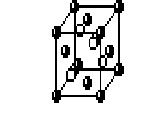
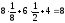
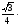 a
a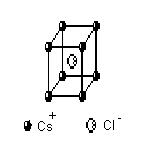
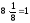
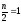
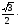 a
a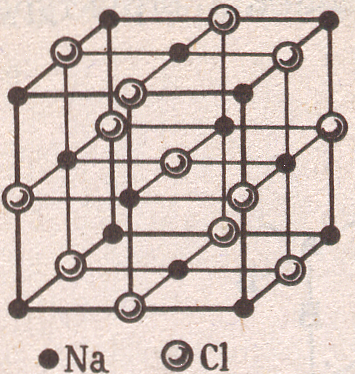

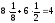
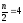
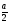
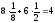
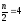
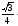 a
a