
Термохимия
.doc
Термодинамика химических реакций.
Химические превращения.
Уравнение химической реакции (стехиометрическок уравнение):
![]() . (1)
. (1)
Bi символы химических формул реагирующих веществ,
i стехиометрические коэффициенты.
Каждая химическая формула в уравнении реакции изображает 1 кмоль соответсвующего вещества; индекс «н» указывает начальные (исходные) вещества, индекс «к» конечные вещества (продукты реакции). Таким образом, в левой части стехиометрического уравнения указываются вещества, количества которых в ходе реакции уменьшаются, а в правой части вещества, возникающие в результате реакции.
Стехиометрические коэффициенты показывают, в каких соотношениях изменяются количества молей веществ в химической реакции. Правило знаков стехиометрических коэффициентов: iн < 0, iк > 0 (в литературе по термодинамике может встретиться противоположное правило знаков).
Вещества, участвующие в химической реакции, называются составляющими реакции. Мы будем рассматривать реакции при условии, что все ее составляющие являются идеальными газами.
Мера реакции. Пусть протекает химическая реакция
![]() .
.
В некотором
состоянии 1 в реакторе было
![]() кмоль реагирующих веществ, а в состоянии
2
кмоль реагирующих веществ, а в состоянии
2
![]() кмоль. Изменения количеств реагирующих
веществ в реакции будут
кмоль. Изменения количеств реагирующих
веществ в реакции будут
![]() ,
,
![]() и
и
![]() .
При химических превращениях изменения
количеств реагирующих веществ
пропорциональны соответствующим
стехиометрическим коэффициентам:
.
При химических превращениях изменения
количеств реагирующих веществ
пропорциональны соответствующим
стехиометрическим коэффициентам:
![]() ,
кмоль (2)
,
кмоль (2)
или в дифференциальной форме
![]() ,
кмоль. (3)
,
кмоль. (3)
Коэффициент
пропорциональности
![]() или
или
![]() в этом уравнении называется мерой
реакции (иногда числом пробегов
реакции). Этот коэффициент характеризует
степень изменения состава системы при
химической реакции. Мера реакции является
величиной, общей для всех составляющих
химической реакции.
в этом уравнении называется мерой
реакции (иногда числом пробегов
реакции). Этот коэффициент характеризует
степень изменения состава системы при
химической реакции. Мера реакции является
величиной, общей для всех составляющих
химической реакции.
Выразим через меру реакции изменение количества вещества в реакции:
![]() или
или
![]() ,
кмоль.
,
кмоль.
О работе, получаемой за счет химической энергии. Запишем два выражения дифференциала внутренней энергии:
![]() ,
кДж
,
кДж
и
![]() ,
кДж.
,
кДж.
Здесь
![]() максимальное
количество немеханической работы.
Немеханическая работа имеет максимальное
значение, если химическая реакция
осуществляется термодинамически
обратимо.
максимальное
количество немеханической работы.
Немеханическая работа имеет максимальное
значение, если химическая реакция
осуществляется термодинамически
обратимо.
Химическая реакция называется термодинамически обратимой, если в каждом ее состоянии соблюдается внутреннее и внешнее термодинамическое равновесие, т.е. температуры и давления всех составляющих реакции одинаковы (внутреннее равновесие) и одинаковы температуры и давления реагирующей смеси и окружающей среды (внешнее равновесие). Условием термодинамической обратимости реакции является бесконечно медленное её проведение, т.е. проведение её бесконечно малыми шагами от одного состояния равновесия к следующему, бесконечно близкому предыдущему.
Хотя обратимые процессы возможны только теоретически, но мы вправе рассматривать реакцию как термодинамически обратимую, поскольку на практике к обратимому проведению реакции можно приблизиться и иногда с высокой точностью. Например, в лабораторных условиях возможно практически обратимо проводить химическую реакцию в гальванических элементах. Если сопротивлние внешней цепи гальванического элемента настолько велико (а следовательно, сила тока настолько мала), что выделяющейся в цепи джоулевой теплотой можно пренебречь, то прохождение тока и вызывающую его химическую реакцию можно считать обратимыми.
Сравнивая между собой приведенные выше выражения дифференциала внутренней энергии, получаем:
![]() , (4)
, (4)
где
![]()
изменение химической энергии системы.
Следовательно, за счет изменения
химической энергии системы может быть
получена немеханическая работа; знак
«минус» означает, что при совершении
немеханической работы химическая
энергия уменьшается.
изменение химической энергии системы.
Следовательно, за счет изменения
химической энергии системы может быть
получена немеханическая работа; знак
«минус» означает, что при совершении
немеханической работы химическая
энергия уменьшается.
Чтобы представить себе, как получается, что химическая энергия системы превращается в работу, возьмем для примера гальванический элемент. При протекании в нем химической реакции во внешней цепи возникает электрический ток, который может совершить работу.
Тепловые эффекты химической реакции.
Раздел химической термодинамики, в
котором рассматриваются тепловые
эффекты реакций, называется термохимией.
Этот раздел основывается на первом
законе термодинамики. Химические
превращения принято рассматривать при
условии постоянства в системе либо
температуры и объема
![]() ,
либо температуры и давления
,
либо температуры и давления
![]() ,
поэтому тепловые эффекты рассматриваются
именно для этих условий.
,
поэтому тепловые эффекты рассматриваются
именно для этих условий.
Запишем в конечной форме выражения для изменения внутренней энергии и энтальпии в химической реакции (уравнения первого закона термодинамики):
![]() ,
,
![]() .
.
Здесь
![]() и
и
![]() разность внутренних
энергий и разность энтальпий продуктов
реакции и исходных веществ.
разность внутренних
энергий и разность энтальпий продуктов
реакции и исходных веществ.
Если немеханическая работа не производится, а протекает химическая реакция, то из этих уравнений получим:
![]() и
и
![]() ,
кДж.
,
кДж.
Эти величины называются тепловыми эффектами химической реакции при соответствующих условиях.
Определение.
Тепловым эффектом химической реакции
называется количество теплоты, выделяемое
или поглощаемое системой при неизменных
![]() или
или
![]() и при условии, что системой не производится
немеханическая работа.
и при условии, что системой не производится
немеханическая работа.
Реакции,
сопровождающиеся выделением теплоты,
называются экзотермическими,
а реакции, в которых теплота поглощается,
эндотермическими. В первом
случае теплота должна быть отведена от
системы для поддержания
![]() ,
а во втором с той
же целью теплота должна быть подведена
к системе. В соответствии с правилом
знаков, принятых для количества теплоты,
тепловой эффект экзотермической реакции
отрицателен, а тепловой эффект
эндотермической реакции положителен.
Будем обозначать тепловые эффекты
символами
,
а во втором с той
же целью теплота должна быть подведена
к системе. В соответствии с правилом
знаков, принятых для количества теплоты,
тепловой эффект экзотермической реакции
отрицателен, а тепловой эффект
эндотермической реакции положителен.
Будем обозначать тепловые эффекты
символами
![]() при
при
![]() и
и
![]() при
при
![]() .
Тепловой эффект
.
Тепловой эффект
![]() иногда называют изменением энтальпии
реакции или просто энтальпией реакции.
иногда называют изменением энтальпии
реакции или просто энтальпией реакции.
Найдем связь между тепловыми эффектами
![]() и
и
![]() .
Значения энтальпии в начальном и конечном
состояниях системы:
.
Значения энтальпии в начальном и конечном
состояниях системы:
![]() и
и
![]() .
.
Разность энтальпий:
![]() .
.
При
![]()
![]() ,
,
![]() .
.
Перепишем
последнее выражение, применив к i-тым
составляющим реакции уравнение состояния
идеального газа
![]() .
В этом уравнении p,
Па, V, м3, n,
кмоль, T, К,
.
В этом уравнении p,
Па, V, м3, n,
кмоль, T, К,
![]() ,
Дж/(моль.К).
,
Дж/(моль.К).
Из уравнения
состояния
![]() .
Реакция протекает в условиях
.
Реакция протекает в условиях
![]() .
Следовательно,
.
Следовательно,
![]() .
.
Учитывая, что
разность сумм равна сумме разностей, а
также выражая изменения количеств
составляющих через меру реакции и имея
в виду, что величина
![]() для
данной реакции постоянна, получим
для
данной реакции постоянна, получим
![]() ,
,
где коэффициенты
![]() берутся со своими знаками.
берутся со своими знаками.
Получившееся уравнение
![]() ,
кДж
,
кДж
поделим на
меру реакции
![]() кмоль,
чтобы перейти к молярным значениям
тепловых эффектов:
кмоль,
чтобы перейти к молярным значениям
тепловых эффектов:
![]() или
или
![]() ,
кДж/кмоль.
,
кДж/кмоль.
Если относить изменение функций состояния к 1 кмоль такой составляющей реакции, стехиометрический коэффициент которой равен единице, получим
![]() ,
кДж/кмоль.
,
кДж/кмоль.
В дальнейшем будем обозначать молярные величины без знака волны:
![]() ,
кДж/кмоль. (5)
,
кДж/кмоль. (5)
Термохимическое уравнение. Уравнение химической реакции с указанием значения теплового эффекта называется термохимическим уравнением. Значение теплового эффекта с его знаком указывают в правой части термохимического уравнения, например:
:
СО + 0,5О2 = СО2 284000 кДж/кмоль.
В этой реакции тоже получается двуокись углерода, но тепловой эффект этой реакции имеет другое значение. При определении тепловых эффектов по таблицам следует учитывать, что в таблицах указаны тепловые эффекты образования веществ из элементов. Поэтому в таблице мы найдем для теплового эффекта образования СО2 значение 394000 кДж/кмоль, а не
284000 кДж/кмоль.
Закон Гесса. Положение, называемое законом Гесса, установлено в 1840 г. русским химиком Г.И. Гессом. Оно заключается в следующем: тепловой эффект химической реакции зависит только от начального и конечного состояний реакции и не зависит от ее промежуточных стадий.
На основании закона Гесса термохимическими уравнениями можно оперировать как алгебраическими, т.е. можно комбинировать их по своему усмотрению с целью определения теплового эффекта какой-либо стадии реакции.
Пример 1. Известно:
С + 0,5О2 = СО 110500 кДж/кмоль,
СО + 0,5О2 = СО2 284000 кДж/кмоль.
Сложим эти термохимические уравнения и получим:
С + О2 = СО2 394000 кДж/кмоль.
Количество
теплоты не является функцией состояния:
выделяемое или поглощаемое в процессе
количество теплоты зависит от характера
этого процесса. Но химические реакции
наблюдаются в условиях
![]() или
или
![]() ,
а в этих случаях, согласно уравнениям
1-го закона термодинамики, количество
теплоты выражается разностями функций
состояния (соответственно
,
а в этих случаях, согласно уравнениям
1-го закона термодинамики, количество
теплоты выражается разностями функций
состояния (соответственно
![]() )
и поэтому не зависит от характера
процесса.
)
и поэтому не зависит от характера
процесса.
Пример.
Тепловой эффект реакции образования
ацетилена С2Н2 из элементов
составляет
![]() =
226860 кДж/кмоль; тепловые эффекты полного
сгорания углерода и водорода соответственно
равны 394000 и 242020
кДж/кмоль. Определить тепловой эффект
реакции сгорания ацетилена.
=
226860 кДж/кмоль; тепловые эффекты полного
сгорания углерода и водорода соответственно
равны 394000 и 242020
кДж/кмоль. Определить тепловой эффект
реакции сгорания ацетилена.
Решение. Реакция сгорания ацетилена:
С2Н2 + 2.5 О2 = 2СО2 + Н2О + Н.
Нужно определить Н. Для этого дано: реакция образования ацетилена:
2С + Н2 = С2Н2 + 226860 кДж/кмоль.
Реакции сгорания углерода и водорода:
С + О2 = СО2 394000 кДж/кмоль,
Н2 + 0,5 О2 = Н2О – 242000 кДж/кмоль.
Скомбинируем последние три термохимических уравнения так, чтобы при их сложении получалось уравнение сгорания ацетилена:
С2Н2 = 2С + Н2 226860
2С + 2О2 = 2СО2 2 394000
Н2 + 0,5 О2 = Н2О – 242000
-----------------------------------------------
С2Н2 + 2.5 О2 = 2СО2 + Н2О + Н
Видно, что одну и ту же реакцию можно провести двумя различными путями: первый путь непосредственное сгорание ацетилена, а второй поэтапное проведение реакции.
На основании закона Гесса получим:
Н = –226860 – 2 394000 – 242000 = –1256880 кДж/кмоль.
Запишем этот результат в обозначениях:
Н
= –1![]() +
2
+
2![]() +
1
+
1![]() .
.
Это выражение записано через тепловые эффекты образования всех веществ, участвующих в реакции сгорания ацетилена.
Следствие из закона Гесса: тепловой эффект реакции равен алгебраической сумме произведений стехиометрических коэффициентов на тепловые эффекты образования веществ, участвующих в реакции, т.е.
![]() ,
кДж/кмоль. (6)
,
кДж/кмоль. (6)
В этом выражении
![]() берутся со своими знаками.
берутся со своими знаками.
Это следствие из закона Гесса можно применить и к изохорному тепловому эффекту:
![]() ,
кДж/кмоль. (7)
,
кДж/кмоль. (7)
В таблицах
термодинамических величин даются
изобарные тепловые эффекты образования
веществ при стандартных условиях
![]() ;
эта величина называется стандартной
энергией Гиббса образования.
Стандартные условия:
;
эта величина называется стандартной
энергией Гиббса образования.
Стандартные условия:
![]() =
1 атм и Т0 = 298,15 К. Стандартные
условия отличаются от введенных ранее
нормальных условий значением температуры.
=
1 атм и Т0 = 298,15 К. Стандартные
условия отличаются от введенных ранее
нормальных условий значением температуры.
Стандартная энергия Гиббса реакции определяется по формуле:
![]() . (8)
. (8)
Поскольку в таблицах не приводятся стандартные энергии Гельмгольца образования веществ, то изохорные тепловые эффекты реакций образования при стандартных условиях определяются по уравнению:
![]() .
.
Зависимость теплового эффекта реакции от температуры (уравнение Кирхгофа).
Продифференцируем полученные из закона Гесса выражения
![]() и
и
![]()
по температуре,
первое при
![]() ,
а второе при
,
а второе при
![]() .
Получим:
.
Получим:
 и
и
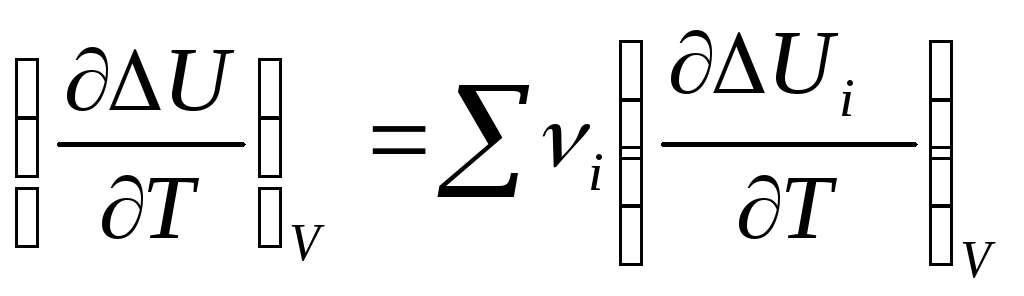 .
.
Так как
![]() и
и
![]() ,
кДж/кмольК,
,
кДж/кмольК,
то
![]() и
и
![]() .
.
Полученные выражения называются
уравнениями Кирхгофа. Они выражают
зависимость теплового эффекта реакции
от температуры. Здесь i
стехиометрические коэффициенты, которые
записываются со своими знаками, а
![]() и
и
![]()
молярные теплоемкости составляющих
реакции.
молярные теплоемкости составляющих
реакции.
Поскольку для идеальных газов внутренняя энергия и энтальпия являются функциями только температуры, то имеем полные производные:
![]() и
и
![]() .
.
Используя
общее обозначение Q
для тепловых эффектов
![]() и
и
![]() ,
запишем полученные выражения в обобщенном
виде
,
запишем полученные выражения в обобщенном
виде
![]()
и произведем интегрирование:
![]() .
.
Здесь Q0 постоянная интегрирования. Чтобы выполнить интегрирование, нужно иметь зависимости истинных молярных теплоемкостей составляющих реакции от температуры. Теплоемкости задаются в виде следующих многочленов:
![]()
Интегрируя, ограничимся тремя членами этой зависимости и получим:
![]() .
(1)
.
(1)
Постоянную
интегрирования Q0
можно было бы рассматривать как тепловой
эффект при
![]() К,
но только в том случае, если бы принятые
при интегрировании зависимости
теплоемкости от температуры были
справедливы вплоть до абсолютного нуля.
Поскольку это не так, то для определения
Q0 нужно располагать
значением теплового эффекта рассматриваемой
реакции при какой-либо определенной
температуре, для которой используемые
зависимости теплоемкостей справедливы,
т.е.требуются начальные условия.
К,
но только в том случае, если бы принятые
при интегрировании зависимости
теплоемкости от температуры были
справедливы вплоть до абсолютного нуля.
Поскольку это не так, то для определения
Q0 нужно располагать
значением теплового эффекта рассматриваемой
реакции при какой-либо определенной
температуре, для которой используемые
зависимости теплоемкостей справедливы,
т.е.требуются начальные условия.
Примем
![]() при
при
![]() .
Получим:
.
Получим:
![]() .
.
Выразим отсюда Q0 и подставим его в уравнение (1):
![]() .
.
Пользуясь
полученным уравнением, можно выразить
и
![]() ,
и
,
и
![]() .
Перепишем его применительно к изобарному
тепловому эффекту
.
Перепишем его применительно к изобарному
тепловому эффекту
![]() ,
а начальные условия выберем при
стандартных условиях:
,
а начальные условия выберем при
стандартных условиях:
![]() при Т1 = 298 К. Тогда получим
следующую формулу, выражающую зависимость
изобарного теплового эффекта реакции
от температуры:
при Т1 = 298 К. Тогда получим
следующую формулу, выражающую зависимость
изобарного теплового эффекта реакции
от температуры:
![]() (А)
(А)
Чтобы подставить
в эту формулу стандартную энергию Гиббса
![]() ,
ее нужно подсчитать по приведенной выше
формуле
,
ее нужно подсчитать по приведенной выше
формуле
![]() .
(В)
.
(В)
Значения
![]() определяются по таблицам стандартных
термодинамических величин.
определяются по таблицам стандартных
термодинамических величин.
Химическое равновесие.
До тех пор, пока не рассматривались химические превращения, понятия «равновесие» и «обратимость» понимались однозначно. Но при переходе к химическим реакциям необходимо отличать понятия химического равновесия и химической обратимости от понятий термодинамического равновесия и термодинамической обратимости.
Запишем уравнение химической реакции:
![]() .
.
Перед
проведением реакции в реакторе смешиваются
начальные вещества (индекс «н»). Такое
состояние реакции называется исходным,
а состав исходным
составом. Молярный исходный состав
реакции будем обозначать прописными
буквами:
![]() кмоль.
кмоль.
Исходная смесь веществ характеризуеся неоднородностью поля химического потенциала, в силу чего и происходит химическая реакция. В этой стадии реакция является химически неравновесной.
Некоторое время реакция идет в прямом направлении в сторону образования конечных веществ (индекс «к»). Когда в реакторе появляется некоторое количество конечных веществ, реакция начинает идти не только в прямом, но и в обратном направлении1, но в прямом интенсивнее, чем в обратном. Постепенно количества начальных веществ уменьшаются, а количества конечных веществ увеличиваются, т.е. на химически
неравновесной стадии реакции ее состав является переменным.
Важно учесть
следующее обстоятельство. В действительности
ни одна реакция не продолжается до
полного израсходования начальных
веществ. В каждой реакции при определенных
Т и р с течением времени
обязательно наступает такое состояние,
в котором реакция начинает идти в прямом
и обратном направлениях с одинаковой
интенсивностью, поэтому ее состав
становится постоянным. В этом состоянии
реакция называется химически
равновесной, а ее состав
равновесным составом. Молярный состав
равновесной смеси будем обозначать
строчными буквами:
![]() кмоль.
кмоль.
В обеих стадиях химически неравновесной и химически равновесной реакция рассматривается как термодинамически обратимая. Понятие термодинамической обратимости процесса было сформулировано выше. Под химической обратимостью понимается возможность протекания реакции как в прямом, так и в обратном направлениях. Любая реакция химически обратима.
Зависимость химического потенциала
от давления. Мы будем рассматривать
химические реакции, главным образом, в
условиях
![]() .
В этих условях характеристической
функцией является энергия Гиббса G.
.
В этих условях характеристической
функцией является энергия Гиббса G.
Запишем основное уравнение термодинамики для сложной системы через энергию Гиббса:
![]() (1)
(1)
С другой стороны, поскольку
![]() ,
,
то
![]() . (2)
. (2)
Учитывая,
что
![]() и
и
![]() и сравнивая выражения (1) и (2), получаем
и сравнивая выражения (1) и (2), получаем
![]() , кДж/кмоль.
, кДж/кмоль.
Продифференцируем это выражение по давлению:
 . (3)
. (3)
Так как результат дифференцирования не зависит от порядка дифференцирования, то
 ,
м3/кмоль.
,
м3/кмоль.
Здесь ![]() представляет собой парциальный молярный
объем i-той составляющей
реакции.
представляет собой парциальный молярный
объем i-той составляющей
реакции.
Таким образом, получено выражение зависимости химического потенциала от давления:
![]() . (4)
. (4)
Химический потенциал составляющей реагирующей смеси идеальных газов. Парциальным называется объем, который занимала бы одна из составляющих смеси, имея давление и температуру смеси. Следовательно, уравнение состояния идеального газа можно записать следующим образом:
![]() ,
,
откуда парциальный молярный объем
![]() .
.
Подставим это выражение в уравнение (4) и получим
![]()
или
![]() .
.
Если система
представляет собой не смесь газов, а
один газ, то парциальный молярный объем
равен просто молярному объему, т.е.
также ![]() ,
следовательно, для одного газа можно
записать:
,
следовательно, для одного газа можно
записать:
![]() .
.
Проинтегрируем
это выражение от некоторого давления
![]() до текущего давления
до текущего давления
![]() :
:
 .
.
Получим при
![]() :
:
![]() .
.
Поскольку химический потенциал зависит и от температуры, то теперь будем считать температуру не постоянной, а переменной величиной:
