
606_HHerbakov_JU._S._Praktikum_Monitoring_sredy_obitanija_
.pdf
более ±1, что недостаточно для анализа питьевой и природной воды. Аппаратура: рН-метр; эталонные растворы; дистиллированная вода;
стаканчики на 200мл – 4 шт.; фильтровальная бумага
Материал: воды грунтовые, поверхностные и сточные.
Ход определения. Потенциометрический метод основан на измерении разности потенциалов на границах между внешней поверхностью стеклянной мембраны электрода и исследуемым раствором с одной стороны и внутренней поверхностью мембраны и стандартным раствором - с другой стороны. Стандартный раствор имеет постоянную активность ионов водорода, поэтому потенциал на внутренней поверхности мембраны не меняется . Сдвиг рН на единицу вызывает изменение потенциала электрода на 58,1 мВ при 200С. Метод отличается высокой точностью до 0,02. Результат определения не зависит от окраски, мутности, присутствия окислителей или восстановителей. Для измерения рН можно пользоваться рН-метрами различных марок. Перед началом работы ознакомиться с инструкцией на прибор. Определить рН поверхностной, грунтовой и сточной воды.
Контрольные вопросы
1.Что такое рН?
2.На каком принципе основано определение рН?
3.Какие требования по величине рН предъявляются к воде хозяйственнопитьевого назначения?
Практическое занятие №8
Определение биохимического потребления кислорода
В природной воде водоемов всегда присутствуют органические вещества, которые разрушаются бактериями, претерпевая аэробное биохимическое кисление с образованием двуокиси углерода. На окисление расходуется астворенный в воде кислород и его убыль косвенно является мерой содержания в оде органических веществ. Соответствующий показатель качества воды, характеризующий суммарное содержание в воде органических веществ, называется биохимическим потреблением кислорода (БПК).
БПК – количество кислорода в миллиграммах, требуемое для окисления находящихся в 1л воды органических веществ в аэробных условиях, без доступа света, при 200С, за определенный период в результате протекающих в воде биохимических процессов.
Методом биохимического потребления кислорода определяют количество растворенного кислорода (в миллиграммах на 1 л воды), которое требуется для окисления органического вещества аэробными бактериями.
Время, нужное для полной минерализации органического вещества, зависит при прочих равных условиях от природы органических веществ, содержащихся в испытуемой жидкости. К легкоокисляющимся («биологически мягким») веществам относятся формальдегид, сахара, спирты,
61

фенолы; к тяжело окисляющимся («биологически жестким») – неионогенные ПАВ, гидрохинон; к нормально окисляющимся – нафтолы, крезолы, анионогенные ПАВ, гидрохинон и др.
Обычно определяют БПК за 5 суток инкубации ( БПК5 ), однако содержание некоторых соединений более нормативно характеризуется величиной БПК за 10 суток
( БПК10 ) или за период полного окисления ( БПКполн.).
В поверхностных водах величина БПК5 колеблется в пределах от 0,5 – 5,0 мг/л; она подвержена сезонным и суточным изменениям, что связано с изменением температуры и биохимической активности микроорганизмов.
Норматив на БПКполн. не должен превышать: для водоемов хозяйственнопитьевого водопользования3мг/л, для водоемов культурно-бытового водопользования – 6 мг/л, а БПК5 для тех же водоемов 2 мг/л и 4 мг/л соответственно.
Определить истинное значение полного БПК сложно, так как при малом содержании в пробе органических веществ одновременно с их окислением идет процесс нитрификации.
Нитрификация протекает под воздействием особых нитрифицирующих бактерий. Эти бактерии обеспечивают окисление азотсодержащих соединений, которые обычно присутствуют в загрязненных природных и некоторых сточных водах, и тем самым способствуют превращению азота сначала из
аммонийной в нитритную, а затем и нитратную формы по уравнениям:
2NH4+ + 3O2 = 2HNO2 + 2H2O + 2H+ + Q
2HNO2 + O2 = 2HNO3 + Q
Количество кислорода, пошедшее на нитрификацию, может в несколько раз превышать количество кислорода, требуемое для биохимического окисления органических веществ. Нитрификация начинается примерно на седьмые сутки инкубации, поэтому при определении БПК за 10 и более суток необходимо вводить в пробу ингибиторы, подавляющие жизнедеятельность нитрифицирующих бактерий. Для этих целей используют тиомочевину, которую вводят в пробу или в разбавляющую воду в количестве
0,5 мг/мл.
Предлагаемый метод определения БПК до появления азота нитритов в количестве 0,1 мг/л с достаточной полнотой характеризует ход процесса биохимического окисления ( ИСО 5815 ).
Определение БПК производится в натуральной или в разбавленной пробе воды по разнице между содержанием растворенного кислорода в склянке в момент постановки опыта и после определенного периода инкубации. Разбавляющую воду добавляют в том случае, если в пробе очень много органических веществ. Пробы воды для определения БПК не консервируют, а анализируют сразу после отбора.
.Определение БПК в натуральной пробе воды (без разбавления
62

Для определения БПК воды с предполагаемым потреблением кислорода до 6 мг/л пробу воды отбирают в бутыль емкостью 2 л. Температура воды должна быть 20±1°С; если температура иная, то в лаборатории воду подогревают на водяной бане или охлаждают до требуемой температуры и сильно встряхивают в течение 10 мин для насыщения кислородом воздуха. Если при 20°С содержание растворенного кислорода выше 9 мг/л, что наблюдается во время цветения воды в водоеме (т. е. во время сильного развития водорослей), то жидкость перед анализом фильтруют через планктонную сеть), а избыток кислорода удаляют, так как при инкубации возможно выделение газообразного кислорода и выбрасывание пробки. Для удаления избытка кислорода применяется один из следующих приемов:
1)отсасывание воздуха из бутыли, заполненной жидкостью наполовину (после того как вода примет температуру 20°С), встряхивание склянки ускоряет выделение кислорода;
2)пропускание через воду сжатого воздуха. При наличии в речной воде взвеси БПК определяется как без отстаивания, так и в пробе, предварительно отстоенной в течение 30 мин непосредственно на месте отбора проб.
3)Аппаратура, реактивы: кислородные калиброванные склянки для
инкубирования проб; чашки Петри; термостат-инкубатор, обеспечивающий поддержание температуры (20±1)0С; оксиметр.
Материал: поверхностная вода водоема.
Из бутыли с помощью сифона воду наливают в 5 калиброванных склянок с притертыми пробками емкостью 200—250 мл, предварительно дважды ополоснутые испытуемой водой; затем стеклянную трубку сифона опускают на дно склянки и после вытеснения воды (в трехкратном объеме) наполняют склянки водой доверху и немедленно закрывают стеклянной пробкой, чтобы не оставалось пузырька воздуха. Затем эту же воду наливают в колпачки от склянок и, перевернув последние вверх дном, вставляют их в колпачки, вытесняя из последних воду, чтобы пузырьки воздуха из них попали в колпачки).
Водной из склянок с исследуемой водой тотчас же определяют растворенный кислород. Ход определения см. работу 3.4. Все остальные склянки помещают в нормальном положении в термостаты и хранят при 20°С (с колебаниями ±1°) в течение определенного времени (2, 5, 7, 10 суток).
Время между заполнением склянок и фиксированием кислорода при определений его концентрации в нулевых пробах не должно превышать 16 мин.
Определение БПК с разбавлением исследуемой воды
При определении БПК загрязненных вод растворенного кислорода может не хватить для покрытия потребности воды в нем, в этом случае воду перед началом определения разбавляют дистиллированной водой, содержащей
63

биогенные элементы. Степень разбавления должна обеспечить остаточное содержание растворенного кислорода в конце инкубации не менее 3—4 мг/л и убыль кислорода 4—5 мг/л. Когда величина БПК неизвестна, необходимо делать несколько разбавлений, например: 1:1, 1:2, 1:4, потребность в больших разбавлениях может иметь место для очень сильно загрязненных речных вод. В таких случаях разбавление приблизительно можно установить по окисляемости; кратность разбавления составляет 3/4 величины содержания
кислорода, определенного по перманганатной окисляемости.
Аппаратура: см. работу 4.1.
Реактивы. Разбавляющая вода готовится из дистиллированной воды, которая не должна содержать медь и свинец более 0,01 мг/л, цинк свыше 1 мг/л (ионы этих металлов могут попасть в дистиллированную воду из материала перегонного куба). Вода не должна так же содержать едкие щелочи, кислоты, активный хлор, хлорамины и другие бактерицидные вещества. Дистиллированную воду выдерживают в бутылях, закрытых марлей в течение нескольких дней, при комнатной температуре (целесообразно, чтобы температура воды была 20°С). Сосуды, применяемые для этой воды, использовать для других целей нельзя (даже для приготовления разбавляющей воды). Перед применением разбавляющей воды в нее добавляют по 1 мл на 1 л следующие растворы:
а) фосфатный буферный раствор (запасной раствор). В 500 мл дистиллированной воды растворяют 8,5 г КН2РО4; 21,75 г К2НРО4; 33,4 г
Na2HPО4·7H2O; 11,7 г NH4C1 и затем объем доводят до 1 л. Величина рН этого
раствора должна быть 7,2; б) раствор сульфата магния. В дистиллированной воде растворяют 22,5 г
MgSO4·7H2O и разбавляют до 1 л;
в) раствор хлорида кальция. В дистиллированной воде растворяют 27,5 г хлорида кальция и разбавляют до 1 л;
г) раствор хлорида железа (III). В дистиллированной воде растворяют 0,25 г FeCl3·6H2O и разбавляют до 1 л.
После прибавления солей воду хорошо перемешивают, но не аэрируют. Материал: вода водоема. В случае транспортировки проб летом вода
должна иметь температуру, близкую к нулю, для чего бутыль с водой помещается в экскурсионный ледник, а зимой воду предохраняют от замерзания, накладывая на бутыль пузырь с теплой водой. При наличии взвешенных веществ содержимое бутыли перемешивают перед каждым заполнением легким вращательным движением.
Ход определения. Мерную колбу посредством сифона заполняют до половины разбавляющей водой, прибавляют точно отмеренное (пипеткой, мерной колбой или мерным цилиндром) количество исследуемой воды и доливают до метки разбавляющей водой. Колбу закрывают и содержимое тщательно перемешивают, переворачивая колбу 15 - 16 раз.
В связи с тем, что исследуемая вода может содержать небольшое
64

количество бактерий, для интенсификации процесса можно сконцентрировать бактериальную биомассу на мембранном фильтре № 3, предварительно профильтровав воду через бумажный фильтр для удаления планктонных организмов. На 1 л разбавляющей воды достаточно обычно профильтровать 100 мл исследуемой воды. Сконцентрированную на фильтре биомассу смывают в стаканчик небольшим количеством воды и переливают в колбу с разбавляющей водой. Воду, обогащенную бактериями, описанным выше способом разливают в 5 калиброванных склянок (таким же способом, как при определении БПК в натуральной воде без разбавления). Одновременно наполняют разбавляющей водой 5 калиброванных склянок. Каждой пробе испытуемой воды должна соответствовать одна склянка с разбавляющей водой.
В одной из склянок с испытуемой водой и в одной из склянок с разбавляющей водой (нулевые пробы) тотчас же определяют растворенный кислород.
Все остальные склянки помещают в термостат и хранят при температуре 20±10С.
Через 2, 5, 7, 10 суток от начала инкубации из термостата вынимают по одной склянке с испытуемой и с разбавляющей водой и определяют в них растворенный кислород и содержание нитритов. Нитриты определяют в воде, налитой в колпачок склянки, который снимают так же, как надевали (т. е. перевернув склянку вверх дном). Если в пробе начался процесс нитрификации, что обнаруживается по появлению в воде нитритов в концентрации, превышающей 0,1 мг/л, то дальнейшее определение БПК не проводят. Если следы нитритов появляются на вторые или пятые сутки, то следующее определение производится через 4 и 7 суток соответственно. Если в лаборатории нет склянок с пришлифованными стеклянными колпачками, то для контроля за процессом нитрификации в термостат можно поставить дополнительно 8 неградуированных склянок любого размера, наполненных той же водой (испытуемой и разбавляющей), и в них определять содержание нитритов после каждого срока инкубации. Все склянки ставятся в термостате в сосуд, наполненный небольшим количеством дистиллированной воды, пробками вниз, так, чтобы горлышко склянок было погружено в воду, которая образует водяной затвор. Дистиллированную воду в сосуде обновляют при каждом определении. Если содержание азота нитритов в склянке будет больше 0,1 мг/л, определение растворенного кислорода производится с азидом натрия, либо по одному из следующих методов:
1)с сульфаминовой кислотой или с раствором мочевины (вариант А);
2)с бикарбонатом натрия (вариант Б).
Вариант А. В кислородную склянку, заполненную доверху пробой, добавляют 2 мл раствора сульфата марганца (40%), при этом наполненную пипетку погружают до самого дна кислородной склянки. Затем открывают верхний конец пипетки и ее медленно вынимают. Другой пипеткой прибавляют к пробе 2 мл раствора едкого кали (70%). Кончик пипетки при
65

этом опускают только под уровень воды в горлышке кислородной склянки. Склянку осторожно закрывают, чтобы под пробкой не образовались пузырьки воздуха. Содержимое хорошо перемешивают (переворачиванием склянки) до образования хлопьевидного хорошо выпадающего осадка. Осадку дают отстояться и затем жидкость над осадком сифонируют, а к осадку добавляют 5 мл разбавленной серной кислоты. Полученный раствор переливают в колбу, склянку ополаскивают 3 раза небольшими порциями дистиллированной воды, которые вливают в ту же колбу. Затем в колбу добавляют 0,3 мл 40%-ного раствора сульфаминовой кислоты или 0,3 мл 40%-ного раствора мочевины и после этого 2 мл 15%-ного раствора KJ. Через 5 мин раствор титруют 0,05Н раствором тиосульфата натрия с индикатором крахмалом.
Вариант Б. После растворения осадка гидроокиси марганца в колбу для титрования прибавляют 1 г бикарбоната натрия и оттитровывают выделившийся йод тиосульфатом натрия.
Надежным должно считаться определение БПК в тех пробах, где нитрификация только началась. Для большей достоверности получаемых результатов рекомендуется на инкубацию ставить параллельно 2 склянки; из найденных величин вычисляют среднюю.
Определение и расчет количества растворенного кислорода в пробе.
Расчет.
БПКполн вычисляют |
по |
формуле |
БПКполн = 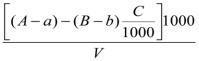 ,
,
где А - начальное количество растворенного кислорода в воде, мг/л;
α — количество растворенного кислорода в воде после n суток инкубации, мг/л; В — начальное количество растворенного кислорода в разбавляющей воде, мг/л;
b —количество растворенного кислорода в разбавляющей воде спустя n суток инкубации, мг/л; С — количество разбавляющей воды, мл;
V — объем исследуемой воды, взятый для анализа, мл.
Определение БПК в воде, содержащей свободный хлор
Вода, содержащая свободный хлор, перед определением должна быть освобождена от активного хлора, для чего ее обрабатывают сульфитом натрия или тиосульфатом натрия. Для установления требующегося количества сульфита натрия отбирают отдельную порцию воды, подкисляют 0,02 Н
66

соляной кислотой, прибавляют 10 мл 10%-ного раствора химически чистого йодида калия и раствор крахмала и оттитровывают выделившийся йод раствором сульфита натрия до исчезновения синего окрашивания.
Количество тиосульфата натрия, необходимое для восстановления свободного хлора, определяют также титрованием отдельной пробы. К 100 мл исследуемой воды прибавляют 10 мл 10%-ного раствора йодида калия и титруют 0,025Н раствором тиосульфата натрия с применением раствора крахмала в качестве индикатора.
На 100 мл пробы, предназначенной для определения БПК, прибавляют раствор сульфита натрия или тиосульфита натрия в количестве, рассчитанном по результатам вышеописанного титрования, после чего пробу перемешивают.
Аппаратура: кислородные склянки с хорошо притертой косо срезанной пробкой, емкостью 200—250 мл со стеклянным пришлифованным колпачком, калиброванные с точностью до 0,1 мл; мерные колбы и пипетки; сифон; бутыль; термостат на 20°С с колебаниями не более ±1°С; склянки и мерная посуда для разведения должны быть очень тщательно вымыты, так как даже небольшое загрязнение дает увеличение БПК.
Склянки должны быть обезжирены хромовой смесью, тщательно отмыты от хромовой смеси и высушены.
Реактивы: сульфаминовая кислота, 40% -ный раствор; мочевина, 40%- ный раствор; бикарбонат натрия; тиосульфат натрия, 0,16 г безводного Na2S203 растворяют в 100 мл дистиллированной воды непосредственно перед применением. Раствор неустойчив.
Сульфит натрия: 3,5 г кристаллического сульфита натрия Na2S03*7H20 растворяют в 1 л воды.
Ход определения. После добавления растворов сульфита натрия или тиосульфата натрия определение ведут так, как описано на в работе 3.2.2.
Контрольные вопросы
1.Что такое БПК? С какой целью ее определяют?
2.Как влияют на величину БПК процессы нитрификации?
3.С какой целью определяют БПК5 и БПКполн.?
4.Как определяют БПК в натуральной пробе без разбавления?
5.Как определяют БПК с разбавлением испытуемой воды?
6.Каковы особенности определения БПК в воде, содержащей свободный хлор?
Определение жесткости воды
Жесткость воды отражает содержание в ней ионов кальция и магния. Различают общую Жо, карбонатную Жк и некарбонатную Жнкжесткость.
|
Жо = Жк + Жнк |
|
Карбонатная жесткость |
Жк обусловлена |
присутствием в воде |
гидрокарбонатов кальция |
и магния ( |
Са(НСО3)2, Mg(HCO3)2 ), |
|
67 |
|
анекарбонатная жесткость |
Жнк - |
хлористыми, |
сернокислыми и другими |
|||||
некарбонатными солями кальция и магния. |
|
|
|
|
|
|||
Различают |
также |
постоянную |
и |
временную |
(устранимую) |
|||
жесткость. Устранимая жесткость |
определяется |
экспериментально |
и |
|||||
показывает на сколько уменьшилась жесткость воды за 1 час кипячения. За это время бикарбонаты переходят в малорастворимые карбонаты, что приводит к образованию накипи и уменьшению жесткости воды.
Жпост = Жо - Жвр
Общую Жо и карбонатную Жк жесткость воды определяют методом титрования.
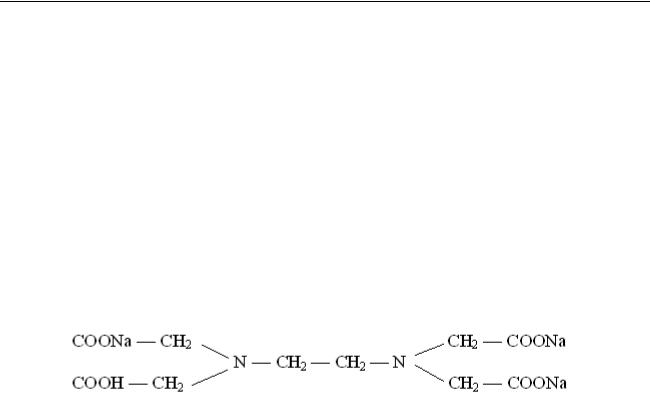
Основным рабочим раствором является трилон Б – двунатриевая соль этилендиамин-тетрауксусной кислоты:
Определение суммарного содержания ионов кальция и магния основано на способности трилона Б образовывать с этими ионами прочные комплексные
соединения в щелочной среде, замещая свободные ионы водорода на катионы
Са2+ и Mg2+:
Ca2+ + Na2H2R → Na2CaR + 2H+,
где
R – радикал этилендиаминтетрауксусной кислоты.
В качестве индикатора используется хромоген черный, дающий с Mg2+ соединение винно-красного цвета; при исчезновении Mg2+ он приобретает голубую окраску. Реакция идет при рН ~ 10, что достигается добавлением в пробу аммиачного буферного раствора
(NH4OH + NH4Cl). В первую очередь связываются ионы кальция, а затем магния.
Определению мешают ионы меди (> 0,002 мг/л), марганца (> 0,05 мг/л), железа (> 1,0 мг/л), алюминия (> 2,0 мг/л).
Оборудование, реактивы: бюретка; пипетки: 15 мл и 100 мл; колба коническая 250 мл; капельница; мерный цилиндр 100 мл; раствор трилона Б ~0,05 Н; раствор MgSO4 0,05Н; аммиачный буферный раствор ((NH4OH + NH4Cl)); индикатор хромоген черный.
Материал: вода водоема.
Ход работы:
1. Определение нормальности трилона Б производится по стандартному
0,05 Н раствору MgSO4.
68

В коническую колбу отмеряют пипеткой 15 мл 0,05Н раствор MgSO4, добавляют 85 мл дистиллированной воды (до 100 мл мерным цилиндром), приливают 5 мл аммиачного буферного раствора и 5 капель индикатора хромогена черного, после чего проводят титрование раствором трилона Б
(~0,05 Н).
Пробу титруют до появления голубой окраски от одной прилитой капли трилона Б, что свидетельствует об исчезновении ионов Mg2+.
Дальнейшее прибавление трилона Б не изменяет голубой окраски раствора, поэтому следует внимательно следить за постепенным изменением окраски от винно-красной через переходные окраски (фиолетовую, грязносинюю) до голубой.
Титрование проводится дважды. Поправочный коэффициент к нормальности трилона Б рассчитывают по формуле:
К= 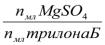
2.Определение общей жесткости пробы.
3.Пипеткой Мора отмеряют 100 мл испытуемой воды в коническую колбу, добавляют буферный раствор и индикатор (в том же количестве, что и при определении поправочного коэффициента), и титруют раствором трилона Б. определение повторяют и берут средний результат.
4.Вычисление общей жесткости в мг-экв/л производят по формуле:
Жо = 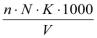 ,
,
где:
n- количество трилона Б, израсходованное на титрование, в мл; К – поправочный коэффициент к нормальности трилона Б;
V – объем пробы, в мл;
N – нормальность трилона Б.
Для питьевых целей предпочитают воду средней жесткости, для промышленных и хозяйственных целей – мягкую.
Жесткость питьевой воды по стандарту должна быть не выше 7 мг-экв/л.
Вода с жесткостью свыше 10 мг-экв/л часто имеет неприятный вкус.
При использовании очень жесткой воды ухудшается течение почечно-каменной болезни.
Жесткие воды способствуют появлению дерматитов. При повышенном Поступлении в организм кальция с питьевой водой на фоне йодной недостаточности часто возникает зобная болезнь.
69

Таблица 6 Степень жесткости природных вод
Характеристи |
|
|
|
ка |
жесткость, |
Характеристик |
Жесткость, |
|
|
а |
|
Воды |
мг-экв/л |
|
мг-экв/л |
|
|
воды |
|
|
Мягкая |
< 4 |
Жесткая |
8 – 12 |
|
|
Средней |
4 - 8 |
Очень жесткая |
> 12 |
|
|
жесткости |
|
|
|
|
|
|
|
|
|
|
Определение химической окисляемости воды и химического потребления кислорода (ХПК)
Под окисляемостью воды понимают количество кислорода в мгО/л искусственно введенного окислителя ( например, KMnO4 или K2Cr2O7 ), идущее на окисление содержащихся в воде органических веществ. Различают перманганатную ( KMnO4 ), бихроматную ( K2Cr2O7 ) и иодатную ( KIO3 ) окисляемость.
Повышенная окисляемость может указывать на загрязнение воды органическими веществами. Прямое определение органических веществ в воде является сложной и трудоемкой задачей. Поэтому пользуются более простыми косвенными методами, например методом определения перманганатной окисляемости, дающим представление о содержании в воде легко окисляющихся органических веществ. Его используют для анализа природных малозагрязненных вод. В более загрязненных водах - определяют бихроматную (KCr2O7) или иодатную ( KIO3 ) окисляемость, т.к. ими достигается наиболее полное окисление ( 95 – 100% ).
В природных водах содержание трудноокисляющихся органических веществ обычно крайне мало и результаты, получаемые при анализе природных вод бихроматным и перманганатным методами, достаточно близки. Наименьшую окисляемость имеют глубинные подземные воды 1 – 2 мг О/л. В грунтовых водах окисляемость обычно выше - 2 – 4 мг О/л. В воде открытых водоемов окисляемость повышается до 5 – 6 мг О/л в реках и до 6 – 8 мг О/л в водохранилищах, достигая еще больших величин в водах болотного происхождения.
Нормативы на окисляемость - для питьевой воды – 5 мг О/л (для перманганатной окисляемости);
70
