
606_HHerbakov_JU._S._Praktikum_Monitoring_sredy_obitanija_
.pdfМассу всей витающей пыли без разделения на фракции рассчитывают по увеличению массы фильтра. Лучшими являются фильтры из ткани ФПП. Фильтры Петрянова обладают высокой эффективностью и малым аэродинамическим сопротивлением, их ткань обладает водоотталкивающими свойствами. Метод применяется для определения разовых и среднесуточных концентраций пыли в воздухе населенных пунктов и санитарно-защитных зон в диапазоне 0,04 – 10 мг/м3.
Аппаратура, реактивы: улавливающее устройство (фильтродержатель, фильтр из ткани ФПП, аспиратор для отбора проб, стакан-насадка на фильтродержатель); аналитические весы; эксикатор; пинцет; чашки стеклянные диаметром 10 см; барометр; психрометр; анемометр.
Материал: воздух населенного пункта.
Ход работы. Фильтр из ткани ФПП выдерживают в течение 40 – 60 мин. в весовой комнате, взвешивают, помещают в пакет и доставляют на место пробоотбора, где его вкладывают в фильтродержатель, который крепко завинчивают. Перед отбором проб проверяют герметичность фильтродержателя, для чего его входное отверстие закрывают пробкой и включают прибор: при герметичном присоединении расходомер воздуха показывает ноль.
Отбор проб проводят со скоростью 250 – 400 л/мин, чтобы навеска пыли на фильтре была не менее 4 мг. Отбор ведется не более 30 мин. После протягивания воздуха фильтр пинцетом извлекают из держателя, складывают вчетверо запыленной поверхностью внутрь и помещают в тот же пакет, из которого он был взят. В лаборатории фильтр выдерживают в течение 40 – 60 мин. при комнатной температуре и доводят до постоянной массы. Если отбор пробы проводился при относительной влажности, близкой к 100%, то фильтр помещают в стеклянной чашке в эксикатор с плавленым хлористым кальцием на 30 – 50 мин., а затем уже выдерживают при комнатной температуре 40 – 50 мин. Концентрацию пыли С, мг/м3 вычисляют по формуле:
С= 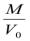 ,
,
где
М – масса пыли на фильтре, равная разности масс запыленного и чистого фильтра, мг;
V0 – объем аспирированного воздуха, приведенный к нормальным условиям, м3.
Под нормальными условиями подразумевается температура 00С и атмосферное давление 1013 гПа ( 760 мм рт. ст. ):
бV0 =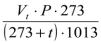 ,
,
31
где
Vt – объем аспирированного воздуха при температуре t и атмосферном давлении Р гПа, м3; 273 – коэффициент расширения газов; 1013 – нормальное давление, гПа.
Контрольные вопросы
1.Как производится отбор проб воздуха?
2.От чего зависит выбор способа отбора проб воздуха?
3.Дайте характеристику фильтрам из ткани ФПП.
4.При температуре воздуха 240С, давлении 750 мм рт. ст. отобран воздух для лабораторного исследования в течение 20 мин. со скоростью 25 л/мин. Рассчитайте объем протянутого воздуха и приведите объем воздуха к нормальным условиям.
5.Как рассчитывается содержание пыли?
6.Отобрано 100 дм3 воздуха. Масса фильтра до отбора – 0,3452 г, после
отбора – 1,5848 г. Рассчитайте концентрацию пыли и сравните с ПДК ( 6 мг/м3 ).
7. Пропущено 600 дм3 воздуха при температуре 160С, давлении 742 мм рт. ст. Масса задержанной пыли 10 мг. Рассчитайте концентрацию пыли, сопоставьте с гигиеническими нормами.
Практическая работа № 4 Определение концентрации диоксида азота в атмосферном воздухе
Цель работы: Исследовать физико-химических
Порядок выполнения.
8.Ознакомиться и законспектировать общие сведения о физико-химических процессах, происходящих в техносфере.
9.Изучить свойства техносферы.
10.Изучить виды техносферных зон.
11.Пользуясь электронной картой города (Дубль-ГИС) и справочными данными графически отобразить на ней техносферные зоны города и дать их краткую характеристику.
12.Сделать выводы и ответить на контрольные вопросы.
1. Общие сведения о
Азот образует смесь различных оксидов, но лишь NO и NO2 имеют значение как атмосферные загрязнители. Обычно суммарные концентрации NO и NO2 в атмосфере обозначаются как NOx .
Оксиды азота играют основную роль в образовании фотохимического «смога», влияют они и на разрушение озонового слоя, ведут также к образованию кислотных дождей. Загрязнение атмосферы оксидами азота в
32
целом сравнительно невелико. Но в районах с развитой химической промышленностью имеются локальные зоны повышенного содержания NO и NO2 в воздухе.
Монооксид азота NO – бесцветный газ, образующийся в малых количествах в цилиндрах двигателей внутреннего сгорания при взаимодействии О2 с N2 . В дальнейшем он окисляется кислородом до двуокиси азота NО2.
Диоксид азота представляет собой коричнево-бурый газ, ядовитый, с неприятным запахом. При растворении NO2 в воде образуется азотная кислота.
Газообразный NO2 токсичен ( 2 класс опасности ), является также сильным коррозионно-активным агентом.
Предельно допустимая концентрация NO2 максимально разовая составляет 0,085 мг/м3, среднесуточная - 0,04 мг/м3.
Метод определения содержания диоксида азота в воздухе с реактивом Грисса-Илосвая основан на взаимодействии двуокиси азота и сульфаниловой кислоты с образованием диазосоединения, которое, реагируя с α-нафтиламином, дает азокраситель. Последний окрашивает раствор от бледно-розового до красно-фиолетового цвета. По интенсивности окраски раствора определяют количество NO2.
Чувствительность определения 0,1 мкг в анализируемом объеме пробы. Диапазон измеряемых концентраций составляет 0,03 – 0,64 мг/м3при отборе пробы воздуха 5 л.
Аппаратура, реактивы:
-улавливающее устройство;
-аспиратор для отбора проб, поглотительный прибор Рыхтера;
-аналитические весы; барометр;
-термометр; фотоколориметр;
-калий йодистый, х.ч.;
-натрий азотистокислый, х.ч.;
поглотительный раствор: 20 г KI растворяют в 250 г воды.
Полученный раствор должен быть бесцветным и храниться в банке из темного стекла. Срок хранения 2 недели; натрий сернистокислый, х.ч., 0,06%- ный раствор. 0,03 г Na2SO3 растворяют в 50 мл воды.
Раствор готовят перед анализом; уксусная кислота, х.ч., 12%-ный раствор. 64 мл концентрированной кислоты помещают в мерную посуду на 500мл и доводят до метки водой; сульфаниловая кислота, ч.д.а., 5г сульфаниловой кислоты растворяют в 150мл 12%-ного раствора уксусной кислоты.
Хранят раствор в плотно закрытой склянке из темного стекла; α- нафтиламин, ч.д.а. 0,2 г α-нафтиламина растворяют в 20мл воды при нагревании на водяной бане до образования лиловых капель на дне колбы. Раствор осторожно сливают в темную склянку, оставляя осадок в колбе, и
33
приливают к раствору 150 мл 12%-ного раствора уксусной кислоты; составной реактив (реактив Грисса-Илосвая).
Перед анализом смешивают растворы α-нафтиламина и сульфаниловой кислоты в отношении 1:1; исходный стандартный раствор: 2 – 3 г азотистокислого натрия растирают и сушат при температуре 50 – 600С в течение 2 часов. Навеску NaNO2 0,15 г растворяют в мерной колбе емкостью 100 мл 1мл полученного раствора соответствует 1000 мкг NO2; раствор, 1мл которого соответствует 10 мкг NO2, готовят разведением стандартного раствора поглотительным раствором в 100 раз; рабочий стандартный раствор. Готовят 10-кратным разбавлением раствора, содержащего 10 мкг/мл NO2 поглотительным раствором. 1 мл рабочего раствора соответствует 1 мкг NO2. Исходный стандартный раствор сохраняется в течение 2 недель в склянке из темного стекла. Рабочий стандартный раствор готовят перед анализом.
Материал: воздух населенного пункта.
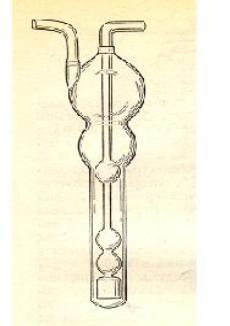
Ход работы. Для определения разовой концентрации NO2 исследуемый воздух протягивают через поглотитель Рыхтера (рис.5), наполненный 6 мл поглотительного раствора, со скоростью 0,25 л/мин в течение 20 мин.
Во время отбора пробы следует избегать освещения поглотительного прибора солнечными лучами. Срок хранения отобранных проб не более 2 суток.
.
Рис.5. Поглотитель Рыхтера
В лаборатории уровень раствора в поглотительном приборе доводят до метки 6 мл дистиллированной водой. Для анализа 5 мл раствора из каждой пробы переносят в пробирку и добавляют по 0,5 мл составного реактива.
Содержимое пробирок тщательно встряхивают и через 20 мин. (непосредственно перед измерением ) в пробирки приливают по 5 капель
34
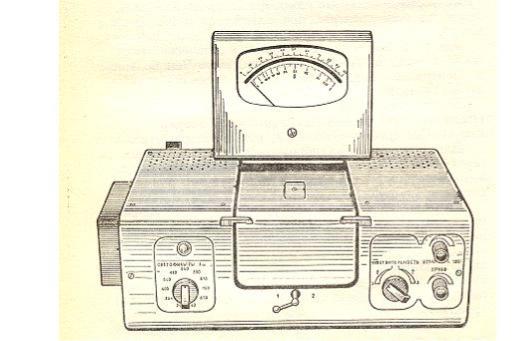
0,06%- ного раствора Na2SO3 и еще раз встряхивают. Оптическую плотность измеряют на фотоколориметре (рис.8) в кюветах толщиной 10 мм при длине волны 540 нм относительно воды. Время от добавления составного реактива до измерения оптической плотности всех проб должно быть одинаковым.
Рис. 6 Прибор КФК-2 (одноканальный)
Количество NO2 в пробах находят по калибровочному графику. Одновременно проводятся измерения оптической плотности нулевой пробы.
Расчет концентраций диоксида азота в воздухе проводят по формуле:
С = 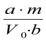 ,
,
где  – общий объем пробы в поглотительном приборе (6 мл );
– общий объем пробы в поглотительном приборе (6 мл );
b – объем пробы для анализа (5 мл ); m – количество NO2 в пробе, найденное по калибровочному графику, мкг;
V0 – объем протянутого воздуха, приведенный к нормальным условиям, л.
Построение калибровочного графика
В мерные колбы на 50 мл наливают 1, 2, 4, 6, 8, 10, 20 мл рабочего стандартного раствора (1 мкг/мл ) и разбавляют до метки поглотительным раствором. Концентрация NO2 в 5 мл стандартного раствора в мерных колбах составляет соответственно 0,1; 0,2; 0,4; 0,6; 0,8; 1,0; 2,0 мкг.Для приготовления шкалы стандартов отбирают в пробирки по 5 мл каждого стандарта и определяют их оптическую плотность.
35
Контрольные вопросы
1.Какие виды ПДК существуют для воздуха?
2.Напишите формулу приведения отобранного объема воздуха к нормальным ( стандартным ) условиям.
3.Напишите формулу для расчета концентраций газов в воздухе ( в мг/м3 ).
4.В чем заключается принцип метода определения оксидов азота? Какие реактивы применяются в качестве стандартных и поглотительных растворов?
5.Как проводится отбор проб воздуха и готовится шкала стандартов для определения оксидов азота?
6.Для определения оксидов азота воздух со скоростью 0,2 л /мин в течение 5мин протягивается через 10 см3 поглотительного раствора. При фотометрии 1 см3 пробы обнаружено 0,5 мкг оксида азота. Вычислите концентрацию оксида
азота и сопоставьте с ПДК. 7. Для определения ртути через гофрированную трубку протянуто 200 дм3 воздуха при температуре 150С и давлением 746 мм рт.ст. Общий объем пробы составляет 2 см3. При фотометрии 1 см3 пробы окраска совпала с пробиркой стандартной шкалы, содержащей 1,0 мкг ртути. Определите концентрацию ртути и сопоставьте с ПДК.
8. Для определения аммиака воздух со скоростью 0,5 л/мин протягивают в течение 5 мин через 10 см3 поглотительногораствора. При фотометрии 1 см3 пробы обнаружено 4,0 мкгаммиака. Определите концентрацию аммиака в воздухе и сопоставьте с ПДК.
9. Наметьте основные пути снижения концентрации токсичных веществ в атмосферном воздухе и воздухе промышленных предприятий.
Практическая работа № 5 Определение загрязнения атмосферного воздуха по физико-химическим характеристикам
Цель работы: Исследовать физико-химических параметров и физико-
химических Порядок выполнения.
13.Ознакомиться и законспектировать общие сведения о физикохимических процессах, происходящих в техносфере.
14.Изучить свойства техносферы.
15.Изучить виды техносферных зон.
16.Пользуясь электронной картой города (Дубль-ГИС) и справочными данными графически отобразить на ней техносферные зоны города и дать их краткую характеристику.
17.Сделать выводы и ответить на контрольные вопросы.
1.Общие сведения о
36
Оценка загрязнения окружающей среды по степени загрязнения снежного покрова является широко используемым во всем мире приемом проведения мониторинга окружающей среды. Подобные исследования позволяют получать четкую картину экологической обстановки на значительных территориях в течение ряда лет. Такие исследования могут включать оценку степени запыленности воздуха, загрязнения тяжелыми металлами, нитратами, сульфатами, хлоридами, органическими веществами и представляют собой основу для осуществления рекреационных мер по восстановлению экологического благополучия природы, общества, человека.
Аппаратура:
-фотоэлектроколориметр;
-рН-метр;
-аналитические весы;
-плоскодонные колбы;
-химические воронки;
-складчатые фильтры;
-полиэтиленовые бутыли из под питьевой воды емкостью 1,5 – 2л. Реактивы: азотнокислое серебро, 10%-ный раствор; трилон Б, 0,05 М;
эриохром черный Т; салициловокислый натрий; едкий натр, 10Н раствор; гликолевый реагент; соляная кислота.
Подготовка к работе. Перед началом исследования составляют схему обследуемой территории с указанием выбранных мест отбора снега, основных зданий и сооружений и их назначения. Мест отбора проб снега должно быть не менее 10. Ориентируясь по схеме, отбирают образцы снега в выбранных местах на площадках размером не менее 1 м2.
Количество снега должно составлять свыше 600 – 800 г. В качестве емкостей для отбора снега удобно пользоваться полиэтиленовыми бутылями на 1,5 – 2 л из-под питьевой воды, для чего у них отрезают ножницами верхнюю суживающуюся часть (снег в емкости должен быть плотно утрамбован). Каждая емкость должна быть пронумерована в соответствии с номерами мест отбора проб снега, номер закреплен на емкости скотчем.
Для таяния снега собранные образцы оставляют при комнатной температуре до следующего занятия. В день сбора образцов снега студенты готовят к следующему занятию складчатые фильтры, плоскодонные колбы и химические воронки. Каждый складчатый фильтр взвешивают на аналитических весах. Вес бумажного фильтра и номер пробы записывают на краю фильтра карандашом. Параллельно нумеруют плоскодонные колбы в соответствии с номерами проб.
3.1. Определение запыленности территории.
Ход работы: После того как снег растаял, его фильтруют через предварительно взвешенный складчатый фильтр, перенося осадок количественно на фильтр (рис.7).
37
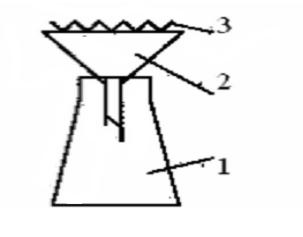
Рис. 7. Прибор для фильтрования талого снега: 1-плоскодонная колба; 2- химическая воронка; 3 – бумажный фильтр
Измеряют объем талого снега каждой пробы. Бумажные фильтры помещают в сушильный шкаф, нагретый до температуры 60 – 800С, или оставляют при комнатной температуре до следующего занятия.
После высушивания фильтры взвешивают и определяют массу осадка. Поскольку объем талого снега во всех образцах разный, то, для того чтобы можно было провести сравнительную оценку запыленности территории, каждую величину пересчитывают на 1 л (кг ) талого снега:
Количество пыли на кг талого снега = 
3.2.Определение рН талого снега
Вработе используют индикаторную бумагу (интервал рН = 1 ÷ 14 ) или
рН-метр; рН талого снега можно определить во время фильтрования.
3.3. Определение содержания органических примесей
Ход работы. Количество органических примесей можно определить, пока происходит фильтрование талого снега. Это значение оценивают по величине поглощения светового потока органическими веществами при 364 нм , которое происходит в соответствии с законом Бугера-Ламберта-Бера:
D = lgI0/Ic = eCl,
где D – оптическая плотность раствора; I0 – интенсивность света, падающего на раствор; Ic – интенсивность света, прошедшего через раствор; e -
38
молярный коэффициент светопоглощения; С – концентрация растворенного вещества, г-моль/л; l - толщина слоя раствора , см.
Данное исследование проводят при помощи фотоэлектроколориметра КФК-2, принцип работы которого следующий. Колориметр имеет два кюветных отделения: одно - для исследуемого раствора, другое – для растворителя. Первоначально в кюветное отделение для растворителя помещают дистиллированную воду и «зануляют» прибор ( величина поглощения на табло должна быть равна нулю ), благодаря чему при измерении величины поглощения светового потока исследуемым раствором поглощение самой водой автоматически вычитается, а регистрируемое значение соответствует только поглощению органических веществ.
3.4 Качественное определение ионов хлора
Метод основан на осаждении хлорида серебра по реакции:
AgNO3 + Cl - = AgCl¯ + NO3-
В пробирку наливают 5 мл пробы профильтрованного талого снега и добавляют 3 капли 10%-ного раствора азотнокислого серебра. Примерное содержание хлор-иона определяют по внешнему виду осадка:
-опалесцирующий ( слабая муть ) – содержание Cl - 1 – 10 мг/л;
-сильная муть – содержание Cl - 10 – 50 мг/л;
-хлопья, осаждающиеся не сразу – содержание Cl - 50 – 100мг/л;
-белый объемный осадок – содержание Cl - более 100 мг/л.
3.5 Определение общей жесткости в пробах снега
Метод представляет собой комплексонометрическое титрование и основан на вытеснении эриохрома черного Т из комплекса с ионами кальция и магния этилендиаминтетрауксусной кислотой – процесс, сопровождающийся изменением цвета раствора с фиолетового на голубой (рис.8).
39
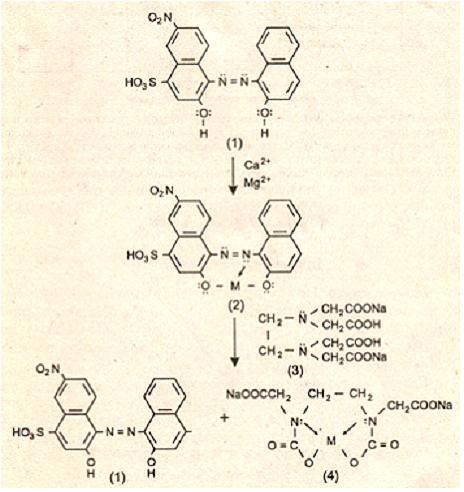
Рис. 8. Схема химических превращений при определении общей жесткости воды
Эриохром черный Т (1) - представляет собой азоткраситель, обладающий сопряженной системой двойных связей, обеспечивающей окраску данного соединения (голубой цвет при рН более 8 ). С ионами кальция и магния это соединение образует комплекс розово-фиолетового цвета ( 2 ).
Этилендиаминтетрауксусная кислота (ЭДТА, трилон Б) (3) – наиболее сильный из известных в настоящее время комплексонов. Количество ионов кальция и магния, находящихся в связанном состоянии, определяют титрованием раствора комплекса (2) раствором ЭДТА (3) известной концентрации. Поскольку ЭДТА является более сильным комплексоном по сравнению с эриохромом черным Т, то последний вытесняется из комплекса с металлами, и в точке эквивалентности розовая окраска комплекса (2) исчезает, появляется голубое окрашивание, соответствующее раствору свободного эриохрома черного Т (1 ). Комплекс ( 4 ) бесцветный
Ход работы. Отбирают 10 мл исследуемой пробы в плоскодонную коническую колбу на 100 мл, добавляют 1 – 2 мл аммиачного буфера с рН = 8 и на кончике шпателя краситель эриохром черный Т до получения светлорозового окрашивания и титруют 0,05 М раствором трилона Б до получения голубого цвета раствора. Жесткость воды в мг-экв/л рассчитывают по формуле:
40
