
Фармакопейный анализ неорганических веществ
.pdfОпределение проводят следующим образом: к 10 мл раствора испы-
туемого препарата, приготовленного, как указано в соответствующей частной статье, прибавляют 2 мл раствора сульфосалициловой кислоты и 1 мл раствора аммиака и через 5 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора В и такого же количества реактивов, какое прибавлено к испытуемому раствору.
Окраска, появившаяся в испытуемом растворе, не должна превышать эталон.
Эталонный раствор железо(Ш)-иона. Определяют содержание железа в железоаммониевых квасцах методом, описанным для хлорида окисного железа. Около 2,5 г препарата (точная навеска) растворяют в воде в мерной колбе вместимостью 100 мл и доводят объем раствора водой до метки, 20 мл этого раствора переносят в колбу с притертой пробкой, прибавляют 10 мл хлористоводородной кислоты и 2 г йодида калия, смесь взбалтывают и оставляют в темном месте на 30 мин, затем прибавляют 50 мл воды и титруют раствором тиосульфата натрия (0,1 моль/л) (индикатор— крахмал). 1 мл раствора тиосульфата натрия соответствует 0,005585 г железа.
На основании полученных результатов готовят 0,1% раствор желе- зо(III)-иона, для чего рассчитанное количество железоаммониевых квасцов растворяют в воде в мерной колбе вместимостью 100 мл, прибавляют 1 мл хлористоводородной кислоты и доводят объем раствора водой до метки (раствор А).
15 мл раствора А помещают в мерную колбу вместимостью 500 мл и доводят объем раствора водой до метки (раствор Б). 10 мл раствора Б помещают в мерную колбу вместимостью 100 мл и доводят объем раствора водой до метки (раствор В). Этот раствор содержит 0,003 мг (3 мкг) железо (III)-иона в 1 мл. Раствор В пригоден только в день его приготовления.
Испытание на соли цинка
Растворы солей цинка в зависимости от концентрации образуют с раствором ферроцианида калия белый осадок или муть, нерастворимые в разведенных кислотах.
Предельная чувствительность реакции 0,001 мг (1 мкг) цинк-иона в 1 мл раствора. 0,005 мг (5 мкг) цинк-иона в 1 мл раствора дают при этой реакции хорошо заметную муть.
Определение проводят следующим образом: к 10 мл раствора испы-
туемого препарата, приготовленного, как указано в соответствующей частной статье, прибавляют 2 мл хлористоводородной кислоты, 5 капель раствора ферроцианида калия и через 10 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора Б и такого же количества реактивов, какое прибавлено к испытуемому раствору. Муть, появившаяся в испытуемом растворе, не должна превышать эталон.
П р и м е ч а н и е . В случае появления в испытуемом растворе синего окрашивания, мешающего нефелометрическому сравнению, следует предварительно отделить железо. Для этого к испытуемому раствору, нагретому до кипения, прибавляют раствор аммиака до отчетливого запаха и смесь фильтруют. В соответствующей части фильтрата определяют цинк.
Эталонный раствор цинк-иона. 0,625 г окиси цинка, предварительно прокаленной до постоянной массы, растворяют в 10 мл азотной кислоты, переносят в мерную колбу вместимостью 500 мл и доводят объем раствор? водой до метки (раствор А). 1 мл раствора А помещают в мерную колбу вместимостью 200 мл, прибавляют 4 капли азотной кислоты и доводят объем раствора водой до метки (раствор Б). Этот раствор содержит 0,005 мг (5 мкг) цинк-иона в 1 мл.
Испытание на соли тяжелых металлов
Растворы солей свинца в зависимости от концентрации образуют с растворами сульфида натрия или сероводорода черный осадок или бурое окрашивание раствора.
0,0005 мг (0,5 мкг) свинец-иона в 1 мл раствора дают при этой реакции при наблюдении в слое толщиной от 6 до 8 см заметное буроватое окрашивание (предел чувствительности).
Определение тяжелых металлов в растворах препаратов
К10 мл раствора испытуемого препарата, приготовленного, как указано
всоответствующей частной статье, прибавляют 1 мл разведенной уксусной кислоты, 2 капли раствора сульфида натрия, перемешивают и через 1 мин сравнивают с эталоном, состоящим из 1 мл эталонного раствора Б, такого же количества реактивов, какое прибавлено к испытуемому раствору, и 9 мл воды.
В сравниваемых растворах допустима лишь слабая опалесценция от серы, выделяющейся из сульфида натрия.
П р и м е ч а н и е . В препаратах, содержащих железо в количестве 0,05% и более, определение тяжелых металлов проводят после отделения железа, согласно указаниям в соответствующих частных статьях.
Эталонный раствор свинец-иона. 0,915 г свежеперекристал-
лизованного ацетата свинца растворяют в воде в мерной колбе вместимостью 1 л, прибавляют 1 мл разведенной уксусной кислоты и доводят объем раствора водой до метки (раствор А). 1 мл раствора А помещают в мерную колбу вместимостью 100 мл и доводят объем раствора водой до метки (раствор Б). Этот раствор содержит 0,005 мг (5 мкг) свинец-иона в 1 мл.
Раствор Б пригоден только в день его приготовления.
Контрольные вопросы и ситуационные задачи
1.Каковы причины и источники загрязнения веществ?
2.Могут ли примеси оказать влияние на результаты испытания подлинности и количественного определения лекарственных веществ? Ответ по-
ясните.
3.Каковы общие требования к выполнению испытаний на наличие примеси?
4.Какие испытания на примеси вынесены в общую статью ГФ XI?
5.Можно ли с помощью методик, рекомендованных ГФ XI, судить о количественном содержании примеси в лекарственных веществах? Ответ поясните.
6.Какие химические реакции лежат в основе способов обнаружения примесей солей тяжелых металлов, цинка, железа, кальция, а также хлоридов, сульфатов, аммиака?
7.Почему необходимо делать выдержку во времени при выполнении испытаний на чистоту?
8.Как готовят эталоны для определения примесей неорганических ионов в лекарственных веществах? Приведите примеры.
9.По фармакопейной статье в натрия хлориде реакция на примесь ионов калия с раствором винной кислоты должна быть отрицательной. В другом веществе — кальция хлориде — допускается содержание примеси солей щелочных металлов, в том числе и калия. Чем можно это объяснить?
10.В статье ГФ XI «Общие реакции на подлинность» ионы цинка обнаруживаются двумя реакциями: с сульфидом натрия и с гексацианоферратом(П) калия. Можно ли обе эти реакции использовать для определения примеси ионов цинка в лекарственных веществах?
11.При испытании доброкачественности кислоты ацетилсалициловой устанавливают примесь салициловой кислоты. Каковы возможные причины
иисточники её попадания в указанное лекарственное вещество?
12.При количественном определении натрия салицилата установлено, что содержание его равно 100%. Есть ли необходимость в этом случае проводить определение примесей или результаты количественного определения являются доказательством достаточной степени чистоты лекарственного вещества?
13.Для определения примеси хлоридов в гексаметилентетрамине необходимо взять навеску лекарственного вещества массой 1,5 г. Можно ли отвесить её на ручных весах? С какой точностью проводится отвешивание при определении примесей?
14.При установлении степени чистоты различных лекарственных веществ нередко определяют примесь тяжелых металлов, хлоридов, сульфатов. Чем объяснить загрязненность этими примесями?
15.При определении примесей в лекарственном веществе не соблюдалась последовательность добавления реактивов. Может ли это отразиться на результатах испытаний? Приведите пример.
16.В ФС на натрия хлорид при определении в нем примеси сульфатов указано, что раствор 2 г лекарственного вещества в 10 мл воды должен выдержать испытание на сульфаты. Каково предельно допустимое содержание данной примеси в указанном веществе, если эталон содержит в 1 мл 0,01 мг сульфат-иона?
17. Окраска испытуемого раствора калия иодида при определении примеси железа признана одинаковой с окраской эталона. Раствор готовился добавлением к навеске лекарственного вещества массой 3,0 г 10 мл воды. Каково содержание примеси в испытуемом лекарственном веществе? Эталон содержит в 1 мл 3 мкг железа(Ш)-иона.
Занятие 4.
Приготовление титрованных растворов, индикаторов и реактивов.
Цель занятия:
∙приобрести умения по приготовлению титрованных растворов;
∙освоить способы приготовления индикаторов и реактивов по ГФ XI, используемые в фармацевтическом анализе;
∙ориентироваться и уметь работать с ГФ XI.
Самостоятельная подготовка. Титрованные растворы. Общая характеристика, использование в аналитической химии и фармацевтическом анализе, классификация (по методам анализа). Молярность, титр, титр титранта по определяемому веществу, условная частица (УЧ), способы расчета молярности (М) и поправочного коэффициента . Методики приготовления титрованных растворов. Хранение титрованных растворов. Изучить общие статьи ГФ XI «Индикаторы» и «Реактивы». Изучить формулы индикаторов и знать интервалы перехода их окраски. Способы приготовления индикаторов, индикаторных смесей и реактивов. Хранение.
Объекты исследования: Реактивы см. табл.1 Индикаторы см. табл.2 Титрованные растворы см. табл.3 Конкретные задачи занятия:
∙ответить на вопросы входного контроля;
∙приготовить реактив, индикатор, титрованный раствор;
∙установить молярность титрованного раствора;
∙сделать заключение о качестве приготовленного титрованного рас-
твора.
В процессе самоподготовки и на занятии студент должен приобрести следующие знания и умения:
Знать:
∙способы выражения концентраций в титриметрическом анализе;
∙способы приготовления титрованных растворов;
∙хранение титрованных растворов;
∙ способы приготовления индикаторов, индикаторных смесей, реактивов и их условия хранения.
Уметь:
∙приготовить реактивы, индикаторы, титрованные растворы;
∙установить молярность титрованного раствора;
∙рассчитывать поправочный коэффициент;
∙проводить расчеты для укрепления или разбавления растворов;
∙практически укреплять или разбавлять раствор.
Задание на занятие:
Каждый студент получает объекты исследования. Необходимо:
1.Приготовить реактив.
2.Приготовить индикатор.
3.Приготовить титрованный раствор и установить молярность приготовленного раствора.
4.Рассчитать поправочный коэффициент приготовленного титрованного раствора. Сделать заключение о приготовленном растворе.
5.Результаты оформить в виде таблиц 4,5,6.
По условию методики, приведенной в табл. 1, приготовить раствор реактива. Предварительно рассчитать массу исходного вещества на 25 мл приго-
товленного раствора реактива.
Таблица 1
|
Условия приготовления реактивов по ГФ XI. |
|
|
|
|
Реактив |
Приготовление |
|
Аммония кар- |
10 г аммония карбоната растворяют в 30 мл воды, прибавляют |
|
10 мл раствора аммиака и доводят объем раствора водой до |
||
боната раствор |
||
100 мл. |
||
Аммония хло- |
10 г аммония хлорида растворяют в воде и доводят объем рас- |
|
рида раствор |
твора водой до 100 мл. |
|
Аммония окса- |
4 г аммония оксалата растворяют при нагревании в воде и до- |
|
лата раствор |
одят объем раствора водой до 100 мл, раствор фильтруют. |
|
Аммония рода- |
5 г аммония роданида растворяют в воде и доводят объем рас- |
|
нида раствор |
твора водой до 100 мл. |
|
Бария хлорида |
5 г бария хлорида растворяют в воде и разбавляют водой до |
|
раствор |
100 мл. Раствор фильтруют. |
|
Калия ферро- |
5 г калия ферроцианида растворяют в воде и доводят объем |
|
цианида рас- |
раствора водой до 100 мл. |
|
твор |
|
|
Калия ферри- |
5 г калия феррицианида растворяют в воде и доводят объем |
|
цианида рас- |
раствора водой до 100 мл. |
|
твор |
|

Калия бихро- |
5 г калия бихромата растворяют в воде и доводят объем рас- |
мата раствор |
твора водой до 100 мл. |
Калия бромида |
10 г калия бромида растворяют в воде и доводят объем рас- |
раствор |
твора водой до 100 мл. |
Калия перман- |
0,1 г калия перманганата растворяют в воде и доводят объем |
ганата раствор |
раствора водой до 100 мл. |
Кальция хло- |
20 г кальция хлорида растворяют в воде и доводят объем рас- |
рида раствор |
твора водой до 100 мл. |
Меди сульфата |
10 г меди сульфата растворяют в воде и доводят объем рас- |
раствор |
твора водой до 100 мл. |
Натрия гидро- |
5 г натрия гидрокарбоната растворяют в воде и доводят объем |
карбоната рас- |
раствора водой до 100 мл. |
твор |
|
По условию методики, приведенной в табл.2, приготовить раствор индикатора 25 мл. Предварительно рассчитать массу навески, необходимую для
приготовления 25 мл раствора индикатора.
Таблица 2
|
Приготовление индикаторов по ГФ XI |
|
|
|
|
Индикатор |
Приготовление |
|
Бромфеноло- |
0,1 г индикатора растворяют в 7,5 мл раствора натра ед- |
|
кого (0,02 моль/л) и доводят объем раствора свежепроки- |
||
вый синий |
||
пяченной и охлажденной водой до 250 мл. |
||
|
||
Калий хромо- |
5 % раствор. |
|
вокислый |
|
|
Кислотный |
Индикаторная смесь. 0,25 г индикатора и 25 г натрия |
|
хлорида растирают в ступке и перемешивают. |
||
хром черный |
||
|
||
специальный |
|
|
|
|
|
|
1 г крахмала растворимого смешивают с 5 мл воды до по- |
|
Крахмал рас- |
лучения однородной кашицы и смесь медленно вливают |
|
при постоянном размешивании в 100 мл кипящей воды. |
||
творимый |
||
Кипятят в течение 2 мин до получения слегка опалесци- |
||
|
||
|
рующей жидкости. |
|
Метиловый |
0,1 % раствор. Растворение проводят в горячей воде. |
|
оранжевый |
|
|
Бромтимоло- |
0,1 г индикатора растворяют в 8 мл раствора натра едкого |
|
(0,02 моль/л) и доводят объем раствора свежепрокипя- |
||
вый синий |
||
ченной и охлажденной водой до 250 мл. |
||
|
Таблица 3 Приготовление и установка титра титрованных растворов по ГФ XI.
|
Концентра- |
|
|
|
|
|
|
ции титро- |
|
|
|
|
|
Титрант |
ванных рас- |
|
Приготовление |
Установка титра |
||
|
творов, |
|
|
|
|
|
|
(моль/л) |
|
|
|
|
|
Раствор |
0,1 |
8,5 |
мл концентриро- |
Около 0,15 г ( точная навеска) на- |
||
хлористо- |
|
ванной |
хлористоводо- |
трия карбоната растворяют в 50 мл |
||
водород- |
|
родной |
кислоты поме- |
воды и титруют приготовленным |
||
ной кисло- |
|
щают в мерную колбу |
раствором |
хлористоводородной |
||
ты |
|
вместимостью 1 л, до- |
кислоты до появления розовато- |
|||
|
|
водят |
объем раствора |
оранжевого окрашивания (индика- |
||
|
|
водой до метки и тща- |
тор-метиловый оранжевый). Мо- |
|||
|
|
тельно перемешивают. |
лярность |
раствора вычисляют по |
||
|
|
|
|
|
первому способу. |
|
|
0,05 |
100 мл раствора хлори- |
Около 0,1 г ( точная навеска) на- |
|||
|
|
стоводородной кислоты |
трия карбоната растворяют в 50 мл |
|||
|
|
(0,1 моль/л) помещают |
воды и титруют приготовленным |
|||
|
|
в мерную колбу вме- |
раствором |
хлористоводородной |
||
|
|
стимостью 200 мл и до- |
кислоты до появления розовато- |
|||
|
|
водят |
объем раствора |
оранжевого окрашивания (индика- |
||
|
|
водой до метки. |
тор-метиловый оранжевый). Мо- |
|||
|
|
|
|
|
лярность |
раствора вычисляют по |
|
|
|
|
|
первому способу. |
|
|
0,02 |
100 |
мл |
растворахлори- |
Около 0,05 г ( точная навеска) на- |
|
|
|
стоводородной кислоты |
трия карбоната растворяют в 50 мл |
|||
|
|
(0,1 моль/л) помещают |
воды и титруют приготовленным |
|||
|
|
в мерную колбу вме- |
раствором |
хлористоводородной |
||
|
|
стимостью 500 мл и до- |
кислоты до появления розовато- |
|||
|
|
водят |
объем раствора |
оранжевого окрашивания (индика- |
||
|
|
водой до метки. |
тор-метиловый оранжевый). Мо- |
|||
|
|
|
|
|
лярность |
раствора вычисляют по |
|
|
|
|
|
первому способу. |
|
|
0,01 |
100 мл раствора хлори- |
Около 0,025 г ( точная навеска) на- |
|||
|
|
стоводородной кислоты |
трия карбоната растворяют в 50 мл |
|||
|
|
(0,1 моль/л) помещают |
воды и титруют приготовленным |
|||
|
|
в мерную колбу вме- |
раствором |
хлористоводородной |
||
|
|
стимостью 1 л и дово- |
кислоты до появления розовато- |
|||
|
|
дят объем раствора во- |
оранжевого окрашивания (индика- |
|||
|
|
дой до метки. |
тор-метиловый оранжевый). Мо- |
|||
|
|
|
|
|
лярность |
раствора вычисляют по |
|
|
|
|
|
первому способу. |
|
|
|
|
|
|
||
Раствор |
0,1 |
13 |
г кристаллического |
К 25 мл раствора натрия тиосуль- |
||
Йода |
УЧ 1/2 |
йода растворяют в рас- |
фата (0,1 моль/л) прибавляют 25 |
|||
|
|
творе 36 г калия йодида |
мл воды и титруют приготовлен- |
|||
|
|
в 50 мл воды в мерной |
ным раствором йода до синего |
|||
|
|
колбе вместимостью 1 |
окрашивания (индикатор - крах- |
|||
|
|
л и доводят объем рас- |
мал). Молярность раствора вы- |
|||

|
|
твора водой до метки. |
числяют по второму способу. |
|||
|
0,01 |
100 мл |
раствора йода |
К 25 мл раствора натрия тиосуль- |
||
|
|
(0,1 моль/л) помещают |
фата (0,01 моль/л) прибавляют 25 |
|||
|
|
в мерную колбу вме- |
мл воды и титруют приготовлен- |
|||
|
|
стимостью 1 л и дово- |
ным раствором йода до синего |
|||
|
|
дят объем раствора во- |
окрашивания (индикатор - крах- |
|||
|
|
дой до метки. |
мал). Молярность раствора вы- |
|||
|
|
|
|
числяют по второму способу |
||
Раствор |
0,1 |
Около3,567 (точная на- |
20 мл |
приготовленного Раствора |
||
калия йо- |
УЧ 1/6 |
веска) |
г калия йодата |
калия йодата помещают в колбу с |
||
дата |
|
х.ч., |
предварительно |
притертой пробкой |
прибавляют |
|
|
|
высушенного при тем- |
100 мл воды, 25 мл разведенной |
|||
|
|
пературе 110 0С до по- |
серной кислоты, 2 г калия йодида |
|||
|
|
стоянной массы и тонко |
и оставляют на 10 мин в защи- |
|||
|
|
растертого, растворяют |
щенном от света месте. Выделив- |
|||
|
|
в воде в мерной колбе |
шийся йод титруют раствором на- |
|||
|
|
вместимостью 1 л и до- |
трия |
тиосульфата |
(0,1 моль/л) |
|
|
|
водят объем раствора |
(индикатор - крахмал). Моляр- |
|||
|
|
водой до метки. |
ность раствора вычисляют по вто- |
|||
|
|
|
|
рому способу |
|
|
Таблица 4
Сведения приготовленного реактива
Реактив Приготовление
Таблица 5 Сведения о качестве приготовленного индикатора
Название индикатора и |
Описание |
Растворимость |
рН перехода |
|
химическая формула |
||||
|
|
|
||
|
|
|
|
Таблица 6
Результаты приготовленного титрованного раствора
Титрант |
Концентрация титрован- |
Способ установ- |
Результаты (хи- |
|
ного раствора, (моль/л) |
ления титра |
мическое уравне- |
|
|
|
ние, все расчеты) |
|
|
|
|
Титриметричекий анализ применяется для количественного определения многих лекарственных веществ. Этот метод основан на точном измерении количества реактива, израсходованного на реакцию с определяемым вещест-

вом. Для целей титриметрического анализа используют титрованные растворы.
Титрованными растворами называют предназначенные для целей титриметрического анализа растворы титрантов точно известной концентрации, выраженной молярностью, титром или титром по определяемому веществу.
Молярность - выраженное в молях количество растворенного вещества, содержащееся в одном литре раствора. Количество вещества в молях - это количество вещества, эквивалентное числу молей ионов водорода или числу молей электронов в соответствующих реакциях. Молярность вычисляется как отношение количества растворенного вещества к объему раствора (моль/л).
Титр - выраженная в граммах масса растворенного вещества, содержащаяся в одном миллилитре раствора. Вычисляют титр как отношение массы растворенного вещества к объему раствора (г/мл).
Титр титранта по определяемому веществу - выраженная в граммах масса определяемого вещества, эквивалентная одному миллилитру данного титранта. Вычисляют титр исходя из молярности или титра гаранта с учетом стехиометрических коэффициентов уравнения химической реакции, протекающей при титровании, и молярных масс реагирующих веществ (размерность - г/мл).
Титр по определяемому веществу (Т) вычисляют по формуле:
Т= М × Э
1000
где: М - молярная концентрация титранта; Э - молярная масса эквивалента определяемого вещества
Молярная масса эквивалента вещества (Э)- это произведение массы одного моля этого вещества на фактор эквивалентности (fэ) или «условную частицу» (УЧ):
Э = fэ·М.м.
Фактор эквивалентности вещества (fэ) или условная частица (УЧ) -
это число, обозначающее, какая доля молекулярной массы вещества эквивалентна одному электрону в данной реакции окисления-восстановления, одному иону водорода в данной кислотно-основной реакции, одному заряду в данной осадительной реакции.
Например, в реакции окисления-восстановления:
5 H2O2 + 2 KMnO4 + 3 H2SO4 2 MnSO4 + K2SO4 + 8 H2O + 5 O2
2 MnSO4 + K2SO4 + 8 H2O + 5 O2
f'э(H2O2) = 1/2
В реакции кислотно-основного титрования:
Na2B4O7 10 H2O + 2 HCl
10 H2O + 2 HCl 2 NaCl + 4 H3BO3 + 5 H2O f'э(Na2B4O7) =1/2
2 NaCl + 4 H3BO3 + 5 H2O f'э(Na2B4O7) =1/2

В реакции осадительного титрования:
CaCl2 + 2 AgNO3 2 AgCl
2 AgCl 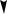 + Ca(NO3)2
+ Ca(NO3)2
fэ(CaCl2) = ½
Титрованные растворы готовят, растворяя массу химически чистого вещества в определенном объеме свежепрокипяченной и охлажденной воды очищенной или другого растворителя, а также из фиксанала. Если вещество нельзя получить в достаточно чистом виде или его концентрация меняется при хранении раствора, то готовят раствор несколько большей концентрации, чем необходимо по расчету.
Титр полученного раствора устанавливают по стандартному титрованному раствору (фиксаналу) или по точной массе другого химически чистого вещества, устойчивого при хранении. Полученный раствор при установке титра отбирают пипеткой и обязательно проводят контрольный опыт.
Молярность (М, моль/л) вычисляют двумя способами:
Способ 1 - по точной массе химически чистого вещества с помощью формулы:
М = а ×1000
V × Э
где: а - масса навески химически чистого вещества, г; Э - молярная масса эквивалента (условных частиц) химически чистого вещества, г/моль;
V - объем раствора, пошедшего на титрование массы вещества, мл; 1000 - количество миллилитров в 1 литре раствора.
Способ 2 - по титрованному раствору известной концентрации с помощью формулы:
М = М0 ×V0
V
где: М0 - молярность раствора вещества, по которому устанавливается титр (моль/л);
V0 - объем раствора, по которому устанавливают титр (мл); V - объем раствора, молярность которого устанавливают (мл).
Для приготовленных титрованных растворов вычисляют поправочный коэффициент (К), представляющий собой отношение реально полученной концентрации тированного раствора (М) к теоретически заданной концентрации (М0):
М= М
М0
