
- •15.03.04 «Автоматизация технологических процессов и производств» и
- •27.03.02 «Управление качеством» подготовки бакалавров Составитель г.Ю. Вострикова
- •Рецензенты:
- •Оглавление
- •Введение
- •Раздел 1. Основные химические понятия и стехиометрические законы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Раздел 2. Квантово-механические представления
- •Основные теоретические положения
- •47 Ag 1s22s22p63s23p64s23d104p65s24d9 - неправильно,
- •47 Ag 1s22s22p63s23p64s23d104p65s14d10- правильно,
- •2.2. Химическая связь и строение молекул Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Способы образования ковалентной связи
- •Решение типовых задач
- •Вопросы для семинарского занятия
- •2.3. Окислительно-восстановительные реакции Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Примерный вариант самостоятельной работы
- •Раздел 3. Общие закономерности химических процессов
- •3.1. Энергетика химических процессов
- •Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •3.2. Химическая кинетика и равновесие Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 5, § 5.5; гл. 6, § 6.1; гл. 7, §§ 7.1 – 7.3]; [2 – гл.VI, §§ 57 – 61, 63]. Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Вопросы для семинарского занятия
- •Раздел 4. Растворы. Дисперсные системы
- •4.1. Способы выражения количественного состава растворов Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 4, § 4.1]; [2 – гл. VII, §§ 73, 74]. Основные теоретические положения
- •Основные способы выражения концентрации
- •Решение типовых задач
- •0,5 Моль/л.
- •4.2. Общие свойства растворов Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Решение типовых задач
- •4.4. Водородный показатель рН. Гидролиз солей Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 8, §§ 8.5, 8.6]; [2 – гл.VII, §§ 90 – 92]. Основные теоретические положения
- •Решение типовых задач Задача 1. Вычислите рН раствора гидроксида кальция с молярной концентрацией 0,005 моль/л, считая диссоциацию Са(он)2 полной.
- •Из уравнения диссоциации следует, что
- •Задачи для самостоятельного решения
- •Объясните, написав уравнения реакций в молекулярной и ионно-молекулярной форме.
- •Вопросы для семинарского занятия
- •4.5. Гетерогенные дисперсные системы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Молекулы пав обозначают следующим символом:
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Тема 5. Электрохимические системы
- •5.1. Электродные потенциалы и электродвижущие силы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Стандартные электродные потенциалы в водных растворах при 298 к
- •Решение типовых задач
- •5.2. Электролиз Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •5.3. Коррозия и защита металлов от коррозии Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Вопросы для семинарского занятия
- •Раздел 6. Технология и переработка полимеров
- •6.1. Методы получения, строение и свойства полимеров Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •6.2. Переработка полимерных материалов Содержание материала для самостоятельного изучения
- •Некоторые представители композиционных материалов, применяемых в строительстве
- •Задачи для самостоятельного решения
- •Заключение
- •Библиографический список Основной
- •Дополнительный
- •15.03.04 «Автоматизация технологических процессов и производств»
- •3 94006 Воронеж, ул. 20-летия Октября, 84
Раздел 4. Растворы. Дисперсные системы
4.1. Способы выражения количественного состава растворов Содержание материала для самостоятельного изучения
Концентрация компонентов в растворе: массовая концентрация, молярная, массовая и объемная доли, молярная и моляльная концентрации, молярная концентрация эквивалента.
Литература: [1 – гл. 4, § 4.1]; [2 – гл. VII, §§ 73, 74]. Основные теоретические положения
Растворы – это термодинамически устойчивые однофазные системы переменного состава, состоящие из двух или более компонентов.
Растворы могут быть жидкими, твердыми и газообразными. В строительном производстве приходится иметь дело с жидкими растворами и дисперсными системами с дисперсионной средой в виде раствора, например, в «строительных растворах». Многие вяжущие материалы и металлические сплавы являются твердыми растворами.
Условно компоненты раствора делят на растворитель (обозначают буквой А) и растворенное вещество (обозначают буквой В). Растворителем считают тот компонент, который существует в том же агрегатном состоянии, что и раствор, или которого в растворе больше. При растворении в жидкости газов или твердых веществ растворителем всегда является жидкость.
Одной из важнейших характеристик раствора является его состав (концентрация компонентов). Концентрацией вещества в растворе называют количество, массу или объем растворенного вещества в определенной массе или объеме раствора или растворителя.
В производстве для выражения концентрации чаще всего используют массу вещества, в химии – количество вещества. Массу вещества, растворителя или раствора выражают в г или кг, объем – в л (дм3) или в м3, количество вещества – в молях.
Основные способы выражения концентрации
Массовая концентрация растворенного вещества сВ [г/л или кг/м3] – масса растворенного вещества в единице объема раствора:
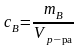 ,
(4.1)
,
(4.1)
где mВ – масса растворенного вещества, г;
Vр-ра – объем раствора, л.
Массовая доля или процентная концентрация растворенного вещества ωВ [доли единицы или масс. %] – отношение массы растворенного вещества к общей массе раствора:
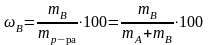 ,
(4.2)
,
(4.2)
где mВ и mА – масса растворенного вещества и растворителя соответственно, г;
mр-ра – масса раствора, г.
Массовая доля показывает, сколько граммов вещества содержится в 100 г раствора. Например, 10 %-ный раствор NaCl это такой раствор, в 100 г которого содержится 10 г NaCl и 90 г воды.
Объемная доля вещества В [доли единицы или об. %] – отношение объема растворенного вещества к общему объему раствора:
 ,
(4.3)
,
(4.3)
где Vр-ра – объем раствора, л.
Молярная доля растворенного вещества В (или растворителя А) [доли единицы или мол. %] – отношение количества растворенного вещества (или растворителя) в молях к общему количеству вещества и растворителя в растворе:
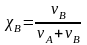 или
или
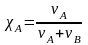 ,
(4.4)
,
(4.4)
где В и А – количество растворенного вещества и растворителя соответственно, моль.
Молярная концентрация вещества сМ (молярность М) [моль/л] – количество растворенного вещества в 1 л раствора:
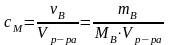 ,
(4.5)
,
(4.5)
где В – количество растворенного вещества, моль;
mB – масса растворенного вещества, г;
MB – молярная масса растворенного вещества, г/моль;
Vр-ра – объем раствора, л.
Выражение 0,5 М раствор NaОН означает, что в 1 л раствора содержится 0,5 молей NaОН, то есть сМ (NaОН) = 0,5 моль/л.
1 М – одномолярный, 0,1 М – децимолярный, 0,01 М – сантимолярный растворы.
Молярная концентрация эквивалента вещества сэ (нормальность н.) [моль/л] – число молей эквивалента вещества в 1 л раствора:
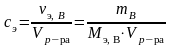 ,
(4.6)
,
(4.6)
где э,В – число молей эквивалентов вещества, моль;
Мэ,В – молярная масса эквивалента вещества, моль/л;
mB – масса растворенного вещества, г;
Vр-ра – объем раствора, л.
Выражение 2 н. раствор H2SO4 означает, что в 1 л раствора содержится 2 моля эквивалента H2SO4, то есть сэ(H2SO4) = 2 моль/л.
Для однокислотных оснований (NaOH, KOH …), одноосновных кислот (HCl, HNO3 …) и полученных из них солей (NaCl, KNO3 …) молярная концентрация эквивалента равна молярной концентрации сэ = сМ. Для двухосновных кислот (например, H2SO4) и двухкислотных оснований (например, Ba(OH)2) сэ = 2сМ ).
Моляльная концентрация сm (моляльность m) [моль/кг] – число молей растворенного вещества в 1 кг или 1000 г растворителя:
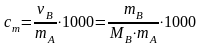 ,
(4.7)
,
(4.7)
где В – количество растворенного вещества, моль;
mВ и mА – масса растворенного вещества и растворителя соответственно, г;
MB – молярная масса растворенного вещества, г/моль;
1000 – коэффициент перевода г в кг.
