
- •Аналитическая химия
- •Авторский коллектив:
- •Рецензенты:
- •Введение
- •Глава 1 основы качественного анализа
- •1.1. Качественный анализ неорганических веществ
- •1.1.1. Аналитическая классификация катионов
- •1.1.2. Аналитическая классификация анионов
- •Вопросы для самоподготовки
- •Задачи для самостоятельного решения
- •Глава 2 количественный химический анализ
- •2.1. Сущность и характеристика
- •Гравиметрического метода анализа
- •2.1.1. Операции гравиметрического анализа
- •2.1.2. Отбор средней пробы и подготовка её к анализу
- •2.1.3. Расчет навески для анализа и взвешивание
- •2.1.4. Вскрытие навески
- •2.1.5. Устранение влияния мешающих компонентов
- •2.1.6. Осаждение определяемой составной части вещества в виде малорастворимого соединения
- •2.1.6.1. Механизм образования осадков
- •2.1.6.2. Влияние условий осаждения на структуру осадка
- •2.1.6.3. Причины загрязнения осадков
- •2.1.6.4. Старение осадков
- •2.1.7. Фильтрование и промывание осадков
- •2.1.7.1. Правила фильтрования
- •2.1.7.2. Промывные жидкости
- •2.1.7.3. Высушивание, прокаливание осадков
- •2.1.7.4. Техника получения гравиметрической формы и ее взвешивание
- •2.1.8. Расчет количества определяемого вещества
- •2.1.9. Метрологическая оценка результатов анализа
- •Математическая обработка результатов количественного анализа
- •Влияние отдельных ошибок на конечный результат
- •Значащие цифры
- •Определение гигроскопичной воды Материалы, оборудование и реактивы
- •Порядок выполнения работы
- •Определение SiO2 в силикате
- •Материалы, оборудование и реактивы
- •Порядок выполнения работы
- •Определение оксида серы so3
- •Материалы, оборудование и реактивы
- •Порядок выполнения работы
- •Определение полуторных оксидов Al2o3, Fe2o3, TiO2
- •Материалы, оборудование и реактивы
- •Порядок выполнения работы
- •Вопросы для самоподготовки
- •Задачи для самостоятельного решения
- •2.2. Сущность и характеристика титриметрического метода анализа
- •2.2.1. Стандартизация растворов титрантов
- •2.2.2. Основные приемы титрования
- •2.2.3. Расчеты в титриметрическом анализе Химический эквивалент
- •Расчет результата прямого титрования при разных способах выражения концентрации раствора
- •Расчет результата в методах обратного титрования
- •2.2.4. Кривые титрования
- •2.2.5. Основные методы титриметрического анализа
- •2.2.6. Кислотно-основное титрование
- •2.2.6.1. Рабочие растворы
- •2.2.6.2. Кривые титрования и выбор индикатора
- •100,0 Мл 0,1 н hCl 0,1 н раствором NaOh
- •100,0 Мл 0,1 м уксусной кислоты 0,1 м раствором NaOh
- •2.2.7. Комплексонометрическое титрование
- •Синий цвет
- •Посуда, приборы, реактивы
- •Порядок выполнения работы
- •2.2.8. Титрование по методу осаждения
- •2.2.8.1. Аргентометрия
- •2.2.8.2. Кривые титрования и способы обнаружения конечной точки титрования
- •Порядок выполнения работы
- •2.2.9. Окислительно-восстановительное титрование
- •2.2.9.1. Перманганатометрия
- •2.2.9.2. Способы обнаружения конечной точки титрования
- •Вопросы для самоподготовки
- •Задачи для самостоятельного решения
- •Глава 3 спектральные методы анализа
- •3.1. Принципы аналитической оптической спектроскопии
- •3.2. Основные узлы и приборы для аналитической оптической спектроскопии
- •3.3. Молекулярная абсорбционная спектроскопия
- •3.3.1. Основной закон светопоглощения - закон Бугера-Ламберта-Бера
- •Таким образом
- •3.3.1.1. Ограничения и условия применения закона Бугера-Ламберта-Бера
- •3.3.1.2. Аппаратура в молекулярной абсорбционной спектроскопии
- •3.4. Молекулярная спектроскопия в инфракрасном диапазоне (икс)
- •3.4.1. Задачи, решаемые инфракрасной спектроскопией
- •Лабораторная работа № 7
- •Цель работы
- •Теоретическая часть
- •Посуда, приборы, реактивы
- •Порядок выполнения работы
- •Вопросы для самоподготовки
- •Задачи для самостоятельного решения
- •Концентрация Оптическая
- •Глава 4 электрохимические методы анализа
- •4.1. Потенциометрические методы
- •4.1.1. Методы проведения потенциометрического анализа
- •4.1.2. Потенциометрическое титрование
- •Посуда, приборы, реактивы
- •Порядок выполнения работы
- •4.2. Кулонометрический анализ
- •4.2.1. Установка для кулонометрического титрования
- •4.3. Кондуктометрические методы анализа
- •4.3.1. Прямая кондуктометрия
- •4.3.2. Кондуктометрическое титрование
- •Выполнение кондуктометрических измерений с помощью учебно-лабораторного комплекса «Химия»
- •Посуда, приборы, реактивы
- •Порядок выполнения работы
- •Вопросы для самоподготовки
- •Задачи для самостоятельного решения
- •Глава 5 хроматографические методы анализа
- •5.1. Хроматографические параметры
- •5.2. Обработка хроматограмм
- •5.3. Жидкостная хроматография
- •5.4. Газовая хроматография
- •5.5. Тонкослойная хроматография (тсх)
- •5.5.1. Параметры тонкослойной хроматографии
- •5.5.2. Количественные характеристики эффективности разделения в тсх
- •Посуда, приборы и реактивы
- •Порядок выполнения работы
- •Посуда, приборы и реактивы
- •Порядок выполнения работы
- •Вопросы для самоподготовки
- •Задачи для самостоятельного решения
- •Глава 6 микроскопические методы исследования
- •6.1. Принцип работы и конструкция сзм NanoEducator
- •6.2. Техническая спецификация оборудования NanoEducator
- •Посуда, приборы и реактивы
- •Порядок выполнения работы
- •Вопросы для самоподготовки
- •Заключение
- •Библиографический список Основная литература
- •Дополнительная литература
- •3 94006 Воронеж, ул. 20-летия Октября, 84
4.1.1. Методы проведения потенциометрического анализа
Прямая потенциометрия (ионометрия) – непосредственное измерение электродного потенциала и нахождение активности ионов в исследуемой системе.
Установка для ионометрии состоит из исследуемой схемы, в которой находится два электрода: индикаторный электрод и электрод сравнения (рис. 4.2.). Для усиления сигнала от электродов в приборе есть блок усилителя и преобразователя электродного потенциала в показатель активности исследуемого иона рХ, например рН.
Усилитель
Преобразователь



Индик.
Эл-д эл-д
Сравн.

Рис. 4.2. Схема установки для ионометрии
Ионометрия используется для измерения рН водных вытяжек из камня строительных материалов, например, цементного камня.
В процессе твердения портландцемента происходит гидролиз и гидратация основных клинкерных минералов, в результате которых образуются гидросиликаты, гидроалюминаты и гидроферриты кальция и определённое количество Ca(OH)2.
Водная вытяжка готовится путем настаивания измельченного цементного камня в воде, т. е. это жидкая часть суспензии, находящаяся в равновесии с твёрдой фазой. В жидкую фазу переходит растворимая часть цементного камня, т. е. Са(ОН)2. Таким образом, задача сводится к измерению концентрации гидроксида кальция.
Поскольку в водных растворах ионное произведение воды
кw = аН+ ∙ аОН_ или кw = сН+ ∙ сОН_ = 10-14, то сОН_ = 10-14/сН+.
В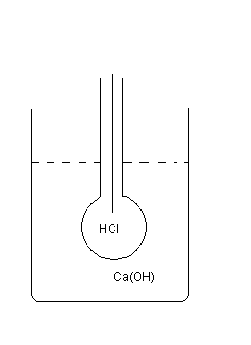 стеклянном электроде имеется разная
концентрация ионов водорода внутри
стеклянного шарика и снаружи – в
исследуемой среде.
стеклянном электроде имеется разная
концентрация ионов водорода внутри
стеклянного шарика и снаружи – в
исследуемой среде.
Внутри HCl С = 0,1 моль/л,
если принять активность а = с, и α = 1, то
с
Са(ОН)2
Если допустить, что СМ(Са(ОН)2) = 0,005 моль/л и
т. к. Са(ОН)2 → Са2+ + 2ОН-, то СОН- = 0,01 моль/л.
Ионный обмен между жидкими фазами и твёрдой фазой стеклянной мембраны создаёт некоторую разность потенциалов, зависящую от рН исследуемой среды.
4.1.2. Потенциометрическое титрование
Потенциометрическое титрование – это титриметрический метод анализа, в котором точка эквивалентности определяется не визуально, а с помощью прибора.
Установка для потенциометрического титрования по сравнению с прямой потенциометрией дополняется бюреткой. Результаты анализа представляются в виде кривой титрования (рис. 4.3).
Е
![]()




т. э. Vраб. р-ра т. э. Vраб. р-ра
а) б)
Рис. 4.3. Кривые потенциометрического титрования:
а) интегральная кривая; б) дифференциальная кривая
Скачок на кривой титрования появляется тогда, когда меняется природа потенциалопределяющего иона.
Пример. Для изготовления жаростойких бетонов применяются шлаки, в которых содержатся алюмофосфаты. Соответствующей обработкой пробы фосфаты превращают в фосфорную кислоту, которая титруется ступенчато.
р Н
Н


 14
14
10,5
7 ,0
,0
3 ,5
(т. э.) (т. э.)2 VNaOH, мл
Фиксирование двух точек эквивалентности позволяет определить содержание моно-, двух- и трёхзамещённых фосфатов, т. е. ионов – Н2РО4-, НРО42- и РО43-. Это важно, т. к. ионы Н2РО4- образуют растворимые соли кальция, магния, железа, что вредно для бетонов.
Преимущества потенциометрического титрования по сравнению с обычным состоит в том, что можно титровать окрашенные и мутные растворы, достаточно легко определяются несколько веществ в смеси (несколько скачков титрования).
Потенциометрическое титрование дает возможность осуществлять автоматический контроль производства, т. к. информация поступает в виде электрического сигнала. Кроме того, исключена субъективная ошибка в определении точки эквивалентности.
Лабораторная работа № 8
Прямая потенциометрия.
Определение pH раствора водной вытяжки цементного камня
с использованием стеклянного электрода
Цель работы
Усвоить метод прямой потенциометрии для исследования состава и свойств строительных материалов.
Овладеть техникой подготовки водных вытяжек и измерения их рН.
Изучение зависимости рН водных вытяжек из камня строительных материалов от степени измельчения, времени настаивания.
Теоретическая часть
Согласно пункту 4.1 данного учебного пособия разберите примеры, где используется прямая потенциометрия.
Пример 1. Рассчитайте содержание гидроксида кальция (г/л) в водной вытяжке гипсового камня, если после 90 мин настаивания навески 2 г в 50 мл воды значение рН водной вытяжки составляет 8,8.
Решение. Щелочная среда в водной вытяжке гипсового камня обусловлена наличием гидроксида кальция, который диссоциирует
Са(ОН)2 → Са2+ + 2 ОН. Так как рН = 8,8, то СН+ = 10-8,8 моль/л и поскольку СН+· СОН- = 10-14, то СОН- = 10-5,2 моль/л.
В соответствии с уравнением диссоциации концентрация Са(ОН)2 в два раза меньше концентрации ионов ОН- и составляет См (Са(ОН)2) = 0,5·10-5,2 моль/л, масса Са(ОН)2 в 1л составляет
m Са(ОН)2 = 0,5·10-5,2 моль/л · 74 г/моль = 2,3·10-4 г/л.
пример 2. Определите содержание фосфатов в пересчете на Р2О5 в исходном сырье для изготовления жаростойкого бетона, если после растворения и соответствующей обработки 1,1022 г сырья на потенциометрическое титрование 1/10 части пробы израсходовано 7,8 мл раствора NaOH с молярной концентрацией эквивалента 0,0983 моль/л.
Решение. Масса определяемого вещества в анализируемой пробе вычисляется через титр по определяемому веществу по формуле
![]()
М(Р2О5) = 142 г/моль; Мэ(Р2О5)= 142:10=14,2 г/моль.
![]()
Массовая доля Р2О5
в исходном сырье
![]()
