
Методическое пособие 689
.pdfЕсли H T0
ln Kp = |
G0 |
|
H |
0 |
|
S |
0 |
T |
T |
T |
|||||
|
RT |
|
RT |
|
|
R |
|
< 0,то константа равновесия при повышении
температуры уменьшается. Если H T0 > 0 (эндотермическая
реакция), то величина Kp при повышении температуры увеличивается.
Зависимость константы равновесия от температуры при V = const выражается уравнением изохоры химической реакции:
ln Kp = |
U |
0 |
|
S |
0 |
T |
T |
||||
|
RT |
|
|
R |
|
Принцип Ле Шателье. При изменении условий протекания реакции (T, P, C какого либо из веществ) скорости прямого и обратимого процессов изменяются неодинаково и химическое равновесие нарушается. В результате преимущественного протекания реакции в одном из возможных направлений устанавливается состояние нового химического равновесия, отличающееся от исходного. Процесс перехода от одного равновесного состояния к новому равновесию называется
смещением химического равновесия. Направление этого смещения подчиняется принципу Ле Шателье: если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия.
Так повышение температуры приводит к смещению равновесия в направлении реакции, сопровождающейся поглощением теплоты, т.е. охлаждением системы.
Например, для обратимой экзотермической реакции
N2 (г) + 3H2 (г) 2NH3 (г), H 2980 = - 91 кДж
173
Повышение температуры будет смещать равновесие влево, в сторону разложения аммиака на N2 и Н2. Например, выход аммиака для этой реакции при 300 0С и 20 МПа составляет 64%, а при 600 0С и том же давлении - всего 8 %.
Повышение давления вызывает смещение равновесия в направлении уменьшения общего числа молей газообразных веществ, т.е. в направлении, приводящем к понижению давления. При увеличении давления, например, в реакции синтеза аммиака (рассмотренной выше), выход продукта возрастает. В частности при 300 0С и при давлении 100 МПа выход аммиака достигает 92 %.
При увеличении концентрации, например, исходных веществ сдвиг равновесия произойдет в сторону образования продуктов реакции. Например, при увеличении концентрации азота или водорода равновесие реакции сместится в сторону образования аммиака.
Константа равновесия Kp химической реакции связана со стандартным изменением энергии Гиббса этой реакцииGT0 уравнением:
GT0 2,3 RT lg K p
При 298 К это уравнение имеет вид:
G2980 5,69 lg K298
Видно, что G < 0 в том случае, если lg K > 0, т.к. K > 1, а положительный ( G0 > 0), если lg K < 0, т.е. K < 1. Это зна-
чит, что при отрицательных значениях G0 равновесие смещено в направлении прямой реакции и выход продуктов реакции сравнительно велик; при G0 > 0 равновесие смещено в сторону обратной реакции и выход продуктов прямой реакции сравнительно мал.
174

6.3. Цепные реакции
Молекула A ↑↓ B с ковалентной связью между атомами А и В в активированном состоянии может распадаться на ионы:
A↑↓ B→A++ ↑↓ B-(а),
атакже и атомы (или свободные радикалы):
A ↑↓ B → A ↑ + ↓ B (б)
В реакции (а) разрыв связи называется гетеролическим или ионным, в реакции (б) гомолитическим или радикальным.
Существует два типа цепных реакций; с неразветвленными и разветвленными цепями. Примером с разветвленными цепями может служить фотохимический синтез хлорида водорода, который протекает со взрывом при облучении смеси водорода и хлора солнечным светом. Для цепных реакций характерны три стадии;
а) стадия зарождения цепи
|
|
+ |
↑ |
Cl |
Cl2 + h →Cl ↓ |
||||
б) стадия развития цепи |
|
|
|
|
Cl |
↓ + H2 → HCl + |
↓ |
H |
|
H ↓ |
+ Cl2 → HCl + |
↓ |
Cl |
и т. д. |
в) стадия обрыва цепи (столкновения двух атомов)
H ↓ + ↑ H → H2
Cl ↓ + ↑ Cl → Cl2
175
H ↓ + ↑ Cl → HCl
Цепные реакции с разветвленными цепями протекают так, что каждая активная частица порождает не одну, как в неразветвленной цепи, а минимум две новые активные частицы.
Примером реакции с разветвленными цепями может служить окисление водорода, протекающее при определенных условиях по цепному механизму.
Если пропустить через смесь равных объемов водорода и кислорода электрический заряд (h ), то произойдет образование двух свободных радикалов
H2 + O2 → 2 HO ↓ ,
каждый из которых характеризуется высокой активностью. Новый акт взаимодействия протекает самопроизвольно:
|
HO ↓ + H2 → H2O + H ↓ , |
И далее |
H ↓ + O2 |
HO ↓ + H2

 H2O H ↓ + O2
H2O H ↓ + O2
H ↓ + O2 ↓ O ↓ + H2
↓ O ↓ + H2


HO ↓ + H2
По цепному механизму протекают многие химические реакции, например, крекинг и полимеризация, образование смога в атмосфере и др.
176
6.4. Фазовые равновесия
Гетерогенные равновесия, связанные с переходом вещества из одной фазы в другую без изменения химического состава, называются фазовыми. К их числу можно отнести равновесия в процессах испарения, плавления, конденсации. Для фазовых равновесий справедлив принцип Ле Шателье. На-
пример, H2O (ж) H2O (г)
Одним из наиболее общих законов гетерогенных (в том числе и фазовых) равновесий является правило фаз. Согласно этому правилу в равновесной системе число фаз Ф, число независимых компонентов К и число степеней свободы связаны соотношением:
С + Ф = К + n,
где n - число внешних факторов, влияющих на равновесие системы. Внешними факторами чаще всего бывают температура и давление, тогда n = 2 и уравнение принимает вид:
С + Ф = К + 2
Число термодинамических степеней свободы С равно числу условий (T, P и С), произвольное которых в известных пределах не меняет числа и вида фаз системы.
По числу степеней свободы системы делят на инвариантные (С = 0), моновариантные (С = 1), бивариантные (С = 2) и поливариантные (С > 2).
К - число компонентов, равно общему числу видов молекул минус число независимых химических реакций.
Пример 1. В гетерогенной системе медь - кислород два компонента. Она состоит из четырех различных веществ: Cu, CuO, Cu2O, O2, т. е. из четырех фаз реакции:
2Cu + O2 2CuO
4Cu + O2 2Cu2O
177

Итак, в этой системе имеют место две реакции и число компонентов K = 4 – 2 = 2. Число степеней свободы по графику фаз C = 2 + 2 – 4 = 0. Такая система существует при строго определенной температуре давления кислорода. Система инвариантна (рис. 52).
Рис. 52. Схема гетерогенного равновесия окисления меди кислородом
Пример 2. В системе из диссоциирующего карбоната кальция три фазы и два компонента:
CaCO3 → CaO (Т) + CO2 (Г)
Число степеней свободы C = 2 + 2 – 3 = 1. Система моновариантная (рис. 53).
Рис. 53. Схема обратимой реакции диссоциации карбоната кальция
178
За степень свободы можно принять или температуру, или давление, т. к. эти параметры функционально связанны:
P CO2 = f1 (T); T = f2 (P CO2 )
Если PCO2 является только температурной функцией, то
его можно принять за константу равновесия.
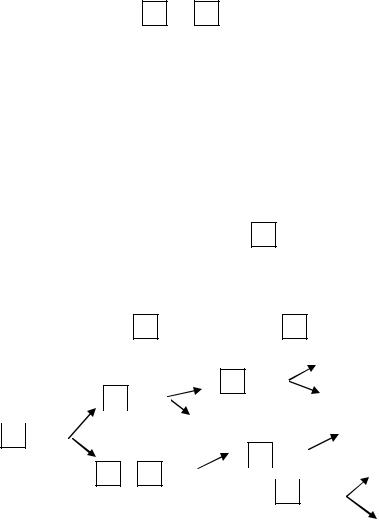
Пример 3. Равновесная система из твердого углерода, оксида и диоксида углерода имеет две фазы и два компонента (K = 3 – 1 = 2):
C (Г) + CO2 (Г) 2CO (Г)
Число степеней свободы по правилу фаз C = 2 + 2 – 2 = 2. Система бивариантная. В данной системе давление СО2 зависит от температуры и давления или от концентрации СО
(рис. 54).
Рис. 54. Схема равновесия между твердым углеродом, CO и CO2
При изучении фазовых равновесий широко применяется графический метод построения диаграмм состояния.
179
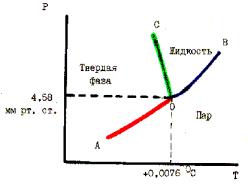
Рис. 55. PT - диаграмма состояния воды
Например, на рис. 55 представлена диаграмма для воды в координатах Р - Т. Линии АО и ОВ ограничивают область пара, линии ОВ и ОС - область жидкости и линии АО и ОС - область твердой фазы. Эта диаграмма описывает фазовые равновесия только при низком давлении.
Влюбой области однофазной системы С = K + 2 – Ф = 1
+2 – 1 = 2, т. е. в таких системах можно произвольно изменять два параметра (Р и Т) в некоторых пределах без изменения числа фаз. Это бивариантные системы. Для любой точки на одной из линий - ОА, ОВ, ОС, которые соответствуют равновесию двух фаз число степеней свободы С = 1 + 2 – 2 = 1. Это моновариантные системы в которых можно изменять один параметр (Р или Т). При наибольшем возможном числе фаз, равном 3, в системе в условиях, определяющих тройную точку О,
не остается ни одной степени свободы (С = 0). Это нонвариантная система. Для воды тройная точка отвечает Т = 0,00760 С
и Р=4,58 мм. рт. ст. При насыщении воды воздухом с давлением 1 атм. Равновесие воды льда и пара наступает при 00 С. Из рис. 55 видно, что с повышением давления температура плавления льда снижается ( линия ОС наклонена влево). Это является следствием большей плотности воды по сравнению с плотностью льда при равновесии. По принципу Ле Шателье
180
равновесие лед вода - 6,1 кДж/моль при увеличении давления смешается в сторону воды, имеющей меньший объем. Если теперь при повышенном давлении повышать температуру, то равновесие должно смещаться в сторону льда (с выделением теплоты).
6.5. Катализаторы и каталитические системы
Одним из наиболее распространенных в химической практике методов ускорения химических реакций является катализ. В присутствии катализатора изменяется путь, по которому проходит суммарная реакция, а потому изменяется ее скорость. Катализаторы - это вещества, изменяющие скорость реакции за счет участия в промежуточном химическом взаимодействии с компонентами реакции, но восстанавливающие после каждого цикла промежуточного взаимодействия свой химический состав. Увеличение скорости катализируемой реакции связано с меньшей энергией активации нового пути реакции.
Изменение скорости катализируемой реакции за счет снижения энергии активации ее отдельных стадий можно рассмотреть на следующем примере. Допустим, между веществами А и В возможно взаимодействие с образованием соединения
АВ (∆ G < 0):
А + В → А…В → АВ
активный
комплекс
Но в силу высокой энергии активации эта реакция протекает с очень малой, практически равной нулю скоростью. Пусть, с другой стороны, найдено такое третье вещество К (катализатор), которое легко вступает во взаимодействие с А (в силу другой природы реагирующих веществ, а следовательно, другой, меньшей, энергии активации), образуя соединение АК:
181

А + K → А…K → АK
активный
комплекс
Соединение же АК легко взаимодействует с веществом В (опять-таки в силу иной природы веществ и малой энергии активации), образуя вещества АВ и К:
B + АK → B…АK → АB + K
активный
комплекс
Суммируя два последних уравнения, получим
А + В = АВ
т.е. в результате реакции катализатор остался без изменения. На рис. 56 показана энергетическая диаграмма хода реак-
ции в отсутствие (кривая 1) и в присутствии (кривая 2) катализатора. Как видно на рис. 56, в присутствии катализатора энергия активации реакции снижается на величину ∆ E кат.
Рис. 56. Энергетическая схема хода реакции
вотсутствие и в присутствии катализатора.
∆E кат – снижение энергии активации под влиянием катализатора
182
