
Методическое пособие 494
.pdfВодородная связь определяет многие свойства органических веществ, в частности белка, аминокислот и др. сложных соединений. Менее прочная водородная связь имеет место в др. водородосодержащих соединениях, в которых водород связан с менее электроотрицательными элементами (S, Cl, N и др.). Например, водородная связь между молекулами аммиака составляет 8 кДж/моль. Можно сказать, что водородная связь занимает промежуточное положение между ковалентной связью и межмолекулярным взаимодействием, обусловленным вандерваальсовыми силами. Прочность ковалентной связи 150400 кДж/моль, а прочность водородной связи 8-40 кДж/моль, то есть водородные связи слабее, чем ковалентные, но существенно влияют на свойства вещества.
Агрегатные состояния. Межмолекулярное взаимодействие
Известны следующие агрегатные состояния веществ: газообразное, жидкое и твердое (при относительно высоких температурах в вакууме возможно плазменное состояние). Жидкое и твердое состояния называются конденсированным состоянием.
В газах, молекулы или атомы находятся в беспрестанном хаотическом поступательном движении, среднее расстояние между частицами максимально. При своем движении молекулы или атомы газа сталкиваются друг с другом: число соударений молекул очень велико и достигает при нормальных условиях около миллиарда в секунду. Однако, столкнувшись, частицы (молекулы или атомы), вследствие малых сил взаимодействия и большой кинетической энергии движения, тотчас же разлетаются. В жидком состоянии между молекулами и атомами расстояние меньше, чем в газе и силы взаимодействия проявляются в большей степени. Эти силы удерживают частицы жидкости или твердого тела друг около друга. Поэтому вещества в конденсированном состоянии, в отличие от газов, имеют постоянный при данной температуре объем. Силы, удерживающие частицы жидкости или твердого тела друг около друга, имеют различную природу в зависимости от того, что представляют собой частицы. Если вещество построено из атомов, но не является металлом, то его атомы обычно связаны друг с другом ковалентной связью, если вещество – металл, то его атомы связаны металлической связью; если вещество имеет ионное строение, то последние удерживаются ионной связью. В веществах с молекулярной структурой имеет место межмолекулярное взаимодействие, называемое силами Ван- дер-Ваальса. Эти силы слабее ковалентных сил, но проявляются на больших расстояниях. В основе их лежит электростатическое взаимодействие диполей (диполь μ = lδ, то есть это молекула, состоящая из двух равных по величине и противоположных по знаку зарядов +δ и -δ, находящихся на некотором расстоянии друг от друга. Расстояние между центрами тяжести положительных и
40
отрицательных зарядов называется длиной диполя). Вандерваальсовы силы зависят, прежде всего, от расстояния между центрами взаимодействующих молекул. На больших расстояниях эти силы ничтожно малы: газы под обычным давлением характеризуются практически полным отсутствием взаимодействия за счет вандерваальсовых сил, чему, как уже говорилось, препятствует беспорядочное тепловое движение молекул. В газах, находящихся под повышенным давлением, следует учитывать силы межмолекулярного взаимодействия.
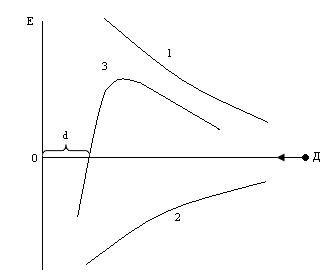
Рис. 23
Если молекулу, находящуюся в точке Д, постепенно приближать к другой молекуле (точка О), то между ними действуют силы притяжения (1), так и силы отталкивания (2). По мере приближения молекулы к положению О силы притяжения постепенно возрастают, но так же действуют и силы отталкивания. Результирующая кривая (3) отображает общее соотношение между силами притяжения и отталкивания двух сближающихся молекул: силы притяжения резко возрастают, достигая максимума, а затем падают вследствие возрастания сил отталкивания. Отрезок d отвечает равновесному состоянию, то есть выражает величину максимального сближения молекул (4-7А0). На этом расстоянии силы притяжения и отталкивания взаимно уравновешивают друг друга.
Молекулы жидкости в отличие от молекул газа не могут совершать беспорядочных движений, так как тепловая энергия их не дает возможности молекуле удалиться из сферы действия вандерваальсовых сил (~10А0). Молекулы жидкости «скользят» одна около другой, и только те из них, которые окажутся на поверхности могут преодолеть силы межмолекулярного взаимодействия и перейти в парообразную фазу (испарение жидкости). Жидкость частично может обладать упорядоченной структурой (ближний порядок), то есть часть молекул в ней сохраняет определенное пространственное расположение, объединив-
41
шись в некоторый монокристаллит. Под влиянием теплового движения молекул одни монокристаллиты могут разрушаться, а другие создаваться. Чем ниже температура жидкости, тем лучше условия для создания монокристаллитов: при низких температурах жидкости имеют более упорядоченную структуру, близкую к структуре твердого тела, имеющих дальний порядок.
Втвердых телах поступательное движение молекул отсутствует: частицы могут совершать лишь колебательные движения около определенных центров равновесия. Силы межмолекулярного взаимодействия в данном агрегатном состоянии имеют наибольшее значение, а расстояние между молекулами достигает некоторого минимума.
Вразличных веществах механизм действия вандерваальсовых сил различен: 1. Ориентационное взаимодействие (диполь-диполь) проявляется между
полярными молекулами, когда диполи ориентируются друг по отношению к другу противоположно заряженными полюсами, вследствие чего наблюдается их взаимное притяжение (HCl, H2O); это взаимодействие зависит от температуры, чем она выше, тем слабее взаимодействие.
2.Индукционное взаимодействие молекул осуществляется за счет их индуцированных диполей. В неполярных, но склонных к поляризации молекул, под действием электрического поля возникает диполь. Под действием полярной молекулы неполярная деформируется и в ней возникает (индуцируется) диполь. Индуцированный диполь притягивается к постоянному диполю полярной молекулы. Это взаимодействие не зависит от температуры. Пример: в СО2 можно возбудить диполь.
3.Дисперсионное взаимодействие – это взаимодействие между неполярными молекулами. Оно обусловлено взаимодействием за счет мгновенных диполей, возникших за счет флуктуаций электронного облака, то есть деформируемости молекулы.
Относительный вклад каждого из рассмотренных видов межмолекулярных сил зависит в основном от двух свойств взаимодействующих молекул: полярности и поляризуемости (деформируемости). Чем выше полярность, тем значительнее роль ориентационных сил, чем больше деформируемость, тем значительнее роль дисперсионных; индукционные силы зависят от обоих факторов, но сами обычно играют лишь второстепенную роль. Например, у HCl 81% дисперсионного взаимодействия, для HBr эта величина 95%, для HI –
99,5%.
Комплексообразование
Комплексные соединения составляют достаточно широкий и разнообразный класс неорганических веществ. Комплексообразование − это явление, ко-
42
гда из менее сложных систем образуются более сложные системы. Комплексообразование может сопровождаться возникновением более или менее устойчивых химических соединений, называемых комплексными за счет электростатического и донорно-акцепторного взаимодействия, а которых указано ранее. К комплексным соединениям относятся H[BF4], NH4Cl. Свойства и строение комплексных соединений объясняет координационная теория, предложенная в 1893 г. А. Вернером, согласно которой в молекуле любого комплексного соединения один из ионов, чаще всего положительно заряженный, занимает центральное место и называется комплексообразователем, вокруг которого координируется некоторое число противоположно заряженных ионов или электронейтральных молекул, называемых лигандами или аддендами, которые образуют внутреннюю сферу. Остальные ионы, расположившиеся на расстоянии от центрального иона составляют внешнюю сферу, например, [BF4]ˉ; [NH4]+ – внутренняя сфера, H+ и Cl- – внешняя сфера, а число лигандов, окружающих центральный атом, называются координационным числом. Образование комплексных соединений можно объяснить электростатическим взаимодействием между центральным катионом и анионами или нейтральными молекулами внутренней сферы.
[Zn(NH3)4]Cl2
лиганды(адденды) комплексообразователь
По характеру электрического заряда различают катионные, анионные и нейтральные комплексы: катионные комплексы образуются за счет координации вокруг положительного иона (комплексообразователя) нейтральных молекул (NH3, H2O и др.). Например, [Zn(NH3)4]Cl2 – тетрааммиакат цинка. Анионными являются комплексы, в которых у комплексообразователя координируются анионы K3[Fe(CN)6]; K4[Fe(CN)6] – гексаферри(о)цианид калия.
Нейтральные комплексы образуются при координации вокруг нейтрального комплексообразователя нейтральных лигандов, а также при одновременной координации вокруг центрального иона положительно заряженных и нейтральных лигандов. Нейтральные комплексы, следовательно, являются комплексными соединениями без внешней сферы:
[Co(NH3)3Cl3] триаминотрихлорид кобальта.
43
СПЕЦИФИКАЦИЯ ТЕСТА ПО ТЕМЕ: «ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМОВ. ПЕРИОДИЧЕСКАЯ СИСТЕМА
ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА. ХИМИЧЕСКАЯ СВЯЗЬ»
Для контроля знаний по данной теме предлагаются тестовые варианты заданий, включающие разделы:
-уравнение Шредингера и квантовые числа;
-строение многоэлектронных атомов, принципы и правила заполнения электронных орбиталей;
-элементы малых и больших периодов в периодической системе;
-периодически повторяющиеся свойства элементов;
-химическая связь.
Перечень объектов контроля:
а) фактологические знания – знание основных терминов, обозначений; б) базовые знания – знания основных понятий, принципов и правил за-
полнения электронных орбиталей, периодической системы элементов Д. И. Менделеева, типов химической связи;
в) методологические знания и умения – знать и уметь использовать теоретические представления для объяснения строения атомов элементов и их свойств с учетом их расположения в периодической системе, типы химической связи.
Используются две формы задания:
-закрытая форма с выборочными ответами;
-открытая форма.
Общее время выполнения варианта теста 45 минут. За первые четыре правильно выполненные задания начисляется по два балла, за пятое, шестое и седьмое задания – по три балла. Максимальная сумма баллов 17. Предлагается следующая категория пересчета по пятибалльной системе
16 – 17 |
5 |
14 – 15 |
4 |
12 – 13 |
3 |
ВАРИАНТЫ ТЕСТА
Вариант 1
1. Числа 35 и 17 в обозначении атома хлора 1735 Cl показывают число протонов и нейтронов хлора
1)число протонов и нейтронов хлора;
2)массовое число и заряд ядра хлора;
44
3)атомную массу и порядковый номер хлора;
4)общее число электронов и число валентных электронов элемента хлора. 2. Структура валентного электронного слоя атома молибдена выражается
формулой
1)…5s25p4 2)…4d55s1 3)…4d35s3 4)…5s15p5
3. Квантовые числа, характеризующие состояние электронов 6s  , имеют значения
, имеют значения
1) |
n = 6 |
|
|
n = 6 |
|
|
|
2) |
n = 6 |
|
n = 6 |
|
|
|
ℓ = 5 |
|
|
ℓ = 5 |
|
|
|
|
ℓ = 0 |
|
ℓ = 0 |
|
|
|
mℓ = 4 |
mℓ = 4 |
|
|
|
mℓ = 0 mℓ = 0 |
|||||||
|
ms = |
1 |
|
ms = |
1 |
|
ms = |
1 |
ms = - |
1 |
|||
|
2 |
|
2 |
|
2 |
2 |
|||||||
|
|
|
|
|
|
|
|
|
|||||
3) |
n = 6 |
|
|
n = 6 |
|
|
|
4) |
n = 6 |
|
n = 6 |
|
|
|
ℓ = 5 |
|
|
ℓ = 5 |
|
|
|
|
ℓ = 5 |
|
ℓ = 5 |
|
|
|
mℓ = -5 |
mℓ = -5 |
|
mℓ = 5 mℓ = -5 |
|||||||||
|
ms = |
|
1 |
|
ms = - |
1 |
|
|
ms = |
1 |
ms = - |
1 |
|
|
|
2 |
|
2 |
|
|
2 |
2 |
|||||
|
|
|
|
|
|
|
|
|
|||||
4. Электронная формула элемента заканчивается …5d66s2, следовательно, тип (s-, p-, d-, f-) элемента, период и группа, в которой он расположен, высшая степень окисления, имеют следующие значения:
1) s–элемент |
2) s–элемент |
3) d–элемент |
4) d–элемент |
6-ой период |
5-ый период |
5-ый период |
6-ой период |
2-ая группа |
2-ая группа |
2-ая группа |
8-ая группа |
+2 |
+8 |
+2 |
+8 |
5.На каком основании германий и титан помещены в одной группе, но в разных подгруппах периодической системы? У какого из этих элементов в большей мере проявляются металлические свойства? Ответ дать с использованием электронных структур атомов.
6.Как изменяется энергия ионизации элементов в главных побочных подгруппах с увеличением порядкового номера. Ответ дать, исходя из электронного строения атомов элементов.
7. К какому типу химической связи относится связь между атомами в
молекулах |
|
|
1) КI 2) Br2 |
3) Sn |
4) НCl. |
45
Вариант 2 1. Числа 93 и 41 в обозначении атома ниобия показывают общее
число электронов и число валентных электронов в атоме:
а) общее число электронов и число валентных электронов в атоме; б) атомную массу и порядковый номер; в) число протонов и нейтронов; г) массовое число и заряд ядра.
2. Структура валентного электронного слоя атома рения выражается формулой
1)…5s25p5 |
2)…4d55s2 |
|
3)…5d56s2 |
4)…6s26p5 |
|
|
|
|||||||||
3. Квантовые числа, характеризующие состояние электронов 4Р |
, |
|||||||||||||||
имеют значения |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1) n = 4 |
|
|
n = 4 |
|
|
n = 4 |
|
n = 4 |
|
|
n = 4 |
|
n = 4 |
|
|
|
ℓ = 1 |
|
|
ℓ = 1 |
|
|
ℓ = 1 |
|
ℓ = 1 |
|
|
ℓ = 0 |
|
ℓ = 0 |
|
|
|
mℓ = 0 |
ml = 0 |
mℓ =-1 |
mℓ =-1 |
mℓ =1 |
mℓ =1 |
|
|
|
||||||||
ms = |
1 |
|
ms =- |
1 |
|
ms = |
1 |
ms = - |
1 |
|
ms = |
1 |
ms = - |
1 |
|
|
2 |
|
2 |
|
2 |
2 |
|
2 |
2 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
2) n = 4 |
|
|
n = 4 |
|
|
n = 4 |
|
n = 4 |
|
|
n = 4 |
|
n = 4 |
|
|
|
ℓ = 3 |
|
|
ℓ = 3 |
|
|
ℓ = 3 |
|
ℓ = 3 |
|
|
ℓ = 3 |
|
ℓ = 3 |
|
|
|
mℓ = 1 |
ml = 1 |
mℓ =-2 |
mℓ =-2 |
mℓ =0 |
mℓ =0 |
|
|
|
||||||||
ms = |
1 |
|
ms =- |
1 |
|
ms = |
1 |
ms = - |
1 |
|
ms = |
1 |
ms = - |
1 |
|
|
2 |
|
2 |
|
2 |
2 |
|
2 |
2 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
3) n = 4 |
|
|
n = 4 |
|
|
n = 4 |
|
n = 4 |
|
|
n = 4 |
|
n = 4 |
|
|
|
ℓ = 2 |
|
|
ℓ = 2 |
|
|
ℓ = 2 |
|
ℓ = 2 |
|
|
ℓ = 2 |
|
ℓ = 2 |
|
|
|
mℓ = -2 |
ml = -2 |
mℓ =-1 |
mℓ =-1 |
mℓ =0 |
mℓ =0 |
|
|
|
||||||||
ms = |
1 |
|
ms =- |
1 |
|
ms = |
1 |
ms = - |
1 |
|
ms = |
1 |
ms = - |
1 |
|
|
2 |
|
2 |
|
2 |
2 |
|
2 |
2 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
4) n = 4 |
|
|
n = 4 |
|
|
n = 4 |
|
n = 4 |
|
|
n = 4 |
|
n = 4 |
|
|
|
ℓ = 1 |
|
|
ℓ = 1 |
|
|
ℓ = 1 |
|
ℓ = 1 |
|
|
ℓ = 1 |
|
ℓ = 1 |
|
|
|
mℓ = -1 |
ml = -1 |
mℓ =0 |
mℓ =0 |
|
|
mℓ =1 |
mℓ =1 |
|
|
|
||||||
ms = |
1 |
|
ms =- |
1 |
|
ms = |
1 |
ms = - |
1 |
|
ms = |
1 |
ms = - |
1 |
|
|
2 |
|
2 |
|
2 |
2 |
|
2 |
2 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
4. Электронная формула элемента заканчивается…4p65s1, следовательно, тип (s-, p-, d-, f-), период и группа, в которой элемент расположен высшая сте-
пень окисления, имеют следующие значения: |
|
||
1) s-элемент |
2) p-элемент |
3) p-элемент |
4) s-элемент |
5-й период |
4-й период |
5-й период |
4-й период |
1-я группа |
7-я группа |
7-я группа |
1-я группа |
+1 |
+7 |
+7 |
+6 |
46
5.На основании электронного строения атомов обосновать сходство и различие марганца и брома, находящихся в седьмой группе четвертого периода
6.Среди приведенных ниже электронных конфигураций указать невоз-
можные и объяснить причину невозможности их реализации
1р3; 3p6; 3s2; 2s2; 2d5; 5d2; 3f12; 2p4; 3p7. |
|
|
|
|
|
|
|
|
|
||||||||||||
7. Водородные связи образуются между молекулами: |
|
|
|
|
|||||||||||||||||
1. Хлора |
|
|
2. Воды |
3. Этилового спирта |
4. Этана |
|
|
|
|||||||||||||
|
|
|
|
|
|
Вариант 3 |
|
|
|
|
|
|
|
|
|
||||||
1. При орбитальном квантовом числе ℓ = 3, магнитное квантовое число |
|||||||||||||||||||||
принимает значения |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1) -3,-2,0,2,3 |
2) 0,1,2,3 |
|
3) -3,-2,-1,0,1,2,3 4) -2,-1,0,1,2 |
|
|
|
|
||||||||||||||
2. Структура валентного электронного слоя атома франция выражается |
|||||||||||||||||||||
формулой: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1)…6p67s1 2)…6p57s2 3)…6d107s1 4)…6f147s1 |
|
|
|
|
|
|
|
|
|
||||||||||||
3. Квантовые числа, характеризующие состояние электронов 2p |
, |
||||||||||||||||||||
имеют значение: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1) n = 2 |
|
|
n = 2 |
n = 2 |
2) n = 2 |
n = 2 |
n = 2 |
|
|
|
|||||||||||
ℓ = 0 |
|
|
ℓ = 1 |
ℓ = 0 |
ℓ = 1 |
ℓ = 1 |
ℓ = 1 |
|
|
|
|||||||||||
mℓ = 0 |
ml = 0 |
mℓ =0 |
mℓ =0 |
mℓ =-1 |
mℓ =1 |
|
|||||||||||||||
ms = |
1 |
|
ms = |
1 |
|
ms = - |
1 |
ms = |
1 |
|
ms = |
1 |
|
|
ms = |
1 |
|
|
|||
2 |
|
|
|
|
|
|
|
2 |
|
|
|||||||||||
|
|
2 |
|
2 |
2 |
|
2 |
|
|
|
|
|
|||||||||
3) n = 2 |
|
|
n = 2 |
n = 2 |
4) n = 2 |
n = 2 |
n = 2 |
|
|
|
|||||||||||
ℓ = 0 |
|
|
ℓ = 0 |
ℓ = 0 |
ℓ = 1 |
ℓ = 1 |
ℓ = 1 |
|
|
|
|||||||||||
mℓ = -1 |
ml = 0 |
mℓ =1 |
mℓ =0 |
mℓ =0 |
mℓ =-1 |
|
|||||||||||||||
ms = |
1 |
|
ms = |
1 |
|
ms = |
1 |
|
ms = |
1 |
|
ms = - |
1 |
|
ms = |
1 |
|
|
|||
2 |
|
|
|
|
|
2 |
|
|
|||||||||||||
|
|
2 |
|
2 |
|
2 |
|
2 |
|
|
|
|
|||||||||
4. Электронная формула элемента заканчивается …4f55d16s2, следовательно, тип (s-, p-, d-, f-) элемента, период и группа, в которой он расположен, высшая степень окисления имеют значения:
1) d-элемент |
2) d-элемент |
3) f-элемент |
4) |
f-элемент |
6-й период |
4-й период |
6-й период |
|
6-й период |
3-я группа |
3-я группа |
3-я группа |
|
8-я группа |
+3 |
+8 |
+3 |
|
+8 |
5. На каком основании хром и селен помещены в одной группе, но в раз- |
||||
ных подгруппах периодической системы элементов? |
У |
какого элемента в |
||
47
большей мере выражены металлические свойства? Ответ мотивировать, исходя из электронного строения атома.
6.Исходя из электронного строения атома объяснить, как меняются окис- лительно-восстановительные свойства в ряду галогенов F – Cl – Br – I.
7.Неспаренные электроны содержатся на молекулярных орбиталях в мо-
лекуле
1. F2 |
2. N2 |
3. Ne |
4. O2 |
|
|
|
|
|
||||||||
|
|
|
|
|
|
Вариант 4 |
|
|
|
|
|
|
||||
1. Электроотрицательность увеличивается в ряду |
|
|
|
|||||||||||||
1) Bi, Sb, As |
2) Cd, Hg, Ba |
3) I, Te, Sb |
4) Ca, Sr, Ba |
|
|
|||||||||||
2. Квантовые числа, характеризующие состояния электронов 2s , име- |
||||||||||||||||
ют значения |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1) |
n = 2 |
n = 2 |
2) |
n = 2 |
|
|
n = 2 |
|
|
|||||||
|
ℓ = 0 |
ℓ = 0 |
|
|
|
|
ℓ = 1 |
|
|
ℓ = 1 |
|
|
||||
|
mℓ = 0 mℓ = 0 |
mℓ = 1 |
mℓ = 1 |
|||||||||||||
|
ms = |
1 |
|
|
ms = |
1 |
|
ms = |
1 |
|
ms = - |
1 |
|
|||
|
|
|
|
|
|
|
2 |
|
2 |
|
||||||
|
2 |
|
|
|
2 |
|
|
|
|
|
||||||
3) |
n = 2 |
n = 2 |
4) |
n = 0 |
|
|
n = 0 |
|
|
|||||||
|
ℓ = 1 |
ℓ = 1 |
|
|
|
|
ℓ = 5 |
|
|
ℓ = 5 |
|
|
||||
|
mℓ = 0 mℓ = 0 |
mℓ = -1 |
mℓ = -1 |
|||||||||||||
|
ms = |
1 |
|
ms = - |
1 |
|
|
ms = |
1 |
|
ms = - |
1 |
|
|||
|
|
2 |
|
|
2 |
|
2 |
|
||||||||
|
2 |
|
|
|
|
|
|
|
|
|
||||||
3. Среди приведенных ниже электронных конфигураций невозможны: 1) 7s2 2) 2d3 3) 4p6 4) 4f9
4. Электронная формула элемента заканчивается …3d104s2, следовательно, тип (s-, p-, d-, f-) элемента, период и группа, в которой он расположен, выс-
шая степень окисления имеют значения: |
|
|
|
1) s-элемент |
2) s-элемент 3) |
d-элемент |
4) d-элемент |
4-й период |
3-й период |
4-й период |
3-й период |
2-я группа |
2-я группа |
2-я группа |
2-я группа |
+2 |
+2 |
+2 |
+2 |
5.Исходя из теории строения атома, объяснить, почему при химических реакциях хлор выступает в качестве окислителя, а ионы хлора – в качестве восстановителя.
6.Какое из сравниваемых двух соединений является более сильным осно-
ванием: а) NaOH или CsOH; б) Ca(OH)2 или Ba(OH)2; в) Zn(OH)2 или Cd(OH)2?
Ответ мотивировать исходя из электронного строения атомов.
48
7. |
Линейное строение имеют вещества |
|
|
|
|
|
|
|
|
||||||||||
|
|
1) BF3 |
2) H2S |
|
|
3) CO2 |
4) CH4 |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
Вариант 5 |
|
|
|
|
|
|
|
|
|||
1. |
Формула высшего оксида элемента с электронной конфигурацией |
||||||||||||||||||
1s22s22p63s23p63d14s2 имеет вид: |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
1) ЭО |
2) ЭО2 |
3) Э2О3 |
4) Э2О5 |
|
|
|
|
|
|
|
|
||||||||
2. |
Структура валентного электронного слоя атома лантана имеет вид: |
||||||||||||||||||
1) …5d06s26p1 2) …5d15f16s1 3) …5d06s16p2 4) …5d16s |
|
|
|
||||||||||||||||
3. |
Квантовые числа, характеризующие состояние электронов 5p |
, |
|||||||||||||||||
|
|
1) n = 5 |
n = 5 |
n = 5 |
|
|
2) |
n = 5 |
n = 5 |
n = 5 |
|
|
|||||||
|
|
ℓ = 4 |
ℓ = 4 |
ℓ = 4 |
|
|
|
ℓ = 1 |
ℓ = 1 |
ℓ = 1 |
|
|
|||||||
|
|
mℓ = 4 |
ml = -4 |
mℓ =0 |
|
mℓ =-1 mℓ =0 |
mℓ =-1 |
||||||||||||
|
|
ms = |
1 |
|
ms = |
1 |
|
ms = |
|
1 |
|
ms = |
1 |
ms = |
1 |
|
ms = |
1 |
|
|
|
|
|
2 |
|
|
|
2 |
|
||||||||||
|
|
2 |
|
2 |
|
|
|
2 |
2 |
|
|
|
|||||||
|
|
3) n = 5 |
n = 5 |
n = 5 |
|
|
4) |
n = 5 |
n = 5 |
n = 5 |
|
|
|||||||
|
|
ℓ = 3 |
ℓ = 3 |
ℓ = 3 |
|
|
|
ℓ = 2 |
ℓ = 2 |
ℓ = 2 |
|
|
|||||||
|
|
mℓ = -3 |
ml = 3 |
mℓ =0 |
|
mℓ =-2 mℓ =-2 |
mℓ =0 |
||||||||||||
|
|
ms = |
1 |
|
ms = |
1 |
|
ms = |
|
1 |
|
ms = |
1 |
ms = |
1 |
|
ms = |
1 |
|
|
|
|
|
2 |
|
|
|
2 |
|
||||||||||
|
|
2 |
|
2 |
|
|
|
2 |
2 |
|
|
|
|||||||
4. Электронная формула элемента заканчивается…4d55s2, следовательно, тип (s-, p-, d-, f-) элемента, период и группа, в которой он расположен, высшая
степень окисления имеют значения: |
|
|
||
1) d-элемент |
2) s-элемент |
3) d-элемент |
4) s-элемент |
|
5-й период |
5-й период |
4-й период |
5-й период |
|
7-я группа |
7-я группа |
2-я группа |
2-я группа |
|
|
+7 |
+7 |
+7 |
+2 |
5. Определите количество вакантных 3d-орбиталей у возбужденных атомов |
||||
1) Cо |
2) V |
3) Mn |
4) Cl |
|
6.На каком основании фосфор и ванадий помещены в одной группе, но в разных подгруппах периодической системы? У какого из этих элементов в большей мере проявляются металлические свойства? Ответ дать с использованием электронных структур атомов.
7.Наибольшая прочность связи в молекуле
1) Н – I 2) Н – Br 3) Н – Cl 4) H - F
49
