
Методическое пособие 494
.pdf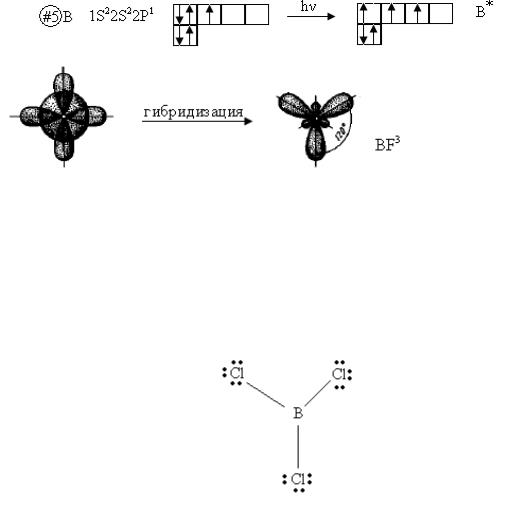
На возбуждение и процесс гибридизации атомных орбиталей требуется затрата энергии. Однако эта энергия с избытком компенсируется той энергией, которая выделяется при образовании химической связи за счет перекрывания электронных гибридных облаков с электронными облаками атома хлора. Так как в образовании гибридных облаков принимают участие одно s и одно p- облако, то этот вид гибридизации носит название sp-гибридизация. Все молекулы, в которых имеет место sp-гибридизация имеют линейное строение. Угол между всеми связями 1800. Термин гибридизация был введен американским физиком Поллингом.
sp2 –гибридизация:
Рис. 11
Комбинация одного s- и двух p-электронов приводит к образованию трех гибридных облаков, расположенных друг к другу под углом 1200, например BCl3 или BF3, молекула имеет плоскостную треугольную форму.
Рис. 12
В молекулах, где имеет место sp2-гибридизация, углы между связями 1200. Молекула имеет плоскостное строение.
30
sp3-гибридизация:
Рис. 13
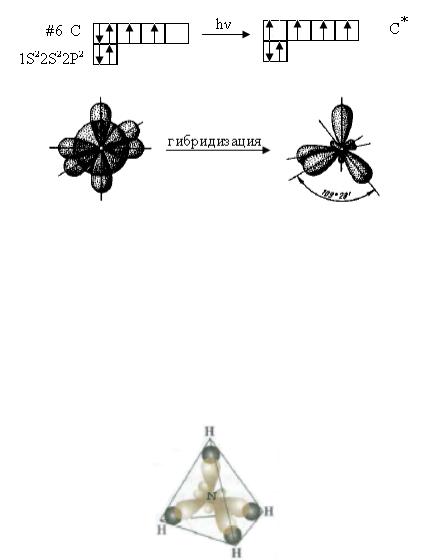
Комбинация облаков одного s- и трех p-электронов приводит к sp3- гибридизации, при которой четыре гибридных облака симметрично ориентированы в пространстве к четырем вершинам тетраэдра, то есть под углом 109028´. Тетраэдрическое расположение связей характерно для многих соединений четырех валентного углерода, например СН4. Вследствие sp3-гибридизации орбиталей атома азота аналогичную структуру имеет и комплексный ион NH4+.
Рис. 14
Молекулы имеют пространственное строение. Углы между связями
109028´.
Механизмы образования ковалентной связи
Существует два механизма образования ковалентной связи:
1)если химическая связь возникает за счет перекрывания электронных орбиталей двух неспаренных электронов с антипараллельными спинами, принадлежащих двум различным атомам, то такой механизм называется обменным (потому что в решении уравнения Шредингера используется обменный интеграл);
2)донорно-акцепторный.
При взаимодействии нейтральных молекул
31

NH3+ HCl→NH4Cl
газ газ тв
BF3+ HF→ HBF4
Рис. 15
Поскольку хлор очень электроотрицательный элемент, то он перетягивает на себя электронную пару. Когда молекулы подходят близко друг к другу, то атом водорода оказывается между двумя электронными парами и водород подсоединяется к неподелённой электронной паре азота. Связь в ионе NH4+ образована тремя электронными парами, образованными за счёт неспаренных электронов азота и водорода, и четвёртой неподеленной парой азота и свободной орбиталью водорода. Такая связь, которая образована неподеленной электронной парой одного атома и свободной электронной орбиталью другого атома, называется донорно-акцепторной связь.
Атом, предоставляющий для образования связи неподеленную электронную пару, называется донором, а атом, предоставляющий свободную электронную орбиталь – акцептором. Связь в ионе BF4образована тремя электронными парами, образованными за счёт неспаренных электронов бора и фтора, и четвёртой неподеленной парой фтора и свободной орбиталью бора. В ионе BF4- донор F- , а акцептор В.
Донорно-акцепторная связь может возникать между атомами не только при взаимодействии сложных веществ друг с другом, но и при образовании молекулы из атомов.
Экспериментально было установлено, что в молекуле С = О, связь значительно более прочная, чем обычная двойная. Было высказано предположение, что в молекуле СО наряду с двумя связями, образованными по обменному механизму, имеет место донорно-акцепторная связь. Третья связь между углеродом и кислородом возникает за счет неподеленной электронной пары кислорода и свободной орбитали углерода С  О (стрелка от донора к акцептору).
О (стрелка от донора к акцептору).
32

Рис. 16
Валентность с точки зрения метода валентных связей
По современным представлениям валентность элемента определяется количеством неспаренных электронов в нормальном и возбужденном состояниях, образующих общие электронные пары с другими атомами. У s-элементов валентные электроны располагаются только на s-подуровне внешнего слоя. Исключение составляет гелий, у которого два электрона на внешнем слое. У p- элементов валентные электроны располагаются только на внешних s иp подуровнях. Количество валентных электронов равно номеру группы, в которой стоит элемент. Исключение составляют азот, кислород, фтор. По количеству неспаренных электронов азот максимально может быть трехвалентным. С учетом образования донорно-акцепторной связи азот может быть четырехвалентным, пятивалентным.
Рис. 17
В то же время аналоги азота, кислорода, фтора могут проявлять набор валентностей. Например, сера
Рис. 18
Для серы характерен набор четных валентностей. Для хлора характерен набор нечетных валентностей 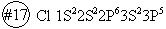 .
.
33

У d-элементов валентными являются электроны внешнего s-подуровня и неспаренные электроны предпоследнего d-подуровня.
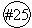 Mn 1S22S22P63S23P63d54S2
Mn 1S22S22P63S23P63d54S2
Fe 1S22S22P63S23P63d64S2 |
3d |
Рис. 19
Количество неспаренных электронов уменьшается с порядковым номером, и максимальная валентность понижается, для железа максимальная валентность равна шести. Еще меньше неспаренных электронов у кобальта и никеля. Кобальт и никель проявляют валентность два и три в соединениях. Соединений с более высокой валентностью для этих элементов не получено. Для элементов платиновой группы максимальная валентность равна шести. И только осмий в соединениях может быть восьмивалентен. Его d-электроны могут распариваться на предпоследний f-подуровень. У f-элементов валентные электроны располагаются на внешнем s, предпоследнем d, предпредпоследнем f. Наиболее часто f-элементы проявляют валентность 3, 4 и реже шесть.
Ионная связь
По современным представлениям, основывающимся на волновых свойствах электрона, нельзя говорить о 100% ионной связи между атомами в молекуле, так как энергия ионизации всегда больше сродства к электрону. Экспериментально определены эффективные заряды над атомами в кристалле. Доля ионности определяется эффективными зарядами над ионами в молекуле. 100% ионной связи не может быть и потому, что вероятность нахождения электрона между двумя атомами, образующих связь, не может быть равна нулю, так как электрон обладает волновыми свойствами. По современным представлениям мы рассматриваем ионную связь, как очень сильнополярную ковалентную связь, при образовании которой общая электронная пара очень сильно смещена в сторону атома более электроотрицательного элемента. Таким образом, универсальным видом химической связи является ковалентная связь, а ионная связи лишь частный случай полярной ковалентной связи, возникающей между атомами очень сильно отличающимися по своей электроотрицательности. Условились считать ионной связью связь между типичными металлами и сильно электроотрицательными неметаллами (связь, возникающую между щелочными и щелочноземельными металлами, галогенами, кислородом и серой). Соединения с преобладанием ионного типа связи обладают некоторыми общими свойствами:
34
1)при обычных условиях они находятся в твердом, кристаллическом состоянии;
2)в кристаллах таких соединений каждый положительно заряженный ион окружен определённым количеством отрицательно заряженных ионов, а они окружены в свою очередь определенным количеством положительных ионов. В связи с этим каждый кристалл ионного соединения можно рассматривать как макромолекулу;
3)кристаллические вещества с ионным типом связи имеют достаточно высокие температуры плавления и кипения;
4)при сильном нагревании (выше температуры кипения) вещества переходят в пар в виде отдельных молекул, в которых имеет место обычный тип ковалентной связи.
В отличие от обычной ковалентной связи ионная связь не обладает свойством направленности и насыщаемости. Каждый ион создает вокруг себя электрическое поле шаровой симметрии. Количество противоионов, которые может присоединить к себе за счет сил электростатического притяжения данный ион, определяется зарядом иона, его радиусом, а так же зарядом и радиусом противоиона. Кристалл ионного соединения образуется в том случае, когда силы притяжения между противоположно заряженными ионами преобладают над силами отталкивания одноименнозаряженных ионов.
Метод молекулярных орбиталей (ММО)
На основе метода ВС невозможно объяснить существование свободных радикалов, молекул, ионов Н2+; Не2+, О2-, которые имеют неспаренные электроны (а МВС исходит из того, что ковалентная связь осуществляется общей парой электронов). МВС не может объяснить некоторые магнитные свойства веществ. Слабомагнитные вещества делятся на диамагнитные, которые выталкиваются из магнитного поля, и парамагнитные, которые втягиваются в магнитное поле. Магнитные свойства атома от магнитных свойств электронов. Если на атомной орбитали находятся два электрона, то спины их антипараллельны, магнитные поля взаимно компенсируются и суммарный магнитный момент электронной пары равен нулю. Поэтому, если молекуле все электроны спарены, то она должна быть диамагнитна. Образование молекулы кислорода О2 описывается методом ВС как результат создания двух общих электронных пар. Согласно такому описанию О2 не содержат неспаренных электронов. Но магнитные свойства О2 указывают, что в молекуле О2 имеются два неспаренных электрона, то есть О2 – парамагнитен (втягивается в магнитное поле). Эти факты получают свое объяснение в ММО, в основе которого лежит качественно другой подход: ядра атомов составляют каркас молекулы. Подобно тому, как электроны в ато-
35
мах располагаются на атомных орбиталях, обобществленные электроны в молекуле располагаются на молекулярных орбиталях (МО). Молекулярные орбитали, как и атомные, заполняются в порядке возрастания энергии (принцип минимума энергии), с соблюдением «запрета» Паули и правила Гунда. Молекулярные орбитали образуются в результате сложения или вычитания волновых функций атомных орбиталей, почему и называются «линейная комбинация атомных орбиталей-молекулярная орбиталь» ЛКАО – МО, которая требует соблюдение следующих правил:
1.Число молекулярных орбиталей равно общему числу АО, из которых комбинируется МО.
2.Энергия одних МО оказывается выше, других – ниже энергии исходных АО, приблизительно совпадает со средней энергией этих АО.
3.Электроны заполняют МО как и АО в порядке возрастания энергии с соблюдением принципов «запрета» Паули и правила Гунда.
4.Наиболее эффективно комбинируются АО с теми АО, которые характеризуются сопоставимыми энергиями и соответствующей симметрией.
5.Как и в МВС прочность связи в методе МО пропорциональна степени перекрывания электронных орбиталей.
Наиболее простые случаи линейных комбинаций осуществляется в двухатомных молекулах, образованных одинаковыми атомами.
Если обозначить АО атомов А и В через ψА и ψВ, а МО через ψАВ, то согласно ЛКАО ψАВ = аψА ± bψВ, где ψАВ – волновая функция в молекуле (МО); а
иb – коэффициенты, учитывающие долю каждой АО в образовании МО; ψА и ψВ – волновые функции (АО) в атомах А и В.
При сложении волновых функций АО энергия МО будет ниже исходных АО. Такая орбиталь называется В случае вычитания волновых функций МО имеет большую энергию, чем исходные АО, и называется разрыхляющей. Электроны на связующей орбитали обеспечивают связь между атомами, а электроны на разрыхляющей орбитали, ослабляют связь между атомами. Вопрос об образовании молекулы сводится, таким образом, к вопросу о том, что энергетически более выгодно для электронов: оставаться в изолированных атомах или перейти на молекулярные орбитали.
Число связей (порядок) определяются по разности между числом электронов на связующих и разрыхляющих орбиталях, делённой на два:
n eñâÿç eðàçð .
2
Для описания строения молекулы в ММО применяются энергетические диаграммы, аналогично электронографическим формулам для АО. Молекулярные орбитали, полученные при комбинации s-AO, называют σх-МО; при комбинации рХ-АО – σх-МО, ( х – координата по линии, соединяющей ядро ато-
36
мов); при комбинации рy- и рz-AO – πy- и πz-МО. π – молекулярные орбитали также формируются при комбинации р- и d-АО и некоторых d-АО:
а) |
б) |
|
Рис. 20
Метод МО успешно объясняет строение и свойства таких молекул, описание которых с помощью метода ВС затруднено. Например, для О2:
O2 [(σсв2S)2(σр2S)22(πсв2P)2(σсв2P)22(πр2P)1]
Металлическая связь
Металлы обладают рядом специфических свойств:
1)высокой электро- и теплопроводностью;
2)способностью достаточно легко отдавать электроны.
Для объяснения этих свойств металлов немецкий ученый Друзе и Лоренц
в20-х годах нашего века предложили гипотезу электронного газа для валентных электронов, находящихся в металле. По их расчетам валентные электроны
вметалле не связаны со своими атомами, а свободно перемещаются, обобществляя все атомы и ионы кристаллов металла.
Ссовременных позиций металлическая связь не может быть объяс-
нима методом валентных связей. Для описания металлической связи используется другой квантовомеханический метод, названный методом молекулярных орбиталей (ММО) (Гунд, Поллинг 1927).
В соответствии с этим методом при образовании молекулы или кристалла атомы теряют свою индивидуальность, электроны с атомных орбиталей переходят на новые, общие для всех взаимодействующих атомов, молекулярные орбитали. Электроны, в том числе и валентные, становятся делокализо-
37
ванными, то есть они не принадлежат конкретно какому-то определенному атому, а принадлежат всем атомам одновременно. С позиции ММО металлы представляют кристаллическую решетку, в узлах которой находятся положительно заряженные ионы, а валентные электроны перемещаются в междоузлиях подобно свободному «электронному газу». Именно наличие этих свободных, делокализованных, не связанных с определенным атомом, электронов объясняются электро- и теплопроводность, пластичность металлов с химической точки зрения наличие свободных электронов объясняет важные восстановительные свойства металлов (способность при реакциях легко отдавать свои электроны).
Водородная связь
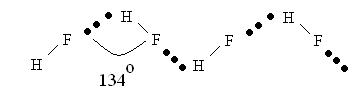
Водородная связь – это дополнительная связь, которая может возникнуть между сильно полярными молекулами, в состав которых входят атомы водорода и атом какого-нибудь сильно электроотрицательного элемента. Прочность водородной связи в молекуле HF 40 кДж/моль. Казалось бы, HF в воде должна была бы образовать очень сильную кислоту. Однако путем измерения электропроводности установлено, что фтористоводородная кислота слабый электролит, который даже со щелочами может образовывать кислые соли NaHF2. В то же время аналоги HF – HCl, HBr, HI являются сильными электролитами. Аномалия свойств HF в воде объясняется тем, что между отдельными молекулами HF возникают очень прочные межмолекулярные связи.
Рис. 21
Водородная связь между молекулами HF настолько велика, что в концентрированных растворах молекулу плавиковой кислоты изображают H2F2. Даже в парообразном состоянии фтористый водород находится в виде димеров, тримеров, тетрамеров HF, n=2÷4. В конденсированном состоянии HF полностью полимеризован, то есть связан водородными связями между собой и располагаются молекулы под углом 1340, отсюда и низкая электропроводность.
38
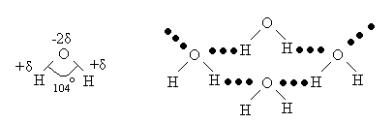
Наиболее интересно влияние водородной связи на свойства воды.
Рис. 22
В одном объеме все молекулы воды связаны друг с другом водородными связями. Именно наличием водородных связей между молекулами воды объясняются аномально высокие температуры плавления и кипения Н2О, плотность и вязкость воды. Все водородные аналоги кислорода H2S, H2Te, H2Se при обычных условиях являются газами, причем температуры их кипения и плавления увеличиваются сверху вниз (с ростом атомной массы). В таком случае Н2О, если бы в ней не было водородных связей, должна была бы быть самым легкоплавким соединением (замерзать при самой низкой температуре) и закипать при самой низкой температуре. Если рассчитать свойства соды по свойствам её аналогов, то температура плавления воды должна быть не 00С, а 1000С, а температура кипения не 1000С, а -800С. Аномальные свойства воды определяются именно наличием водородной связи между молекулами Н2О. В конденсированном состоянии все молекулы Н2О связаны между собой водородными связями и представляют собой огромную макромолекулу. При этом от каждого атома кислорода отходят две обычных ковалентных связи и две водородных связи, а каждый атом водорода связан с соседним атомом кислорода одной обычной ковалентной связью и одной водородной связью. Прочность водородной связи между молекулами воды ~ 20 кДж/моль. Наличием водородной связи и объясняется ажурное строение кристаллической водыльда. Именно поэтому лед имеет меньшую плотность, чем жидкая вода, и всплывает на её поверхность. Даже в парах воды обнаруживаются димеры (Н2О)2.
Итак, действие межмолекулярных водородных связей способствует образованию димеров и тримеров т.е. в жидкости молекулы ассоциированы, а в твёрдом состоянии создаются сложные кристаллические структуры, что приводит к значительным затратам энергии для их разрыва, так как произошло изменение свойств этих веществ: повышение вязкости, диэлектрической постоянной, температур кипения и плавления, теплот плавления и парообразования.
Существует и внутримолекулярная водородная связь, возникающая между атомами водорода и отрицательными полярных групп в одной и той же молекуле, например, салициловом альдегиде.
39
