
Методическое пособие 494
.pdfэнергии 96,5 кДж/моль). Энергия ионизации, выраженная в электрон-вольтах, численно равна потенциалу ионизации, выраженному в вольтах.
Энергия сродства к электрону
Сродство к электрону является количественной мерой способности нейтрального атома элемента присоединять к себе электроны, превращаясь в отрицательные ионы. Энергия сродства к электрону – это энергия, которая выделилась при присоединении электронов к 1 молю нейтральных атомов. Энергия сродства к электрону служит количественной мерой неметаллических свойств элементов и обозначается буквой Е. По периоду слева направо энергия сродства к электрону возрастает.
Электроотрицательность (ЭО)
Это величина равна полусумме энергии ионизации и энергии сродства к
электрону ЭО= |
I E |
(характеризует способность атома данного элемента оття- |
|
2 |
|||
|
|
гивать к себе общую электронную пару). Электроотрицательность в периодах слева направо увеличивается. В группах сверху вниз ЭО уменьшается. Электроотрицательность также характеризует активность элемента в химических взаимодействиях. Самый электроотрицательный элемент F, самый электроположительный элемент, то есть имеет min электроотрицательность, Fr (франций).
Изменение валентности в группах и периодах
По Менделееву номер группы совпадает с максимально возможной валентностью по кислороду. По современным представлениям валентность определяется количеством химических связей, которыми атом данного элемента связывается с атомами другого элемента. С точки зрения строения атома валентность определяется количеством электронов данного элемента, способных образовывать общие электронные пары с атомами другого элемента. Поскольку у атомов элементов главной подгруппы 1-ой группы только один электрон на внешнем слое, то все эти элементы могут быть только одновалентны. У атомов главной подгруппы второй группы по два электрона на внешнем слое, поэтому эти элементы только двухвалентны. У атомов элементов главной подгруппы третьей группы на внешнем слое три электрона, следовательно, они трехвалентны. Если количество электронов на внешнем слое больше трех, то не все электроны одновременно могут принимать участие в образовании химической связи. Поэтому, начиная с четвертой группы, валентность элементов может
20

быть переменной. Но максимальная валентность в большинстве случаев совпадает с номером группы, в которой стоит элемент.
Исключение составляют кислород (валентность 2), фтор (валентность 1), медь, серебро и золото вследствие особенности своей электронной структуры могут проявлять валентность 1, 2, 3. При этом для Cu наиболее устойчивые соединения, где медь двухвалентна, для серебра – одновалентна, для золота – трехвалентна. Наиболее устойчивыми состояниями на d подуровне является наполовину заполненное d5 и d10:
№29 1S22S22P63S23P63d94S2 ↔ 1S22S22P63S23P63d104S1.
Изменение химических свойств элементов и их соединений в группах и периодах
Как было указано ранее свойства оксидов и гидроксидов элементов определяются характером элемента их образующего. Чем больше проявляет элемент металлические свойства, тем сильнее проявляются основные свойства оксидов и гидроксидов. Наиболее активными являются щелочные и щелочноземельные металлы. Их оксиды проявляют только основные свойства. Их гидроксиды являются сильными основаниями, хорошо растворимыми в воде, т. е. щелочами. Основные свойства оксидов и гидроксидов возрастают сверху вниз в главных подгруппах. С увеличением валентности элемента основные свойства оксидов и гидроксидов ослабляются, а кислотные возрастают.
Так в ряду Li2O, BeO, B2O3, CO2, |
N2O5 |
|||
осн. |
амф. |
кисл. |
кисл. |
кисл. |
Be(OH)2 |
H3BO3 |
H2CO3 |
HNO3 |
|
H2BeO2
Металлические и неметаллические элементы в периодической системе Д. И. Менделеева
Все s-элементы, кроме водорода и гелия, являются металлами. Металлами являются все d- и f-элементы, то есть к металлам относятся все элементы, у которых во внешнем слое не более 2-х электронов. d-элементы находятся в побочных подгруппах, f-элементы внесены в нижнюю часть таблицы и образуют семейства лантаноидов и актиноидов. Среди p-элементов к металлам относятся: в III A все, кроме бора; в IV A металлами являются олово и свинец, Ge – полуметалл, в зависимости от условий проявляет свойства металла и неметалла; V A
– Bi – металл, мышьяк и сурьма – полуметаллы. У мышьяка преобладают неме-
21
таллические, а у сурьмы – металлические свойства. В VI A группе – кислород, сера, селен, теллур – неметаллы, а полоний – металл. В VII A группе – галогены
– неметаллы. В VIII A группе все элементы образуют инертные (благородные) газы – неметаллы.
Начинают период щелочные металлы, бериллий – металл, но его валентные (внешние) электроны достаточно близко расположены относительно ядра, поэтому оксид и гидроксид Be обладают амфотерными свойствами, они нерастворимы в воде, но растворяются в кислотах и щелочах. Mg – более активный металл, чем бериллий, его оксид и гидроксид нерастворимы в воде, но проявляют только основные свойства, значит, растворяются только в кислотах. Ca, Sr, Ba, Ra – щелочноземельные металлы. Их оксиды и гидроксиды растворимы
вводе, с увеличением порядкового номера элемента растворимость его оксидов и гидроксидов в воде увеличивается. Растворы гидроксидов и щелочноземельных металлов в воде также являются щелочами. Гидроксиды всех основных металлов в воде нерастворимы. Составляют исключение оксиды и гидроксиды металлов, в которых металл проявляет высшие валентности. Так в соответствии
впериодической системе Cr может образовать три оксида:
II |
III |
VI |
|
|
CrO; |
Cr2O3; |
CrO3 |
CrO3 +H2O= H2CrO4 |
|
осн. |
амфот. |
высш. оксид |
хром. к-та |
|
взаимод. |
|
кисл. св-ва |
|
|
только с |
|
раствор. в H2O |
|
|
кислотами, |
|
|
|
|
а марганец пять: |
|
|
|
|
II |
III |
IV |
VI |
VII |
MnO; |
Mn2O3; |
MnO2; |
MnO3; |
Mn2O7 |
осн. |
амф. |
амф. |
кисл. |
кисл. |
Mn(OH)2 |
Mn(OH)3 |
Mn(OH)4 |
H2MnO4 |
HMnO4 |
H3MnO3 H4MnO4
Металлы при взаимодействии с другими веществами могут только отдавать электроны, превращаясь в положительно заряженные ионы. Неметаллы также могут отдавать электроны, в образующихся соединениях элементы проявляют валентность по кислороду, максимальная же валентность равна номеру группы, в которой стоит элемент. Неметаллы в отличие от металлов могут образовывать газообразные (летучие) соединения с водородом. Валентность по водороду для неметалла равна 8 – номер группы, в которой стоит элемент. Исключение составляет бор, для него водородное соединение BH3.
22

Химическая связь
Важнейшей проблемой теоретической химии является исследование природы химической связи в простых и сложных веществах; так как именно природой химической связи определяется реакционная способность каждого вещества. Под химической связью понимаются различные виды взаимодействий, обуславливающие устойчивое состояние двух и многоатомных соединений: молекул, ионов и других видов. При изучении строения молекул возникает два вопроса: почему и каким путем образуются химические связи в молекуле и как их количественно характеризовать. Первые достаточно реалистические гипотезы были выдвинуты после установления сложного строения атома. В 1907 году Дж. Томсон высказал предположение, что, по-видимому, химическая связь возникает за счет электронов атомов. В 1916 году немецкий ученый Коссель обратил внимание на устойчивость электронных оболочек инертных элементов (2 для He и 8 для других элементов), и высказал предположение о том, что при образовании молекулы из атомов, атомы одних элементов отдают, а атомы других элементов принимают такое количество электронов, чтобы около каждого из них образовалась устойчивая электронная оболочка инертного элемента. Если Na взаимодействует с хлором, то процесс можно представить следующим образом:
Теряя электроны, атомы превращаются в положительно заряженные ионы, а принимая – в отрицательные ионы. Связь между противоположно заряженными ионами осуществляется за счет сил электростатического взаимодействия. Но гипотеза не могла объяснить образование молекул простых веществ. В 1916 году американский ученый Льюис выдвигает гипотезу образования химической связи между атомами за счет создания общих электронных пар атомами взаимодействующих элементов. По схеме Льюиса электроны обозначались точками, причем учитывались электроны на внешнем слое:
Молекула образуется за счет создания общей электронной пары, которая в равной мере принадлежит двум взаимодействующим атомам. При этом обращалось внимание на устойчивость двух и восьми электронных оболочек, характерных для инертных газов.
23
Гипотеза Косселя легла в основу представлений о ионной связи, а гипотеза Льюиса легла в основу представлений о ковалентной связи. По современным представлениям химической связью называется взаимодействие атомов, обусловленное перекрыванием электронных облаков принадлежащих взаимодействующим атомам и, сопровождающееся выделением энергии. Любая химическая связь образуется с выделением энергии, то есть понижением запаса внутренней энергии системы: Н + Н = Н2 + 435 кДж/моль, эта величина получена экспериментально и теоретически при решении уравнения Шредингера.
Современные представления о механизме образования химической связи
В настоящее время признаны два квантово-механических подхода к описанию механизма образования химической связи:
1.Метод валентных связей (МВС).
2.Метод молекулярных орбиталей (ММО).
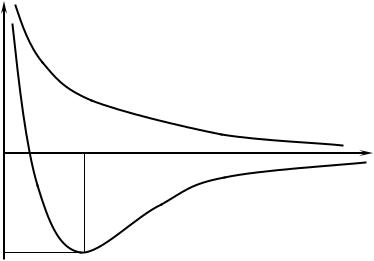
Оба метода основаны на достижениях квантовой химии, учитывающей корпускулярно – волновую природу электрона. Оба метода основаны на том, что условием образования химической связи является убыль энергии при образовании молекул из атомов и более сложных молекул из более простых молекул. Химическая связь всегда образуется с выделением энергии. В химии более широко используется МВС. МВС был разработан в 1927 году немецкими учеными Гейтлером и Лондоном. Они рассмотрели систему из двух атомов водорода и, решая уравнение Шредингера для этой системы, рассчитали потенциальную энергию двух атомов водорода при сближении их от расстояния 5А0 между ними минимально возможного. Результаты их расчетов могут быть представлены следующим графиком (рис. 2).
E |
Потенциальная энергия системы из |
|
|
|
двух атомов водорода. |
1– спины антипараллельны;
2– спины параллельны.
|
2 |
|
E0 |
r0 |
|
r– расстояние |
||
|
1
EСВ
Рис. 2
График зависимости потенциальной энергии системы из двух атомов водорода от расстояния между атомами атомами. В случае двух электронов с параллельными спинами (а) при их сближении потенциальная энергия возрастает. Следовательно, в этом случае химическая
24
связь не может образоваться. В случае с антипараллельными спинами (б) при сближении электронов энергия системы уменьшается, достигает минимального значения при расстоянии r0. Дальнейшее сближение приводит к резкому возрастанию энергии отталкивания.
Основные положения метода валентных связей (МВС)
1.Химическая связь образуется двумя валентными электронами различных атомов с антипараллельными спинами. При этом происходит перекрывание электронных облаков и между ними возникает зона повышенной электронной плотности, что приводит к уменьшению потенциальной энергии.
2.В пространстве химическая связь располагается в направлении максимального перекрывания электронных облаков.
3.Из нескольких связей прочнее та, у которой перекрывание атомных орбиталей наибольшее.
Метод ВС хорошо объясняет возникновение ковалентной связи.
Характеристики ковалентной связи
1. Энергия образования ковалентной связи – это та энергия, которая выделяется при образовании 1 моль вещества из атомов.
Н+Н=Н2+435 кДж/моль Чем больше энергии выделяется при образовании химической связи, тем
больше энергии надо затратить на её разрыв.
2.Энергия разрыва связи – это та энергия, которую необходимо затратить на разрыв числа Авогадро связей в молекулах простого или сложного вещества. Энергия разрыва связей равна по величине и противоположна по знаку энергии образования связей. Энергия разрыва связей характеризует прочность химической связи.
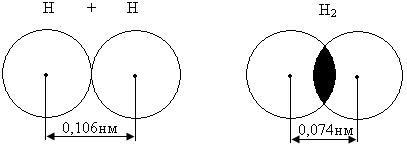
3.Под длиной связи понимаем расстояние между центрами ядер двух взаимодействующих атомов в молекуле (рис. 3).
Рис. 3
25

В однотипных молекулах длина связи увеличивается с увеличением атомного радиуса и в этой же последовательности уменьшается прочность связи.
4. Полярность ковалентной связи.
Если молекула образована атомами одного и того же элемента, то область повышенной электронной плотности располагается симметрично относительно ядер обоих атомов. Такая связь называется ковалентной неполярной или гомеополярной.
Если химическая связь возникает между двумя атомами, различающихся по своей электроотрицательности, то область перекрытия электронных облаков всегда будет смещена в сторону более электроотрицательного элемента. Вследствие этого над взаимодействующими атомами возникает дробные электрические заряды (рис. 4).
Рис. 4
Такая ковалентная химическая связь, при образовании которой область повышенной электронной плотности смещена в сторону более электроотрицательного элемента, называется ковалентной полярной или гетерополярной. Полярность связи увеличивается с увеличением различия в электроотрицательности взаимодействующих атомов (рис. 5).
Li – O; Be – O; B – O; C – O; N – O; O – O
увеличение полярности связи
H – F; H – Cl; H – Br; H – I
увеличение полярности связи.
Рис. 5
Количественной мерой полярности химической связи является дипольный момент μ=δl, где δ – заряд, возникающий над атомами, а l – расстояние между центрами возникающих зарядов.
5. Направленность химической связи.
Химическая связь всегда направлена в сторону наибольшего перекрывания электронных облаков взаимодействующих атомов. Направление перекры-
26
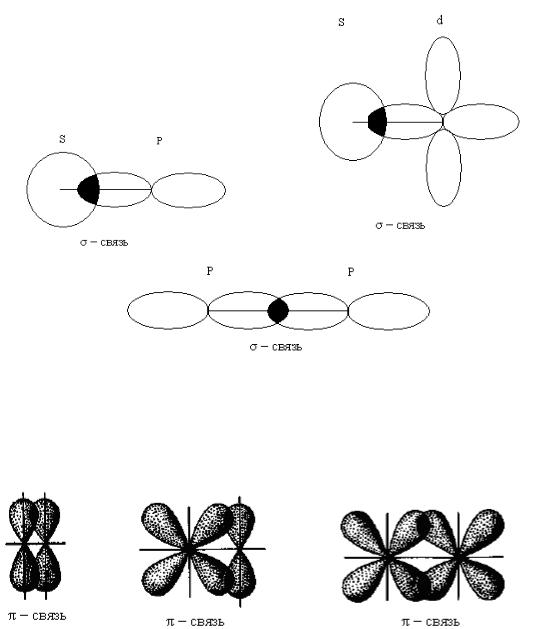
вания электронных облаков определяется формой электронных облаков взаимодействующих атомов.
Если область повышенной электронной плотности лежит на прямой (оси), соединяющей ядра атомов, то такая связь называется σ-связь (рис. 6).
Рис. 6
При взаимодействии p- и d-электронных облаков, ориентированных перпендикулярно оси связи образуются не одна, а две области перекрывания, расположенные по обе стороны от этой оси. Такая связь называется π- связью (рис. 7).
Рис. 7
При взаимодействии двух d-электронных облаков, расположенных в параллельных плоскостях образуется δ-связь (дельта-связь) перекрывание четырех лепестков d-электронов.
6. Кратность химической связи.
Если два атома связаны друг с другом только одной связью, то связь называется простой или одинарной. Простая связь – это всегда σ-связь. Если два
27
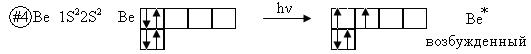
атома связаны между собой двумя парами электронов, то связь называется двойной. В двойной связи одна связь – σ-связь, другая – π-связь.
Если два атома связаны между собой тремя парами электронов, то связь называется тройной. В тройной связи одна σ-связь и две π-связи. Следует помнить, что прочность двойной связи всегда меньше, чем удвоенная прочность простой связи, так как σ-связь прочнее в большинстве случаев π-связи. Обычно при химических реакциях разрывается сначала π-связь, и только затем σ-связь.
7. Насыщенность ковалентной связи.
Так как каждый атом имеет определенное количество неспаренных электронов, он может образовать определенное количество связей химической связи. Свойство атомов образовывать определенное количество связей с другими атомами определяет свойство насыщенности ковалентной связи. Благодаря насыщенности ковалентной связи, каждое химическое вещество имеет стехиометрический состав. Благодаря направленности химической связи, каждая молекула имеет строго определенное расположение в пространстве атомов относительно друг друга, то есть каждая молекула имеет определенное строение.
Электронные структуры возбужденных атомов и гибридизация атомных орбиталей
Рис. 8
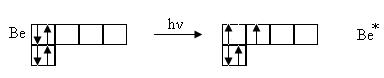
В нормальном состоянии бериллий не может образовывать химические связи, так как у него нет неспаренных электронов. Однако известно, что бериллий достаточно химически активный элемент с металлическими свойствами. Бериллий легко вступает в реакции, образуя соединение с валентностью, равной двум. Процесс перехода электрона на более высокий энергетический подуровень в пределах данного уровня называется возбуждением, или промотированием (один электрон с s- подуровня переходит на p-подуровень).
Если бы два атома хлора образовывали химическую связь с орбиталями разного типа Be, то молекула оказалась бы несимметричной и прочность обеих связей Be – Cl была бы разной. Однако всеми исследованиями установлено, что обе связи Be – Cl имеют одинаковую прочность, одинаковую длину, а молекула BeCl2 имеет линейное строение, то есть все атомы находятся на одной прямой. На основании строения молекулы BeCl2 и других подобных молекул было введено понятие гибридизации атомных орбиталей.
28
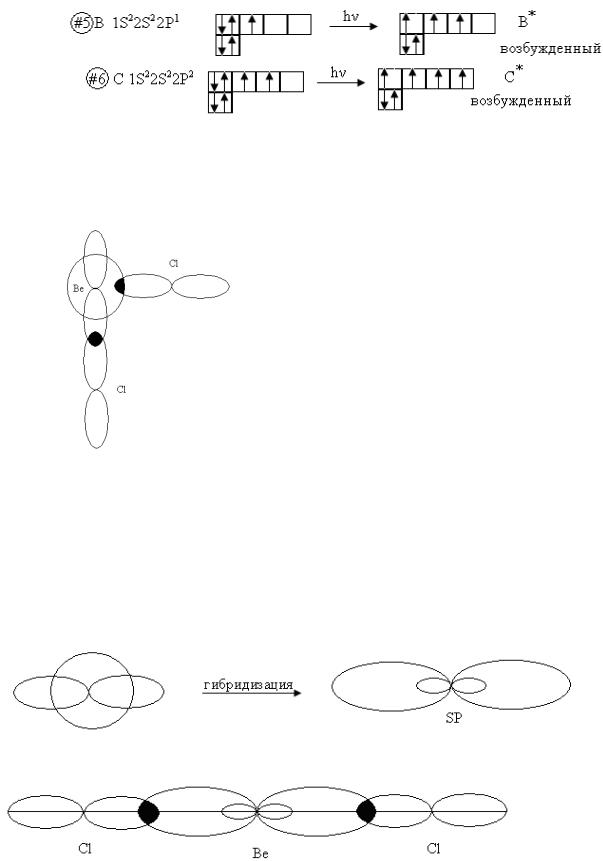
 Be +Cl2=BeCl2
Be +Cl2=BeCl2
Рис. 9. Гибридизация атомных орбиталей
Под гибридизацией следует понимать выравнивание орбиталей разного типа по форме и энергии. В атоме Be вместо одной s-орбитали и одной p- орбитали получаются две совершенно одинаковые гибридные орбитали.
spгибридизация:
Рис. 10
29
