
- •Основные положения теории химического строения а.М.Бутлерова.
- •Изомерия: структурная, пространственная.
- •А) Структурная изомерия алкенов Виды структурной изомерии: изомерия углеродного скелета, изомерия положения двойной связи и межклассовая изомерия.
- •Б) Пространственная изомерия алкенов
- •Строение электронных подуровней атома углерода. Гибридное состояние атомных орбиталей: sp3-; sp2-; sp-гибридизации. Понятие о σ и π- связях.
- •Классификация органических соединений. Понятие гомологический ряд. Функциональная группа.
- •1. Классификация органических соединений в зависимости от строения цепи (углеродного скелета)
- •2. Классы органических соединений в зависимости от природы функциональных групп
- •Механизмы химических реакций. Гомолитический и гетеролитический разрывы химической связи. Радикальный, электрофильный и нуклеофильный механизмы реакций (схемы).
- •1. Гомолитический (радикальный) разрыв связей.
- •1. Гомологический ряд алканов: общая формула, названия
- •2. Пространственное строение молекул
- •3. Номенклатура предельных углеводородов
- •4. Физические свойства
- •1. Реакции замещения
- •1.1. Галогенирование
- •1.2. Нитрование алканов
- •2. Реакции разложения
- •2.1. Дегидрирование и дегидроциклизация
- •2.2. Пиролиз (дегидрирование) метана
- •2.3. Крекинг
- •3. Реакции окисления алканов
- •3.1. Полное окисление – горение
- •3.2. Каталитическое окисление
- •4. Изомеризация алканов
- •Получение алканов
- •1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
- •2. Водный или кислотный гидролиз карбида алюминия
- •3. Электролиз солей карбоновых кислот (электролиз по Кольбе)
- •4. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
- •5. Гидрирование алкенов, алкинов, циклоалканов, алкадиенов
- •6. Синтез Фишера-Тропша
- •7. Получение алканов в промышленности
- •2. Изомерия алкенов
- •А) Структурная изомерия алкенов Виды структурной изомерии: изомерия углеродного скелета, изомерия положения двойной связи и межклассовая изомерия.
- •Б) Пространственная изомерия алкенов
- •4. Получение алкенов
- •5. Физические свойства алкенов
- •6. Химические свойства алкенов
- •Изомеризация алкенов
- •1. Химические свойства алкенов
- •11.2 Номенклатура алкинов (ацетилена)
- •11.3 Изомерия алкинов
- •2. Галогенирование.
- •11.5 Получение алкинов
- •11.6 Физические свойства алкинов
- •11.7 Реакции присоединения: реакция Кучерова (гидратация этина).
- •1. Строение спиртов
- •2. Номенклатура
- •3. Классификация
- •4. Изомерия спиртов
- •5. Физические свойства
- •6. Способы получения спиртов
- •7. Основно-кислотные свойства.
- •8. Химические свойства одноатомных спиртов
- •2. Окисление
- •3.Реакции отщепления
- •4. Реакции этерификации
- •Химические свойства альдегидов и кетонов. Реакции присоединения по двойной связи карбонильной группы (получение полуацеталей и ацеталей). Реакции конденсации.
- •Номенклатура
- •Классификация
- •В) Гетерофункциональные карбоновые кислоты
- •Лабораторный синтез Реакция Канниццаро:
- •Реакция Гриньяра:
- •Производные карбоновых кислот. Номенклатура. Способы получения солей, сложных эфиров, галогенангидридов, ангидридов, амидов, нитрилов. Понятия анион и ацил.
- •Осбенности строение ароматических аминов (на примере анилина)
- •1. Получение аминов при взаимодействии алкилгалогенидов с аммиаком (реакция Гофмана).
- •Ароматические углеводороды. Бензол: строение, изомерия, номенклатура
- •Структура бензола
6. Химические свойства алкенов
Алкены обладают большой реакционной способностью, чем алканы. Это обусловлено наличием в их молекулах двойной связи. π–Связь менее прочная, чем σ-связь. Она легко разрушается под воздействием различных реагентов с образованием валентных (неспаренных электронов).
По этой причине алкены легко вступают в реакции присоединения (в отличие от алканов) с образованием ковалентных связей.

Реакции присоединения (виды)
1. Гидрирование или гидрогенизация (присоединение водорода)
Эта реакция протекает в присутствии катализатора – мелко раздробленного никеля, платины или палладия при повышенном давлении. При гидрогенизации алкены превращаются в предельные углеводороды:
![]()
2. Галогенирование (присоединение галогенов) – см. схему Рис.1
Присоединение галогенов по двойной связи С=С происходит легко при обычных условиях (при комнатной температуре, без катализатора). Образуются дигалогеналканы (ди -2, галоген – один из галогенов, алкан –одинарные связи):
![]()
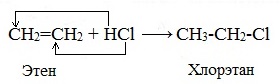
3. Гидрогалогенирование (присоединение галогеноводородов) – см. схему Рис.1
При взаимодействии алкенов с галогеноводородами (НCl, НBr) образуются галогеналканы.
4. Гидратация (присоединение воды)
При взаимодействии алкенов с водой в присутствии минеральных кислот (серной, фосфорной) образуются одноатомные спирты. Минеральные кислоты выполняют роль катализаторов и являются источниками протонов.
Протоны (Н+) за счет большой активности распаривает электроны π–связи. Затем процесс идет по схеме Рис.1.
![]()
5. Полимеризация — процесс образования высокомолекулярного вещества (полимера) путём многократного присоединения молекул низкомолекулярного вещества (мономера) к активным центрам в растущей молекуле полимера.
![]()
Число n называется степенью полимеризации. Реакции полимеризации алкенов идут в результате разрушения π–связей (под действием температуры, давления и катализаторов). У атомов углерода, образуются неспаренные (валентные) электроны, которые и обеспечивают ковалентные связи между молекулами.
Реакции окисления
Внимание! Газообразные гомологи алкенов образуют с воздухом взрывчатые смеси.
1. Горение
Как и все углеводороды, алкены горят в кислороде, и при этом образуют диоксид углерода и воду.
а) Полное (избыток О2).
Горение этена:
![]()
Общая формула горения алкенов при избытке кислорода:
б) Неполное (недостаток О2).
Горение этена:
![]()
Общая формула горения алкенов при недостатке кислорода:
![]()
2. Неполное каталитическое окисление
Если смешать алкен с кислородом и пропустить эту смесь над нагретым до 2000С серебряным катализатором, то образуется оксид алкена (эпоксид). Циклические оксиды широко используются в органическом синтезе.
![]()
Изомеризация алкенов
Алкены вступают в реакцию изомеризации при нагревании в присутствии катализаторов (Al2O3).
Изомеризация алкенов приводит к перемещению π–связи:
![]()
или к перестройке углеродного скелета:
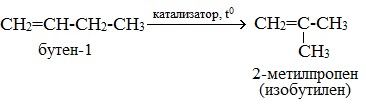
Химические свойства алкенов. Галогенирование. Индуктивный эффект и правило Марковникова; гидрогалогенирование. Гидратация, взаимодействие с серной кислотой. Реакции окисления в жестких условиях, реакция Вагнера.
