
4096
.pdfМинистерство образования и науки Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего образования
«Воронежский государственный лесотехнический университет имени Г.Ф.Морозова»
ЗАЩИТА ТРАНСПОРТНЫХ СРЕДСТВ ОТ КОРРОЗИИ
Методические указания к лабораторным работам для бакалавров по направлению подготовки
15.03.02 – «Технологические машины и оборудование»
Воронеж 2016
УДК 629.3.067 : [620.19 + 667.6 + 621.793]
Новикова, Л.А. Защита транспортных средств от коррозии [Текст]: методические указания к лабораторным работам для бакалавров направления 15.03.02 – «Технологические машины и оборудование» / Л. А. Новикова, Л. И. Бельчинская, А. И. Дмитренков, Н.А. Ходосова; Министерство образования и науки РФ, ФГБОУ ВО «ВГЛТУ». – Воронеж, 2016. – 48 с.
Печатается по решению учебно-методического совета |
|
ФГБОУ ВО «ВГЛТУ» (протокол № ... от .................... |
г.) |
Рецензент к.х.н., доцент кафедры неорганической |
|
химии и химической технологии |
|
ФГБОУ ВПО «ВГУИТ» |
Ю.С. Перегудов |
СОДЕРЖАНИЕ
стр.
Введение……….………..………..………..………..………..………………........
Лабораторная работа № 1. Химические свойства металлов, используемых в автомобилестроении ……………………………
Лабораторная работа № 2. Исследование коррозии цинка и защита от коррозии ингибированием ……………………………
Лабораторная работа № 3. Коррозия металлов в кислой среде. Оксидирование поверхностей для защиты от коррозии
……………………………
Лабораторная работа № 4. Химическая и электрохимическая коррозия внутренних узлов автомобиля
………………………………………………………………………
Лабораторная работа № 5. Получение и расчет толщины гальванического покрытия ………………………………………………………………………..
Лабораторная работа № 6 Определение степени смачивания защитных покрытий …………………………………………….
Библиографический список……………………………………………………..
4
5
12
18
25
31
38
46
ВВЕДЕНИЕ
Методические указания предназначены для бакалавров направления подготовки 15.03.02 – «Технологические машины и оборудование» при изучении дисциплины по выбору «Защита транспортных средств от коррозии» и содержат лабораторные работы по данному курсу. При освоении данной дисциплины студент приобретает знания в области обеспечения защиты транспортных средств от коррозии для создания условий надежности работы их агрегатов и узлов при эксплуатации. В курсе дисциплины обобщаются знания о причинах, видах и механизме коррозионных процессов, включая методы борьбы с коррозией с использованием неметаллических и металлических покрытий, в том числе, гальванических покрытий.
При самостоятельной подготовке к лабораторной работе студент должен составить конспект работы и изучить теоретический материал по соответствующему разделу дисциплины. Для получения допуска к лабораторной работе студент представляет конспект и отвечает на вопросы преподавателя по теории и порядку выполнения опытов. Студент, получивший допуск к работе, выполняет опыты по теме и оформляет работу в рабочей тетради по следующей форме: тема работы, цель, теоретическая часть (даются основные понятия и определения), экспериментальная часть – подробное описание выполнения опыта, полученные результаты и их анализ, вывод.
Лабораторная работа № 1
СВОЙСТВА МЕТАЛЛОВ, ИСПОЛЬЗУЕМЫХ В АВТОМОБИЛЕСТРОЕНИИ
Цель работы:
1.Определить стандартные потенциалы медного, цинкового и свинцового электродов.
2.Изучить взаимодействие металлов с кислородом воздуха, водой,
кислотами и щелочами.
Теоретическая часть
Металлы и металлические сплавы – основные конструкционные материалы для большинства отраслей промышленности. Характерные признаки металлов обусловлены электронным строением внешних оболочек. Для металлов характерна кристаллическая структура, высокая тепло- и электропроводность, металлический блеск, магнитные и механические свойства и др. Химические свойства металлов ярко выражены в их восстановительной способности. Атомы металлов отличаются склонностью образовывать положительно заряженные ионы: М − nē = Мn+ , где М − атом металла; ē − электрон; Мn+ − положительно заряженный ион металла с зарядом n+.
Для металлов характерна небольшая величина энергии (потенциала) ионизации. Это наименьшая энергия, необходимая для удаления одного электрона с внешней электронной оболочки атома или иона. Чем меньше энергия ионизации, тем активнее металлы участвуют в восстановительном процессе. Самыми энергичными восстановителями являются щелочные металлы (Li, Na, K, Rb, Cs), так как их атомы характеризуются самыми малыми значениями энергии ионизации.
По активности металлы расположены в определенной последовательности, названной рядом напряжений металлов, или рядом стандартных электродных потенциалов (табл.1).
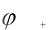
Таблица 1
Стандартные электродные потенциалы в водных растворах
|
Электрод |
|
Электродная реакция |
0 |
|
|||||||||||||||||||||||||||||||
|
|
|
Men / Me , В |
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
1 |
|
2 |
3 |
|
||||||||||||||||||||||||||||||||
Li+/Li |
|
Li+ + |
|
|
|
|
|
|
|
|
|
|
= Li |
-3,045 |
|
|||||||||||||||||||||
е |
|
|||||||||||||||||||||||||||||||||||
Rb+/Rb |
|
Rb+ + |
|
|
|
|
|
|
|
|
|
= Rb |
-2,925 |
|
||||||||||||||||||||||
е |
|
|||||||||||||||||||||||||||||||||||
K+/K |
|
K+ + |
|
|
|
|
|
|
|
= K |
-2,925 |
|
||||||||||||||||||||||||
е |
|
|||||||||||||||||||||||||||||||||||
Cs+/Cs |
|
Cs+ + |
|
|
|
|
|
|
|
|
|
= Cs |
-2,923 |
|
||||||||||||||||||||||
е |
|
|||||||||||||||||||||||||||||||||||
Ba+2/Ba |
|
Ba+2 + 2 |
|
|
|
|
|
|
|
|
= Ba |
-2,906 |
|
|||||||||||||||||||||||
е |
|
|||||||||||||||||||||||||||||||||||
Ca+2/Ca |
|
Ca+2 + |
|
|
|
|
|
|
|
|
= Ca |
-2,866 |
|
|||||||||||||||||||||||
е |
|
|||||||||||||||||||||||||||||||||||
Na+/Na |
|
Na+ + |
|
|
|
|
|
|
|
= Na |
-2,714 |
|
||||||||||||||||||||||||
е |
|
|||||||||||||||||||||||||||||||||||
Mg+2/Mg |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-2,363 |
|
|||
|
Mg+2 + 2 е = Mg |
|
||||||||||||||||||||||||||||||||||
Al+3/Al |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-1,662 |
|
|||
|
Al+3 + 3 е = Al |
|
||||||||||||||||||||||||||||||||||
Ti+2/Ti |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-1,628 |
|
|||
|
Ti+2 + 2 е = Ti |
|
||||||||||||||||||||||||||||||||||
Mn+2/Mn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-1,180 |
|
|||
|
Mn+2 + 2 е = Mn |
|
||||||||||||||||||||||||||||||||||
Cr+2/Cr |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-0,913 |
|
|||
|
Cr+2 + 2 е = Cr |
|
||||||||||||||||||||||||||||||||||
Zn+2/Zn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-0,763 |
|
|||
|
Zn+2 + 2 е = Zn |
|
||||||||||||||||||||||||||||||||||
Cr+3/Cr |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-0,744 |
|
|||
|
Cr+3 + 3 е = Cr |
|
||||||||||||||||||||||||||||||||||
Fe+2/Fe |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-0,440 |
|
|||
|
Fe+2 + 2 е = Fe |
|
||||||||||||||||||||||||||||||||||
Cd+2/Cd |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-0,403 |
|
|||
|
Cd+2 + 2 е = Cd |
|
||||||||||||||||||||||||||||||||||
Co+2/Co |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-0,277 |
|
|||
|
Co+2 + 2 е = Co |
|
||||||||||||||||||||||||||||||||||
Ni+2/Ni |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-0,250 |
|
|||
|
Ni+2 + 2 е = Ni |
|
||||||||||||||||||||||||||||||||||
Sn+2/Sn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-0,136 |
|
|||
|
Sn+2 + 2 е = Sn |
|
||||||||||||||||||||||||||||||||||
Pb+2/Pb |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-0,126 |
|
|||
|
Pb+2 + 2 е = Pb |
|
||||||||||||||||||||||||||||||||||
Fe+3/Fe |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-0,036 |
|
|||
|
Fe+3 + 3 е = Fe |
|
||||||||||||||||||||||||||||||||||
|
2H+ /H2 |
|
|
|
|
|
|
|
|
0 |
|
|||||||||||||||||||||||||
|
|
|
2H+ + 2 е = H2 |
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
Cu+2/Cu |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+0,337 |
|
|||
|
Cu+2 + 2 е = Cu |
|
||||||||||||||||||||||||||||||||||
Cu+/Cu |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+0,521 |
|
|||
|
Cu+ + е = Cu |
|
||||||||||||||||||||||||||||||||||
Ag+/Ag |
Ag+ + е = Ag |
+0,799 |
||||||||
Hg+2/Hg |
|
|
|
|
|
|
|
|
|
+0,854 |
Hg+2 + 2 е = Hg |
||||||||||
Pt+2/Pt |
|
|
|
|
|
|
|
|
|
+1,200 |
Pt+2 + 2 е = Pt |
||||||||||
Au+3/Au |
|
|
|
|
|
|
|
|
|
+1,498 |
Au+3 + 3 е = Au |
||||||||||
Au+/Au |
|
|
|
|
|
|
|
|
|
+1,691 |
Au+ + е = Au |
||||||||||
В этом ряду металлы расположены слева направо в порядке возрастания величин стандартных электродных потенциалов. Чем меньше потенциал, тем металл химически активнее, тем он легче окисляется и труднее восстанавливается из своих ионов. Каждый металл вытесняет все другие металлы, имеющие более положительные электродные потенциалы, из растворов их солей. Например, цинк будет вытеснять из растворов только ионы металлов, стоящих в ряду напряжений после него. Металлы, стоящие в ряду напряжений до водорода, способны вытеснять его из растворов, в которых окислителем является ион водорода Н+.
Металлы вступают в реакции с различными окислителями: неметаллами, солями, кислотами, оксидами, щелочами, водой. Окисляемость металлов кислородом воздуха в определенной степени связана с их положением в ряду напряжений. Металлы от Li до Na окисляются быстро, от Mg до Pb − медленнее, но ещѐ при обычных температурах; Cu,Hg − при нагревании; такие металлы, как, например, Pt и Au на воздухе не окисляются. Образующаяся оксидная пленка у одних металлов рыхлая (Fe), у других − весьма плотная и прочная (Al, Cr), способная защищать металл от коррозии.
Сводой взаимодействуют в основном щелочные и щелочноземельные металлы (элементы групп IА и IIА, начиная с магния), образуя растворимые или частично растворимые в воде гидроксиды металлов. При этом из воды восстанавливается водород, например, 2K + H2O = 2KOH + H2.
Скислотами, в которых окислителем является ион водорода Н+, точнее Н3О+, взаимодействуют все металлы, имеющие отрицательные значения стандартных электродных потенциалов, т. е. находящиеся в ряду напряжений до водорода. В результате реакции образуется соль соответствующей кислоты с выделением водорода: Fe + 2HCl = FeCl2 + H2
Fe − 2ē → Fe2+ – восстановитель, 2H+ + 2ē → H2 – окислитель. Исключение составляют металлы, стоящие в ряду напряжений непосредственно перед водородом, например свинец, которые пассивируются нерастворимыми или малорастворимыми осадками образующихся солей:
Pb + H2SO4 ≠ PbSO4↓ + H2
Металлы, занимающие в ряду напряжений места после водорода (исключение Au, Pt), взаимодействуют только с окисляющими азотной и концентрированной серной кислотами. В этих реакциях меняется степень окисления атома азота в HNO3 и атома серы в концентрированной H2SO4. Поэтому водород из них не вытесняется, а связывается кислородом в H2O. Продукты восстановления этих кислот в зависимости от их концентрации, активности металла и температуры различны.
Со щелочами взаимодействуют металлы, поверхностная пленка которых разрушаeтся щелочью (Be, Al, Zn, Sn, Pb и др.). Процесс растворения протекает в соответствии со со следующим уравнением химического процесса:
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2 Zn − 2ē → Zn+2
2H+ + 2ē → H2
Ионы металлов, находящихся в растворе, можно определить качественно и количественно. При качественном анализе используют обычно характерные реакции, сопровождающимися внешними эффектами. Например, образованием осадков, выделением газов, изменением окраски раствора или осадка и т. п.
Реактивы и оборудование
1.рН-метр
2.Хлорсеребряный электрод
3.Солевой мостик
4.Цинковая, медная и свинцовая пластины
5.1 М растворы солей ZnSO4, CuSO4, PbSO4
6.Провода, наждачная бумага.

Экспериментальная часть
Опыт 1. Определение потенциалов отдельных электродов
Собрать стандартный медный электрод: хорошо зачищенную медную пластину погрузить в 1 М раствор, соединить медный электрод с хлорсеребряным электродом при помощи солевого мостика, оба электрода подсоединить к рН-метру. Измерить разность потенциалов. Записать измеренную величину ЭДС. Аналогичные измерения провести с цинковым и свинцовым электродом.
Таблица 2
Стандартные и экспериментально определенные величины потенциалов металлов
Электрод |
Концентрация |
Стандартный |
Величина |
|
электролита, |
электродный |
электродного |
||
(полуэлемент) |
||||
моль/л |
потенциал, В |
потенциала, В |
||
|
||||
Zn | ZnSO4 |
0,1 |
|
|
|
Cu | CuSO4 |
0,1 |
|
|
|
Pb | PbSO4 |
0,1 |
|
|
В таблицу 2 внести значения стандартного электродного потенциала и величину потенциала, полученную экспериментально. Рассчитать абсолютную и относительную погрешность измерений.
|
|
Етеор |
Еэкс |
, |
|
(1) |
|
где ε – абсолютная погрешность измерения, Етеор - |
теоретическое значение |
||||||
потенциала, Еэкс – измеренное значение потенциала. |
|
||||||
|
Етеор |
Еэкс |
|
100% |
, |
(2) |
|
|
|
||||||
|
|
|
|
|
|||
|
|
Етеор |
|||||
|
|
|
|
|
|||
где δ – относительная погрешность измерения.
Опыт 2. Взаимодействие металлов с водой, кислотами и щелочами Реактивы и оборудование
1.Образцы металлов
2.Индикатор фенолфталеин
3.0,1 М соляная и азотная кислоты
4.Роданид железа KCNS, красная кровяная соль K3[Fe (CN)6]
5.1 М раствор NaOH, КОН.
Взаимодействие металлов с водой
Исследуйте взаимодействие магния, алюминия, цинка, железа, меди с водой. Для этого поместите металлы в пробирки и добавьте 5−10 капель воды.
Если реакция идет плохо, то пробирки нагрейте на водяной бане. Добавьте в пробирки 2-3 капли фенолфталеина. На присутствие каких ионов указывает окраска раствора? Напишите реакции, составив электронный баланс.
Взаимодействие металлов с кислотами
В две пробирки налейте по 1–2 мл разбавленной соляной, и в две – разбавленной азотной кислоты. В пробирки опустите по кусочку железа и меди.
Если реакции не идут, растворы осторожно подогрейте на спиртовке.
Чтобы определить степень окисления полученного в результате реакции железа, содержимое пробирок, в которые оно помещено, разделите на две части. К одной из них добавьте 1-2 капли роданида железа KCNS, который в присутствии Fe3+ окрашивает раствор в красный цвет:
Fe3+ + 3 KCNS = Fe (CNS)3 + 3 K+.
К другой части добавьте 1-2 капли красной кровяной соли K3[Fe (CN)6],
которая при наличии в растворе ионов Fe2+ образует осадок темно-синего цвета
– турнбулеву синь:
3 Fe2+ + 2 K3[Fe (CN)6] = Fe3[Fe (CN)6]2 + 6 K+.
Запишите схемы происходящих окислительно-восстановительных реакций и рассчитайте коэффициенты методом электронного баланса, укажите окислитель и восстановитель, процессы окисления и восстановления. Обратите
