
4096
.pdfвнимание на то, какой ион является окислителем в соляной кислоте, и какой – в
азотной.
Fe + HCl → FeCl2 + H2↑;
Fe + HNO3 → Fe (NO3)3 + NO↑ + H2O;
Cu + HNO3 → Cu (NO3)2 + NO↑ + H2O.
Ориентируясь на значения стандартных электродных потенциалов, объясните,
почему медь не растворяется в разбавленной соляной кислоте, а в азотной растворяется и почему железо растворяется в обеих кислотах.
Взаимодействие металлов с щелочами
В две пробирки налейте по 5–10 капель раствора NаOH или КОН и опустите кусочки алюминия и цинка. Обе пробирки слегка нагрейте на водяной бане. Наблюдайте выделение водорода. Составьте уравнения реакций,
учитывая, что получаются соответствующие гидроксокомплексы.
Вопросы для самоконтроля и повторения
1.Каковы особенности электронного строения атомов металлических элементов? Чем объясняется относительно слабая связь валентных электронов атомов металлов с ядром?
2.Какие металлы нельзя хранить на воздухе? Почему? Напишите уравнения реакций этих металлов с кислородом.
3.Какие оксиды образуют металлы? Приведите примеры.
4.Какие металлы и почему взаимодействуют со щелочами?
5.Чем обусловлена способность металлов взаимодействовать с кислотами?

Лабораторная работа № 2
ИССЛЕДОВАНИЕ КОРРОЗИИ ЦИНКА И ЗАЩИТА ОТ КОРРОЗИИ
ИНГИБИРОВАНИЕМ
Цель работы:
1Ознакомиться с явлениями коррозии металлов и их сплавов.
2Ознакомиться с методами защиты металлов и их сплавов от коррозии.
3Исследовать влияние ингибитора на скорость коррозии цинка в соляной кислоте.
4Рассчитать ингибиторный эффект и степень защиты от коррозии металлической поверхности.
Теоретическая часть
Для получения металлов из их природных соединений требуется большая затрата энергии (за исключением химически стойких металлов: золота, платины, серебра, ртути). Энергия, затраченная на получение металлов, накапливается в них как свободная энергия Гиббса и делает их химически активными веществами, переходящими в результате взаимодействия с окружающей средой в состояние положительно заряженных ионов.
Например, в металлургическом процессе происходит восстановление ионов до атомарного состояния
Me n ne Meo .
В процессе использования металлов, при котором необходимым условием является контакт металла с окружающей средой, происходит окисление металлов, т.е. происходят коррозионные процессы, связанные с разрушением
Meo |
ne |
Me n . |
Коррозионные процессы |
протекают необратимо, самопроизвольно |
|
( G<0), сопровождаются выделением |
энергии ( H<0), энтропия при этих |
|
процессах растет ( S>0).
Коррозия наносит большой ущерб всем отраслям промышленности, которые связаны с использованием металлов, сплавов или изделий из них. Наибольшие потери от коррозии металлических изделий имеет топливноэнергетический комплекс – 29 %, сельское и лесное хозяйство – 20 %, химическая и нефтехимическая промышленность – 15 %, металлообработка – 52 %, прочие отрасли – 30 %.
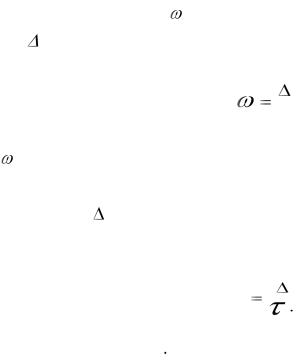
Имеются два механизма коррозии: химическая и электрохимическая. Химическая коррозия протекает в отсутствие электролитов при температурах, исключающих возможность образования насыщенного пара воды. К ней относятся высокотемпературная (или газовая) коррозия и коррозия в неэлектролитах. Примером газовой коррозии является окисление металлических поверхностей кислородом воздуха при высоких температурах. Например, химической коррозии подвержены детали и узлы машин, работающие при высоких температурах – двигатели поршневого и турбинного типов, ракетные двигатели. Коррозия в органических жидкостях также относится к химической коррозии. Химическая коррозия - это взаимодействие окислителя с металлической поверхностью, не приводящее к образованию гальванических пар, генерирующих электрический ток.
Электрохимическая коррозия протекает в электролите и характеризуется действием макро- и микрогальванических пар, в результате которого между анодными и катодными участками протекает электрический ток. Примером электрохимической коррозии является коррозия в растворах кислот, щелочей, солей, атмосферная коррозия, коррозия в речной и морской воде. Примером электрохимической коррозии также является разрушение кузова автомобиля, металлических поверхностей машин и механизмов, работающих в атмосферных условиях, а также коррозия внутренних поверхностей сушильных камер при сушке древесины.
Скорость коррозии ( ) может измеряться толщиной слоя растворенного металла ( h) за единицу времени (t) по формуле
h |
. |
(3) |
|
||
t |
|
|
выражают в мм/час, мм/год. Это глубинный показатель коррозии. Кроме этого, скорость коррозии (Vк) может быть выражена как изменение
массы металла m за определенное время ( ) на определенной площади поверхности (S) по формуле
) на определенной площади поверхности (S) по формуле
Vк |
m |
. |
(4) |
|
|||
S |
|
||
Vк выражают в г/м2 ч. Это весовой показатель коррозии.
Влажность атмосферы и рН имеют большое значение для коррозионных
процессов. Водородный показатель является одним из факторов, влияющих на
коррозию металлов. При понижении рН скорость |
соответственно |
увеличивается. Методы защиты металлических поверхностей от коррозии.
Коррозионная стойкость металлов определяется природой самого
металла и коррозионной среды. Следовательно, защита металла от коррозии
зависит, в первую очередь, от этих факторов.
Ингибирование
Сущность этого метода состоит в добавлении в коррозионную среду ингибиторов, то есть специальных веществ, замедляющих коррозию. При действии ингибиторов в процессе замедления коррозии участвуют электролит, ионы растворяющегося металла и продукты взаимодействия ингибитора со средой. Ингибиторами могут быть азотсодержащие органические соединения (амины, аминокислоты, амиды, алкалоиды, белки), серосодержащие (сульфокислоты), а также продукты конденсации альдегидов и аминов. Неподеленная пара электронов у азота или серы создает условия для адсорбции ингибиторов на активных участках металла, пассивируя их. Стойкие, длительно действующие ингибиторы должны иметь высокую температуру кипения и низкую упругость пара для того, чтобы десорбция их с металлической поверхностью происходила медленно.
Ингибиторами могут быть неорганические соединения: хроматы, бихроматы, нитраты. Они адсорбируются на поверхности металла, образуя оксидную пленку, предохраняющую металл от дальнейшего растворения. Некоторые ингибиторы взаимодействуют с ионами металлов, перешедшими в раствор, образуя на анодных участках трудно растворимые продукты коррозии - карбонаты, фосфаты, силикаты.
Неметаллические покрытия
Наиболее распространены масляные краски, лаки, эмали, полимерные пленки. Масляные краски могут просто механически защищать металлическую поверхность от коррозии. Кроме механической защиты многие краски содержат ингибиторы коррозии и тогда краски несут двойную нагрузку: защитную (механически) и ингибиторную (за счет имеющихся в краске компонентов, обладающих ингибиторным эффектом).
Промышленное значение имеют масляные, спиртовые, асфальтовые лаки и нитролаки. Лаки обладают высокими защитными свойствами в условиях атмосферной коррозии. Коррозионная стойкость спиртовых лаков мала. Нитролаки весьма стойки во влажной атмосфере, но токсичны, взрывоопасны и горючи. Эмалевые лаки эластичны, прочны, обладают хорошей стойкостью в холодной и горячей воде, в растворах солей. Из полимерных материалов имеют применение полихлорвиниловые и фенолоальдегидные пластмассы.
Реактивы и оборудование
1U-образная трубка.
2Набор электродов и пластин из различных видов стали.
3Вольтметр.
4Соединительные проводники.
5Набор растворов кислот и солей.
6Измерительная бюретка с резиновой трубкой и воронкой.
7Реакционная пробирка с пробкой и газоотводной трубкой.
8Наждачная и фильтровальная бумага.
Экспериментальная часть
Наблюдение за явлениями коррозии металлов и выяснение роли ингибитора в коррозии металлов проводится на установке, представленной на рис. 1. В реакционный сосуд поместить кусочек цинка. Туда же добавить 4…5 мл 2 н раствора соляной кислоты. После выдержки (2…3 минуты) цинк начинает реагировать с кислотой. Закрыть пробирку с кислотой и цинком пробкой, соединенной газоотводной трубкой с бюреткой. Проверить герметичность прибора. Для этого опускать или поднимать воронку вместе с кольцом на 10…15 см. Если уровень воды в бюретке не меняется, то прибор герметичен, и можно приступать к опыту. Если уровень воды в бюретке резко меняется, то необходимо уплотнить пробки в бюретке и реакционном сосуде до достижения герметичности установки.

Рис. 1. Установка для исследования влияния ингибитора на коррозию цинка:
1 – бюретка для измерения;
2 – воронка;
3 – резиновая трубка;
4 – газоотводная трубка;
5 – реакционный сосуд
Записать уровень воды в бюретке на время начала измерения с точностью до 0,1 мл.
Водород, выделяющийся в результате взаимодействия цинка с соляной кислотой, вытесняет из бюретки воду. Воронку при этом следует опускать и во время опыта стараться держать воду в воронке и бюретке на одном уровне, чтобы давление газа внутри прибора было все время близким к атмосферному.
Отсчет следует проводить 10 минут, фиксируя изменение положения столба воды в бюретке через каждые 2 минуты. Объем выделяющегося водорода занести в табл. 3.
Таблица 3
Экспериментальные данные определения скорости коррозии металла
Металлический |
Время протекания |
Объем |
Скорость |
|
выделившегося |
||||
материал |
реакции, , мин |
коррозии, К0, мл/мин |
||
водорода, V, мл |
||||
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Постройте график зависимости объема выделившегося водорода (V) от времени ( ) и по тангенсу угла наклона определите скорость коррозии металла. Среднюю скорость коррозии (Ко) можно рассчитать по формуле

Kо V , (5)
где Ко – скорость коррозии без ингибитора, мл/мин; V – объем выделившегося водорода, – время протекания реакции, мин.
Следующим этапом эксперимента является введение в электролит ингибитора. Каждой группе студентов преподаватель дает определенное количество ингибитора (от 1 до 5 мл). Студенты помещают ингибитор в рабочий электролит с условием, что суммарный объем должен быть равным объему электролита в предыдущем опыте. Время нахождения металла в электролите постоянно и равно 10 мин. По результатам опыта следует рассчитать величину ингибиторного эффекта и степень защиты от коррозии. Полученные данные занести в табл.4.
Ингибиторный эффект ( ) показывает, во сколько раз ингибитор уменьшает скорость коррозии и вычисляется по формуле
K |
100% . |
(6) |
|
||
Ko |
|
|
где К и Ко – скорость коррозии в присутствии ингибитора и без него. Степень защиты от коррозии (Z) вычисляется по формуле
|
|
Z |
Kо |
K |
100% . |
|
(7) |
|
|
|
Ko |
|
|||||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
Таблица 4 |
|
Показатели защиты металла от коррозии в присутствии ингибитора |
||||||||
|
|
|
|
|
|
|
|
|
Металлич |
Объем |
Время |
|
Объем |
Ингибиторн |
Степень защиты |
||
выделившегос |
||||||||
еский |
ингибитор |
эксперимен |
ый эффект, |
от коррозии, Z, |
||||
материал |
а, V, мл |
та, , мин |
я водорода, V, |
, % |
% |
|||
|
мл |
|||||||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Сделайте вывод о скорости коррозии и об эффективности действия ингибитора, основываясь на величинах Ко, и Z.
Вопросы для самоконтроля и повторения
1.Сформулируйте понятие коррозии. Химическая и электрохимическая коррозия.
2.Какие процессы происходят на электродах в гальваническом коррозионном элементе?
3.Математическое выражение для определения скорости коррозии.
4.Ингибирование коррозионных процессов. Какие ингибиторы вы знаете?
Лабораторная работа № 3
КОРРОЗИЯ МЕТАЛЛОВ В КИСЛОЙ СРЕДЕ. ОКСИДИРОВАНИЕ КАК МЕТОД ЗАЩИТЫ ОТ КОРРОЗИИ
Цель работы:
1.Изучить влияние кислой среды на процесс коррозии металлов.
2.Ознакомиться с процессом оксидирования стали как методом защиты от коррозии.
3.Составить схемы коррозионных элементов и определить их ЭДС.
Теоретическая часть
Основной целью имеющегося многообразия лакокрасочных и металлических покрытий направлено на защиту металлов от коррозии, т.е. разрушения под воздействием факторов окружающей среды.
Коррозионные процессы заключаются в окислении металлов,
Meo ne Me n ,
приводящему к их разрушению и большому ущербу для всех отраслей промышленности, использующих металлы, сплавы и изделия из них. Наибольшие потери от коррозии металлических изделий имеет топливноэнергетический комплекс – 29 %, сельское и лесное хозяйство – 20 %,
химическая и нефтехимическая промышленность |
– 15 %, металлообработка – |
52 %, прочие отрасли – 30 %. |
|
По механизму протекания различают химическую и электрохимическую |
|
коррозию металлов. Химическая коррозия |
протекает в отсутствие |

электролитов при температурах, исключающих возможность образования насыщенного пара воды, при этом взаимодействие окислителя с металлической поверхностью не приводит к образованию гальванических пар, генерирующих электрический ток. К химической относятся высокотемпературная (или газовая) коррозия и коррозия в неэлектролитах. Примером газовой коррозии является окисление металлических поверхностей кислородом воздуха при высоких температурах. Например, химической коррозии подвержены детали и узлы машин, работающие при высоких температурах – двигатели поршневого и турбинного типов, ракетные двигатели. Коррозия в органических жидкостях также относится к химической коррозии.
Электрохимическая коррозия протекает в электролите и характеризуется действием макро- и микрогальванических пар, в результате которого между анодными и катодными участками протекает электрический ток. Примером электрохимической коррозии является коррозия в растворах кислот, щелочей, солей, атмосферная коррозия, коррозия в речной и морской воде. Разрушению подвергаются кузова автомобилей, металлические поверхностей машин и механизмов, работающих в атмосферных условиях, а также коррозия внутренних поверхностей сушильных камер при сушке древесины.
Скорость коррозии ( ) измеряется либо толщиной слоя растворенного металла ( h) за единицу времени (t) и выражается в мм/час, мм/год (глубинный показатель коррозии)
h |
, |
(8) |
|
t |
|||
|
|
либо изменением массы металла m за определенное время ( ) на определенной площади поверхности (S) по формуле
Vк |
m |
. |
(9) |
|
|||
S |
|
||
При этом Vк выражают в г/м2 ч. Это весовой показатель коррозии.
Таблица 5 Величина pH в сушильных камерах в зависимости от породы деревьев,
начальной влажности древесины (Wнач,%) и режима сушки
|
Wнач., % |
|
|
Режим |
|
|
Порода |
|
|
||
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
Сосна, ель |
|
|
Береза |
|
||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Мягкий |
4,1 |
|
|
3,7 |
|
||
100 |
|
|
Нормальный |
3,9 |
|
|
3,3 |
|
|||
|
|
|
|
Высокотемпературный |
3,4 |
|
|
3,5 |
|
||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
Мягкий |
3,9 |
|
|
4,1 |
|
||
40 |
|
|
Нормальный |
4,2 |
|
|
3,8 |
|
|||
|
|
|
|
Высокотемпературный |
3,8 |
|
|
3,4 |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
Влажность атмосферы и рН среды, в которой происходит эксплуатация металлического оборудования, определяют тип и скорость коррозионных процессов. Например, при увеличении влажности в камерах для сушки древесины рН среды понижается, как показано в табл. 5. При понижении рН скорость коррозии металлов увеличивается.
В табл. 6 приведена десятибалльная шкала коррозионной стойкости по ГОСТ 5272-68.
|
|
|
|
|
|
|
Таблица 6 |
||
|
|
Коррозионная стойкость металлов |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
Группа стойкости |
|
|
Скорость коррозии, мм/год |
|
|
Балл |
|
|
|
|
|
|
|
|
|
|
|
|
|
Совершенно стойкие |
|
|
Менее 0,001 |
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Весьма стойкие |
|
|
Свыше 0,001 до 0,05 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Стойкие |
|
|
Свыше 0,001 до 0,05 |
|
3 |
|
|
|
|
|
|
|
Свыше 0,005 до 0,01 |
|
4 |
|
|
|
|
|
|
|
Свыше 0,01 до 0,1 |
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Пониженно-стойкие |
|
|
Свыше 0, 1 до 0,5 |
|
|
6 |
|
|
|
|
|
|
Свыше 0,51 до 1,0 |
|
|
7 |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
Малостойкие |
|
|
Свыше 1,0 до 5,0 |
|
8 |
|
|
|
|
|
|
|
Свыше 5,0 до 10,0 |
|
9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Нестойкие |
|
|
Свыше 10,0 |
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|
|
Устойчивость различных типов сталей и сплавов представлена в табл. 7.
