
4096
.pdfТаблица 7 Устойчивость сталей и сплавов по шкале коррозионной стойкости
|
Марки |
|
|
Группа стойкости |
|
|
|
|
|
||
|
|
|
|
|
|
|
Углеродистая сталь |
|
Пониженно-стойкая (6,7 баллов) |
||
|
|
|
|
||
|
Х13 |
|
Стойкая (2-5 баллов) |
||
|
|
|
|
||
|
Х18Н9 |
|
Весьма стойкая (2 балла) |
||
|
|
|
|
||
|
Х18Н9Т |
|
Совершенно стойкая (1 балл) |
||
|
|
|
|
|
|
Примечание. Х - содержание хрома, Н - содержание никеля, Т - содержание титана.
Две последние стали, приведенные в табл. 7, являются конструкционными, они наиболее часто используются для изготовления деревообрабатывающего оборудования, а также машин и механизмов лесопромышленного комплекса.
Методы защиты металлических поверхностей от коррозии
Защита металла сводится к повышению коррозионной стойкости металлов и снижению коррозионной активности окружающей среды.
Метод ингибирования основан на добавлении в коррозионную среду специальных веществ, замедляющих коррозию (ингибиторы). Ингибиторами могут быть органические (амины, аминокислоты, сульфокислоты) и неорганические соединения (хроматы, бихроматы, нитраты), которые адсорбируются на поверхности металла, образуя оксидную пленку, предохраняющую металл от дальнейшего растворения, либо взаимодействуют с ионами металлов и образуют трудно растворимые продукты коррозии - карбонаты, фосфаты, силикаты на анодных участках.
Неметаллические покрытия (краски, лаки, эмали, полимерные пленки) механически защищают металлическую поверхность от коррозии. Кроме этого, многие краски содержат ингибиторы коррозии и обладают большим защитным действием против разрушения.
Промышленное значение имеют масляные, спиртовые, асфальтовые лаки и нитролаки. Лаки обладают высокими защитными свойствами в условиях атмосферной коррозии. Коррозионная стойкость спиртовых лаков мала. Нитролаки весьма стойки во влажной атмосфере, но токсичны, взрывоопасны и горючи. Эмалевые лаки эластичны, прочны, обладают хорошей стойкостью в холодной и горячей воде, в растворах солей. Из полимерных материалов имеют применение полихлорвиниловые и фенолоальдегидные пластмассы.
Для сушильных камер имеется определенный набор лакокрасочных покрытий, устойчивых в атмосфере лесосушильных камер (табл. 8).
Таблица 8 Лакокрасочные покрытия, устойчивые в атмосфере лесосушильных камер
|
Покрытие |
|
Срок службы покрытия, год |
|
|
||
|
|
|
|
|
Эмаль ФЛ-777 |
5,0 |
|
|
|
|
|
|
Шпатлевка ЗП-00-10 |
5,0 |
|
|
|
|
|
|
Лак ГФ-95 с алюминиевой пудрой |
3,0 |
|
|
|
|
|
|
Краска АКС-3 |
2,5 |
|
|
|
|
|
|
Лак КФ-95 с алюминиевой пудрой |
1,5 |
|
|
|
|
|
|
Эмаль ПхВ-14 |
1,0 |
|
|
|
|
|
|
Краска БТ-177 |
1,0 |
|
|
|
|
|
Оксидирование применяется для создания на поверхности металлических изделий защитных оксидных пленок.
Термический способ оксидирования стали при температуре 623…723 К называется воронением. Фосфатирование - это химический процесс, при котором на поверхности стали образуется пленка нерастворимых в воде фосфатных соединений марганца и железа. Эта пленка выдерживает температуру до 873 К и обладает электроизоляционными свойствами.
Для защиты от химической коррозии используют покрытие защищаемого металла металлическими покрытиями: хромом (термохромирование), алюминием (термоалютирование), кремнием (термосилицирование).
Для защиты от электрохимической коррозии используют гальванические покрытия, получаемые в процессе электролиза. Защищаемая металлическая поверхность выполняет роль катода. Она может покрываться за счет процесса восстановления хромом (хромирование), никелем (никелирование), железом (железнение), серебром (серебрение) и так далее. Этот процесс называют гальваностегией.
Протекторная защита заключается в том, что создается гальванический элемент из защищаемого металла и другого металла, обладающего более электроотрицательным потенциалом. Последний служит анодом и называется протектором. Протекторы должны располагаться на участках, наиболее подверженных коррозии. Для железных конструкций в качестве протектора применяют цинк, магниевые сплавы. Радиус действия протектора тем выше, чем
больше электропроводимость агрессивной среды. Для морской воды он составляет 3-5 м.
Электрозащита или катодная защита обеспечивается подключением защищаемой металлической конструкции к катоду внешнего источника постоянного тока. В качестве анода используется любой металлический лом, который подключают к положительному полюсу источника тока.
Для повышения коррозионной стойкости металлов используют метод легирования, при котором в состав сплава вводят металлы (хром, никель, титан, молибден, вольфрам), вызывающие пассивацию защищаемого металла. При химической коррозии в качестве легирующих агентов используют хром, алюминий, кремний. При электрохимической коррозии легирующими металлами являются хром, вольфрам, никель титан, кобальт, молибден, ванадий и другие.
Реактивы и оборудование
1.U -образная трубка.
2.Набор электродов и пластин из различных видов стали.
3.Вольтметр.
4.Соединительные проводники.
5.Набор растворов кислот и солей.
6.Наждачная и фильтровальная бумага.
Экспериментальная часть Опыт 1. Защита стали и чугуна методом оксидирования
Для исследования коррозии стали и методов ее защиты от коррозии стальную пластину необходимо очистить наждачной бумагой и измерить электродный потенциал относительно электрода сравнения (каломельного электрода). Затем вытащить рабочий электрод из U-образной трубки, высушить фильтровальной бумагой и нагревать в пламени горелки до тех пор пока на ней не образуются тончайшие слои оксидов, о чем свидетельствуют цвета побежалости на поверхности пластин. Довести температуру рабочего электрода до комнатной и после этого измерить потенциал электрода, покрытого оксидными пленками. Замеры электродных потенциалов не оксидированной и оксидированной пластины производить через 5 минут после помещения электродов в раствор электролита, данные занести в табл. 9.

Таблица 9
Значения ЭДС коррозионного элемента
Коррозионный |
Не оксидированная |
Оксидированная |
электролит |
пластина |
пластина |
|
|
|
|
|
|
|
|
|
|
|
|
Сделайте вывод об изменении ЭДС коррозионного элемента и назовите причину этого изменения. Напишите схемы коррозионных гальванических элементов и объясните их работу.
Опыт 2 Коррозия металлических поверхностей в кислой среде Наиболее активно коррозия металлических поверхностей происходит в
кислой среде. Например, одним из окислительных агентов в лесосушильных камерах является уксусная кислота, которая реагирует с металлическим материалом камер.
Для проведения эксперимента поместить в U-образную трубку 10%-ный раствор уксусной кислоты в таком количестве, чтобы электроды были погружены в электролит на 2…3 см. Измерить электродный потенциал взятого металла через 1, 5, 10 и 20 минут. Полученные данные внести в табл. 10 и сделать вывод о том, что происходит с металлической поверхностью в результате работы микрогальванических пар.
Таблица 10 Электродный потенциал сталей, используемых в лесопромышленном
комплексе
|
Продолжительность коррозии сталей |
|||
Вид материала |
|
в уксусной кислоте |
|
|
|
1 |
5 |
10 |
20 |
Сталь Х3 |
|
|
|
|
Низколегированная сталь Х13 |
|
|
|
|
Нержавеющая сталь Х18Н9Т |
|
|
|
|
Напишите схему работы коррозионных гальванических элементов. В лабораторной работе вместо стали в схеме можно использовать железо, которое является основным компонентом стали.
Вопросы для самоконтроля:
1.Каковы виды и механизм коррозии металлов?
2.Каковы основные методы защиты от коррозии?
3.В чем измеряется скорость коррозии?
4.В чем заключается метод оксидирования?
Лабораторная работа № 4
ХИМИЧЕСКАЯ И ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ ВНУТРЕННИХ УЗЛОВ АВТОМОБИЛЯ
Цель работы:
1.Разобраться в сущности процессов коррозии металлов
2.Исследовать влияние природы металла и внешних условий на процесс коррозии
Теоретическая часть
Коррозией называется процесс самопроизвольного разрушения металлов под влиянием внешней среды. Вред, причиняемый коррозией, весьма велик. По имеющимся данным, примерно треть получаемого металла выбывает из технического употребления из-за коррозии.
Впроцессе коррозии происходит переход из металлического состояния в ионное. Коррозия – самопроизвольный процесс, сопровождается уменьшением свободной энергии (ΔG<0), увеличением энтропии системы и определенным энергетическим эффектом.
Внекоторых случаях коррозия поражает всю поверхность, в других –
часть ее. Характер разрушения зависит от свойств металла и условий протекания процесса. На рис. 2 представлены различные виды коррозийных разрушений: равномерное (а), пятнами (б), точечное (в), питтинг (г),
межкристаллитное (д), растрескивающее (Е), селективное (Ж). Наиболее опасными является питтинг и межкристаллитное разрушения.
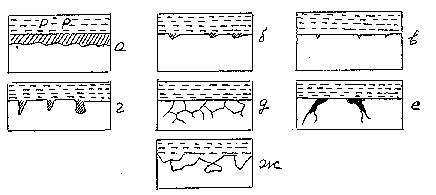
|
|
б |
|
в |
а |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
д |
|
е |
г |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ж |
|
|
|
|
|
|
|
Рис. 2. Виды коррозийный разрушений По принципу их протекания все коррозийные процессы принято
подразделять на химические и электрохимические.
Химическая коррозия
Химическая коррозия обусловлена взаимодействием металла с сухими газами или жидкостями, не проводящими электрического тока. Химической коррозии подвергаются детали и узлы машин, работающих в атмосфере кислорода, галогенов, при высоких температурах (турбинные, ракетные двигатели, оборудование химических производств).
Механизм реакции сравнительно прост. Продукты реакции образуются на тех участках металлической поверхности, которые вступили в реакцию. Так, на железе при 250-300оС появляется видимая пленка оксидов, при 600оС и выше поверхность металла покрывается слоем окалины, состоящей из оксидов железа различной степени окисления (FeO, Fe3O4, Fe2O3). Окалина не может защитить металл от дальнейшего окисления, так как содержит трещины и поры, которые позволяют проникать кислороду к металлу. При повышении температуры свыше 800оС скорость окисления железа резко увеличивается.
Образующиеся на металле оксидные пленки часто препятствуют дальнейшему окислению (образуется так называемая «защитная» пленка,
которая препятствует проникновению к металлу как газов, так и жидкостей).
Защитными свойствами обладает только та пленка, которая может покрывать сплошь весь металл. Расчеты показывают, что это возможно, если объем оксида

металла больше объема самого металла, пошедшего на образование этого оксида: Vокс/Vме > 1
Для щелочных и щелочно-земельных металлов это условие не соблюдается
(Vокс/Vме<1). Такие пленки защитными свойствами не обладают и эти металла ввиду своей химической активности принадлежат к числу коррозионно нестойких. На алюминии и хроме образуются хорошие защитные пленки,
благодаря чему металлы в атмосферных условиях коррозийно стойки (хотя химически активны). Толщина таких пленок крайне мала, например, на алюминии она достигает только 100 Å. Такие пленки состоят всего из нескольких слоев молекул и могут быть обнаружены только специальными оптическими методами.
Электрохимическая коррозия
Разрушение металла при соприкосновении с электролитом с возникновением в системе электрического тока называется электрохимической
коррозией.
В атмосферных условиях роль электролита играет водная пленка на металлической поверхности, в которых часто растворены электропроводящие примеси. Электродами обычно являются сам металл и примеси в нем содержащиеся. В качестве примера рассмотрим действие серной кислоты на железо, содержащего примесь меди. При таком контакте возникает множество
микроскопических гальванических элементов. |
|
|
||
(-) Fe ׀ H2SO4 ׀ Cu(+) |
0 |
2 = - 0,44 В |
0 |
2 = 0,34 В |
|
Fe |
Fe |
Cu |
Cu |
|
|
|
||
Более активный металл-железо – окисляется, посылая электроны атомам меди и переходит в раствор в виде ионов Fe2+, а ионы водорода разряжаются
(восстанавливаются) на меди.
Помимо этого железо может растворяться и при непосредственном взаимодействием с кислотой (Fe + 2Н+ = Fe2+ + Н2↑), но опыт показывает, что скорость этой реакции мала по сравнению со скоростью растворения железа

как анода гальванопары. Механизм коррозии в кислой и нетральной среде различен.
Рассмотрим коррозию технического железа на воздухе, когда оно покрыто влажной пленкой или находится в растворе электролитов с небольшой концентрацией гидроксид ионов. В качестве анода здесь служит основной металл – железо, катодом, являются примеси содержащиеся в металле,
например, зерна графита:
Анод: Fe – 2e- = Fe2+
Катод: 2H2O + O2 + 4e- = 4OH-
Ионы OH- соединяются с перешедшими в раствор ионами Fe2+
Fe2+ + 2OH- = Fe(ОН)2
4Fe(ОН)2 + O2 + 2H2O = 4Fe(ОН)3 Fe(ОН)3 = Fe О + H2O
О + H2O
 ОН
ОН
ржавчина
Согласно теории электрохимической коррозии при соприкосновении металла с электролитом на его поверхности возникает множество микрогальванических элементов. При этом анодами являются частицы металлов, катодами – загрязнения, примеси и участки металла, имеющие более положительный потенциал. Механическая обработка изменяет электродный потенциал, поэтому соприкосновение двух участков металла деформированного и недеформированного достаточно для появления разности потенциалов. Корродировать будет деформированный участок. Разность потенциалов возникает и там где соприкасаются обнаженный и покрытый пленкой участки.
Поскольку ионы и молекулы, связывающие электроны в катодном процессе, называют деполяризаторами, то часто говорят о водородной деполяризации в кислой и кислородной деполяризации в нейтральной и скабощелочной средах.
Поскольку электрохимическая коррозия обусловлена деятельностью гальванических элементов, можно сделать вывод, что факторы способствующие деятельности гальванических элементов усиливают коррозию.
Скорость коррозии тем больше, чем дальше отстоят в ряду напряжений металлы, из которых образовалась гальваническая пара. Скорость коррозии возрастает с ростом температуры и с увеличением концентрации окислителя в растворе.
Нередко продукты коррозии оказываются малорастворимыми в данной среде и своим присутствием защищают металл от дальнейшего разрушения.
Например, железо в щелочных растворах, свинец в разбавленной серной кислоте коррозионно стойки вследствие образования пленок Fe(OH)2, PbSO4.
Большое значение в процессах коррозии имеют поляризация электродов,
образование пленок на металлах, перенапряжение водорода. Если бы в коррозионных процессах не происходило поляризации электродов, то процессы коррозии протекали бы с такой скоростью, что железо и ряд других металлов потеряли бы свое значение в технике.
Реактивы и оборудование
1.Роданид железа KCNS, красная кровяная соль K3[Fe (CN)6]
2.Цинковая и медная пластинки
3.Пластинка оцинковонного и луженого железа
4.Раствор 1 М серной кислоты
Экспериментальная часть
Опыт 1. Коррозия в месте контактов металла
В две пробирки налейте примерно по 2 мл серной кислоты и добавьте несколько капель красной кровяной соли К3[Fe(CN)6], опустите в одну из них скрепку с медью, в другую – скрепку с цинком. Красная кровяная соль – реактив на ионы Fe+2. В присутствии этих ионов раствор окрашивается в синий цвет образующимся осадком темно-синего цвета «турнбулевой сини» :

3Fe+2 + 2 К3 Fe (СN)6
Fe (СN)6 = Fe3
= Fe3 Fe (СN)6 2 +6К+ .
Fe (СN)6 2 +6К+ .
Запишите наблюдения и составьте схемы коррозионных элементов.
Разберите работу каждого из них. Напишите уравнения электродных процессов
(табл. 11).
|
|
Таблица 11 |
|
|
|
|
|
Схема элемента |
Катодный процесс |
Анодный процесс |
|
|
|
|
|
По какому механизму протекает коррозионный процесс и в чем заключается его сущность?
Опыт № 2 . Химическая и электрохимическая коррозия цинка
В пробирку налейте 2 – 4 мл серной кислоты, поместите в нее гранулу цинка. Обратите внимание на скорость выделения водорода. Запишите уравнение проходящей реакции.
Опустите в кислоту медную проволоку, не доводя ее до соприкосновения с цинком. Выделяется ли водород на меди? Погрузите медную проволоку так,
чтобы она касалась гранулы цинка. Что происходит? Объясните, почему в данном случае на меди выделяется водород, составьте схему образовавшегося коррозионного элемента и запишите уравнения электродных процессов.
Сделайте вывод о скорости процесса в случае химической и электрохимической коррозии цинка?
Опыт № 3 Электрохимическая коррозия оцинкованного и луженого
железа
В две пробирки налейте по 2-3 мл соляной кислоты и добавьте по 2-3
капли реактива на ионы Fe2+ - K3[Fe(CN)6]. В одну пробирку поместите предварительно зачищенную пластину луженого (покрытого оловом) железа, в
другую – оцинкованного железа. На каком образце появилось синее
