
4047
.pdfсодержится в 10 л воздуха. Каждая микробная клетка дает начало одной колонии. Зная количество выросших колоний и время экспозиции, вычисляют количество микробов, содержащихся в 1 м3(1000 л) воздуха.
Для определения микробной загрязненности воздуха расплавляют на водяной бане стерильные среды МПА и СА и разливают каждую в 3 стерильные чашки Петри (всего 6 чашек). Чашки ставят в месте отбора проб и открывают на 5, 10 и 15 мин. Время выдержки отмечают на крышке чашки.
Затем чашки с МПА термостатируют при 37° С 48 ч, а с СА - при 24° С 6-7 суток, перевернув их вверх дном. Подсчет колоний ведут на следующем занятии.
Определение микробного числа воды
Микробное число воды - это общее количество микроорганизмов, содержащееся в 1 мл воды. Для санитарно-микробиологического исследования водопроводной воды пробы берут из уличных водоразборов и кранов внутренних водопроводов. Краны обжигают, затем полностью открывают и спускают воду 10 мин., а затем отбирают пробы воды с соблюдением требований асептики, не смачивая пробки, в количестве не менее 0,5 л. Если вода подвергалась хлорированию, то ее собирают в колбы, содержащие 2 мл 1,5%-ого стерильного раствора тиосульфата натрия. При посеве в агаризованную среду 1 мл воды вносят в пустую стерильную чашку Петри, куда затем наливают 10-12 мл расплавленного МПА (45° С) и тщательно перемешивают. После застывания агара посевы инкубируют при 37° С 24 ч. Из одной пробы воды засевают 3 параллельных чашки и не только на МПА, но и на сусло - агар для выявления роста дрожжей и грибов, в этом случае посевы инкубируют 2-З суток при температуре 24° С.
Определение микробной загрязненности предметов обихода и рук
Для анализа микробной загрязненности столов, оборудования, полотенец, халатов, рук персонала используют тампонный метод. Для этого готовят ватные тампоны, стерилизуют их, погружают в пробирки с 2 мл стерильной воды или изотонического раствора хлорида натрия, при этом тампон не должен касаться поверхности жидкости, смачивают тампон непосредственно перед взятием проб. Для отбора проб с плоских крупных поверхностей (столы) используют трафареты из проволоки или жести, которые предварительно стерилизуют фламбированием; затем накладывают их на поверхность стола, производят смыв влажным тампоном (салфеткой) с поверхности 100 см2, ограниченной трафаретом; тампон помещают в пробирку, добавляют еще 8 мл жидкости и тщательно прополаскивают тампон (салфетку) с последующим отжимом его.
Общую микробную загрязненность определяют, засевая 1 мл смыва, в глубину расплавленного МПА в чашке Петри, как это описано для определения микробного числа воды. Посевы выращивают сутки
при 37° С, подсчитывают количество выросших колоний и определяют общую микробную загрязненность данного объекта. Для выявления дрожжей и грибов делают посев на сусло-агар.
Смывы с рук получают, тщательно протирая ладони, межпальцевые и подногтевые пространства влажным стерильным тампоном на деревянной пилочке. Тампон погружают в ту же пробирку, в которой он смачивался, добавляют еще 8 мл стерильной воды. Смывы с поверхности предметов содержатся в 10 мл стерильной воды (2 мл для увлажнения салфетки, 8 мл доливают к смывам), поэтому исходный смыв уже разведен 1:10. Для приготовления разведения 1:100 1 мл исходного смыва (1:10) помещают в пробирку и доливают к нему 9 мл стерильной водопроводной воды. Берут две стерильные чашки Петри, нумеруют их со стороны дна (№ 1 и 2). В первую чашку вносят 1 мл исходного разведения смыва (1:10), во вторую - 1 мл разведения 1:100. Заливают в каждую чашку 15-30 мл расплавленного и охлажденного до 35° С МПА. После застывания агара посев термостатируют при 37° С сутки. Параллельно ведут посев на 2 чашки со стерильным СА. Этот посев выдерживают при 24° С 4- 5 суток.
В отчете по данной работе указать классификацию и способы стерилизации питательных сред, этапы подготовки микробиологических материалов для количественного учета чашечным методом, схему подготовки разведении и посева, описать конкретную задачу.
Подсчет клеток в счетных камерах
Метод прямого подсчета клеток микроорганизмов в счетных камерах успешно применяют для определения общего количества микроорганизмов, содержащихся во взвесях (суспензиях).
Известны счетные камеры разных конструкций (Горяева, Фукс - Розенталя, Петрова - Хауссера, Тома - Цейса и др.).
Метод количественного учета микроорганизмов с помощью счетных камер имеет ограничения применения, связанные с тем, что в счетных камерах проводится учет всех клеток микроорганизмов без их дифференциации на живые и мертвые клетки. Кроме того, счетные камеры могут быть использованы лишь для подсчета относительно крупных объектов – клеток водорослей, дрожжей, спор грибов, микроскопируемых при объективе от 8 до 40´.
В качестве примера можно привести камеру Горяева, которая внешне представляет собой толстое предметное стекло, разделенное поперечными бороздками, образующими три поперечно расположенные плоские площадки (рисунок 3а). Средняя площадка продольным прорезом разделена пополам, причем на каждой половине нанесена квадратная сетка. Две боковые площадки расположены на 0,1
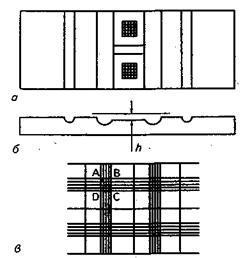
мм выше средней, они служат для притирания покровного стекла (рисунок 3 б).
Сетка разделена на определенное число больших и маленьких квадратов, по-разному сгруппированных. Постоянной величиной во всех сетках является маленький квадрат АВСD (рисунок 3 в), сторона которого равна 1/20 мм, площадь его – 1/400 мм², а объем при высоте камеры 1/10 мм – 1/4000 мм³ или 1/4000000 мл. Так называемый большой квадрат АВСD состоит из 16 малых квадратиков. Камера Горяева имеет площадь 9 мм², объем камеры 9 мм³ и разбита на 225 больших квадратов (15 рядов по 15 больших квадратов в каждом ряду).
а– вид сверху; б – вид сбоку;
в– вид при малом увеличении; h – высота камеры Рисунок 3 – Счетная камера Горяева
Заполнение камеры и подсчет клеток
Каплю взвеси наносят капилляром или пипеткой на сетку камеры и сверху накрывают чистым покровным стеклом. Жидкость под покровным стеклом должна равномерно без пузырьков распределиться по всей сетки, не выступая в желобок между стенками. Большими пальцами покровное стекло плотно притирают к боковым площадкам камеры до появления картины интерференции (колец Ньютона). Заполненную камеру помещают на предметный столик микроскопа и через 2 минуты микроскопируют с объективом от 8 до 40´ (в поле зрения должны быть отчетливо видны как квадратики, так и клетки микроорганизмов). Подвижные клетки перед заполнением камеры убивают нагреванием или 0,5%-ным раствором формалина.
Обычно просчитывают количество клеток в пяти больших квадратах (т. е. в 80 малых), расположенных по диагонали. Учитывают все клетки, размещенные внутри квадрата и на пограничных линиях, если они большей частью лежат внутри квадрата. Клетки, разделенные пограничной линией пополам, считают только на двух из четырех границ квадрата, а клетки, лежащие большей своей половиной вне

данного квадрата, совсем не учитывают. Количество клеток в 1 мл исследуемой суспензии вычисляют по формуле:
где М – количество клеток в 1 мл суспензии;
a – среднее количество клеток в квадрате сетки; h – высота камеры, мм;
S – площадь квадрата сетки, мм²;
10³ – коэффициент перевода [см³] в [мм³];
n – коэффициент разведения исследуемой суспензии.
1.4 Метод микрокультур
Метод позволяет получить быстрый ответ о биологическом состоянии объекта. Для получения микрокультур в центр стерильного предметного стекла с начерченной миллиметровой сеткой площадью 5 см² наносят определенный объем (0,05 мл) разведенной культуры.
Сюда же прибавляют две или три капли питательной среды, расплавленной и охлажденной до 45 ºС, перемешивают ее с посевным материалом и размазывают по всей поверхности сетки. Полученный препарат накрывают покровным стеклом, кладут в стерильную чашку и ставят в термостат при температуре от 30 ºС до 37 ºС на 8 ч. Затем его вынимают, подсушивают и микроскопируют. Колонии можно подкрасить метиленовым синим Леффлера, разбавленным в соотношении 1:4. Окрашенный препарат снизу протирают, мазок накрывают покровным стеклом и подсчитывают колонии под микроскопом.
Определение количества клеток высевом на плотные питательные среды (метод Коха)
Метод широко применяют для определения численности жизнеспособных клеток в различных естественных субстратах и в лабораторных культурах. В его основе лежит принцип Коха, согласно которому каждая колония является потомством одной клетки. Это позволяет на основании числа колоний, выросших после посева на плотную питательную среду определенного объема исследуемой суспензии, судить об исходном содержании в ней клеток микроорганизмов. Результаты количественного определения микроорганизмов, проведенного по методу Коха, часто выражают не в числе клеток, а в условных, так называемых колониеобразующих единицах (КОЕ). Каждая колония на чашке с питательной средой вырастает из одной колониеобразующей единицы, которая может представлять собой бактериальную, дрожжевую клетку, спору, кусочек мицелия актиномицета или гриба.
Определение числа микроорганизмов этим методом включает три этапа: приготовление разведений, посев на плотную среду в чашки Петри и подсчет выросших колоний.
Приготовление разведений
Численность популяции микроорганизмов обычно велика, поэтому для получения изолированных колоний необходимо приготовить ряд последовательных разведений. Разведения готовят в стерильной водопроводной воде или в 0,85%-ном растворе NaCL (физиологическом растворе). В ходе опыта целесообразно использовать один и тот же коэффициент разведения, например 10, что уменьшает вероятность ошибки.
Для приготовления разведений стерильную водопроводную воду разливают по 9 мл в стерильные сухие пробирки. Затем 1 мл исследуемой суспензии стерильной пипеткой переносят в пробирку с 9 мл стерильной воды – это первое разведение (10-1). Полученное разведение тщательно перемешивают новой стерильной пипеткой, несколько раз вбирая в пипетку и выпуская из нее полученную суспензию клеток. Затем той же пипеткой отбирают 1 мл суспензии и переносят во вторую пробирку, получая второе разведение (10-2). Таким же образом готовят последующие разведения. Степень разведения зависит от плотности исследуемой популяции микроорганизмов; соответственно она тем больше, чем больше плотность популяции.
Для приготовления каждого разведения следует обязательно использовать новую пипетку. Пренебрежение этим правилом приводит к получению ошибочного результата вследствие высокой способности клеток микроорганизмов к сорбции на поверхности стекла.
Посев
Высевать суспензию можно поверхностным или глубинным способом. Перед посевом поверхностным способом (рисунок 4) разливают расплавленную агаризованную питательную среду в ряд стерильных чашек Петри от 15 до 20 мл в каждую. Чашки оставляют на горизонтальной поверхности, пока среда не застынет. Поверхности агаризованных сред перед посевом рекомендуется подсушить для удаления конденсационной воды, например, поместив чашки в термостат на 2…3 суток крышками вниз.
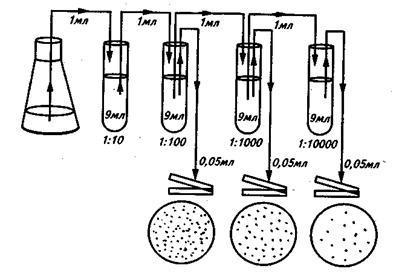
Рисунок 4 – Схема приготовления разведений и посева суспензии микроорганизмов
В чашку Петри с подсушенной средой вносят точно измеренный объем (0,05 или 0,1 мл) соответствующего разведения и распределяют его стеклянным шпателем по поверхности среды. Высевы на плотную среду проводят, как правило, из трех последних разведений, причем из каждого делают от двух до четырех параллельных высевов. Посевы можно делать одной пипеткой, но при этом начинать следует обязательно с большего разведения. Для каждого разведения используют новый стерильный шпатель.
После посева чашки Петри помещают в термостат крышками
вниз.
При глубинном посеве точно измеренный объем (как правило, 0,1; 0,5 или 1,0 мл) исходной суспензии или разведения вносят в расплавленную и остуженную до 45…50 ºС среду, тщательно перемешивают, затем немедленно выливают в чашку Петри и дают среде застыть. В случае глубинного посева пользуются средой, разлитой в пробирки. При больших масштабах работы среду по пробиркам не разливают, а поступают следующим образом. По 1 мл из соответствующего разведения переносят стерильной пипеткой в 2…4 стерильные чашки Петри. Затем заливают в чашки по 15…20 мл среды, расплавленной и остуженной до 45…50 ºС, и смешивают питательную среду с посевным материалом легким вращательным движением чашки по поверхности стола, после чего чашки оставляют на горизонтальной поверхности до застывания среды. Когда среда застынет, чашки Петри в перевернутом виде помещают в термостат.
Для определения количества клеток анаэробных микроорганизмов чашки Петри после посева помещают в анаэростат. Иногда для определения численности анаэробов плотную среду после засева оставляют в пробирках. Поверхность застывшей среды заливают
парафином. Для лучшего учета колоний микроорганизмов среды в этом случае рекомендуется осветлять.
Подсчет выросших колоний
Колонии микроорганизмов в зависимости от скорости роста подсчитывают через 1…15 суток инкубации. Подсчет, как правило, проводят, не открывая чашек Петри. Для удобства каждую просчитанную колонию отмечают точкой на наружной стороне дна чашки. При большом количестве колоний дно чашки Петри делят на секторы, просчитывают колонии в каждом секторе и суммируют результаты. Иногда для подсчета колоний используют специальные полуавтоматические счетчики.
Лучшим разведением следует считать то, из которого при высеве в чашке Петри вырастает от 30 до 150 колоний. Если число выросших колоний меньше 10, то эти результаты для расчета количества клеток в исходном материале не используют. Результаты параллельных высевов из одного и того же разведения суммируют и определяют среднее число колоний, выросших при высеве из разведения на одной чашке.
Количество клеток в 1 мл исследуемого субстрата вычисляют по формуле:
М |
a 10n |
, |
|
V |
|||
|
|
где М – количество клеток в 1 мл; а – среднее число колоний, выросших после посева из данного разведения;
V – объем суспензии, взятый для посева, мл; 10 – коэффициент разведения;
n – порядковый номер разведения, из которого сделан высев.
Определение количества клеток высевом в жидкие среды (метод предельных разведений)
Метод используют для подсчета микроорганизмов, которые плохо или совсем не растут на плотных питательных средах. В пробирки с жидкой средой вносят строго измеренный объем из различных разведений питательного субстрата. После инкубации, исходя из числа пробирок, в которых наблюдался или отсутствовал рост, рассчитывают наиболее вероятное число клеток, содержащихся в 1 мл исследуемого субстрата. Таким образом, определение количества микроорганизмов методом предельных разведений включает приготовление разведений, посев в жидкую среду, регистрацию наличия или отсутствия роста после инкубации и расчет наиболее вероятного числа клеток в единице объема исходного субстрата.
Вопросы для самоконтроля
1. Какие счетные камеры вам известны?
2.Что из себя представляет счетная камера Горяева?
3.Из каких этапов складывается процесс изготовления исследуемого препарата для проведения количественного учета с помощью счетных камер?
4.Каковы размеры бактериальных клеток?
5.Способы измерения микроорганизмов.
6.Как определить цену окуляр-микрометра?
Литература
1.Белясова, Н.А. Микробиология [Электронный ресурс]: утв. Министерством образования республики Беларусь в качестве учебника
/Н.А. Белясова. – Минск: Выш. шк., 2012. – 443 с. - ЭБС "Знаниум".
2.Мамонтов С. Г. Биология [Текст] : доп. М-вом образования и науки Рос. Федерации в качестве учеб. для студентов высш. учеб. заведений / С. Г. Мамонтов, В. Б. Захаров, Т. А. Козлова; под ред. С. Г. Мамонтова. - 3-е изд., стер. - М.: Академия, 2008. - 576 с.
3.Сидоренко О. Д. Микробиология [Электронная версия]: доп. Министерством сельского хозяйства РФ в качестве учебника / О.Д. Сидоренко, Е.Г. Борисенко, А.А. Ванькова, Л.И. Войно. — М. : ИНФРА-М, 2017. — 286 с. - ЭБС "Знаниум".
