
4047
.pdfЦель работы: доказать каталитическое действие белков-ферментов, показать их высокую специфичность, а также наивысшую активность в физиологической среде.
Задание
Определить специфичность действия фермента амилазы.
Материальную основу всех процессов жизнедеятельности составляют тысячи химических реакций, скорость протекания которых зависит oт ряда факторов: природы реагирующих веществ, их концентрации, температуры, давления и т.д. Для организма человека вышеназванные факторы имеют небольшое значение, однако скорость протекания биохимических реакций чрезвычайно высока. Например, в лабораторных условиях гидролиз 1 г белка до составляющих его аминокислот протекает в течение 24 часов при температуре 100оС в присутствии соляной кислоты высокой концентрации. В пищеварительном тракте этот же процесс заканчивается через 2 часа при температуре 37оС и концентрации соляной кислоты в три раза ниже, чем вне организма. Объяснение этому – присутствие в клетке специфических катализаторов – ферментов.
Ферменты или энзимы - вещества белковой природы, образующиеся непосредственно в клетках и ускоряющие течение всех типов химических реакций живого организма.
Как и все белки, они имеют высокую молекулярную массу от 12 000 до 500 000 у.е., определенный уровень организации (чаще третичную структуру), подвергаются гидролизу и денатурации.
Синтезируются ферменты только в клетках различных тканей и работать могут как внутри, так и вне создавшей их клетки. Поэтому различают ферменты внутри- и внеклеточные.
Внутриклеточные ферменты содержатся и действуют в определенных органоидах. В настоящее время установлено, что ферменты гликолиза находятся в цитоплазме, ферменты цикла трикарбоновых кислот и -окисления жирных карбоновых кислот – в матриксе митохондрий, ферменты окислительного фосфорилирования
–на внутренней мембране митохондрий, ДHK – полимеразы – ядрах, гидролитические ферменты – в лизосомах и т.д. Клетки различных тканей и органов различаются не только по набору ферментов, но и по их активности. Например, ферменты гликолиза и креатинкиназа наиболее активны в скелетных мышцах, ферменты орнитинового цикла
–в клетках печени, глутаминаза – в клетках мозга.
Внеклеточные ферменты образуются в клетках, но действуют, как правило, внутри полых органов. Например, пищеварительные ферменты вырабатываются клетками стенок пищеварительного тракта, а работают в различных отделах пищеварительной системы. По строению ферменты делят на простые (протеины) и сложные
(протеиды). Молекулы простых ферментов построены только из аминокислот. К ним относятся все гидролитические ферменты (пепсин, трипсин, липаза, амилаза, мальтаза, сахараза и т.д.), уреаза. Молекулы сложных ферментов в своем составе имеют белковую часть, состоящую из аминокислот (апофермент), и небелковую часть
(кофермент). В составе последнего встречаются ионы металлов (Zn2+, Cu2+, Fe2+, Mo2+), витамины (РР, В1, В2, В3, В6, B12, Вс), ацетил-КоА и другие вещества (табл. 1). Апофермент и кофермент по отдельности
малоактивны, но при их соединении активность резко возрастает. Таблица 1.Важнейшие коферменты, в состав которых входят витамины
Специфичность ферментов подразделяют:
-на абсолютную, то есть способность катализировать одну единственную реакцию (например, уреаза ускоряет расщепление мочевины на аммиак и углекислый газ);
-относительную, позволяющую воздействовать на определенный тип химической связи (например, пепсин расщепляет амидные связи, липаза сложноэфирные связи).
Их высокая специфичность заключается в том, что каждый фермент может катализировать только одну или группу сходных реакций, действуя на одно вещество или на ряд близкородственных веществ. Так, амилаза слюны ускоряет гидролиз только полисахаридов и не оказывает действие на дисахариды.
Практическая часть
Ферментативный гидролиз крахмала. В качестве фермента, гидролизующего крахмал на его составные части (мальтозу, глюкозу), выступает амилаза слюны. Оценка результатов опытов проводится с помощью цветных реакций с иодом и реакции Троммера. Соответственно продукты гидролиза крахмала не дают реакции с иодом, но положительно реагируют на реактив Троммера.
В 2 пробирки налейте по 10 капель 1%-ного раствора крахмала. В пробирку №1 (контроль) внесите 4 капли воды, а в пробирку №2 – 4 капли раствора слюны, разведенной в 5 раз. Перемешайте и поставьте в термостат или водяную баню на 15 мин при 370С. Затем из пробирки возьмите 4 капли исследуемого вещества, которые внесите в 2 разные пробирки. В одну из них добавьте одну каплю 1%-ного раствора иода, а в другую – одну каплю 5%-ного раствора сульфата меди и 4 капли 10%-ного раствора гидроксида натрия, осторожно нагрейте до кипения (реакция Троммера). Аналогичную процедуру выполните с содержимым пробирки №2. Результат должен показать, что в присутствии воды гидролиза крахмала не происходит и реакция с иодом должна быть положительной, а реакция Троммера – отрицательной (гидрат окиси меди – голубой цвет), тогда как в присутствии амилазы слюны результаты должны быть противоположными, поскольку произошел гидролиз крахмала.

Нет реакции с иодом и произошло окрашивание в кирпичнокрасный цвет (закись меди) в реакции Троммера.
Специфичность действия ферментов.
Каждый фермент действует только на одно вещество или группу сходных субстратов, что обусловлено соответствием структуры фермента, точнее его активного центра и структуры субстрата. Например, амилаза действует только на крахмал, сахараза – только на сахарозу.
Приготовление сахарозы: палочку дрожжей (100г) разотрите и залейте водой (400мл). через 2час отфильтруйте и храните в холодильнике. В две пробирки (№1 и №2) внесите по 10 капель 1%- ного раствора крахмала, в две другие (№3 и №4) – по 10 капель 2%- ного раствора сахарозы. Затем в пробирки №1 и №3 добавьте по 4 капли раствора слюны, разведенного в 5 раз, а в пробирки №2 и №4 – такое же количество раствора сахарозы. Перемешайте и оставьте в термостате на 15 мин при 370с. После этого с содержимым всех четырех пробирок осуществите реакции с иодом и Троммера. Результаты занесите в таблицу.
№ |
Субстрат |
Фермент |
Реакция |
с |
Реакция |
пробирки |
|
|
иодом |
|
Троммера |
|
|
|
|
|
|
1 |
Крахмал |
Амилаза |
|
|
|
|
|
|
|
|
|
2 |
Крахмал |
Сахараза |
|
|
|
|
|
|
|
|
|
3 |
Сахароза |
Амилаза |
|
|
|
|
|
|
|
|
|
4 |
Сахароза |
Сахараза |
|
|
|
|
|
|
|
|
|
В выводах следует отметить, в какой пробирке и при каких условиях обнаружено действие фермента и почему.
Влияние рН среды на активность фермента.
Для каждого фермента существует определенное значение реакции среды, при котором он проявляет наивысшую активность. Изменение рН вызывает снижение или полное торможение деятельности фермента.
В 8 пробирок прилейте по 1 мл дистиллированной воды, а затем в пробирку №1 внесите 1 мл 0,2%-ного раствора соляной кислоты, перемешайте, отберите из нее 1 мл смеси и перенесите в пробирку №2. Перемешайте, отлейте 1 мл и перенесите в пробирку №3 и т.д. из пробирки №8 отберите 1 мл и вылейте, таким образом получите различные рН среды. После этого в каждую пробирку добавьте по 2 мл 1%-ного раствора крахмала и по 1 мл раствора слюны, разведенного
1:10. Пробирки встряхните и поставьте в термостат на 15 мин при 370С. Затем охладите и добавьте во все пробирки по 1 капле 1%-ного раствора иода.
Полный гидролиз крахмала произойдет в пробирках №5 и №6, где рН среды раствора находится в пределах 6,8-7,2, т.е. оптимальных для действия амилазы.
Вопросы для самопроверки
1.Что такое ферменты, их химическая природа?
2.Какие отличия есть в составе молекулы простых и сложных ферментов?
3.Что такое активный центр фермента?
4.Механизм действия ферментов.
5.Дайте определение понятий: энергетический барьер реакции, энергия активации.
6. Свойства ферментов как биологических катализаторов.
В чем состоит специфичность действия ферментов? Приведите примеры.
7. Какие процессы в организме катализируют ферменты гидролазы? Приведите примеры.
Лабораторная работа №6
Приготовление питательных сред для микроорганизмов, способы их стерилизации. Автоклавирование
Цель работы: ознакомиться с методами дезинфекции и стерилизации.
Задание
1.Ознакомиться с основными методами дезинфекции и дезинфицирующими веществами.
2.Ознакомиться с основными методами стерилизации.
3.Подготовить к стерилизации лабораторную посуду: чашки Петри, пробирки и пипетки.
4.Провести стерилизацию лабораторной посуды.
Питательные среды (ПС) должны отвечать следующим минимальным требованиям: в них должны присутствовать все элементы, из которых строится клетка в такой форме, в которой микроорганизмы способны их усваивать. По количественному вкладу в построении клетки различают микро- и макроэлементы. К
макроэлементам относят: C, N, H, O, S, Ca, K, Fe, P, Mg. К
микроэлементам относят: Mn, Zn, Mo, Cu, Co и др. Они содержатся в основном в качестве примесей в солях микроэлементов, а также попадают в ПС из стекла лабораторной посуды, с пылью и водопроводной водой. Также многие микроорганизмы нуждаются в факторах роста. Эти вещества входят в основной состав клетки, но некоторые организмы не способны их синтезировать сами.
В микробиологической практике для выращивания микроорганизмов используют разнообразные питательные среды, которые по составу подразделяют на естественные или натуральные, полусинтетические и синтетические среды.
Натуральные среды состоят из продуктов животного и растительного происхождения. К таким средам относятся овощные или фруктовые соки, кровь, молоко, вода, отвары, полученные из природных субстратов, как, например, мясо, навоз, почва и др. На таких средах хорошо развиваются многие микроорганизмы, так как они содержат все компоненты, необходимые для их роста и развития. Однако эти среды имеют сложный, непостоянный состав и малопригодны для изучения физиологии обмена веществ микроорганизмов, так как не позволяют учесть потребление ряда компонентов среды и образования продуктов обмена по ходу развития. Натуральные среды используют для поддержания культур микроорганизмов и накопления их биомассы. Примерами натуральных сред являются: мясо-пептонный бульон (МПБ), гидролизат рыбной муки (ГРМ), бульон Хоттингера, пивное, солодовое, виноградное, яблочное, мелассное сусло, дрожжевая, картофельная, капустная среды, почва и др. При добавлении агара в ГРМ получают ГРМ-агар, в МПБ - МПА.
Полусинтетические среды в своѐм составе наряду с соединениями известной химической природы содержат вещества неопределенного состава. К полусинтетическим средам относят МПБ с
глюкозой и фосфорнокислым калием, картофельную среду с глюкозой и пептоном, а также среды известного состава с добавкой различных факторов роста (гидролизата казеина, дрожжевого автолизата, кукурузного экстракта и т. д.).
Синтетические среды – это среды, в состав которых входят известные химические соединения, взятые в точно указанных концентрациях. Такие среды наиболее удобны для исследования обмена веществ микроорганизмов. Зная точный состав и количество входящих в среду компонентов, можно изучить их потребление и превращение в соответствующие продукты обмена.
По назначению различают элективные и дифференциальнодиагностические (индикаторные) среды. Элективные среды обеспечивают преимущественное развитие одного вида или группы микроорганизмов и менее пригодны (или совсем непригодны) для развития других. Для выделения молочнокислых бактерий используют молочную среду или гидролизат молока. Дифференциальнодиагностические (индикаторные) среды позволяют быстро отличить одни виды микроорганизмов от других. Состав этих сред подбирают с таким расчетом, чтобы он позволил чѐтко выявить наиболее характерные свойства определѐнного вида. В состав таких сред часто входят красители. Например, среда Эндо используется для выделения бактерий группы кишечной палочки.
По физическому состоянию различают жидкие, плотные и сыпучие среды.
Жидкие среды применяют для выяснения физиолого-биохимических особенностей микроорганизмов, для накопления биомассы, а также для поддержания и хранения микроорганизмов, плохо развивающихся на плотных средах.
Сыпучие среды (отруби, разваренное пшено, свекловичный жом, почва) предназначены для хранения некоторых видов микроорганизмов, и их спор, приготовления маточного, посевного материала и поверхностного культивирования микроорганизмов.
Плотные среды используют для выделения чистых культур, для хранения культур, для диагностических целей и др. Такие среды получают путем добавления в жидкие среды уплотнителей.
Уплотнители питательных сред. Для уплотнения сред применяют агарагар, желатин и кремнекислый гель (селикагель).
Агар-агар – это сложный полисахарид, получаемый из морских водорослей. Большинство микроорганизмов не использует его в качестве питательного субстрата. В воде агар-агар образует гели, плавящиеся при 100° С, затвердевающие при температуре около 40° С. Поэтому на агаризованных средах можно культивировать микроорганизмы практически при любой подходящей для их роста температуре. Чаще всего агар-агар добавляют в жидкие среды в количестве 1,5-2 %.
Желатин – это белок, получаемый путѐм вываривания костей и хрящей животных. Его используют, главным образом, для выявления протеолитической активности микроорганизмов, а также получения глубинных колоний дрожжей с целью их идентификации. Желатин добавляют к жидким средам в количестве 10-15 %.
Кремнекислый гель применяют как твѐрдую основу для синтетических сред. Готовят его путѐм смешения равных объѐмов соляной кислоты и жидкого стекла (Na2SiO3). Добавляют к средам в количестве 1-1,5 %.
Стерилизацией (sterilis – бесплодный) называют полное освобождение какого-либо объекта (питательная среда, посуда и др.) от всего живого, в том числе, от спор. Существуют физические, механические и химические методы стерилизации.
Физические методы стерилизации основаны на применении высоких температур, ультрафиолетового облучения.
Прокаливание в пламени горелки применяется для поверхностной стерилизации негорючих и теплоустойчивых предметов непосредственно перед их использованием (препаровальные иглы, бактериологические петли, стеклянные палочки, пинцеты, предметные и покровные стѐкла). После прокаливания охлажденные предметы сразу используются, их нельзя класть на стол и следует держать так, чтобы они не касались других предметов.
Кипячение используют для обработки инвентаря и посуды. Добавление 1-2 % соды значительно повышает стерилизующее действие кипящей воды.
Фламбирование используют для обработки поверхностей посуды, столов и инструментов непосредственно перед использованием.
Суховоздушная стерилизация производится в электросушильном шкафу. Сухим жаром стерилизуют пипетки, чашки Петри, пробирки, шпатели и т. д., завернутые в бумажные салфетки.
Стерилизацию ультрафиолетовым облучением проводят с помощью бактерицидных ламп для обеззараживания воздуха и поверхностей различных помещений (боксов, микробиологических лабораторий и др.). Ввиду неблагоприятного действия УФ-лучей на организм человека бактерицидные лампы включают только при отсутствии людей в помещении.
Пастеризация – неполная стерилизация производится нагреванием до 50-60° С в течение 15-30 мин или до 70-80° С в течение 5-10 мин с последующим охлаждением до 10-11° С. Применяется для инактивации вегетативных клеток микроорганизмов в продуктах, которые при воздействии более высоких температур теряют качество и питательную ценность: (молоко, пиво, соки и т. п.).
Автоклавирование – наиболее надѐжный и широко используемый способ стерилизации, осуществляемый в автоклаве. Автоклав представляет собой металлический двустенный сосуд, способный выдерживать высокое давление. Внутренняя часть – стерилизационная
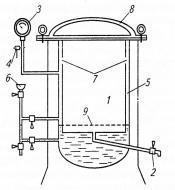
камера, которая окружена водопаровой камерой, имеющей кран для выхода воздуха и пара. При стерилизации в водопаровую камеру наливают дистиллированную воду до необходимого уровня. Внутрь стерилизационной камеры на специальную подставку помещают стерилизуемый материал. Предметы следует размещать не слишком плотно, так как пар должен свободно проходить между ними. Крышка автоклава герметично закрывается (рис. 2).
Рисунок 2. Схема автоклава: 1 - стерилизационная камера; 2 - кран для выхода воздуха и конденсата; 3 - манометр; 4 - предохранительный клапан; 5 - водопаровая камера; 6 - воронка для заполнения автоклава водой; 7 - отверстия для поступления пара в стерилизационную камеру; 8 - крышка автоклава; 9 - подставка для размещения стерилизуемых материалов.
Химические методы стерилизации применяются для дезинфекции. Дезинфекция – это способ уничтожения микроорганизмов при помощи сильнодействующих химических веществ (антисептиков), таких как хлорная известь, йод, этиловый спирт и др. В лабораторной практике методы дезинфекции применяют для обезвреживания рабочего стола, рук, боксов.
Механические методы стерилизации применяются в тех случаях, когда субстраты не выдерживают нагревания и воздействия химических веществ (белки, сыворотки, антибиотики, витамины и др.). Осуществляется фильтрованием через специальные мелкопористые бактериальные фильтры.
Практическая часть 1. Подготовить посуду к стерилизации.
Перед стерилизацией лабораторную посуду моют и сушат. Новую посуду в начале кипятят в воде, в которую добавляют соляную кислоту так,
чтобы получился 1%-ный раствор, затем промывают холодной водой и,
не вытирая, высушивают. Посуду, бывшую в употреблении, выдерживают в 20%-ном растворе серной кислоты в течение суток, затем моют в горячей воде, тщательно прополаскивают и высушивают. Колбы, пробирки и флаконы перед стерилизацией закрывают ватными пробками. Чашки Петри стерилизуют, завернув их в бумагу по 1–5 штук, в бумагу заворачивают и пипетки.
Приготовить к стерилизации 3–5 пробирок и 1–2 колбы. Для этого чистые пробирки и колбы закрывают ватными пробками. Их готовят из гигроскопической ваты, поскольку она хорошо обеспечивает стерильность субстрата и не сильно тлеет. Для изготовления пробки берут прямоугольный кусочек ваты, загибают его края и сворачивают плотным валиком, примеривая его к горлышку пробирки или колбы. Валик плотно оборачивают марлей так, чтобы вся вата была под ней, и завязывают нитками. Лишние концы марли обрезают. Пробка для пробирок должна иметь длину не более 3 см, быть достаточно плотной, хорошо сохранять свою форму и свободно входить в нее. Поверх пробки на колбу надевают бумажные колпачки, которые предохраняют ее горлышко от пыли.
Подготовить к стерилизации 3–5 пипеток. В верхнюю часть каждой пипетки вставляют кусочек ваты, чтобы ее содержимое при работе не могло попасть в рот. Плотную бумагу нарезают полосками шириной 5–6 см и длиной 60–70 см. Полоску бумаги кладут на стол и загибают ее левый конец под углом 45°. На двойной слой бумаги кладут острый конец пипетки, загибают на него бумагу и плотно заворачивают. Затем, вращая пипетку, наматывают на нее по спирали бумагу до тех пор, пока вся пипетка не будет завернута. Чтобы бумага не развернулась, конец полоски закручивают.
Подготовить к стерилизации вату и марлю. Перед стерилизацией марлю нарезают кусочками, а вату сворачивают в виде шариков, после
чего заворачивают их в плотную бумагу по 1–3 штуки так, чтобы она не разворачивалась. Удобно из бумаги сделать кулечки, положить туда вату или марлю и хорошо закрыть кулечки.
Провести стерилизацию посуды. Подготовленную к стерилизации посуду и вату загружают в сушильный шкаф. Их кладут не слишком плотно, для того чтобы воздух мог хорошо циркулировать по всей камере и обеспечивался равномерный нагрев. После этого дверцу шкафа закрывают и включают нужную температуру.
Провести стерилизацию бактериальных петель.
Бактериальные петли стерилизуют в пламени спиртовки. Петли делают из нихромовой или платиновой проволоки, чтобы при прокаливании на них не появлялась окалина. Если петля сухая, то ее в вертикальном положении вносят в верхнюю, самую горячую часть пламени и прокаливают до красного каления сначала ее нижнюю, а затем верхнюю часть. Если на петле находится какой-нибудь материал,
то петлю в горизонтальном положении вносят в нижнюю, самую холодную часть пламени (если внести в горячую часть, то может произойти разбрызгивание материала), и только после того, как материал полностью сгорит, продолжают прокаливание в верхней – горячей части пламени.
Вопросы для самопроверки
1.Какой процесс называется дезинфекцией?
2.Какие вещества используются для проведения дезинфекции?
3.Какой процесс называется стерилизацией?
4.Что такое промышленная стерилизация?
5.Какими способами можно проводить стерилизацию?
6.Что и при каких условиях стерилизуют в автоклаве?
7.Что и при каких условиях стерилизуют в сушильном шкафу?
8.Что и при каких условиях стерилизуют кипячением?
Лабораторная работа № 7 Выделение чистой культуры микроорганизмов
Цель работы: ознакомиться с методиками посева микроорганизмов. Приобрести навыки по выделению чистых культур.
