
- •СПИСОК СОКРАЩЕНИЙ
- •ПРЕДИСЛОВИЕ
- •ВВЕДЕНИЕ
- •ПНЕВМОНИИ
- •ХРОНИЧЕСКАЯ ПНЕВМОНИЯ
- •ХРОНИЧЕСКИЙ БРОНХИТ
- •ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЕГКИХ (ХОБЛ)
- •ТЯЖЁЛОЕ ОБОСТРЕНИЕ АСТМЫ (АСТМАТИЧЕСКИЙ СТАТУС)
- •БРОНХОЭКТАТИЧЕСКАЯ БОЛЕЗНЬ
- •ЭМФИЗЕМА ЛЕГКИХ
- •ИНТЕРСТИЦИАЛЬНЫЕ (ДИССЕМИНИРОВАННЫЕ) БОЛЕЗНИ ЛЕГКИХ
- •ФИБРОЗИРУЮЩИЕ АЛЬВЕОЛИТЫ
- •САРКОИДОЗ ОРГАНОВ ДЫХАНИЯ
- •Диагностика
- •РЕСПИРАТОРНЫЙ ДИСТРЕСС-СИНДРОМ
- •МУКОВИСЦИДОЗ
- •ЗАКЛЮЧЕНИЕ
ГЛАВА 16 МУКОВИСЦИДОЗ
Муковисцидоз (син.: кистозный фиброз поджелудочной железы, синдром Фанкони) представляет собой наследственное заболевание, передающееся по ау- тосомно-рецессивному типу, характеризующееся системным поражением экзокринных желез как слизеобразующих (респираторного тракта, кишечника, поджелудочной железы), так и серозных – слюнных, потовых, слезных. Характерной чертой муковисцидоза является повышение вязкости секрета слизеобразующих желез, что применительно к бронхолегочной системе обусловливает нарушение очистительной функции бронхов и бронхиальной проходимости [2, 3, 4].
Передающиеся по наследству, или генетически детерминированные, заболевания легких, среди которых муковисцидоз встречается чаще всего, представляют собой одну из наиболее сложных и наименее изученных проблем современной пульмонологии.
Муковисцидоз и другие наследственные заболевания в большинстве случаев принимают за те или иные формы приобретенной легочной патологии, а иногда вообще не диагностируют. В результате этого меры вторичной профилактики и лечения оказываются запоздалыми, что пагубно отражается на исходе заболевания, способствуя сокращению продолжительности жизни больных. Наследственные болезни, вопреки сложившимся представлениям, не являются редкими. По данным разных авторов, такие больные составляют 5-35 % от общего числа в специализированных пульмонологических стационарах.
В литературе имеются сведения о 36 наследственных заболеваниях и патологических состояниях, при которых поражаются или могут поражаться легкие. Это так называемые хромосомные или генные болезни, в том числе связанные с нарушением обмена веществ (болезни накопления и другие энзимопатии), наследственные заболевания структурных белков, иммунной системы и т.д. В большинстве случаев патология носит системный характер, причем легкие не являются главным объектом поражения.
578
Наследственных заболеваний, имеющих достаточно отчетливые и характерные для данной нозологической формы патологические изменения в бронхолегочной системе, немного; основными из них являются муковисцидоз и дефицит α1-ингибитора протеаз (рассматривается в главе, посвященной эмфиземе легких). Кроме того, терапевтам, пульмонологам, врачам общей практики необходимо иметь в виду, что они могут встретиться с изменениями в легких при некоторых других наследственных заболеваниях:
●синдроме Марфана – системном заболевании структурных белков, приводящем к формированию эмфиземы легких, деструктивным пневмониям;
●болезни (синдроме) Рандю-Ослера, в основе которого лежит наследственная неполноценность мезенхимальных тканей с формированием телеангиоэктазий;
●синдроме Черногубова-Элерса-Данлоса, связанном с молекулярным дефектом коллагена, способствующим развитию ранней эмфиземы, кист, абсцессов
ибронхоэктазий;
●болезни Гирке – энзимопатии, характеризующейся отложением гликогена
вразличных органах и тканях.
В 1936 г. швейцарские педиатры G. Fanckoni, E. Uehlinger и C. Knauer впер-
вые обратили внимание на своеобразное сочетание фиброзного поражения поджелудочной железы и распространенных бронхоэктазов у детей и высказали мнение о врожденном характере данного синдрома. До этого, начиная с 1813 г., было описано около десятка аналогичных наблюдений, авторы которых не сумели сделать решающих обобщений, к которым пришли G. Fanckoni с сотрудниками. В связи с этим данный симптомокомплекс был назван синдромом или болезнью Фанкони. В 1943 г. S. Farber ввел второе название – «муковисцидоз» (от mucus – слизь и viscus – «птичий клей», т.е. вязкое вещество, которое получают из остролиста и используют для ловли мелких птиц). Этот термин характеризовал наиболее существенную патологоанатомическую находку – наличие вязкой слизи в выводных протоках экзокринных желез, главным образом поджелудочной и бронхиальных.
579
Вразвитых странах в последние годы отмечается рост числа больных муковисцидозом подросткового, юношеского возраста и взрослых, что свидетельствует о постепенной его трансформации из безусловно фатального заболевания детского возраста в хроническую патологию взрослых [6]. Более того, ученые предполагают, что уже к 2010 г. он может стать и гериатрической проблемой [8].
ВРоссии у большей части больных муковисцидоз не диагностируется или диагностируется поздно, нередко в запущенной стадии заболевания. В нашей стране число выявленных больных муковисцидозом не превышает 1:100 000 населения, тогда как в индустриально развитых странах Европы – 7:100 000, а в
США – 8:100 000; при этом число больных старше 18 лет в России составляет 7 %, в развитых странах Европы – 20 %, в США – 32 % [6]. Подобные цифры никак не могут быть объяснены только популяционными различиями, они явно свидетельствуют о плохом знании врачами этого заболевания и дефектах диагностики. В Российской Федерации больным с этим заболеванием часто выставляются другие легочные заболевания.
Между тем, муковисцидоз является важной медико-социальной проблемой, потому что с этим заболеванием связаны ранняя инвалидизация и смертность больных.
Этиология и генетические аспекты муковисцидоза
Причиной заболевания является мутация гена муковисцидозного трансмембранного регулятора (МВТР). Ген МВТР был выделен и локализован в 1989 г. Он содержит 27 экзонов, охватывает 25 0000 пар нуклеотидов и расположен в середине длинного плеча 7-й хромосомы. Каждый 20-й житель планеты является носителем дефектного гена. Однако для развития заболевания необходимо получить дефектный ген от каждого их родителей. Другими словами, больной является либо гомозиготным по данной мутации, либо компаудом, когда мутации гена, полученные от обоих родителей, различаются. Экспрессию гена можно наблюдать в разных тканях, которые поражаются при муковисцидозе: легких, поджелудочной железе, слизистой носа, кишечнике [2, 4].
580
На сегодняшний день выделено более 1 000 мутаций гена, ответственных за развитие симптомов муковисцидоза. Наиболее распространенной является мутация F508, которая встречается у 70-90 % больных муковисцидозом в западноевропейской и североамериканской популяциях, в российской популяции – у 53 %. Мутация F508 возникла примерно 25-10 тыс. лет назад и характеризуется отсутствием аминокислоты фенилаланина в 508 положении МВТР. Гомозиготы по F508 характеризуются ранней манифестацией болезни, высокими хлоридами пота, наличием выраженной панкреатической недостаточности, тяжелым поражением бронхолегочной системы [6].
Патогенез
Следствием мутации гена МВТР является нарушение структуры и функции его белкового продукта – трансмембранного регуляторного белка муковисцидоза (ТРБМ), полученного методом обратной генетики (от ДНК к белку). ТРБМ локализуется в апикальной части мембраны эпителиальных клеток и регулирует электролитный (преимущественно хлоридный) обмен между этими клетками и межклеточной жидкостью.
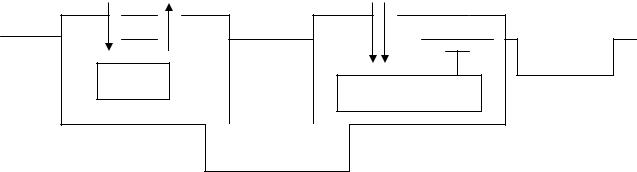
ТРБМ является мембранным каналом для транспорта ионов хлора («хлорный» канал), в активации которого решающую роль играет АТФ. Нарушение электролитного обмена при муковисцидозе (снижение секреции ионов хлора и гиперреабсорбция ионов натрия) приводит к дегидратации и повышению вязкости секретов и дисфункции жизненно важных органов (рис. 1).
Na+ |
|
Cl - |
|
Na+ |
|
Cl - |
норма |
эпителий |
|
муковисцидоз |
||
|
||
|
подслизистый |
|
|
слой |
Рис. 1. Механизм транспорта ионов через апикальную мембрану эпителиальной клетки при муковисцидозе (Амелина Е.Л., Чучалин А.Г., 1997)
581
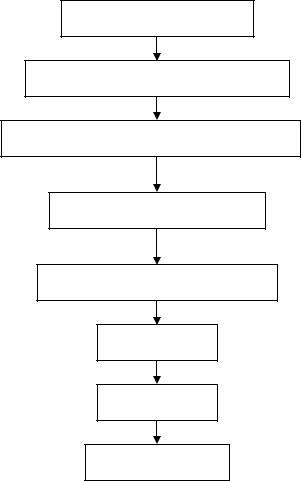
Основным и наиболее серьезным проявлением муковисцидоза является развитие патологического процесса в легких. Ранние легочные изменения обычно появляются в первые 1,5-2 месяца жизни ребенка в виде гипертрофии бронхиальных слизистых желез и гиперплазии бокаловидных клеток. Результатом этих ранних изменений является обтурация периферических дыхательных путей вязким бронхиальным секретом. Он представляет собой очень концентрированный перенасыщенный раствор, тормозящий движение ресничек мерцательного эпителия бронхов, вследствие чего его компоненты легко выпадают в осадок. В результате нарушается механизм самоочищения бронхов, что способствует росту патогенной флоры и развитию воспаления, приводящего к обструктивному бронхобронхиолиту, перибронхиальному фиброзу, цилиндрическим бронхоэктазам [2, 6] (рис. 2).
Мутация гена МВТР
Нарушение функции ТРБМ
↓Cl- - секреции, ↑ Na+ - абсорбции
«Высушивание секрета»
Бронхиальная обструкция
Инфекция
Воспаление
Бронхоэктазы
Рис.2. Патофизиологический «каскад» при муковисцидозе (Авдеев С.Н. и
соавт., 2001)
582
Вязкость мокроты обусловлена соотношением ее золевой и гелевой фаз и, в основном, содержанием двух макромолекул – мукоидных гликопротеидов и ДНК. Главным источником ДНК являются ядра распадающихся полиморфноядерных нейтрофилов, которые скапливаются в дыхательных путях в ответ на хроническую бактериальную инфекцию. Накопление чрезмерного количества ДНК в дыхательных путях увеличивает вязкость слизи, существенно нарушая дренаж бронхов и еще больше благоприятствуя развитию инфекции.
Следовательно, повышение вязкоэластических свойств мокроты при муковисцидозе связано как с нарушением ионного транспорта через апикальную мембрану эпителиоцитов (а это главное), так и с высвобождением большого количества внутриклеточной ДНК нейтрофилов и продукцией алгината мукоидными штаммами синегнойной палочки, о чем будет сказано ниже.
Проникновение патогенных микроорганизмов в нижние отделы респираторного тракта связано не только с нарушением дренажно-очистительной функции воздухоносных путей, но и с нарушением эффективности локальных механизмов противомикробной защиты – снижением секреторного иммуноглобулина А, интерферонообразования, количества макрофагов и их активности («спящие макрофаги»).
Микробно-воспалительный процесс при муковисцидозе, к сожалению, развивается рано. В нем участвует большое количество различных патогенных микроорганизмов, некоторые из них оказываются наиболее распространенными. Первоначально дыхательные пути колонизируются Hemophilus influenzae, затем – Staphylococcus aureus, а к 26 годам 80 % больных муковисцидозом оказываются инфицированными Pseudomonas aeruginosa (мукоидными и немукоидными штаммами). Наиболее неблагоприятно протекает синегнойная инфекция, обусловленная мукоидными штаммами, продуцирующими алгинат – экзомукополисахарид, являющийся дополнительным фактором вязкости бронхиального секрета и важнейшим фактором вирулентности этих бактерий. Микроколонии Pseudomonas aeruginosa, покрытые алгинатом, становятся труднодоступными для действия
583
антибиотиков, что значительно затрудняет лечение и ухудшает прогноз заболевания.
В последние годы возросла роль Burkholderia (ранее называвшейся Pseudomonas) cepacia. Этот вид синегнойной палочки характеризуется полирезистентностью к антибиотикам и связан с наиболее тяжелым вариантом течения болезни.
Хроническая бактериальная инфекция сопровождается массивной нейтро- фил-доминирующей воспалительной реакцией с высокими концентрациями провоспалительного цитокина интерлейкина-8 и высвобождением из гранул нейтрофилов таких ферментов, как эластаза и миелопероксидаза. Известно, что главным ингибитором нейтрофильной эластазы является α1-антитрипсин. Он обеспечивает более 90 % антиэластазной защиты. Хотя продукция α1–антитрипсина у больных муковисцидозом сохранена, ее активность подавляется чрезмерным содержанием нейтрофильной эластазы в мокроте, что способствует протеолитической деструкции легочной ткани.
Таким образом, присоединение синегнойной бактериальной инфекции, эрадикации которой, как правило, достичь не удается, знаменует качественно новый этап течения муковисцидоза – прогрессирование легочного поражения, нарастание дыхательной недостаточности, формирование легочного сердца и неблагоприятный исход болезни в течение ближайших 5-7 лет.
Вовлечение в патологический процесс других органов при муковисцидозе в основном также связано с изменениями вязкости секрета (мекониальный илеус, пансинусит, поражение слюнных желез, обтурация семявыводящих протоков у мужчин, сгущение желчи и пр.).
Необычайная вязкость секрета поджелудочной железы, обусловливающая затруднение его оттока и повышение давления в протоках вызывает ее кистознофиброзное перерождение и стойкое нарушение экзокринной функции со снижением поступления в кишечник липазы и трипсина. Дисфункция желез внешней секреции ухудшает всасывание жиров, жирорастворимых витаминов, белков, углеводов; способствует развитию гнилостных процессов в кишечнике, метеоризму, частому обильному и зловонному стулу. Расстройство пищеварения приводит к
584
гипотрофии пациента, несмотря на повышенный аппетит у большей части больных. В дальнейшем к нарушению экзокринной функции поджелудочной железы могут присоединиться симптомы поражения ее островкового аппарата, что ведет к развитию сахарного диабета.
Патоморфология муковисцидоза
Типичным морфологическим признаком муковисцидоза является обнаружение тягучего вязкого слизисто-гнойного секрета в просвете бронхов и в выводных протоках слизистых желез, которые представляются резко расширенными. Железистый эпителий частично атрофируется, и иногда на месте желез формируются ретенционные кисты. Вокруг желез в подслизистой оболочке бронхов отмечается разрастание грубой волокнистой соединительной ткани. Как правило, резко выражены воспалительные изменения слизистой бронхов. Обычно наблюдаются бронхоэктазы, преимущественно в нижних отделах легких, массивные сливные пневмонии.
При гистологическом исследовании выявляются гнойный и гнойнонекротический бронхит, инфильтрация стенок бронхов воспалительными клеточными элементами (преимущественно лимфоцитами и гистиоцитами). Воспаление в стенках бронхов приводит к фиброзным изменениям как самой стенки, так и перибронхиальных отделов, что способствует развитию необратимого облитерирующего бронхиолита, в результате которого происходит коллапс и/или расширение альвеолярных ходов и альвеол. У детей старшего возраста и взрослых обнаруживается локальная буллезная эмфизема. В терминальной стадии дистальные бронхи превращаются в большие кистоподобные образования, заполненные гноем.
При электронно-микроскопическом исследовании на поверхности эпителия видны тяжи слизи, лейкоциты, а иногда макрофаги. Обращает на себя внимание уменьшение количества ресничек клеток мерцательного эпителия.
Классификация
Несмотря на то, что муковисцидоз является наследственным заболеванием, в соответствии с МКБ-10 он относится к Классу IV «Болезни эндокринной систе-
585
мы, расстройства питания и нарушения обмена веществ» (Е 84.0 – Е 84.9 – Кистозный фиброз).
В настоящее время принято различать следующие клинические формы муковисцидоза [4]:
1)преимущественно легочная форма, когда поражения со стороны желу- дочно-кишечного тракта минимальны или отсутствуют (15-20 %);
2)смешанная форма, когда имеются поражения легких или желудочнокишечного тракта (75-80 %);
3)абортивные или стертые формы (1-4 %);
4)мекониевая непроходимость (5-10 %);
5)преимущественно кишечная форма, когда изменения со стороны легких минимальны (5%).
Наряду с определением клинической формы, целесообразным является также установление генотипа у больного муковисцидозом, что имеет важное значение для прогнозирования особенностей динамики развития патологического процесса.
Выявление этиологии и характера инфекционно-воспалительного процесса
влегких играет решающую роль в выборе адекватной терапевтической тактики. Анализ клинического течения муковисцидоза позволяет выделить 4 основные фа-
зы патологического процесса в легких: обострение, вялотекущее обострение, ремиссия, непрерывное рецидивирование; по тяжести состояния – легкое, среднетяжелое, тяжелое и крайне тяжелое течения.
Коблигатным осложнениям муковисцидоза со стороны органов дыхания следует отнести ателектазы, легочную гипертензию, хроническое легочное сердце, дыхательную и легочно-сердечную недостаточность; к факультативным – абсцессы, пневмо- и пиопневмотораксы, легочное кровотечение. Наиболее частыми осложнениями со стороны других органов и систем являются портальная гипертензия, гастроэзофагеальный рефлюкс, холелитиаз, сахарный диабет, выпадение прямой кишки, бесплодие.
586
С учетом всех перечисленных факторов была разработана и внедрена в медицинскую практику классификация муковисцидоза (табл. 1).
|
|
|
|
|
|
Таблица 1 |
|
|
Современная классификация муковисцидоза |
|
|||||
|
(Т.Е. Гембицкая, А.А. Желенина, 2004) |
|
|||||
|
|
|
|
|
|
|
|
|
|
Инфекционный |
Фаза |
|
|
||
Форма |
Генотип |
процесс в легких |
Течение |
Осложнения |
|||
процесса |
|||||||
|
|
(этиология) |
|
|
|||
|
|
|
|
|
|||
Легочная |
|
Ост- |
Хрони- |
Обострение |
Легкое |
Бронхолегочные |
|
Смешанная |
|
рый |
ческий |
Вялотекущее |
Средне- |
|
|
|
Респираторные |
|
|||||
|
F508F508/deldel F508/nondelF kb/del121delF508 F/nonnonF Прочие |
вирусы |
|
обострение |
тяжелое |
Со стороны |
|
Кишечная |
Пневмотропные |
Непрерывное |
Тяжелое |
других органов |
|||
|
|
||||||
Мекониаль- |
|
микробы: |
рецидивиро- |
|
|
||
ный илеус |
|
стафилококк, |
вание |
Крайне |
|
||
Прочие |
|
синегнойная |
Ремиссия |
тяжелое |
|
||
|
палочка |
|
|
|
|||
|
|
Патогенные |
|
|
|
||
|
|
|
грибы |
|
|
|
|
|
|
|
идр. |
|
|
|
|
Клиническая картина
Признаки поражения легких чаще всего возникают на 1-2-ом году жизни ребенка. Раннее начало легочных проявлений (кашель, приступы удушья, одышка), наряду с наличием в анамнезе больных сведений о мекониальном илеусе в период новорожденности, замедленном физическом развитии, частых поносах, непереносимости жирной пищи, следует считать достаточно характерными признаками болезни [4].
Для больных муковисцидозом, страдающих поражением легких, характерны повторные, тяжело протекающие и с трудом поддающиеся лечению бронхиты и/или пневмонии, обычно двусторонние, с развитием полисегментарных ателектазов, принимающие затяжное течение, раннее развитие и декомпенсация легочного сердца, кровохарканье и легочное кровотечение, рецидивирующий пневмоторакс.
Ведущей жалобой больных является мучительный приступообразный кашель с вязкой, трудноотделяемой, как правило, гнойной мокротой до 200 мл в су-
тки и более. Значительную часть пациентов беспокоит одышка экспираторного
587
характера при умеренных физических нагрузках или в покое, реже кровохарканье. Жалобы на упорные поносы при хорошем аппетите, чередование поносов и запоров, наличие обильного вязкого, липкого, «жирного» стула, вздутие живота связаны с явлениями панкреатической ахилии – снижением или отсутствием в панкреатическом соке липазы, трипсина, амилазы, приводящих к нарушению процессов пищеварения (синдром мальдигестии) и всасывания (синдром мальабсорбции).
У взрослых мужчин отмечается снижение половой функции и во многих случаях стерильность, связанная с нарушением подвижности сперматозоидов и обтурацией семявыносящих протоков. У женщин также возможны расстройства менструального цикла и снижение фертильности.
Многие пациенты отмечают постоянную общую слабость, обморочные состояния при перегревании, склонность к гипотонии.
При осмотре больных муковисцидозом обращает на себя внимание астеническое телосложение, бледность кожных покровов, иногда одутловатость лица, умеренный или выраженный цианоз видимых слизистых, снижение массы тела. Грудная клетка имеет бочкообразную форму. Ногтевые фаланги кистей изменены в виде «барабанных палочек», ногти – по типу «часовых стекол» (пальцы Гиппократа).
При физикальном исследовании перкуторно могут определяться признаки эмфиземы легких (коробочный звук, уменьшение границ относительной сердечной тупости, низкое стояние и малая подвижность диафрагмы). Выслушивается жесткое, а в нижних отделах – ослабленное дыхание, рассеянные низкотональные (в 25% случаев) и высокотональные (свистящие) сухие и/или влажные средне – и мелкопузырчатые хрипы, особенно обильные в период обострения.
В целом клиническая картина отличается полиморфизмом, представлена отдельными симптомами у лиц с легким течением и значительным числом ярко выраженных признаков у тяжелых больных.
Диффузный пансинусит, полипоз носа, сиалоадениты и кисты слюнных желез также не являются редкостью у больных старшего возраста. К другим, более
588
редким проявлениям муковисцидоза, можно отнести билиарный цирроз печени с развитием признаков портальной гипертензии, асцита, кровотечения из варикозно расширенных вен пищевода.
Диагностика
Диагностика муковисцидоза проводится в так называемых группах «риска». К группам риска относятся больные, имеющие в анамнезе следующие заболева-
ния [6]:
Бронхолегочные:
-повторные и рецидивирующие пневмонии с затяжным течением;
-абсцедирующие пневмонии, особенно у детей грудного возраста;
-хронические пневмонии, особенно двусторонние;
-бронхиальная астма, рефрактерная к традиционной терапии;
-рецидивирующие бронхиты, бронхиолиты, особенно с высевом Pseudomonas aeruginosa.
Изменения желудочно-кишечного тракта:
-мекониальный илеус и его эквиваленты;
-цирроз печени;
-сахарный диабет;
-гастроэзофагеальный рефлюкс;
-холелитиаз;
-выпадение прямой кишки.
Изменения других органов и систем:
-нарушение роста и развития;
-задержка полового развития;
-мужское бесплодие;
-хронический синусит;
-полипы носа.
Сибсы из семей, в которых есть больные муковисцидозом.
Несмотря на важность анамнестических сведений и данных объективного исследования, для верификации диагноза муковисцидоза необходимо использо-
589
вать лабораторные данные, результаты рентгенологического и эндоскопического исследований, проводить «потовую пробу», по показаниям – молекулярную (генетическую) диагностику.
Типичных для муковисцидоза изменений гемограммы нет: отмечается картина инфекционно-воспалительного процесса.
Мокрота вязкая, слизисто-гнойная или гнойная с повышенным содержанием общего белка и сиаловых кислот, что свидетельствует о значительном изменении реологических свойств. Характерно постоянное обнаружение в мокроте взрослых пациентов синегнойной палочки в значимых диагностических титрах.
Рентгенологические изменения в легких при муковисцидозе неспецифичны и определяются характером и тяжестью вторичного воспалительного процесса.
Различные поражения, выявляемые на рентгенограммах (компьютерных томограммах), можно сгруппировать в виде синдромов [4]:
синдром поражения интерстициальной ткани легких (усиление, тяжи-
стость, сетчатость, ячеистость легочного рисунка за счет разрастания междольковой, перибронхиальной и периваскулярной соединительной ткани);
синдром нарушения бронхиальной проходимости (повышение прозрачно-
сти легочных полей, низкое стояние диафрагмы, увеличение переднезаднего размера грудной клетки, дольковые и сегментарные ателектазы);
синдром заполнения альвеол (инфильтративные изменения);
синдром «сотового» легкого (крупноячеистая деформация легочного рисунка с образованием тонкостенных полостей диаметром от 0,8 до 1 см).
Нередко у одного и того же больного определяются все вышеперечисленные признаки, однако чаще изменения начинаются с интерстициальных, а затем достаточно быстро присоединяются признаки бронхиальной обструкции.
При фибробронхоскопии выявляются воспалительные изменения различной интенсивности: от катарального до гнойного эндобронхита с характерными сли- зисто-гнойными тяжами, располагающимися по продольным складкам слизистой, иногда в виде обширных «дифтероидных» пленок. Секрет отличается вязкостью (липкостью) и с трудом аспирируется из трахеобронхиального дерева. Характерно
590
наличие слизисто-гнойных или гнойных пробок в устьях расширенных бронхов. Отмечается повышенная кровоточивость слизистой оболочки. При исследовании жидкости бронхоальвеолярного лаважа выявлено высокое содержание нейтрофильных лейкоцитов и низкое – альвеолярных макрофагов и лимфоцитов; последние характеризуются низкой жизнеспособностью, повышенным цитозом.
Бронхография выявляет изменения, связанные с гиперсекрецией слизи («обрывы» бронхов, фрагментированное их заполнение, неровность контуров, уменьшение числа боковых ветвей). Более чем у одной трети больных обнаруживаются цилиндрические, смешанные и мешотчатые бронхоэктазы, зачастую двусторонние, локализующиеся в нижних отделах легких.
Легочная вентиляция у больных муковисцидозом нарушена значительно и имеет ряд особенностей. Прежде всего, характерны обструктивные нарушения вентиляции со снижением абсолютных и относительных скоростных показателей, увеличение остаточного объема легких на ранних этапах болезни. По мере развития заболевания изменения становятся смешанными, но с выраженным преобладанием обструктивных нарушений. Значительное снижение вентиляции и перфузии приводит к хронической гипоксемии, а при дальнейшем прогрессировании процесса – к гиперкапнии и респираторному ацидозу.
Решающее значение в диагностике и дифференциальной диагностике муковисцидоза имеет исследование электролитов пота («потовая проба», «потовый тест»). Метод определения хлоридов в поте был разработан в 1959 г. Гибсоном и Куком и до сих пор является «золотым стандартом» прижизненной диагностики муковисцидоза, рекомендуемым Международной ассоциацией по кистозному фиброзу. Содержание в поте хлоридов выше 60 ммоль/л и натрия выше 70 ммоль/л при трехкратном исследовании большинство авторов считает абсолютным доказательством наличия муковисцидоза. При концентрации хлоридов 40-60 ммоль/л в сочетании с клиническими признаками заболевания необходимы наблюдение за больными и повторные исследования электролитов пота.
Следует помнить также, что существуют ложноположительные и ложноотрицательные результаты «потового теста». Так, ложноотрицательные результаты
591
могут наблюдаться при наличии безбелковых отеков, а также при лечении антибиотиком Cloxacillin. Ложноположительные результаты можно получить у больных со следующими состояниями:
1.Нелеченная надпочечниковая недостаточность.
2.Эктодермальная дисплазия.
3.Нефрогенный несахарный диабет.
4.Гипотиреоз.
5.Резко выраженная гипотрофия (кахексия).
6.Мукополисахаридоз.
7.Фукозидоз.
8.Семейный холестаз.
9.Гликогеноз 2-го типа.
10.Псевдогипоальдостеронизм.
11.Адреногенитальный синдром.
12.Хронический панкреатит.
13.ВИЧ-инфекция.
14.Дефицит глюкозо-6-фосфатазы.
15.Синдром Кляйнфельтера.
16.Семейный гипопаратиреоз.
17.Синдром Маурика.
18.Нервная анорексия.
19.Гипогаммаглобулинемия.
20.Целиакия.
«Потовый тест» проводится в 3 этапа:
-стимуляция потоотделения (пилокарпиновый электрофорез);
-сбор пота;
-анализ потовой жидкости.
Определяя хлориды пота методом Гибсона-Кука, необходимо соблюдать следующие условия:
592
- тест должен проводиться в лаборатории специально обученным персона-
лом;
-«потовый тест» необходимо проводить 3 раза;
-навеска пота должна быть не менее 100 мг;
-у взрослых и подростков часто наблюдаются повышенные значения хлоридов пота, в связи с чем необходимо проводить провокационный «потовый тест»
сиспользованием глюкокортикостероидов (прием преднизолона по 5 мг внутрь в течение 2-х дней). При этом у лиц, не страдающих муковисцидозом, уровень электролитов в поте становится ниже базисной линии, а у больных не меняется.
Таким образом, диагностика муковисцидоза базируется на наличии:хронического бронхолегочного процесса,кишечного синдрома;положительного «потового теста»;
муковисцидоза у сибсов.
При этом для постановки диагноза достаточно сочетания любых двух из этих четырех признаков [6].
Несмотря на свою специфичность, метод Гибсона-Кука является длительным, трудоемким и зависит от опыта проводящего его человека. В связи с этим постоянно ведутся разработки аппаратов, которые позволили бы унифицировать методику, сократить время проведения теста и уменьшить количество пота, необходимого для постановки диагноза. В середине 80-х гг. в практику были внедрены аппараты «Макродакт» и «СF-индикатор» американских фирм «Вескор» и «Скандифарм» для скрининг-диагностики муковисцидоза.
При использовании вышеописанных методов определения хлоридов пота могут встречаться пограничные значения (35,5 % по Гибсону-Куку; 21 % – при пользовании «Макродактом»; 8,5 % – «СF-индикатором»), а также в небольшом проценте случаев как ложноположительные, так и ложноотрицательные показатели электролитов пота. В связи с этим возникает необходимость в дополнительных, более чувствительных диагностических тестах. Одним из таких тестов является измерение трансэпителиальной разности электрических потенциалов (РП).
593
Респираторный эпителий при муковисцидозе является критическим местом, где реализуются вышеупомянутые процессы нарушения ионного транспорта. Измерение трахеобронхиальной разности электрических потенциалов сопряжено с рядом трудностей, поэтому был разработан метод измерения разности назальных потенциалов (РНП), отражающий основной дефект при муковисцидозе. Суть метода состоит в измерении разности электрических потенциалов между электродами, один из которых располагается на поверхности слизистой оболочки носа, а второй на коже предплечья, предварительно «зачищенной» с помощью скраба до легкого покраснения. Поскольку секреция Cl- и гиперабсорбция Na+ являются электрогенными процессами и образуют разность электрических потенциалов, которую можно измерить, то по ней можно судить о нарушениях биоэлектрогенеза в клетках мерцательного эпителия при муковисцидозе. Величины разности назальных потенциалов (- 44,7 ± 2,2 мВ) у больных муковисцидозом достоверно отличаются от таковых у больных с ХНЗЛ (- 17,2 ± 1,8 мВ). Благодаря этому методу (впервые в России он апробирован в НИИ пульмонологии) удается оптимизировать диагностику муковисцидоза в тех случаях, когда клиническое обследование, повторные изменения хлоридов потовой жидкости и рутинный ДНК-анализ дают разнонаправленные данные [4].
Молекулярная диагностика
Хотя существующие клинические и лабораторные методы в большинстве случаев позволяют правильно установить диагноз муковисцидоза, однако выявление генотипа больного является важным для определения характера течения и терапевтического прогноза болезни. В настоящее время для муковисцидоза, как и для многих других моногенных наследственных болезней, принципиально возможны два варианта молекулярной диагностики [4]:
1. Прямой, основанный на идентификации мутации.
Главное преимущество прямого подхода заключается в том, что по результатам анализа ДНК одного индивидуума можно судить о наличии или отсутствии соответствующей мутации. Такой подход особенно важен для семей высокого риска, в которых уже умер больной ребенок. Диагностика носительства мутации у
594
членов такой семьи и пренатальная диагностика возможны только при наличии идентифицируемой мутации.
2. Непрямой – с помощью анализа полиморфизма длины рестрикционных фрагментов (ПДРФ-анализа). Как правило, детекция мутаций основана на применении метода полимеразной цепной реакции синтеза ДНК, при помощи которого удается в течение 2-3 ч получить несколько миллионов копий заданной последовательности ДНК, в которых затем и проводится поиск мутантного сайта. Основное преимущество данного подхода – возможность молекулярной диагностики в случае отсутствия идентифицируемых мутаций.
Поскольку в настоящее время в России возможна идентификация примерно 60-65 % хромосом с мутациями гена МВТР, непрямой метод продолжает оставаться важным для молекулярной диагностики муковисцидоза.
Таким образом, при обнаружении молекулярных признаков заболевания ди-
агноз муковисцидоза становится совершенно убедительным (неоспоримым).
Течение болезни и ее осложнения
Течение заболевания характеризуется периодическими обострениями и ремиссиями. Обострения протекают чаще по бронхитическому, реже – по пневмоническому типам, причем пневмонии имеют тяжелое затяжное течение и склонность к деструкции. Основными клиническими симптомами обострения у больных муковисцидозом являются: изменение характера кашля, появление ночного кашля, увеличение количества гнойной мокроты, нарастание одышки, лихорадка, учащение пульса, ухудшение аппетита, падение веса, снижение толерантности к физической нагрузке, цианоз, ухудшение физикальной и рентгенологической картины в легких, показателей функции внешнего дыхания, усиление признаков воспаления по данным лабораторных методов исследования [6].
При легком течении обострения наблюдаются редко (обычно 1 раз в год). Клинические проявления в периоды ремиссии не выражены и работоспособность сохранена.
При течении средней тяжести обострения бывают 2-3 раза в год, длятся 1- 1,5 месяца и более. Даже в периоды ремиссий нарушены физическая активность и
595
работоспособность, сохраняется кашель с трудноотделяемой мокротой, одышка при умеренной физической нагрузке, общая слабость, потливость. Как правило, имеют место признаки внешнесекреторной недостаточности функции поджелудочной железы.
Тяжелое течение характеризуется непрерывно рецидивирующими обострениями, ремиссии практически отсутствуют. Наблюдаются повторные, тяжело протекающие и с трудом поддающиеся лечению пневмонии, обычно двусторонние с развитием полисегментарных ателектазов. В этой стадии больные становятся тяжелыми «дыхательными» инвалидами, формируются легочная гипертензия и легочное сердце.
К угрожающим жизни осложнениям относятся спонтанный пневмоторакс, изредка могут наблюдаться массивные легочные кровотечения.
Наиболее частыми осложнениями со стороны других органов и систем являются портальная гипертензия, билиарный цирроз печени, кровотечение из варикозно расширенных вен пищевода, сахарный диабет и др.
Примеры формулировки диагноза
1.Муковисцидоз, легочная форма, среднетяжёлое течение, генотип del F 508 / N 1303 K, фаза обострения. Вторичный хронический гнойный обструктивный бронхит в фазе обострения (стафилококковой этиологии). Мешотчатые бронхоэктазы в нижней доле правого легкого. Осложнение: ДН II.
2.Муковисцидоз, смешанная форма, тяжелое течение, генотип del F 508 / del F 508, фаза обострения. Вторичный хронический гнойный обструктивный бронхит в фазе обострения (хроническая синегнойная инфекция). Билиарный цирроз печени III степени. Хронический панкреатит с недостаточностью внешнесекреторной функции поджелудочной железы. Осложнения: ДН III. Легочная гипертензия III степени. Хроническое легочное сердце, декомпенсированное. Н III. Портальная гипертензия. Кровотечение из варикозно расширенных вен пищевода.
Комментарий. Генотип указывается при наличии соответствующих возможностей для данного исследования.
596
Лечение
Лечение муковисцидоза – трудная задача, требующая больших моральных и физических сил, прежде всего, семьи и медицинского персонала, а также времени и значительных материальных затрат. Лечение больных муковисцидозом предпочтительно проводить в специализированных центрах, где работают опытные медицинские работники. Больной муковисцидозом нуждается в комплексной ме- дико-социальной помощи.
В лечебных программах учитываются патофизиологические нарушения, возникающие у больных муковисцидозом (табл. 2).
Таблица 2
Терапевтическая коррекция патофизиологических нарушений у взрослых больных муковисцидозом (Davis, 1996)
Патофизиологический дефект |
Лечение |
|
|
|
|
Дефект гена муковисцидоза |
Генная терапия |
|
|
|
|
Дефект / дефицит белка МВТР |
Активация мутантного МВТР |
|
|
|
|
Снижение секреции Cl- увеличение |
Ингаляция амилорида; АТФ |
|
абсорбции Na+ |
||
Нарушение мукоцилиарного клиренса |
Муколитики |
|
Бронхиальная обструкция |
Бронходилататоры, кинезитерапия |
|
|
|
|
Инфекция |
Антибиотики, иммунизация |
|
|
|
|
Воспаление |
НПВП, стероиды, ДНК-аза, |
|
антиэластазы |
||
|
Лечебные программы, разрабатываемые для взрослых больных муковисцидозом, преследуют следующие цели [7]:
1.Уменьшение обструкции дыхательных путей.
2.Контроль над инфекцией дыхательных путей.
3.Улучшение нутритивного статуса.
4.Лечение легочных осложнений.
Уменьшение обструкции дыхательных путей
В формировании бронхиальной обструкции у больных муковисцидозом играют роль несколько факторов: отек слизистой бронхов, спазм гладкой мускула-
597
туры, но основное значение имеет скопление в дыхательных путях густого, вязкого секрета.
Терапия, направленная на мобилизацию и удаление секрета (базисная терапия), обычно состоит из мукоактивных препаратов и физиотерапевтических процедур. Задачей мукоактивной терапии являются улучшение реологических свойств мокроты, снижение ее вязкости и повышение клиренса.
Муколитическая терапия. Обычно используют ацетилцистеин и амброксол, реже другие муколитики. N-ацетилцистеин (АЦЦ, мукосолвин) разрушает 3- мерную организованную сеть мокроты за счет деполимеризации дисульфидных связей. Кроме того, препарат оказывает антиоксидантный и противовоспалительный эффекты. АЦЦ наиболее эффективен при ингаляционном введении; обычно его назначают по 300-400 мг 2-3 раза в сутки. Однако необходимо помнить, что при аэрозольном назначении возможно развитие бронхоспазма.
Амброксол (лазолван) – нормализует соотношение кислых и нейтральных сиаломуцинов в мокроте, стимулирует продукцию сурфактанта альвеолоцитами 2-го типа, усиливает мукоцилиарный транспорт. Препарат также более эффективен при ингаляционном пути введения, средняя доза составляет 30 мг 3 раза в сутки. Возможно комбинированное назначение АЦЦ и амброксола, при этом один из препаратов вводится ингаляционно, а другой – перорально.
В 2000 г. на Российском рынке появился принципиально новый, не имеющий аналогов муколитический препарат пульмозим (рекомбинантная человеческая дезоксирибонуклеаза – ДНК-аза или дорназа альфа) фирмы «Хоффман ля Рош» (Швейцария), который обладает выраженным муколитическим и противовоспалительным эффектами. Действие пульмозима основано на деполимеризации ДНК-продукта дезинтеграции нейтрофилов мокроты, играющего важную роль в формировании 3-мерной «сети» муцинового геля [6]. Обычно препарат назначают в дозе 2,5 мг 1-2 раза в день в виде ингаляции через небулайзер. Возможно, при обострении заболевания может потребоваться бόльшая доза, хорошая переносимость препарата наблюдается при увеличении дозы до 20 мг.
598
Гепарин также относится к наиболее эффективным современным муколитикам. Его используют в виде аэрозоля по 1 0000 ЕД, хотя муколитический эффект наблюдается и при парентеральном его введении [3].
В настоящее время ведется поиск и других препаратов, способных активно разжижать мокроту у больных муковисцидозом. Природный фермент гельзолин разрушает внеклеточный ф-актин, который, подобно внеклеточной ДНК, высвобождается при дезинтеграции нейтрофилов в дыхательных путях у больных муковисцидозом, что повышает вязкоэластические и адгезивные свойства мокроты. Исследования показали, что гельзолин и пульмозим обладают синергичными свойствами.
Изучается муколитическая эффективность флуимуцила и флуимуцилантибиотика (фирмы «Zambon», Италия). Следует заметить, что фирма производит также ринофлуимуцил, используемый для разжижения секрета в носовых ходах и гайморовых пазухах как у больных муковисцидозом, так и при другой ЛОРпатологии [6]. Доклинические испытания проходит препарат тимозин-β-4.
«Немуколитическим» подходом к улучшению реологии мокроты является воздействие на нарушенный ионный транспорт при муковисцидозе. Антагонист натриевых каналов амилорид ингибирует реабсорбцию Na+ клетками дыхательных путей, повышая при этом водный компонент, что приводит к улучшению мукоцилиарного транспорта. Активаторы альтернативных каналов хлора (уридинтрифосфат и аденозинтрифосфат) усиливают комбинированный эффект с амилоридом.
Кинезитерапия. Одним из наиболее важных и малозатратных компонентов терапии муковисцидоза является специальная лечебная физкультура (ЛФК) или кинезитерапия, основной целью которой является очищение бронхиального дерева от вязкой мокроты, блокирующей бронхи и предрасполагающей к инфекционному поражению легких. Традиционными методами кинезитерапии является постуральный дренаж, который желательно сочетать с перкуссионным и вибрационным массажем грудной клетки. Процедура проводится не менее 2-3 раз в сутки.
599
Альтернативой традиционному постуральному дренажу является недавно предложенный метод высокочастотных компрессий (осцилляций) грудной клетки с помощью специальных аппаратов.
Обязательным компонентом лечебного комплекса является дыхательная гимнастика, которая в основном направлена на тренировку выдоха и улучшение газообмена в легких.
Бронхолитики. С целью расширения бронхов, снижения бронхиальной обструкции и улучшения экспекторации мокроты назначают бронходилататоры. Обычно применяют β2-агонисты и холинолитики, их ингалируют при помощи небулайзера или дозированных ингаляторов. Они используются годами и показаны тем пациентам, у которых выявлено достоверное повышение показателей функции внешнего дыхания после ингаляции бронходилататора.
Предпочтительной ингаляционной техникой является использование небулайзера: не требуется выполнения форсированных инспираторных маневров, обеспечивается хорошая координация вдоха больного с высвобождением препарата, достигается более значительное поступление лекарственного вещества в дыхательные пути. Кроме того, более длительная ингаляция при применении небулайзера (около 10-12 мин) гарантирует бόльшую эффективность препарата, так как успешнее преодолевается барьер, создаваемый мокротой, между лекарственным веществом и рецепторами.
Из β2-агонистов лучше изучены при муковисцидозе эффекты сальбутамола (вентолина) и тербуталина (бриканила). Однократная доза сальбутамола для небулизации 2,5-5 мг, тербуталина – 5-10 мг, кратность ингаляций 4-6 раз в сутки. При обострении муковисцидоза внутривенное назначение β2-агонистов может быть более предпочтительным, чем ингаляции. Данный феномен может быть объяснен тем, что задержка секрета затрудняет доступ ингалируемого препарата в дыхательные пути, в то время как этот фактор не влияет на распределение препарата при парентеральном введении. Средние дозы сальбутамола и тербуталина при внутривенном введении: по 0,5 мг каждые 4-6 часов. При обострении муковисцидоза, особенно с наличием легочно-сердечной недостаточности, лечение не-
600
обходимо начинать с внутривенного введения β2-агонистов с дальнейшим переходом (по мере эвакуации вязкого бронхиального секрета) на ингаляционную терапию.
Единственным доступным антихолинергическим препаратом для небулизации на сегодняшний день остается ипратропиума бромид (атровент). Достоинствами препарата являются безопасность, минимальное число побочных эффектов, большая продолжительность действия, уменьшение под его влиянием продукции бронхиального секрета без изменения его вязкостных свойств. Обычная ингаляционная доза при назначении препарата через небулайзер – 250-500 мг каждые 6- 8 часов.
При обострении муковисцидоза по-прежнему сохраняют свое значение препараты теофиллина. Кроме бронхорасширяющего эффекта, они оказывают положительное влияние на мукоцилиарный клиренс, уменьшают проявления утомления дыхательной мускулатуры, снижают сосудистое сопротивление в малом круге кровообращения, обладают иммуномодулирующим и противовоспалительным действиями [1]. Необходимо помнить о том, что препараты имеют очень узкий терапевтический интервал, т.е. токсические эффекты (дисфункция желудочнокишечного тракта, центральной нервной системы, судороги, аритмии) ассоциированы с концентрацией препарата, ненамного превышающей терапевтическую. В целом препараты теофиллина чаще применяются при неадекватном ответе на другие виды бронхолитической терапии.
Контроль над инфекцией дыхательных путей
Формирование порочного круга бронхиальной обструкции при муковисцидозе (продукция вязкой слизи – обструкция – инфекция) приводит к тяжелому инфекционно-воспалительному процессу, в связи с чем в лечебную программу входят антибиотики, иммуномодуляторы, системнодействующие энзимные препараты, антиэластазы и применение эфферентных методов лечения.
Антибактериальная терапия. Антибиотики являются краеугольным камнем в лечении этой патологии. Антибактериальная терапия назначается с учетом результатов посева мокроты прерывистыми курсами при обострении (от 2 до 4
601
недель) или в плановом порядке (по 2 недели каждые 3 месяца), а также в составе базисной терапии для продления периода ремиссии между обострениями (в тяжелых случаях почти постоянно).
Фармакокинетика антибактериальных препаратов при муковисцидозе изменена: из-за ускорения метаболических процессов в печени и увеличения почечного клиренса максимальная концентрация вводимого антибиотика в сыворотке крови больного муковисцидозом меньше предполагаемой. В связи с этим как дозы антибиотиков, так и длительность курсов существенно отличаются от общепринятых. Доза вводимого антибактериального препарата обычно в 1,5-2 раза превышает среднюю терапевтическую. Во многих случаях используются комбинации из двух, трех и более препаратов, что замедляет развитие антибактериальной резистентности.
Для купирования обострения антибиотики назначаются преимущественно внутривенно в сочетании с эндобронхиальным введением (лечебные бронхоскопии или другие эндотрахеальные методы).
При инфицировании золотистым стафилококком используют антистафилококковые пенициллины (метициллин, оксациллин, клоксациллин, диклоксациллин, флуклоксациллин, нафциллин), цефалоспорины I-II поколений (цефазолин, цефалексин) и линкосамиды (линкомицин, клиндамицин). В случае обнаружения метициллинрезистентных штаммов золотистого стафилококка препаратом выбора является ванкомицин.
При наличии гемофильной палочки применяются амоксициллин в сочетании с клавулоновой кислотой (амоксиклав), цефалоспорины II-III поколений.
Наиболее трудной задачей является лечение хронической синегнойной инфекции. Эта инфекция стала эндемичной для больных муковисцидозом во всех странах. Не только легкие, но и придаточные пазухи носа больных бывают заселены синегнойной палочкой. Она также обнаруживается в испражнениях больных, что, возможно, объясняется проглатыванием некоторого количества мокроты.
602

Основные режимы антибактериальной терапии при инфицировании синегнойной палочкой состоят из сочетания аминогликозидов (гентамицина, тобрамицина, амикацина, нетилмицина) с антисинегнойными пенициллинами (карбенициллином, тикарциллином, азлоциллином, мезлоциллином, пиперациллином), цефалоспоринами III-IV поколений (цефтазидимом, цефотаксимом, цефепимом), монобактамами (азтреонамом) или фторхинолонами (ципрофлоксацином, офлоксацином, норфлоксацином и др.). Карбапенемы (тиенам, меронем, имипинемциластатин) могут использоваться в качестве монотерапии. Обычно применяемые препараты и адекватные дозы представлены в таблице 3.
Таблица 3
Антибиотики, используемые при обострениях бронхолегочных инфекций у больных муковисцидозом (Behrman, 2000)
Микроорганизм |
Антибактериальный |
Доза |
Кратность |
|
|
препарат |
(мг/кг/сут) |
введения |
|
|
Перорально |
|
|
|
Staphylococcus |
Диклоксациллин |
25-50 |
4 |
|
aureus |
Цефалексин |
50 |
4 |
|
|
Клиндамицин |
20 |
3-4 |
|
Haemophilus |
Амоксициллин-клавуланат |
40 |
3 |
|
Influenzae |
Амоксициллин |
50-100 |
3 |
|
Pseudomonas |
Триметоприм-сульфаметоксазон |
20 |
2-4 |
|
Ципрофлоксацин |
15-30 |
2-3 |
||
aeruginosa |
||||
|
|
|
||
|
Внутривенно |
|
|
|
Staphylococcus |
Диклоксациллин |
25-30 |
4 |
|
Цефалексин |
100 |
4 |
||
Aureus |
||||
Клиндамицин |
20 |
4 |
||
|
||||
|
Ванкомицин |
40 |
4 |
|
Pseudomonas |
Тобрамицин |
8-20 |
1-3 |
|
aeruginosa |
Амикацин |
15-30 |
2-3 |
|
|
Нетилмицин |
6-12 |
2-3 |
|
|
Карбенициллин |
400 |
4 |
|
|
Тикарциллин |
400 |
4 |
|
|
Пиперациллин |
300 |
4 |
|
|
Тикарциллин-клавуланат |
400 |
4 |
|
|
Имипинем-циластатин |
45-90 |
3-4 |
|
|
Цефтазидим |
150 |
3 |
|
|
Азтреонам |
150 |
4 |
|
Burkholderia |
Ингаляционно |
|
|
|
cepacia |
Хлорамфеникол |
50-100 |
4 |
|
|
Триметоприм-сульфаметоксазол |
20 |
4 |
|
|
|
|
|
603
Вне обострения рекомендуется длительная ингаляция противосинегнойных препаратов (колестина, гентамицина, тобрамицина, карбенициллина) для подавления постоянно текущего инфекционного процесса. Известно, что аминогликазиды плохо проникают в бронхиальный секрет при парентеральном введении, достигая там лишь 12 % от сывороточной концентрации, поэтому аэрозольное их введение является предпочтительным, поскольку при этом можно достичь высоких концентраций препаратов непосредственно в очаге инфекции (просвете бронхов) без большой опасности системного воздействия. К тому же, это сводит к минимуму риск развития ото- и нефротоксичности.
Чаще используются ежедневные ингаляции гентамицина в дозе 80-160 мг/сут и специальной бессульфатной формы тобрамицина в больших дозах (300 мг 2 раза в сутки), что позволяет достичь максимальных концентраций препарата в мокроте, оказывающих бактерицидное действие на все штаммы синегнойной палочки [6].
Эффективность ингаляционной терапии в большой степени зависит от используемого ингалятора. Сочетание небулайзера и компрессора имеет ряд преимуществ перед ультразвуковым ингалятором. При использовании небулайзера достигается лучшая дисперсия, при которой ингалируемый препарат проникает в более мелкие дыхательные пути; кроме того, ультразвуковой ингалятор несколько нагревает препарат, что может изменить свойства антибиотика.
Рекомендуется следующая последовательность выполнения лечебных процедур: лечение начинают с ингаляции бронхолитика, если это показано; затем ингаляции и/или таблетированный прием муколитика; через 10-15 мин – кинезитерапия, откашливание; после паузы – ингаляция антибиотика.
Принципы иммунокоррекции. Хорошие результаты при лечении больных муковисцидозом, особенно в фазе обострения, дает пассивная иммунотерапия иммуноглобулинами или специфической гипериммунной плазмой (антистафилококковой, антисинегнойной). В связи с имеющимися дефектами Т-клеточного звена иммунитета, при муковисцидозе применяются иимуномодуляторы:
604
Т-активин, тимоген, тималин, тимоптин. Из сравнительно новых препаратов рекомендуются полиоксидоний и ронколейкин.
Полиоксидоний – эффективный активатор иммунитета с выраженными дезинтоксикационными свойствами, обладающий антиоксидантной активностью. Терапию целесообразно назначать со стартовой дозы 12 мг/сут. При необходимости переходят на поддерживающую дозу – 6 мг/сут (через день – два), на курс - от 5 до 10 инъекций.
На современном этапе имеет важное значение иммунотерапия цитокинами. Своевременное и грамотное вмешательство врача, владеющего цитокиновой и антицитокиновой терапией, может существенно уменьшить активность гнойновоспалительного процесса. Рекомбинантные цитокины обладают намного более выраженным и селективным иммунокорригирующим эффектом по сравнению с современными неспецифическими иммуномодуляторами.
Интерлейкин-2 явился первым цитокином, который был идентифицирован и описан на молекулярном уровне как фактор роста Т-клеток [5]. Препаратом ин- терлейкина-2 является Ронколейкин (рекомбинантный интерлейкин-2 человека). Препарат применяют на фоне антибактериальной терапии [5]. Обычно используются следующие альтернативные схемы:
1-я схема: 3-5 внутривенных инфузий по 0,5 мг (500 000 МЕ) на 400 мл физиологического раствора через каждые трое суток;
2-я схема: 10 подкожных инъекций по 0,25 мг (250 000 МЕ) через день в сочетании с местным введением препарата с помощью небулайзера или ультразвукового ингалятора по 0,05 мг (50 000 МЕ) ежедневно в течение 10 дней.
Системная энзимотерапия. Для усиления эффекта антибиотиков в настоящее время предлагается применение системнодействующих высокоактивных энзимов в комбинации с рутином (вобэнзима и флогэнзима) [4].
Основные эффекты системной энзимотерапии: противовоспалительный; противоотечный; фибринолитический; муколитический; иммуномодулирующий; нормализующий реологию крови; повышающий эффективность антибиотиков.
605
Вобэнзим представляет собой комбинацию натуральных высокоактивных энзимов растительного и животного происхождения. Таблетки, драже покрыты кишечнорастворимой оболочкой, содержат 250 мг протеолитических энзимов из растений ананас и папайя и поджелудочной железы животных. В состав одной таблетки входят: панкреатин 100 мг, папаин 60 мг, бромелаин 45 мг, трипсин 24 мг, химотрипсин 1 мг, амилаза 10 мг, липаза 10 мг, рутин 50 мг.
Вобэнзим следует применять на протяжении всего курса антибиотикотерапии по 5 таблеток 3 раза в день. После прекращения курса антибиотикотерапии для восстановления микрофлоры (биоценоза) кишечника препарат рекомендуется назначать по 2-3 таблетки 3 раза в день в течение 2-х недель.
Ингибиторы протеаз. Известно, что главным ингибитором нейтрофильной эластазы является α1-антитрипсин. В настоящее время проходят клинические испытания такие антипротеолитические препараты, как рекомбинантный α1- антитрипсин, даназол, секреторный лейкоцитарный ингибитор протеаз. Последний повышает уровень глутатиона в бронхоальвеолярной жидкости, что увеличивает антиоксидантную способность легких. Это очень важно для больных муковисцидозом, так как защищает α1-антитрипсин легких от инактивации свободными радикалами.
Выраженная антигенемия при хроническом синегнойном воспалении, высокое содержание циркулирующих иммунных комплексов, протеиназ являются показаниями к применению эфферентных методов лечения: плазмафереза, гемосорбции и др. [4].
Улучшение нутритивного статуса
Определяющими для жизни больного муковисцидозом являются характер и степень поражения как легких, так и системы пищеварения, прежде всего – поджелудочной железы и печени.
С учетом длительной антибактериальной терапии, вызывающей дисбиоз кишечника, большую роль в лечении играет применение препаратов, восстанав-
ливающих физиологическое равновесие кишечной микрофлоры, имеющей колос-
сальное значение в пищеварении и всасывании жирорастворимых витаминов.
606
Средства, с помощью которых можно положительно воздействовать на микробиоценоз кишечника, подразделяют следующим образом:
1.Пребиотики – препараты немикробного происхождения, селективно стимулирующие рост и/или активность микрофлоры кишечника (лактулоза и препараты на ее основе – дюфалак, лактусан, нормазе).
2.Пробиотики – препараты микробного происхождения, способствующие регуляции микробной флоры кишечника (бифидумбактерин, лактобактерин, ацилакт, линекс, хилак форте и др.).
3.Синбиотики – комбинированные препараты из пробиотиков и пребиотиков (биовестин-лакто, бифидобак и мальтидофилюс).
4.Бактерийные препараты, обладающие селективной антагонистической активностью (бактериофаги).
5.Продукты питания, содержащие пробиотики.
Применение пре -, про - и синбиотиков позволяет временно создать определенный микробиоциноз, который оказывает благотворное действие на нормальную микрофлору и – в определенной степени – угнетает болезнетворные микроорганизмы.
Экзокринная недостаточность поджелудочной железы считается основной причиной мальабсорбции и мальдигестии жиров и белков при муковисцидозе. Имеется положительная корреляция между стеатореей и креатореей. До 50 % поступившего белка может быть потеряно со стулом. Длительное время коррекция нарушенной функции поджелудочной железы у больных муковисцидозом осуществлялась путем применения панкреатина и комбинированных препаратов, содержащих панкреатин, кишечные ферменты, липотропные вещества, при строгом соблюдении пациентами диеты с ограничением потребления жира.
Новые возможности коррекции панкреатической недостаточности открылись с появлением инкапсулированных микрогранулированных / микротаблетированных ферментов с рН-чувствительной оболочкой, таких как креон, панцитрат, пролипаза, ультраза, панкреаза, зимаза, панкреон и др. После освобождения из твердой желатиновой капсулы (капсула растворяется через 1-2 мин после кон-
607
такта с соляной кислотой) большое количество частиц, содержащих ферменты, равномерно распределяется по желудку. Благодаря этому обеспечивается хорошее смешивание фермента с химусом, что интенсифицирует пищеварительный процесс за счет бόльшей площади контакта. Назначение высокоактивных микросферических ферментов с рН-чувствительной оболочкой позволило рекомендовать больным муковисцидозом высококалорийную диету без ограничения жиров, при этом жиры пищи хорошо перевариваются и практически полностью расщепляются до свободных жирных кислот, фосфолипидов, ди- и моноглицеридов, холестерина. Больным рекомендуется 5-6-разовое питание с повышенным суточным калоражем до 120 %. Микросферические ферменты назначают из расчета 3 000- 5 000 ЕА липазы на 1 кг массы тела, в дальнейшем доза меняется в зависимости от характера стула, копрограммы и динамики массы тела больного.
Суточная доза жирорастворимых витаминов для больных муковисцидозом должна существенно превышать стандартную (табл. 4).
Таблица 4
Рекомендуемые суточные дозы жирорастворимых витаминов для больных муковисцидозом (M. Hodson, 1999; Н.И. Капранов, 2000)
Витамин |
Суточная доза |
|
|
Витамин А |
5-10 тыс. ЕД |
Витамин Д |
400-800 ЕД |
Витамин Е |
200-400 мг |
Витамин К |
5-10 мг |
|
|
Особенно рекомендуются поливитамины с микроэлементами – цинком, селеном и др.
Для профилактики билиарного цирроза печени, желчекаменной болезни, а также для улучшения процессов пищеварения и всасывания применяют холеретики; используют также препараты урсодезоксихолевой кислоты и таурин, регулирующие обмен желчных кислот в печени. Урсодезоксихолевую кислоту (урсосан, урсофальк) применяют в дозе 15-30 мг/кг/сут.
608
Лечение легочных осложнений
При появлении признаков декомпенсации легочного сердца больным назначают оксигенотерапию, диуретики в сочетании с препаратами калия, ингибиторы ангиотензинпревращающего фермента, по показаниям – сердечные гликозиды. Кровохарканье лечится консервативно – гемостатическими средствами, при неэффективности терапии проводится ангиопульмонография с эмболизацией бронхиальной артерии. При возникновении спонтанного пневмоторакса выполняется дренирование плевральной полости с аспирацией воздуха, при рецидивирующем пневмотораксе – химический плевродез или плеврэктомия.
Новые подходы к лечению муковисцидоза
Пересадка легких, комплекса сердце – легкие, печени в ряде случаев является операцией выбора, позволяющей сохранить жизнь пациента. Таких операций в мире выполнено более 450. Большинство больных после операции чувствуют себя удовлетворительно в течение 4-6 лет и ведут близкий к нормальному образ жизни.
Самым перспективным направлением лечения муковисцидоза является создание препарата генной инженерии, который позволит исправить дефект мутантного гена и восстановить нормальную жизнедеятельность клетки. Один из вариантов такого препарата – к-ДНК-овая конструкция, которая в настоящее время проходит клинические испытания в США [4].
Альтернативой генной инженерии может быть разработка препаратов, способных стимулировать синтез, транспорт или функцию неполноценного МВТР. В настоящее время в этом направлении изучается ряд препаратов: аминогликозидные антибиотики, глицерол, фенилбутират натрия, циклопентилксантин, генестин и др. [6].
Возможности профилактики муковисцидоза и прогноз
Предупреждение муковисцидоза представляет значительные трудности. Это связано с тем, что профилактические мероприятия в семье осуществляют только после выявления больного.
609
Прогресс в генетике муковисцидоза очень важен не только с точки зрения перспективы его генной терапии, но и возможности первичной профилактики, т.е. предупреждения рождения больного муковисцидозом ребенка, что в настоящее время может быть гарантировано в 100 % случаев [6].
Пренатальная диагностика и медико-генетическое консультирование являются основными мероприятиями профилактики рождения больных муковисцидозом (первичная профилактика). Проведение успешной пренатальной диагностики определяется тремя основными факторами:
1)информированностью семей, имеющих больных, относящихся к группам «риска» по муковисцидозу, о существовании методики ДНК-диагностики данного заболевания по наличию мутации del F 508 и др.;
2)возможностью своевременной молекулярной диагностики муковисцидоза
уплода;
3)сроком беременности женщины, обратившейся для проведения пренатальной диагностики.
В семьях, где известна мутация гена муковисцидоза, пренатальная диагностика возможна в I триместре беременности. При наличии мутантной хромосомы беременность может быть прервана по желанию родителей. В семьях с неуточненной мутацией гена повторная диагностика проводится при сроках беременности 17-18 недель с использованием молекулярных и биохимических методов. Эффективная дородовая ДНК-диагностика муковисцидоза осуществляется в единичных специализированных центрах (Москва, Санкт-Петербург).
Для ранней диагностики муковисцидоза во многих экономически развитых странах мира существуют программы массового скрининга этого заболевания среди новорожденных. С этой целью проводят анализ хлоридов пота и более чувствительный тест по определению содержания иммунореактивного трипсина в крови новорожденных.
В последние годы все большее внимание привлекает скрининг новорожденных на выявление мутации del F 508 в странах, где частота ее составляет 80-85% (Великобритания, Дания, Бельгия). Применение скрининга в популяциях с более
610
низкой частотой данной мутации считается нерентабельным. Скринирующие исследования среди новорожденных в нашей стране практически не проводятся. Это связано с дефицитом оборудования, реактивов, дороговизной методик. Между тем такие исследования позволили бы выявить не только муковисцидоз на начальных его стадиях, но и обнаружить гетерозиготное носительство [4].
Основой вторичной профилактики являются своевременная диагностика и связанная с ней адекватная терапия заболевания, которая разбиралась выше.
За последние годы при активном участии Российского центра муковисцидоза создана сеть из 26 региональных центров по диагностике и лечению муковисцидоза не только в Европейской части России, но и в Сибири (Новосибирск, Омск, Иркутск и др.) и на Дальнем Востоке (Владивосток). Ближайшие от Чебоксар центры находятся в Казани, Нижнем Новгороде и Ульяновске. Совершенствование диагностики и лечебно-реабилитационных мероприятий привело к тому, что с каждым годом количество взрослых больных муковисцидозом увеличивается [6]. Среди наблюдающихся нами больных имеются пациенты в возрасте
35-43-х лет.
В настоящее время в МЗСР РФ разработана «Национальная программа по муковисцидозу», преследующая цель – совершенствование диагностики, лечения и профилактики этого заболевания в каждом регионе.
Прогноз для выздоровления при муковисцидозе неблагоприятный, для жизни – при среднетяжелых и тяжелых формах заболевания остается серьезным и прямо ассоциируется с качеством диспансерного наблюдения и клинической помощи. До недавнего времени муковисцидоз представлял собой почти исключительно педиатрическую проблему, поскольку больные, как правило, погибали в раннем детстве и крайне редко доживали до подросткового и, тем более, старшего возраста. Случаи муковисцидоза у взрослых рассматривались как редчайшая казуистика.
Одной из основных причин смерти больных муковисцидозом является острая дыхательная недостаточность (ОДН). Как правило, ОДН возникает на фоне уже существующей хронической дыхательной и легочно-сердечной недостаточ-
611
ности. Наиболее частыми причинами развития ОДН являются бактериальные и вирусные инфекции трахеобронхиального дерева, реже – пневмония, ателектаз, пневмоторакс, аритмии, электролитные нарушения, ятрогенные причины (неконтролируемая кислородотерапия, назначение седативных препаратов, хирургические вмешательства и др.).
В последние годы количество тяжелых осложнений и летальных исходов болезни сократилось, а средняя продолжительность жизни увеличилась до 22 лет (по данным центров муковисцидоза). Однако реально с учетом дефектов диагностики и лечения она значительно ниже (число больных старше 18 лет в России составляет 7 % от общего числа пациентов).
Больные с тяжелыми формами заболевания, имеющие серьезные осложне-
ния, как правило, нетрудоспособны. Вместе с тем, большая часть наблюдаемых в центрах муковисцидоза больных являются активными членами общества – учатся или работают.
Еще одной надеждой для больных муковисцидозом и их врачей является генная терапия. Синтезирован ген белка МВТР, проводятся активные попытки ввести этот ген в эпителиальные клетки бронхов. Доказано, что даже 10 % уровень нормального МВТР может обеспечить физиологическую функцию легких. Результаты этих исследований вселяют надежду на то, что к 2010 г. проблема этиологического подхода к лечению муковисцидоза будет успешно решена [4].
Литература
1.Авдеев С.Н., Самойленко В.А., Амелина Е.Л., Чучалин А.Г. Интенсивная терапия при муковисцидозе взрослых // Пульмонология. – 2001. – №3. – С. 87-97.
2.Гембицкая Т.Е. Наследственно детерминированные заболевания легких // Болезни органов дыхания / Под ред. Н.Р. Палеева. – М.: Медицина, 2000. – С. 561569.
3.Гембицкая Т.Е., Желенина Л.А. Современное состояние проблемы муковисцидоза, перспективы лечения // Новые Санкт-Петербургские врачебные ведо-
мости. – 2000. – №3. – С. 54-58.
612
4.Гембицкая Т.Е., Желенина Л.А. Муковисцидоз // Хроническая обструктивная патология легких у взрослых и детей: Руководство / Под ред. А.Н. Кокосо-
ва. – СПб.: СпецЛит, 2004. – С. 124-151.
5.Егорова В.Н., Елькина А.В., Журкин А.Т. и др. Коррекция Ронколейкином иммунной недостаточности при инфекционной патологии // Terra Medica, 2001. – №1. – С. 7-9.
6.Капранов Н.И. Актуальные проблемы диагностики и лечения муковисцидоза // 6-й Национальный Конгресс по муковисцидозу: Сб. статей и тезисов. –
СПб., 2003. – С. 1-15.
7.Davis P., Drumm M., Konstan M.W. Cystic fibrosis // Am. J. Respir. Crit. Care Med. – 1996. – Vol. 154. – P. 1229-1256.
8.Nincovic M.C.F. Soon to be a geriatric problem // Abstr. 25th Cong. ECFS, 2002. – S 12.4. – Р. 322.
613
ГЛАВА 17 ВРОЖДЁННЫЕ ПОРОКИ (АНОМАЛИИ) РАЗВИТИЯ
БРОНХОЛЕГОЧНОЙ СИСТЕМЫ
Врождённые заболевания лёгких являются одной из наиболее сложных диагностических, патогенетических и терапевтических проблем современной пульмонологии. Распознавание их представляет немалые трудности. Нередко их ошибочно принимают за обычные формы хронических неспецифических заболеваний лёгких. Вместе с тем только четкое определение истинного характера патологического процесса обеспечивает успех терапевтических мероприятий.
Диагностический арсенал пульмонологической клиники, обогащение её современными методами функциональных и бронхологических исследований, клинической генетики, биохимии, иммунологии, радиологии и морфологии позволяют расшифровать и дифференцировать различные формы патологии лёгких врождённого и наследственного характера.
Врожденными пороками (аномалиями) развития, по определению Г.И. Лазюка (1983), называют стойкие морфологические изменения органа или организма, выходящие за пределы вариаций их строения и возникающие внутриутробно в результате нарушений развития зародыша, плода или, иногда, после рождения ребёнка как следствие нарушения дальнейшего формирования органов. Подавляющее большинство пороков связано с наследственной патологией.
Сведения о частоте пороков развития среди других заболеваний лёгких противоречивы: на их долю приходится от 1,5 до 50 % и более всей легочной патологии [1, 8]. Столь существенные различия объясняются объективными трудностями дифференциальной и морфологической диагностики антенатальных и постнатальных (приобретённых) изменений в лёгких.
При некоторых аномалиях бронхолёгочной системы тяжёлые клинические признаки наблюдаются сразу после рождения. Другие пороки определенное время протекают бессимптомно и проявляются в более поздние сроки, в том числе у взрослых, главным образом, вследствие присоединения инфекционного процесса или постепенного нарастания функциональных нарушений. Наконец, у части
614
больных на протяжении всей жизни аномалия дыхательной системы может клинически не проявиться.
Классификация
Существует много вариантов классификации аномалий развития лёгких [7, 10]. В НИИ пульмонологии МЗ РФ разработана следующая классификация пороков развития бронхолегочной системы, основанная на морфологических критери-
ях [1, 6]:
I. Пороки, связанные с недоразвитием органа в целом или его анатомических, структурных, тканевых элементов:
1.Агенезия лёгкого.
2.Аплазия лёгкого.
3.Гипоплазия лёгкого простая.
4.Гипоплазия лёгкого кистозная.
5.Синдром Вильямса-Кемпбелла.
6.Врождённая долевая эмфизема.
7.Трахеобронхомегалия (синдром Мунье-Куна).
II. Пороки, связанные с наличием избыточных дизэмбриогенетических формирований:
1.Легочная секвестрация (внедолевая и внутридолевая).
2.Кисты лёгких.
3.Гамартома и другие врождённые опухолевидные образования.
III. Необычное расположение структур лёгкого, которое может иметь клиническое значение:
1.«Зеркальное» лёгкое.
2.Обратное расположение лёгких (в том числе триада ЗивертаКартагенера).
3.Трахеальный бронх.
4.Доля непарной вены.
5.Прочие.
IV. Локализованные нарушения строения трахеи и бронхов:
615
1.Стенозы трахеи и крупных бронхов.
2.Дивертикулы трахеи и бронхов.
3.Трахео(бронхо)пищеводные свищи.
4.Сочетания перечисленных аномалий.
V. Аномалии кровеносных и лимфатических сосудов:
1.Стенозы легочной артерии и её ветвей.
2.Аневризмы легочной артерии и её ветвей.
3.Варикозные расширения легочных вен.
4.Артериовенозные свищи (аневризмы) локализованные.
5.Артериовенозные свищи без чёткой локализации (синдром ОслераРандю).
6.Лимфангиэктазии и другие аномалии лимфатической системы.
Агенезия и аплазия лёгкого
Агенезией легкого принято называть отсутствие его вместе с главным бронхом. Аплазия характеризуется отсутствием ткани лёгкого при наличии рудиментарного главного бронха.
Указанные пороки встречаются редко и во многих случаях сочетаются с другими врождёнными пороками и аномалиями развития.
Во многих случаях агенезия и аплазия легкого как у детей, так и у взрослых, если нет поражения других органов, не имеет выраженных клинических проявлений. В относительно редких случаях сразу после рождения развивается дыхательная недостаточность, которая либо приводит к летальному исходу, либо постепенно компенсируется. У многих больных отмечаются снижение толерантности к нагрузкам, частое развитие ОРЗ, одышка при быстрой ходьбе и беге, цианоз, а также периодический кашель со скудной мокротой, связанный со скоплением бронхиального секрета в культе главного бронха и развитием в ней хронического воспалительного процесса.
При объективном обследовании обнаруживают уплощение половины грудной клетки, сколиоз позвоночника с выпуклостью в здоровую сторону, притупле-
616
ние перкуторного звука и ослабленное дыхание на стороне поражения, особенно выраженное сзади, резкое смещение сердца в больную сторону.
Рентгенологическое исследование показывает сужение легочного поля из-за смещения органов средостения, интенсивное затемнение половины грудной клетки, из-за которого тени сердца и купола диафрагмы не дифференцируются, симптомы пролабирования здорового легкого в противоположную сторону (медиастинальная легочная грыжа), полосу просветления, идущую паравертебрально на стороне поражения за счёт смещения трахеи. Бронхография выявляет смещение трахеи и бронхов в больную сторону, непосредственный переход трахеи в главный бронх при агенезии и культю главного бронха при аплазии легкого. В единственном легком нередко обнаруживаются бронхоэктазы.
Лечение, как правило, не требуется.
Гипоплазия легкого и его долей
Гипоплазией легкого принято называть одновременное недоразвитие бронхов и легочной паренхимы. Большинство авторов разделяют гипоплазию на про-
стую и кистозную.
Простая гипоплазия легкого (доли) представляет собой относительно равномерное уменьшение числа разветвлений бронхов, которые не имеют выраженных кистозных и веретенообразных расширений. Респираторный отдел недоразвит, воздушность его снижена, хотя описаны случаи эмфизематозной трансформации.
Клинические проявления порока зависят от выраженности и длительности вторичного хронического воспаления. Больные часто жалуются на кашель со сли- зисто-гнойной мокротой в умеренном количестве, иногда на одышку при физической нагрузке. При обострениях увеличивается количество мокроты, повышается температура тела, появляются симптомы интоксикации. Физикально обнаруживается асимметрия грудной клетки, сужение межреберных промежутков, высокое стояние диафрагмы – на стороне поражения, а также смещение органов средостения в больную сторону. Нарушение нормального оттока бронхиального секрета
617
при минимальных воспалительных изменениях и даже без них обусловливает постоянные хрипы в области поражённого участка легкого.
При простой гипоплазии долей или сегментов легкого рентгенологически и бронхографически выявляется уменьшение его поражённых отделов. Бронхи резко сближены между собой, в отдельных случаях напоминают «метёлку». Число генераций бронхов может быть уменьшено. Без воспалительных изменений просвет бронхов может быть нормальным или незначительно расширенным. Бронхи непоражённых отделов легкого смещены в сторону гипоплазированных сегментов, а иногда подворачиваются под них, компенсируя их уменьшенный объём.
В других случаях при бронхографии выявляется грубая деформация бронхов поражённой доли и/или заполнение контрастным веществом лишь начальных отделов бронхиальных разветвлений, что не всегда можно связать с длительностью и тяжестью воспалительного процесса.
Ангиопульмонографическое исследование обнаруживает гипоплазию легочных сосудов.
Кистозная гипоплазия (син.: кистозная болезнь легкого, поликистоз, врождённые бронхоэктатические кисты, врождённое «сотовое легкое» и др.) представляет собой аномалию легкого или его части, обусловленную антенатальным недоразвитием легочной паренхимы, бронхов и сосудов с формированием кистозных полостей на различных уровнях бронхиального дерева.
По мнению большинства авторов, кистозная гипоплазия составляет не менее 60-80 % всех пороков развития легкого.
При морфологическом исследовании удалённых легких выявляется множество тонкостенных полостей, выстланных изнутри бронхиальным эпителием (цилиндрическим мерцательным или кубическим), аплазия или уменьшение легочной паренхимы без признаков предшествующего воспаления, отсутствие в субсегментарных и более мелких бронхах хрящевых пластинок, что отличает кистозную гипоплазию от кистозных постнатальных бронхоэктазов.
618
Течение заболевания при кистозной гипоплазии лёгких может быть относительно доброкачественным, однако чаще в связи с неизбежным присоединением инфекции появляются симптомы хронического нагноительного процесса.
Первые проявления болезни очень часто возникают уже в раннем детстве, но иногда пациенты узнают о своём заболевании в юношеском или даже зрелом возрасте. В анамнезе у детей отмечаются повторные респираторные заболевания, ОРВИ, осложнённые бронхитом, затяжные бронхиты, пневмонии. Обычно такие больные предъявляют жалобы на кашель со слизисто-гнойной или гнойной мокротой, одышку, повышение температуры тела, имеются признаки интоксикационного синдрома.
В связи с уменьшением объёма пострадавшего легкого физикально отмечается асимметрия грудной клетки, ограничение дыхательных экскурсий на стороне поражения. Перкуторно в области кистозных изменений выявляется тимпанит. Аускультативно – дыхание жёсткое, над кистами выслушиваются разнокалиберные влажные и сухие хрипы.
Главную роль в диагностике играет рентгенологическое исследование. Характерными рентгенологическими признаками кистозной гипоплазии являются множественные тонкостенные, наслаивающиеся друг на друга просветления (полости) диаметром от 1 до 5 см. Поражённые отделы легкого в большинстве случаев уменьшены в размерах, определяется деформация или усиление легочного рисунка по ячеистому типу. Преобладает односторонняя локализация процесса. Чаще процесс локализуется в нижней доле левого легкого и язычковых сегментах, а также в верхней доле правого легкого.
При бронхографическом исследовании выявляются деформированные и расширенные бронхи, множественные, наслаивающиеся друг на друга тонкостенные полости, частично или полностью заполненные контрастным веществом. Иногда хорошо контрастированное бронхиальное дерево в зоне поражения напоминает украшенную шарами новогоднюю ёлку.
Ангиопульмонография показывает, что при кистозной гипоплазии кровоток в легком либо резко обеднён, либо прекращён. У большинства больных отмечает-
619
ся недоразвитие сосудов малого круга кровообращения в поражённом легком или доле легкого. Субсегментарные и прелобулярные артерии и вены обычно равномерно истончены и огибают кистоподобные образования, как бы подчёркивая их границы.
Бронхоскопически при поражении всего легкого отмечаются смещение трахеи и бифуркации в больную сторону, гнойный эндобронхит; при поражении долей или сегментов – слизисто-гнойный или гнойный эндобронхит.
При исследовании функции внешнего дыхания чаще обнаруживаются смешанные нарушения вентиляции.
Лечение кистозной гипоплазии обычно хирургическое. Операция при кистозной гипоплазии заключается в удалении недоразвитой доли или же всего легкого (пульмонэктомия показана лишь при тяжёлых клинических проявлениях). Больных с установленным диагнозом обычно оперируют в возрасте 7-8 лет и старше.
Консервативное лечение (эндобронхиальные санации, постуральный дренаж, антибактериальная терапия) показано в период обострения с целью подготовки больных к операции, а также пациентам, которым оперативное вмешательство по тем или иным причинам не показано (в случае полного отсутствия симптомов, при двусторонних обширных изменениях, исключающих возможность резекции, при наличии общих противопоказаний к операции на легких).
Синдром Вильямса-Кемпбелла
В основе синдрома Вильямса-Кемпбелла лежит врождённое недоразвитие хрящей и эластического каркаса бронхов среднего калибра, которое приводит к образованию своеобразных симметричных генерализованных бронхоэктазий. Слабость бронхиальной стенки приводит к выраженной дискинезии бронхов – избыточному расширению их просвета во время вдоха и резкому сужению на выдохе веретенообразно расширенных бронхов (в основном субсегментарных), иногда до полного закрытия просвета во время форсированного выдоха.
Эти изменения нарушают вентиляцию и очистительную функцию бронхов, что способствует застою и последующему инфицированию бронхиального секре-
620
та. Таким образом, постоянным спутником заболевания становится хроническое воспаление в бронхах.
Развитие вторичного гнойного обструктивного бронхита в свою очередь вызывает формирование эмфиземы легких, частичную облитерацию мелких бронхиальных разветвлений. На этом фоне могут возникать ателектазы, участки пневмосклероза. При распространённом процессе развивается легочное сердце.
Заболевание проявляется уже в раннем детском возрасте. Начало заболевания у большинства больных сопровождается симптомами тяжёлой пневмонии. В дальнейшем, особенно у детей первых лет жизни, пневмонии бывают 2-3 раза в год.
Однако на первый план у больных с синдромом Вильямса-Кемпбелла выступают симптомы тяжёлого распространённого хронического бронхита. Отмечаются упорный постоянный кашель со скудной мокротой, свистящее дыхание, хроническая интоксикация: плохой аппетит, утомляемость, отставание в массе тела и в росте. Наблюдается деформация концевых фаланг в виде «барабанных палочек» и ногтей по типу «часовых стёкол», деформация грудной клетки в виде асимметричного уплощения, сдавленности с боков и килевидного выпячивания грудины. При перкуссии выявляется коробочный оттенок перкуторного звука, часто неравномерно выраженный. В легких выслушивается множество влажных разнокалиберных и сухих хрипов на фоне обычно жесткого или ослабленного дыхания, удлинённый выдох. Практически у всех больных имеется более или менее выраженная артериальная гипоксемия.
Рентгенологически обычно обнаруживаются двустороннее усиление и груботяжистые распространённые изменения легочного рисунка; возможны неравномерное вздутие отдельных участков легочной ткани, уплотнение стенок бронхов, а также небольшие полости.
Бронхографически выявляются генерализованные веретенообразные расширения субсегментарных и более мелких бронхов, которые коллабируются на выдохе, что хорошо видно при видеозаписи.
621
При бронхоскопии определяется диффузный гнойный эндобронхит, он стойкий и распространяется на все участки бронхиального дерева с преобладанием в нижних отделах легких. Поражение бронхов, как правило, двустороннее и распространённое. Больше поражается правое легкое; наиболее выраженные изменения отмечаются в нижних долях.
При исследовании функции внешнего дыхания обнаруживаются комбинированные формы вентиляционной недостаточности. Кривая форсированного выдоха двухфазная: первая часть направлена вниз и соответствует высокой объёмной скорости выдоха, затем наступает перегиб кривой. Она становится более пологой, что соответствует резкому замедлению тока воздуха, обусловленному коллапсом бронхов.
Диагностика основывается на совокупности клинических симптомов, изменений функции дыхания, типичных рентгенобронхографических признаков.
Лечение состоит в купировании вторичного воспалительного процесса антибактериальными средствами, а также в применении отхаркивающих и общеукрепляющих средств. При декомпенсации легочной функции возможна трансплантация легких.
Прогноз для жизни остается серьёзным ввиду угрозы формирования легочного сердца и развития сердечной недостаточности. Больные обычно погибают от прогрессирующей легочно-сердечной недостаточности.
Врождённая долевая эмфизема
Врождённая долевая эмфизема (син.: лобарная, прогрессирующая эмфизема новорождённых, долевая напряжённая эмфизема и др.) является пороком развития, характеризующимся локальной неполноценностью стенки долевого бронха, аномалией хрящевых колец, гипертрофией слизистой оболочки, что ведёт к формированию клапанного механизма обструкции и острому, подострому или хроническому вздутию соответствующей доли легкого. Резкое увеличение объёма одной из долей обусловливает сдавление остальной части легкого и смещение средостения, приводящее к нарушению вентиляции противоположного легкого и развитию дыхательной недостаточности.
622
Симптомы болезни неспецифичны и могут появиться как в периоде новорождённости, так и в более старшем возрасте. У новорождённых и грудных детей могут наблюдаться острые приступы нарушения дыхания (возникают одышка, беспокойство, цианоз, объём грудной клетки увеличивается при малом объёме дыхательных экскурсий), особенно при кормлении и физическом напряжении. В других случаях, уже у более старших детей, на первый план выступают рецидивирующие пневмонии и бронхиты. У некоторых больных заболевание долго имеет минимальные клинические проявления.
При объективном обследовании больного на стороне поражения можно обнаружить выбухание и отставание грудной клетки при дыхании. Над поражённым участком определяется коробочный оттенок перкуторного звука и ослабленное дыхание при аускультации. Рентгенологические признаки заключаются в повышении прозрачности поражённого участка легкого, обеднении легочного рисунка, расширении межреберных промежутков; в выраженных случаях определяется значительное смещение органов средостения в здоровую сторону. При резком вздутии поражённая доля пролабирует через переднее средостение в противоположную сторону грудной клетки. В соседних с эмфизематозными участками отделах легкого легочной рисунок может быть усилен.
По частоте поражения на первом месте стоит верхняя доля левого легкого, затем – средняя доля и, наконец, верхняя доля правого легкого. Нижние доли поражаются редко. Двусторонние поражения наблюдаются в исключительных случаях.
Бронхоскопия не выявляет, как правило, каких-либо характерных признаков заболевания. В отдельных случаях удаётся обнаружить воспалительные изменения и сужение бронха. В связи с опасностью бронхоскопии при резко выраженной лобарной эмфиземе, особенно у маленьких детей, к ней следует прибегать лишь в целях дифференциальной диагностики. Это целиком относится и к бронхографическому исследованию. По данным различных авторов, на бронхограммах выявляются сужение бронха поражённой доли, плохое заполнение контрастным веще-
623
ством мелких бронхиальных ветвей и сближение бронхов соседних участков легкого. В отдельных случаях долевой бронх полностью непроходим.
Диагностика в типичных случаях нетрудна. Дифференцировать врождённую долевую эмфизему следует с гигантской воздушной кистой, напряжённым спонтанным пневмотораксом, инородным телом бронха с вентильным стенозом с развитием острого вздутия легкого и врождённой диафрагмальной грыжей.
Лечение хирургическое. При синдроме острой дыхательной недостаточности у новорождённых показано неотложное оперативное вмешательство – удаление поражённой доли. В случаях, когда симптомы нарастают постепенно и дыхательные расстройства выражены умеренно, в том или ином возрасте можно выполнить плановую операцию.
Трахеобронхомегалия
Трахеобронхомегалия (син.: синдром Мунье-Куна, трахеобронхомаляция, трахеоцеле) относится к редким порокам развития и представляет собой резко выраженное расширение трахеи и главных бронхов вследствие врождённой неполноценности их стенок (недоразвитие эластических и мышечных волокон трахеи и главных бронхов).
Патоморфологические изменения заключаются в диффузном расширении трахеи, иногда и главных бронхов, часто с множественными мешотчатыми дивертикулами. При этом наблюдается атрофия продольных эластических волокон и истончение мышечных пучков. Гистологические исследования выявляют количественный дефицит и изменения эластических волокон мембранозной части трахеи и истончение мышечных волокон.
Синдром Мунье-Куна нередко комбинируется с другими аномалиями и пороками развития легких.
Данный синдром наблюдается преимущественно у мужчин, клинически может не проявляться в течение ряда лет и впервые диагностироваться в возрасте старше 20 лет, как правило, вследствие присоединения инфекционного процесса и развития вторичного хронического воспаления.
624
Основными жалобами больных являются постоянный кашель приступообразного или лающего характера с выделением большого количества слизистогнойной или гнойной мокроты, боли в груди, частые простудные заболевания. Характерным признаком является кашель, напоминающий блеяние козы, что объясняется патологической податливостью стенок трахеи и бронхов и вибрацией их мембранозной части. При объективном обследовании обнаруживаются: перкуторно чередование участков коробочного звука с участками притупления; аускультативно – местами бронхиальное дыхание, разнообразные хрипы, более ограниченные в периоде ремиссии и распространённые при обострении воспалительного процесса.
На рентгенограммах, томограммах, трахеограммах отмечаются резкое увеличение фронтального размера трахеи и главных бронхов, неровность, фестончатость и деформация их контуров. При кашле мембранозная стенка пролабирует, достигая передней хрящевой части. При ограниченном поражении возникают дивертикулы, которые особенно чётко выявляются при трахеографии. В результате нарушения очистительной функции трахеи и застоя гнойной мокроты в нижних отделах легких могут формироваться вторичные бронхоэктазии.
Исследование функции лёгких и газового состава крови выявляет у всех больных нарушение функции внешнего дыхания по смешанному типу и гипоксемию.
При бронхоскопии наблюдаются необычно широкий просвет трахеи и главных бронхов, выпячивания в промежутках между полукольцами трахеи и в мембранозной её части, пролабирование задней стенки трахеи, симптом недостаточной освещённости бронхоскопического поля, признаки гнойного трахеобронхита.
Лечение порока при диффузных изменениях трахеи и бронхов консервативное (антибактериальная терапия, бронхоскопические санации при обострениях). Локальные одиночные дивертикулы подлежат резекции.
Течение и прогноз болезни могут быть различными.
625
Легочная секвестрация
Секвестрация легких является пороком развития с двумя основными признаками: отсутствием связи поражённого участка с бронхиальной системой легкого (то есть рудиментарный зачаток легкого, отделившийся на ранней стадии эмбриогенеза от нормальной легочной закладки, не имеет сообщения с бронхом) и кровоснабжением из аномальных артерий, отходящих непосредственно от аорты или её основных ветвей.
Секвестрированный участок может располагаться внутри доли легкого (внутридолевая секвестрация) или вне основной части легкого, с которым он связан посредством фиброзной перемычки. Во втором случае говорят о добавочной доле или внелегочной секвестрации.
При внутридолевых секвестрациях аномальный участок расположен среди нормальной легочной ткани и не имеет плеврального отграничения от окружающей паренхимы. Альвеолярная вентиляция осуществляется через периферические коммуникации. Снабжение кровью происходит от надили поддиафрагмальной аорты или их ветвей, венозный отток – через легочную вену и, в исключительных случаях, через непарную вену.
Наиболее часто внутридолевая секвестрация локализуется в заднебазальных сегментах нижней доли, несколько чаще с левой стороны.
Макроскопически внутридолевая секвестрация представляет собой желтоватый непигментированный участок легкого плотной консистенции с одной или несколькими кистами. При гистологическом исследовании обнаруживаются элементы легочной ткани и бронхов: альвеолы, мерцательный эпителий, хрящ, расширенные бронхи, а также нередко признаки воспаления.
При внедолевой секвестрации аномальная легочная ткань отделена от нормального легкого и покрыта собственной плеврой. Артериальное кровоснабжение осуществляется непосредственно из большого круга кровообращения с вариациями, аналогичными таковым при внутридолевой секвестрации. Отток венозной крови осуществляется через систему непарной вены.
626

При внелегочных секвестрациях аномальные участки легкого чаще располагаются в грудной полости над диафрагмой, реже в брюшной полости. Секвестральный участок может находиться в толще нижней легочной связки и диафрагмы.
Внелегочно расположенные секвестрированные участки могут срастаться с соседними органами (пищеводом, желудком и др.), иногда нарушая их функцию. В отдельных случаях внедолевой секвестрации сопутствуют другие пороки развития легкого. Морфологические изменения при обоих видах секвестрации аналогичны.
Клиническая картина данного порока обусловлена воспалительными изменениями в поражённом участке ткани. Главные симптомы: кашель, лихорадка, повторные инфекции дыхательных путей, вспышки пневмоний. Многие больные жалуются на утомляемость.
Рентгенологическое исследование выявляет гомогенное или негомогенное затемнение. В некоторых случаях удается обнаружить кистозные изменения. На рентгенограммах секвестрированный участок легких наиболее часто проецируется в области 10-го сегмента слева или справа и в прямой проекции может быть прикрыт тенью сердца, поэтому при подозрении на такую патологию рекомендуется обязательно проводить рентгенологическое исследование в боковой проекции. Томография иногда позволяет выявить кистозные изменения, не обнаруживаемые на рентгенограммах, а также аберрантный* сосуд, патогномоничный для данного порока.
Подозрение на секвестрацию должно возникнуть при рецидивирующей пневмонии в одном и том же участке легкого и сохранении рентгенологических изменений после ликвидации острого воспаления.
Окончательно подтверждает диагноз обнаружение аберрантного сосуда иногда при томографическом исследовании и, как правило, при аортографии.
Лечение только оперативное.
* Аберрантный (аберрация, лат. aberratio – уклонение) – отклонения от нормы, перестройка, изменение направления сосуда.
627
Кисты легких
Кисты легких представляют собой воздушные или заполненные жидкостью полости.
Различают приобретённые и врождённые кисты лёгких. Приобретённые (ложные кисты, кистоподобные образования в лёгких) образуются при деструктивных пневмониях различной этиологии. Врождённые кисты лёгкого (истинные кисты легкого) возникают в результате нарушения развития бронха (бронхиальная или бронхогенная киста). Бронхогенные кисты содержат в своей стенке элементы бронхиальных структур; эпителий, выстилающий кисту, способен продуцировать жидкость. Кисты легочного происхождения выстланы альвеолярным эпителием и расположены в периферических отделах легкого. Как вариант кистозного перерождения описано «сотовое легкое» с множеством мелких полостей. Врождённые кисты легких у детей нередко сочетаются с другими пороками развития легких.
Врождённые кисты легких могут быть одиночными и множественными (поликистоз), бессимптомными и могут обнаруживаться при случайном рентгенологическом исследовании.
У детей, особенно раннего возраста, болезнь часто протекает как рецидивирующая пневмония в одном и том же участке легкого. Каждый рецидив длительный и весьма часто сопровождается вовлечением регионарных лимфатических узлов.
Физикальные изменения при неосложнённых кистах отсутствуют, при пневмонических обострениях обычно отмечаются укорочение перкуторного звука, ослабленное дыхание и сравнительно небольшое количество влажных хрипов. В периоде ремиссии состояние больных удовлетворительное, симптомов интоксикации и снижения показателей физического развития нет.
При бронхоскопическом исследовании выявляется эндобронхит. В отдельных случаях обнаруживают аномальное деление бронхов, что подтверждает врождённый генез кисты.
628
Врождённые кисты наблюдаются наиболее часто в верхней доле левого легкого, значительно реже в других долях.
Рентгенологически воздушные кисты выглядят как чётко очерченные одиночные или множественные просветления на неизменённом легочном поле или на фоне усиленного и/или деформированного легочного рисунка. При наслаивании полостей друг на друга поражённый участок легкого становится ячеистым. При пневмонических обострениях рентгенологически выявляется картина воспалительной инфильтрации легочной ткани в пределах сегмента или доли с расширением корня легкого за счёт увеличения лимфатических узлов. Обратное развитие замедленное, и нередко, особенно при множественных кистах, остаются стойкие изменения, рентгенологически – в виде крупноочаговых теней различной формы. Увеличение лимфатических узлов при этом сохраняется. При бронхографии кисты легких контрастируются относительно редко.
Типичным осложнением является нагноение. Клиническая картина при этом характеризуется острым воспалением в лёгком. Появление в полости кисты жидкости (слизь, гной) может клинически проявляться кашлем с мокротой. Если же связь с бронхами нарушена, то кашля может не быть, имеются симптомы интоксикации, полость кисты заполняется жидкостью и киста увеличивается.
Рентгенологическая картина осложнённой кисты характеризуется округлой полостью с уровнем жидкости и газовым пузырём над ним. Стенки кисты во время воспаления утолщаются, появляется перифокальная инфильтрация. Наличие вентильного стеноза дренирующего бронха обусловливает вздутие кисты. Киста может быть очень больших размеров, сдавить прилежащие отделы легкого, сместить органы средостения.
Значительно реже встречаются такие осложнения, как спонтанный пневмоторакс, пиопневмоторакс, кровохарканье и кровотечение.
При развитии пневмонии проводится соответствующее лечение. При нагноении или других осложнениях производят энуклеацию кисты или экономную резекцию легкого, реже – лобэктомию. Показания к операции при бессимптомных истинных кистах легкого относительны.
629
Гамартома
Гамартома легкого (хондрома, гамартохондрома) представляет собой типичную доброкачественную опухоль эмбрионального происхождения. Внешне это плотное округлое образование диаметром до 5 см, состоящее преимущественно из хрящевой ткани с включением кистовидных полостей, выстланных цилиндрическим или кубическим эпителием.
Как правило, гамартома легкого протекает бессимптомно и её обнаруживают при случайном рентгенологическом исследовании. Обычно она имеет округлую форму, иногда с волнистыми очертаниями. Тень опухоли довольно интенсивная и гомогенная. Типичным признаком гамартомы является наличие в ней известковых включений.
Чаще всего гамартома локализуется в кортикальном слое легкого, не вызывая каких-либо функциональных нарушений, реже – на внутренней поверхности бронха. В последнем случае возможны клинические проявления в виде гиповентиляции, ателектаза, развития вторичного инфекционного процесса.
Диагноз выставляется на основании результатов трансторакальной пункционной биопсии. При эндобронхиально растущей гамартоме диагноз устанавливают бронхоскопически и подтверждают щипцовой биопсией.
При уверенности в диагнозе внутрилегочной гамартомы показания к операции относительны, хотя в некоторых случаях из-за трудностей дифференциации с периферическим раком легкого, особенно у пожилых курящих мужчин, иногда осуществляют торакотомию и вылущивание патологического образования. Эндобронхиальные гамартомы чаще всего удаляют эндоскопическими методами, среди которых наиболее совершенным следует считать лазерную деструкцию [1, 5]. Удаление образования путём бронхотомии или резекции бронха в настоящее время производят редко.
«Зеркальное» лёгкое
«Зеркальное» лёгкое – это одинаковое, симметричное подразделение обоих легких на доли (двухили трёхдолевое строение легких с обеих сторон). Данное состояние представляет собой не столько порок, сколько крайнюю форму измен-
630
чивости, как правило, без клинических проявлений, случайно распознаваемую при бронхографическом исследовании или на аутопсии.
Синдром Зиверта-Картагенера
Синдром Зиверта-Картагенера – это триада, включающая обратное расположение внутренних органов (situs inversus), поражение околоносовых пазух (гипоплазия или врождённое отсутствие их, параназальный синусит) и бронхоэктатическую болезнь.
В последние годы установлено, что с обратным расположением внутренних органов генетически связан дефект ультраструктуры реснитчатого эпителия (синдром неподвижности ресничек), определяющий нарушение мукоцилиарного клиренса и тем самым создающий основу формирования хронической бронхолегочной патологии, а также неподвижность жгутиков сперматозоидов. Это обстоятельство и объясняет сочетание при триаде Зиверта-Картагенера обратного расположения внутренних органов с хроническим нагноительным процессом в бронхиальном дереве (бронхоэктазии) и в околоносовых пазухах, а также с бесплодием у мужчин.
Клинические симптомы часто возникают в раннем возрасте. В основном больные с синдромом Зиверта-Картагенера жалуются на кашель с отделением гнойной мокроты. Физикальные изменения ярко выражены. Как правило, с двух сторон выслушивается множество влажных, обычно звучных, разнокалиберных хрипов. Перкуторный звук над патологически изменёнными участками лёгких укорочен. Тоны сердца прослушиваются в правой половине грудной клетки. Печень, как правило, пальпируется слева. Многие дети с синдромом ЗивертаКартагенера отстают в физическом развитии. У наиболее тяжёлых больных отмечается утолщение ногтевых фаланг пальцев рук («барабанные палочки»).
Среди клинических симптомов большое значение имеет поражение носоглотки. Наиболее часто поражаются верхнечелюстные полости (гайморовы пазухи). У таких больных отмечаются хронический насморк, затруднённое носовое дыхание.
631
Тяжесть состояния больных с синдромом Зиверта-Картагенера в значительной степени определяется выраженностью бронхоэктатического синдрома и дыхательной недостаточности. У многих больных с этой патологией имеет место одышка в покое или при небольшой физической нагрузке. При функциональном исследовании выявляются признаки вентиляционных нарушений обструктивного и рестриктивного характера. В тяжёлых случаях отмечается гипоксемия.
При рентгенологическом обследовании определяется обратное расположение внутренних органов, отмечаются уменьшение объёма и грубая тяжистость, иногда ячеистость легочного рисунка в поражённых, обычно нижних, отделах легких.
Бронхоскопическая картина отражает обратное расположение бронхиального дерева, характерно наличие диффузного гнойного эндобронхита.
При бронхографии определяются мешотчатые или цилиндрические бронхоэктазы и деформирующий бронхит. Эти изменения, как правило, двусторонние.
При лечении больных с синдромом Зиверта-Картагенера основное внимание уделяется противомикробной терапии в связи с наличием инфекционного процесса в легких и носоглотке. Нарушение функциональной активности ресничек, являющееся важнейшим механизмом мукоциллиарного транспорта, диктует необходимость постоянного применения у таких больных методов и средств, направленных на поддержание дренажной функции бронхов (постуральный дренаж, массаж грудной клетки, ингаляция и пероральный приём муколитических и отхаркивающих препаратов, эндотрахеальные методы введения антибиотиков, в том числе лечебная бронхоскопия).
Так как в основе патологического бронхолегочного процесса лежит генерализованный тканевой дефект, к оперативному лечению бронхоэктазии у больных с синдромом Зиверта-Картагенера необходимо подходить с большой осторожностью. Мы, как и некоторые другие клиницисты [11], полагаем, что лечение таких больных целесообразно ограничить преимущественно консервативными методами. Существует мнение, что и при лечении носоглотки у больных следует избегать повторных хирургических вмешательств.
632
Трахеальный бронх
Трахеальный бронх представляет собой аномальную бронхиальную ветвь (представляет собой бронх I сегмента), отходящую от грудного отдела трахеи, чаще справа. Как правило, он вентилирует часть верхней доли. Крайне редко встречается сверхкомплектный (истинный добавочный) трахеальный бронх, который может заканчиваться слепо кистозной полостью либо участком легочной паренхимы. Трахеальный бронх может быть рудиментарным. В таком случае образуется врождённый дивертикул трахеи.
В большинстве случаев аномалия протекает бессимптомно и обнаруживается случайно при бронхоскопии и/или бронхографии.
Лечение хирургическое. Показания к операции появляются тогда, когда трахеальный бронх или дивертикул трахеи инфицируется, возникают стеноз устья с последующим нагноением, вздутие дивертикула со стенозом трахеи и др. Операция заключается в резекции трахеального бронха с наложением циркулярной прошивной лигатуры на основание либо ушиванием дефекта в трахее узловыми швами.
Доля непарной вены
Доля непарной вены (син.: доля Райсберга) характеризуется тем, что верхнемедиальная часть верхней доли правого лёгкого оказывается как бы отшнурованной необычно расположенной непарной веной и располагается медиальнее последней в кармане, образованном медиастинальной плеврой и вдающемся в средостение. Чаще всего порок клинически не проявляется и обнаруживается случайно при рентгенологическом исследовании. Лишь в редких случаях в отшнурованной части верхней доли в связи с не вполне нормальными условиями функционирования развивается воспалительный процесс.
Рентгенологически на медиальной части верхней доли можно обнаружить каплевидную тень поперечного среза непарной вены, а также линейную тень дупликатуры медиастинальной плевры, идущую от непарной вены по направлению к корню.
633

Стенозы трахеи и крупных бронхов.
Стенозы трахеи и бронхов являются редкими пороками. Их подразделяют на две группы: компрессионные стенозы, обусловленные давлением на трахею и бронхи извне, и стенозы, вызванные образованием внутренней диафрагмы. Во втором случае стенозы нередко сочетаются с гипоплазией легкого или его доли.
Компрессию трахеи могут вызвать аномалии аорты и её ветвей, аномалии легочной артерии, увеличение вилочковой железы, врождённые кисты и опухоли средостения. Истинный врождённый стеноз трахеи обусловлен пороком развития хрящей, образующих на большом протяжении замкнутую трубку, лишённую мембранозной части. М.И. Перельман (1972) предлагает их подразделять на три вида: ограниченный циркулярный, воронкообразный и распространённый циркулярный стеноз. Как правило, главные бронхи при этом не страдают.
В клинической картине стеноза трахеи на первый план выступают расстройства акта дыхания. Наиболее важным симптомом является затруднение дыхания по типу стридора*. Он возникает нередко сразу же после рождения или появляется в первые недели жизни (врождённый стридор).
Чистого экспираторного стридора при стенозе трахеи вообще не бывает; при тяжелом стенозе может быть смешанный стридор.
При высокой степени сужения отмечаются участие вспомогательной мускулатуры, втяжение межреберных промежутков грудной клетки, одышка, цианоз. У таких детей кормление может сопровождаться поперхиванием, отставанием в физическом развитии, часто наблюдаются кашель, осиплость голоса, «беспричинные» приступы асфиксии или цианоза.
Следует добавить, что в периоде новорождённости расстройства дыхания при стенозах трахеи могут отсутствовать или быть едва заметными, проявляясь симптомами недостаточности кровообращения или раздражения центральной нервной системы. В связи с этим у новорождённых стенозы трахеи распознаются крайне редко.
* Стридор – свистящий звук, возникающий главным образом во время вдоха, обусловленный резким сужением просвета гортани, трахеи или бронхов; наблюдается, например, при опухолях, аспирации инородных тел, параличе голосовых связок.
634
В более старшем возрасте проявления врождённого стеноза впервые развиваются на фоне острого респираторного заболевания.
Компрессионные стенозы трахеи чаще всего обусловлены двойной дугой аорты. Находящаяся в аортальном окне трахея легко сжимается, особенно в области мембранозной части, что можно видеть во время трахеоскопии.
Многообразие симптоматики и раннее присоединение инфекционных осложнений затрудняют клиническое распознавание стеноза. Объективными методами исследования, позволяющими обнаружить стеноз, являются рентгенография и томография трахеи в боковой проекции.
При контрастной трахеографии можно получить более конкретные данные. Нужно, однако, помнить, что при стенозах трахеи контрастное исследование небезопасно.
При компрессионных стенозах, вызванных аномалией крупных сосудов, исчерпывающие данные даёт аортография.
Наиболее точно диагноз может быть установлен при трахеобронхоскопии. При фиброзных стенозах просвет трахеи представляется в виде узкого кольца, окаймленного белесоватым хрящом; перепончатая часть отсутствует. Протяженность такого стеноза зависит от количества аномально развитых колец. Эндоскопическая картина при стенозах трахеи, вызванных сосудистыми аномалиями, характеризуется выбуханием передней и боковых стенок надбифуркационной части трахеи, суживающим её просвет. При этом определяется чёткая пульсация стенок. Стенки трахеи в зоне стеноза остаются податливыми и бронхоскоп можно легко провести до бифуркации.
Стенозы крупных бронхов встречаются редко и проявляются в основном рецидивирующей инфекцией в соответствующем отделе легочной ткани в связи с нарушением очистительной функции бронхиального дерева.
Лечение стенозов трахеи и бронхов хирургическое (резекция суженного участка и наложение анастомоза). При врождённой внутритрахеальной перепонке возможно её удаление через бронхоскоп.
635
Дивертикулы трахеи и бронхов
Врождённые дивертикулы представляют собой рудиментарные добавочные бронхи, а также выпячивания в мембранозном отделе и между хрящевыми кольцами трахеи, обнаруживаемые при трахеобронхомегалии, связанные с неравномерностью дефицита эластических и мышечных элементов её стенки.
Дивертикул трахеи является рудиментом трахеального бронха и представляет собой недоразвитый добавочный сердечный бронх. Дивертикулы трахеи и бронхов клинически не проявляются и обнаруживаются случайно при бронхологическом (бронхоскопия или бронхография) или патологоанатомическом исследовании. Иногда застой слизи в дивертикуле ведёт к вялотекущему воспалительному процессу, сопровождающемуся умеренным кашлем с небольшим количеством слизисто-гнойной мокроты, в редких случаях – с примесью крови.
Необходимость в хирургическом лечении возникает редко.
Трахео(бронхо)пищеводные свищи
Трахео(бронхо)пищеводные свищи – это врождённые патологические сообщения между трахеобронхиальным деревом и пищеводом.
Трахео(бронхо)пищеводные свищи проявляются при первом же кормлении ребёнка приступами удушья, кашля с выделением принятой жидкости, цианоза, вздутием желудка из-за попадания в него воздуха через свищ. В дальнейшем быстро присоединяется тяжёлая аспирационная пневмония, как правило, с летальным исходом. При небольших размерах свищевого хода постоянная аспирация небольших количеств пищи ведёт к развитию хронического нагноительного процесса в бронхах с развитием бронхоэктазов. Трахео(бронхо)пищеводные свищи часто сочетаются с атрезией пищевода.
Диагноз уточняется с помощью контрастного и эндоскопического исследования трахеобронхиального дерева и пищевода.
Лечение хирургическое. При наличии значительного свища у новорождённых операцию следует производить немедленно. Вмешательство состоит в разобщении и ушивании стенок трахеи (бронха) и пищевода. При хроническом течении легочного процесса показано удаление необратимо изменённой части лег-
636
кого. Результаты зависят от срока операции: они тем лучше, чем раньше произведено вмешательство.
Стенозы легочной артерии и её ветвей
Стенозы легочной артерии и её ветвей являются редкой аномалией, приво-
дящей к легочной гипертензии, гипертрофии и затем к недостаточности правого желудочка сердца.
Чаще всего больные предъявляют жалобы на одышку, в далеко зашедших случаях – на увеличение и болезненность печени, задержку жидкости, отёки. Объективно определяют цианоз, физикально, рентгенографически и электрокардиографически – гипертрофию правого желудочка, увеличение печени. Точный диагноз устанавливают с помощью ангиопульмонографии и зондирования легочной артерии. Лечение разработано недостаточно.
Врождённые аневризмы легочной артерии и её ветвей, варикозные рас-
ширения легочных вен являются казуистикой. Клинически не проявляются, выявляются случайно при ангиопульмонографии. Лечение не требуется.
Артериовенозные свищи и аневризмы
Артериовенозная аневризма легочных сосудов – врожденное патологическое сообщение между артериями и венами лёгких, через которое происходит сброс неоксигенированной (венозной) крови в артериальное русло, в результате чего развивается гипоксемия.
Такое патологическое сообщение между артериями и венами лёгких может локализоваться на различных уровнях. При сообщениях между сосудами крупного и среднего калибра говорят об артериовенозных свищах. При поражении мелких сосудов (сегментарных и субсегментарных) они расширяются по типу аневризм и образуют конгломерат, который принято называть артериовенозной аневризмой.
Преимущественная локализация порока – нижние доли легких. Клинические проявления связаны с хронической гипоксемией. Больные жа-
луются на одышку, снижение работоспособности, иногда кровохарканье. При ос-
637
мотре отмечаются цианоз кожных покровов и слизистых оболочек, деформация концевых фаланг по типу «барабанных палочек» и ногтей по типу «часовых стёкол». Аускультативно над областью сосудистого свища выслушивается слабый систоло-диастолический шум. При исследовании крови выявляется снижение РаО2, иногда вторичный эритроцитоз.
При рентгенотомографическом исследовании обнаруживают интенсивное затемнение неправильной формы, связанное с расширенными извитыми сосудами. Диагноз верифицируют путём контрастирования легочной артерии, при котором визуализируются приводящий и отводящий сосуды, патологическое сосудистое образование и констатируется непосредственный переток контраста из артерии в вену.
Лечение хирургическое, и заключается в удалении части легкого, содержащей аневризму [9]. Однако в последние годы осуществляют эмболизацию арте- рио-венозного свища и приводящей артериальной ветви синтетическим материалом через зонд, введённый в соответствующее разветвление легочной артерии [3].
Литература
1.Болезни органов дыхания / Под ред. Н.Р. Палеева. – М.: Медицина, 2000.
–С. 549-560.
2.Лазюк Г.И. Пороки развития. – В кн.: БМЭ, 3-е изд., 1983. – Т. 20. –
С. 260-263.
3.Некласов Ю.Ф., Бобров Е.И., Осипов А.М. и др. Эндоваскулярная эмболизация артериовенозных фистул легких // Вестник хирургии. – 1991. – № 3. –
С. 50.
4.Перельман М.И. Хирургия трахеи. – М.: Медицина, 1972. – 208 с.
5.Полякова И.В. Бронхоскопические лазерные оперативные вмешательства при патологических образованиях бронхов: Автореф. дис. … канд. мед. наук. – Санкт-Петербург, 1993.
6.Путов Н.В., Левашов Ю.Н., Бобков А.Г. Кистозная гипоплазия легких. – Кишинёв: Штиинца, 1982.
638
7.Рыжков Е.В. Дизонтогенетические и приобретённые хронические заболевания легких. – М., 1976.
8.Сазанов А.М., Цуман В.Г., Романов Г.А. Аномалии развития легких. – М.: Медицина, 1981.
9.Сотникова Г.Д., Лукина О.Ф., Марков Б.А., Поляев Ю.А. Артериовенозные свищи легких у детей // Грудная и сердечно-сосудистая хирургия – 1990. –
№6. – С. 50.
10.Стручков В.И, Воль-Эпштейн Г.Л., Сахаров В.А. Пороки развития легкого у человека. – М.: Медицина, 1969.
11.Dietzsch H. Storungen der Zilien-Motilitat. – Kinderarztl. Prax., 1982, Bd 50, N. 2, S. 71-76.
639
ГЛАВА 18 ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ. ЛЕГОЧНАЯ ГИПЕРТЕНЗИЯ.
ЛЕГОЧНОЕ СЕРДЦЕ. ХРОНИЧЕСКОЕ ЛЕГОЧНОЕ СЕРДЦЕ (КОМПЕНСИРОВАННОЕ И ДЕКОМПЕНСИРОВАННОЕ). ЛЕЧЕНИЕ ЛЕГОЧНО-СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
Дыхательная недостаточность (ДН), повышение давления в малом круге кровообращения (легочная гипертензия – ЛГ) и связанное с ним развитие хронического легочного сердца (ХЛС) с последующей его декомпенсацией являются грозными осложнениями диффузных заболеваний легких (ДЗЛ), прежде всего хронической обструктивной болезни легких (ХОБЛ). Именно с этими осложнениями связана высокая смертность при ХОБЛ, которая ставит ее по социальному значению в один ряд с такими заболеваниями, как ишемическая болезнь сердца и гипертоническая болезнь.
ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ
ДН при ДЗЛ предшествует развитию ЛГ и ХЛС и является важнейшим патогенетическим фактором их развития. Прежде чем рассмотреть клинические аспекты ДН, необходимо вспомнить, что представляет собой дыхание.
Под дыханием понимается непрерывный биологический процесс, в резуль-
тате которого организм потребляет из внешней среды кислород и выделяет в нее углекислый газ и воду. Различают следующие единые в функциональном отношении звенья дыхания, обеспечивающие газообмен: 1) система внешнего (легочного)
дыхания; 2) система кровообращения; 3) кровь, обеспечивающая транспорт газов к тканям; 4) внутреннее, или тканевое, дыхание; 5) нейрогуморальный аппарат, обеспечивающий регуляцию функции дыхания.
В клинике понятия «дыхание» и «внешнее дыхание», а следовательно, «дыхательная недостаточность» и «недостаточность внешнего дыхания» употребляются как синонимы. Это связано с тем, что в подавляющем большинстве случаев нарушения газообмена (дыхания) происходят на уровне внешнего дыхания, в то время как изменения в остальных звеньях дыхательной цепи являются вторичными.
640
Внешнее дыхание – это газообмен между наружным воздухом и кровью легочных капилляров. Внешнее дыхание обеспечивается: 1) вентиляцией легких, то есть прохождением наружного воздуха до альвеол и из альвеол наружу; 2) диффузией газов через альвеолярно-капиллярную мембрану, то есть проникновением кислорода из альвеол в кровь легочных капилляров и углекислого газа из легочных капилляров в альвеолы; это происходит благодаря разнице между парциальным давлением газов в альвеолярном воздухе и их напряжением в крови; 3) перфузией, то есть кровотоком по легочным капиллярам, что обеспечивает газообмен между альвеолами и кровью.
Недостаточность внешнего дыхания, или просто ДН, – это такое со-
стояние, при котором не обеспечивается нормальный газовый состав крови, то есть достаточная оксигенация крови, протекающей через легкие, и необходимое освобождение ее от углекислоты. Исходя из этого определения, любая ДН должна сопровождаться нарушением газового состава крови. Однако начальные проявления ДН не вызывают заметных газовых нарушений, поскольку достаточный газообмен обеспечивается усиленной работой дыхательной мускулатуры. В таких случаях ДН проявляется одышкой. В дальнейшем компенсаторное усиление работы дыхательной мускулатуры уже не в состоянии обеспечить достаточный газообмен и развиваются гипоксемия, а затем и гиперкапния.
В соответствии с теми механизмами, которые обеспечивают внешнее дыхание, к ДН могут привести: 1) вентиляционные нарушения; 2) нарушение диффузии дыхательных газов; 3) нарушение перфузии, то есть кровообращения в сосудах малого круга.
Наиболее частыми причинами ДН в связи с нарушениями вентиляции явля-
ются:
1. Болезни легких и бронхов (хроническая обструктивная болезнь легких, бронхиальная астма, массивные пневмонии, распространенные формы туберкулеза легких, ателектаз легкого, идиопатический фиброзирующий альвеолит и др.).
641
2.Заболевания центральной нервной системы, приводящие к угнетению дыхательного центра (острые и хронические нарушения мозгового кровообращения, мозговая травма, опухоли головного мозга, прием морфия, барбитуратов и др.).
3.Поражения дыхательной мускулатуры и нарушения ее иннервации (при ботулизме, миастении, заболеваниях спинного мозга и др.).
4.Ограничение движений грудной клетки и легких (выраженный кифосколиоз, болезнь Бехтерева, плевральные сращения, плевральные выпоты, пневмоторакс, асцит, паралич диафрагмы, высокая степень ожирения, синдром Пиквика
идр.).
Нарушения вентиляции, развивающиеся при перечисленных выше заболеваниях, приводят к ДН, то есть нарушению газообмена за счет уменьшения поступления кислорода в альвеолы и затруднения выделения из них углекислого газа, что нарушает диффузию газов.
Нарушения диффузии дыхательных газов, приводящие к ДН, развиваются при отеке легких, воспалении, интерстициальном фиброзе, лимфостазе, при которых утолщается альвеолярно-капиллярная мембрана. Для диффузионной недостаточности характерно наличие гипоксемии, так как прежде всего нарушается диффузия кислорода. Гиперкапнии при изолированных диффузионных нарушениях не наблюдается, поскольку углекислый газ диффундирует в 20-25 раз быстрее кислорода.
Нарушения перфузии чаще наблюдаются при тромбоэмболиях легочной артерии, легочной гипертонии как первичной, так и в связи с левожелудочковой недостаточностью при различных заболеваниях сердечно-сосудистой системы (митральный стеноз, инфаркт миокарда и постинфарктный кардиосклероз, гипертоническая болезнь и др.), легочных васкулитах, наблюдающихся при некоторых диссеминированных заболеваниях легких и аутоиммунных процессах (системной красной волчанке, синдроме Вегенера и др.).
Снижение перфузии приводит к нарушению газового состава артериальной крови, прежде всего к гипоксемии. Однако для нормальной артериализации крови имеет значение не столько абсолютный уровень перфузии, сколько вентиляцион-
642
но-перфузионные соотношения. У здорового человека имеется соответствие между объемом вентиляции и легочным кровотоком в каждом участке легкого. При пневмонии и других паренхиматозных процессах, ателектазе в пораженных отделах сохраняется кровоток по капиллярам, в то время как вентиляция отсутствует или резко снижена. В связи с этим в пораженной зоне кровь недостаточно насыщается кислородом. Поступающая из этих участков кровь соответственно уменьшает и общее напряжение кислорода в крови, оттекающей от легких. Такое примешивание недостаточно насыщенной кислородом (венозной) крови к артериали-
зованной крови называется внутрилегочным шунтированием венозной крови; оно является основной причиной гипоксемии при обширных пневмониях и других паренхиматозных процессах.
При преобладании вентиляции над кровотоком, то есть при синдроме гипервентиляции, увеличивается вымывание из крови (и организма) углекислоты и развивается гипокапния, что приводит к снижению тонуса вен, депонированию крови в венозной системе, уменьшению количества циркулирующей крови, снижению артериального давления, уменьшению церебрального кровообращения. У больного появляются общая слабость, головокружение, мелькание «мушек» перед глазами.
Деление механизмов развития ДН на нарушения вентиляции, диффузии и перфузии применительно к конкретным больным носит в значительной мере условный характер, поскольку при различных патологических состояниях эти механизмы сочетаются, однако доминирующими при заболеваниях легких и некоторых других процессах являются вентиляционные нарушения.
Как следует из вышеизложенного, к развитию ДН могут привести не только заболевания бронхолегочного аппарата, но и другие патологические процессы
(заболевания центральной нервной системы, болезни сердца с застоем в малом круге кровообращения и т.д.). Вариант ДН, связанный с заболеванием легких и бронхов, называется легочной недостаточностью. Легочная недостаточность закономерно развивается при ХОБЛ и связана в основном с нарушением вентиляции, а в дальнейшем, по мере развития легочного сердца, – и с нарушением диф-
643
фузии газов и перфузии. ХОБЛ и эмфизема легких являются самыми частыми причинами ДН.
Дыхательную и легочную недостаточность нередко отождествляют, но правильнее разграничивать эти понятия. При заболеваниях легких можно пользоваться обоими терминами, в то время как нарушения газообмена при других заболеваниях следует именовать ДН.
Клиника и диагностика
Клинические признаки ДН связаны со снижением напряжения кислорода и повышением напряжения углекислоты в крови, а также с нарушением в организме окислительных процессов и сдвигами кислотно-основного состояния (КОС), ко-
торые при выраженной ДН приводят к декомпенсированному дыхательному ацидозу.
Гипоксемия проявляется в основном одышкой и цианозом. При легочной недостаточности цианоз носит диффузный характер, а синюшные кисти теплые на ощупь, что свидетельствует о том, что дефицит кислорода связан с недостаточной артериализацией крови в малом круге кровообращения. Клиническими признака-
ми, связанными в основном с гиперкапнией, являются упорные головные боли и сонливость, гиперемия кожных покровов, потливость, тахикардия, артериальная гипертензия. При крайних степенях ДН, сопровождающихся резко выраженными гипоксемией и гиперкапнией, наблюдаются судороги, спутанность сознания, оглушенность и кома.
Для раннего выявления и уточнения механизмов развития и форм нарушения дыхательной функции, в частности легочной вентиляции, обычно проводят спирографию с подсчетом скоростных показателей, с обязательным выполнением функциональной фармакологической пробы и определением бронхиальной про-
ходимости. Значительно реже, в связи со сложностью методик, определяют остаточный объем легких, показатели легочного кровообращения, вентиляционноперфузионные отношения, диффузионную способность легких. У больных с выраженной ДН крайне желательно определять газы артериальной крови (РаО2 и Ра СО2) и КОС. При этом необходимо иметь в виду, что у здоровых лиц РаО2
644
уменьшается с возрастом. Это объясняется снижением эластичности легочной ткани и появлением гиповентилируемых участков, в которых сохраняется кровоток. Благодаря известному уже нам механизму шунтирования венозной крови это приводит к снижению насыщения артериальной крови кислородом. Должное напряжение кислорода рассчитывается по формуле Н.В. Путова и В.С. Щелкунова: РаО2= 102,6 – 0,32 × возраст. Таким образом, для человека в возрасте 20 лет нормальным РаО2 является 96,2, а в возрасте 65 лет – 81,8 мм рт. ст.
Основное значение в генезе ДН при заболеваниях бронхолегочной системы имеет нарушение вентиляции. Спирографическое исследование позволяет установить характер нарушения легочной вентиляции: обструктивный, рестриктивный (ограничительный) и смешанный. Для обструктивного типа характерно сни-
жение абсолютных скоростных показателей (объема форсированного выдоха за первую секунду – ОФВ1 и максимальной вентиляции легких – МВЛ), которые превышают степень снижения ЖЕЛ. Вследствие этого снижаются и относительные скоростные показатели: ОФВ1/ЖЕЛ (индекс Тиффно) и МВЛ/ЖЕЛ (показатель скорости движения воздуха – ПСДВ), величина которых имеет наибольшее значение для суждения о степени обструкции. В норме ЖЕЛ составляет не менее 90 %, ОФВ1 и МВЛ – не менее 85 % должной величины, индекс Тиффно – более 70 %, а ПСДВ – 22-28. Для расчета должных величин показателей вентиляции используются специальные формулы, в которых учитываются пол, возраст, рост пациента. Обструктивные нарушения вентиляции наблюдаются при ХОБЛ, бронхиальной астме и ряде других заболеваний.
Для рестриктивного варианта нарушения легочной вентиляции характерно преимущественное снижение ЖЕЛ, в меньшей степени – абсолютных скорост-
ных показателей, вследствие чего относительные скоростные показатели существенно не меняются. Типичные рестриктивные нарушения выявляют при обширных пневмониях, массивных плевральных сращениях и экссудатах, фиброзирующих альвеолитах и других интерстициальных заболеваниях легких.
645
При многих заболеваниях легких выявляют смешанный тип нарушения вентиляции, когда наблюдается равномерное снижение ЖЕЛ и абсолютных скоростных показателей.
Классификация
По темпу развития выделяют острую и хроническую ДН. Острая ДН развивается в течение нескольких дней, часов и даже минут, например при бронхиальной астме, массивной пневмонии или тромбоэмболии легочной артерии. Хроническая ДН существует длительное время (годы, месяцы) и характерна для ХОБЛ и других ДЗЛ, заболеваний сердечно-сосудистой системы с застоем в малом круге кровообращения.
Для характеристики степени ДН в практической работе учитывается выраженность одышки и цианоза. При ДН I степени одышка наблюдается при значительных нагрузках, но которые ранее не вызывали нарушения дыхания, цианоз отсутствует; при II степени одышка и цианоз возникают при умеренной или малейшей физической нагрузке и при ДН III степени – в покое. По возможности исследуют газовый состав артериальной крови. При I степени ДН он не изменен (исследование проводится в покое); при ДН II степени имеется умеренно выраженная артериальная гипоксемия (до 70-60 мм рт. ст.), при ДН III степени – выраженная артериальная гипоксемия (обычно < 60 мм рт. ст.), как правило, в сочетании с гиперкапнией (> 45 мм рт. ст.).
ЛЕГОЧНАЯ ГИПЕРТЕНЗИЯ
ЛГ имеет основное значение в механизмах развития ХЛС и его декомпенсации. О ЛГ можно говорить в тех случаях, когда давление в лёгочной артерии в покое превышает нормальные величины: 26-30 мм рт. ст. – для систолического, 8- 10 – для диастолического и 13-20 мм рт. ст. – для среднего давления [2]. ЛГ вызывают любые воздействия, приводящие к уменьшению сосудистого русла малого круга (анатомическому или функциональному), с одной стороны, и к увеличению поступающего в это русло количества крови, замедлению и затруднению кровотока, – с другой.
646
Патогенез легочной гипертензии
Основное значение в патогенезе ЛГ имеют функциональные, на начальных этапах полностью обратимые факторы, воздействием на которые можно до-
биться улучшения состояния больного. К ним относятся, прежде всего, альвеолярная гипоксия и гиперкапния, связанные с нарушением вентиляции, которые рефлекторным путём вызывают спазм мелких артерий и артериол лёгких (альвео- лярно-капиллярный рефлекс Эйлера-Лильестранда). В нормальных условиях этот рефлекс имеет приспособительное значение, так как приводит лёгочное кровообращение в соответствие с лёгочной вентиляцией. Однако при длительном действии он вызывает анатомические изменения в сосудистой стенке и приводит к стойкой легочной гипертензии.
Морфологические (стойкие, необратимые) патогенетические факторы ЛГ
связаны редукцией сосудов малого круга кровообращения, которая особенно выражена при наличии эмфиземы и фиброза лёгких. В этих случаях наблюдаются атрофия и разрыв альвеолярных перегородок, облитерация и запустевание лёгочных артериол и капилляров, сдавление сохранившихся сосудов и развитие в них множественных микротромбозов. К редукции сосудистого русла приводят также изменения лёгочного сурфактанта, который в условиях гипоксии разрушается, что обусловливает формирование множественных микроателектазов и прогрессирование эмфиземы.
В эксперименте показано, что ЛГ в покое развивается при уменьшении сосудистого русла на 2/3. При ДЗЛ редукция сосудистого русла никогда не достигает такой степени. Поэтому основное значение в патогенезе ЛГ придаётся функциональным факторам, прежде всего альвеолярно-капиллярному рефлексу.
Наряду с названными механизмами развития ЛГ при ДЗЛ необходимо учитывать и другие патогенетические факторы.
Развивающаяся у больных легочная недостаточность (ЛН) приводит к развитию гипоксии и артериальной гипоксемии. Последние сопровождаются, с одной стороны, компенсаторным увеличением минутного объёма кровообращения и увеличением кровотока в малом круге, с другой – часто осложняются эритроцито-
647
зом, увеличением объёма циркулирующей крови, повышением её вязкости и нарушением микроциркуляции, что в совокупности являются дополнительными патогенетическими факторами развития ЛГ.
Многие авторы признают также роль в генезе ЛГ и изменений при ДЗЛ биомеханики дыхания. Имеется в виду повышение внутригрудного и внутриальвеолярного давления в фазе выдоха, что приводит к механическому сдавлению кровеносных сосудов в лёгких и уменьшению их просвета.
Впоследние годы доказано значение в генезе ЛГ нарушения функции эндотелия лёгочных сосудов. В условиях гипоксии в эндотелии нарушается метаболизм вазоактивных веществ. Это приводит, с одной стороны, к повышенной продукции сосудосуживающих веществ (биогенные амины, брадикинин, ангиотензин I и др.), с другой – к снижению выработки вазодилатирующих субстанций, среди которых основную роль играет так называемый эндотелий расслабляющий фактор. Среди сосудосуживающих факторов в последние годы важнейшее значение придаётся гиперпродукции эндотелий-пектидных гормонов, выделяемых эндотелиальными клетками в условиях гипоксии.
Одним из компенсаторных механизмов, направленных на уменьшение ЛГ, является развитие артерио-венозных анастомозов. Благодаря анастомозам происходит отток значительного количества крови (до 30 %), что действительно приводит к уменьшению давления в малом круге. Однако в большой круг поступает кровь, не обогащённая кислородом, что увеличивает артериальную гипоксемию, которая по указанным выше механизмам увеличивает ЛГ.
Впрактическом отношении важным является установление роли повыше-
ния активности ренин-ангиотензин-альдостероновой системы (РААС) в генезе не только сердечной недостаточности при ХЛС, но и ЛГ. У больных ДЗЛ с наличием ДН установлено увеличение уровня ангиотензинпревращающего фермента (АПФ)
икомпонентов РААС (ренина, альдостерона), которые способствуют не только изменениям в миокарде, но и увеличению ЛГ.
Знание механизмов развития ЛГ помогает врачу назначить патогенетиче-
ски обоснованное лечение ЛГ и ХЛС.
648
Лёгочная гипертензия при ДЗЛ носит прекапиллярный характер, то есть связана с повышением лёгочного артериолярного сопротивления. Такой гипертензии не свойственны застойные явления в лёгких. Однако, как будет сказано ниже, при ХЛС может вовлекаться в процесс и левый желудочек. В этих случаях развивается также скрытая или явная посткапиллярная (застойная) ЛГ.
Диагностика легочной гипертензии
ЛГ ухудшает газообмен в лёгких и приводит к развитию одышки, а в дальнейшем и цианоза, однако у больных ДЗЛ они наслаиваются на проявления ДН, которая сопровождается такими же симптомами. К объективным клиническим признакам относятся акцент II тона над лёгочной артерией, иногда расширение и пульсация лёгочной артерии во II-III межреберьях слева, диастолический шум над лёгочной артерией, обусловленный относительной недостаточностью её клапанов.
К рентгенологическим признакам ЛГ относят выбухание ствола лёгочной артерии, особенно её конуса, расширение центральных прикорневых сосудов, иногда с усиленной их пульсацией, при ослаблении сосудистого рисунка на периферии.
Наиболее точным методом неинвазивной диагностики ЛГ является допплеровская эхокардиография. Такие методы определения давления в лёгочной артерии, как метод Бурстина (по продолжительности фазы изометрического расслабления), тетраполярная грудная реография, значительно уступают по точности допплеровской эхокардиографии и в настоящее время используются редко.
Классификация легочной гипертензии
Для практических целей удобнее выделять степени, отражающие динамику патологического процесса. При I степени (транзиторной) повышение давления в лёгочной артерии наблюдается лишь при физической нагрузке и при обострении воспалительного процесса в бронхолёгочной системе. При II степени (стабильной) ЛГ определяется в покое и в фазе ремиссии воспалительного процесса. В этой стадии уже имеется ХЛС в стадии компенсации. И, наконец, III степень характеризуется декомпенсацией ХЛС.
649
ХРОНИЧЕСКОЕ ЛЕГОЧНОЕ СЕРДЦЕ
Согласно определению Комитета экспертов ВОЗ, лёгочное сердце – это гипертрофия или сочетание гипертрофии с дилатацией правого желудочка, возникающие на почве заболеваний, поражающих структуру или функцию лёгких или то и другое одновременно и не связанных с первичной недостаточностью левых отделов сердца, например, при приобретённых или врождённых пороках сердца.
К гипертрофии правого желудочка с последующим истощением его энергетических возможностей приводит в основном ЛГ и связанное с ней возрастание сосудистого сопротивления. Без ЛГ нет ХЛС. В связи с этим Европейское общество по клинической физиологии дыхания включило наличие ЛГ в само определение ХЛС. Кроме того, при ХЛС довольно рано вовлекается в процесс левый желудочек с развитием его дисфункции. Это связано с гипоксемией, инфекционнотоксическими влияниями и механическими факторами (сдавление левого желудочка дилатированным правым, парадоксальным движением межжелудочковой перегородки и её выпячиванием в полость левого желудочка, что затрудняет его наполнение). В связи с этим имеется тенденция включить дисфункцию обоих желудочков в определение ХЛС [2].
Внашей стране широко используется классификация лёгочного сердца, предложенная ещё в 1964 г. известным терапевтом и клиническим фармакологом академиком Б.Е. Вотчалом (табл.).
Впрактике врача наиболее часто встречается ХЛС. Причинами ХЛС в 80 % являются заболевания бронхолегочного аппарата: ХОБЛ, фиброзирующие альвеолиты, гранулематозы (саркоидоз, диссеминированный туберкулёз лёгких и др.), системная склеродермия. На втором месте в качестве причины ХЛС стоят поражения торакодиафрагмального аппарата: деформации грудной клетки (кифозы, сколиозы), ожирение (Пиквикский синдром), обширные плевральные шварты, миастения. Несколько меньшее значение имеют заболевания с первичным поражением лёгочных сосудов: первичная лёгочная гипертензия (болезнь Аэрза), узелковый полиартериит и другие системные васкулиты, повторные тромбоэмболии в мелких ветвях лёгочной артерии.
650
|
Классификация легочного сердца (Б.Е. Вотчал, 1964) |
Таблица |
||||||||||
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Состояние |
Преимущест- |
|
Особенности клинической |
|||||||
Характер течения |
венный |
|
||||||||||
компенсации |
|
|
картины |
|
|
|
||||||
|
|
|
|
патогенез |
|
|
|
|
|
|
|
|
I. Острое легочное |
Декомпенси- |
Васкулярный |
Массивная тромбоэмболия легочной |
|||||||||
сердце: развитие в |
рованное |
|
|
артерии |
|
|
|
|
|
|
||
течение нескольких |
|
|
|
|
|
|
|
|
|
|
|
|
часов, дней |
|
|
Бронхолегочный |
|
Клапанный пневмоторакс, пнев- |
|||||||
|
|
|
|
|
|
момедиастинум |
|
|
|
|||
|
|
|
|
|
Бронхиальная |
астма, |
затяжной |
|||||
|
|
|
|
|
|
приступ |
|
|
|
|
|
|
|
|
|
|
|
Пневмония (долевая или массив- |
|||||||
|
|
|
|
|
|
ная сливная) |
|
|
|
|
||
II. |
Подострое ле- |
Компенсиро- |
Васкулярный |
Повторные мелкие тромбоэмболии в |
||||||||
гочное сердце: раз- |
ванное |
|
|
системе легочной артерии – тромбы, |
||||||||
вивается в течение |
|
|
|
эмболы, яйца паразитов, обломки |
||||||||
нескольких недель, |
|
|
|
эритроцитов |
при |
серповидно- |
||||||
месяцев |
Декомпенси- |
|
клеточной анемии и др. |
|
|
|
||||||
|
|
рованное по |
|
|
|
|
|
|
|
|
|
|
|
|
правожелудоч- |
Бронхолегочный |
|
Повторные |
затяжные |
приступы |
|||||
|
|
ковому типу |
|
|
бронхиальной астмы |
|
|
|||||
|
|
|
|
|
Раковый лимфангит легких |
|
||||||
|
|
|
|
Торакодиафраг- |
Хроническая |
гиповентиляция |
цен- |
|||||
|
|
|
|
мальный |
трального и периферического проис- |
|||||||
|
|
|
|
|
хождения при ботулизме, полиомие- |
|||||||
|
|
|
|
|
лите, миастении и др. |
|
|
|
||||
|
|
|
|
Васкулярный |
|
Первичная легочная гипертензия |
||||||
|
|
|
|
|
|
Артерииты |
|
|
|
|
|
|
|
|
|
|
|
|
Повторные эмболии |
|
|
|
|||
|
|
|
|
|
|
Резекция легкого |
|
|
|
|||
III. |
Хроническое |
Компенсиро- |
Бронхолегочный |
Обструктивные процессы в брон- |
||||||||
легочное сердце: |
ванное |
|
|
|
хах и легких (хронический брон- |
|||||||
|
|
|
хит, |
бронхиальная |
астма, эмфи- |
|||||||
развитие в течение |
|
|
|
|
||||||||
|
|
|
|
зема |
легких, |
диффузный |
пнев- |
|||||
ряда лет |
|
|
|
|
||||||||
Декомпенси- |
|
|
|
москлероз с эмфиземой) |
|
|||||||
|
|
|
|
|
|
|||||||
|
|
|
|
Рестриктивные процессы – |
фиб- |
|||||||
|
|
рованное |
по |
|
||||||||
|
|
|
|
розы и гранулематозы |
|
|
||||||
|
|
правожелудоч- |
|
|
|
|
||||||
|
|
|
Поликистоз легких |
|
|
|
||||||
|
|
ковому типу |
|
|
|
|
|
|||||
|
|
|
|
Торакодиафраг- |
Поражение позвоночника и груд- |
|||||||
|
|
|
|
мальный |
|
ной клетки с деформацией ее |
||||||
|
|
|
|
|
Плевральные шварты |
|
|
|||||
|
|
|
|
|
|
Ожирение (синдром Пиквика) |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
651
По состоянию кровообращения различают: 1) компенсированное и 2) де-
компенсированное ХЛС.
Диагностика компенсированного хронического легочного сердца
Диагностика компенсированного ХЛС – это выявление гипертрофии и ди-
латации правого желудочка, а также ЛГ при перечисленных выше заболеваниях. Клинические признаки гипертрофии правого желудочка: разлитой сердеч-
ный толчок, определяемый в области абсолютной сердечной тупости или в подложечной области (не путать с передаточной пульсацией аорты). Эпигастральная пульсация является менее достоверным признаком, поскольку может наблюдаться при эмфиземе лёгких и без гипертрофии правого желудочка за счёт смещения сердца вниз.
Клиническими и рентгенологическими методами выявить гипертрофию удаётся далеко не во всех случаях. Это связано со смещением сердца вниз в связи с эмфиземой («висячее» сердце) и поворотом сердца по часовой стрелке, вследствие чего правый желудочек смещается влево и может занять место левого. Поэтому перкуторное и рентгенологическое увеличение сердца вправо связано не с гипертрофией правого желудочка, а обусловлено дилатацией правого предсердия и свидетельствует уже о декомпенсации ХЛС. Выявить гипертрофию правого желудочка при рентгенологическом исследовании иногда удаётся в первом косом и боковом положениях в виде дугообразного выпячивания в переднее средостение.
Электрокардиографические признаки гипертрофии правого желудочка де-
лятся на прямые и косвенные. Прямые признаки условно обозначаются как R-тип или S-тип гипертрофии правого желудочка. Первый проявляется высоким зубцом R в V1 и V2, второй – резким снижением зубца R и глубокими зубцами S в V5 и V6. Часто наблюдается комбинация признаков обоих типов. Наряду с этим отмечаются смещение SТ ниже изолинии в V1, V2 и появление зубца Q в этих отведениях, сдвиг переходной зоны влево, полная или неполная блокада правой ножки пучка Гиса. К косвенным признакам относится, в частности, увеличение амплитуды зубца Р в отведениях II, III и аVF (P-pulmonale), который указывает на гипертрофию правого предсердия.
652
Необходимо отметить довольно низкую информативность ЭКГ при ХЛС, что связано с отмеченными выше позиционными изменениями сердца, а также с тем, что гипертрофия правого желудочка развивается на фоне длительной гипоксии, вследствие чего не может достигнуть значительных размеров. Даже при декомпенсации ХЛС частота выявления гипертрофии правого желудочка этим методом не превышает 50-60 %. Ещё ниже информативность рентгенологического метода исследования.
Основное значение для выявления лёгочного сердца в настоящее время имеет эхокардиография (в М-режиме, двухмерная и допплерэхокардиография в импульсном и непрерывном волновом режиме). Важнейшими ЭхоКГ-признаками лёгочного сердца являются гипертрофия правого желудочка (толщина его передней стенки превышает 0,5 см), дилатация правых отделов сердца, парадоксальное движение межжелудочковой перегородки в диастоле в сторону левого желудочка, увеличение трикуспидальной регургитации. Преимущество допплерэхокардио-
графии при ХЛС заключается в возможности одновременного определения давления в лёгочной артерии.
Патогенез декомпенсации хронического легочного сердца
Считается, что основное значение в развитии декомпенсации ХЛС имеет прогрессирующая дистрофия гипертрофированного миокарда. Однако у больных ХЛС часто нет соответствия между степенью ЛГ, от которой в основном зависят гипертрофия и дистрофия миокарда, и выраженностью правожелудочковой недостаточности. Поэтому в развитии и прогрессировании сердечной недостаточности (СН) при ХЛС придаётся значение и другим факторам.
Среди них основное значение имеют:
1.Отмеченное ранее повышение активности РАСС.
2.Гипоксия в сочетании с воспалительной интоксикацией. При ДЗЛ накапливаются провоспалительные цитокины, которые оказывают прямое повреждающее действие на кардиомиоциты. Установлена чёткая взаимосвязь между повышением уровня провоспалительных цитокинов (фактора некроза опухоли, интер-
653
3. В последние годы появились данные о том, что за счёт нарушения иммунных механизмов у больных ДЗЛ развивается сенсибилизация к сердечному антигену, что приводит к аутоиммунному поражению миокарда.
Диагностика декомпенсированного хронического легочного сердца
Для оценки выраженной сердечной недостаточности при ХЛС может быть использована классификация недостаточности кровообращения (НК), предложенная Н.Д. Стражеско и В.Х. Василенко. Однако её применение в этих случаях имеет некоторые особенности. Как известно, НК I стадии по этой классификации характеризуется в основном одышкой при физической нагрузке. У больных ХОБЛ и другими ДЗЛ декомпенсация легочного сердца развивается на фоне выраженной лёгочной недостаточности, проявляющейся, в частности, одышкой и цианозом. Это не даёт возможности по клиническим данным установить при ХЛС НК I стадии. Возможность использования для этой цели фазового анализа сердечного цикла подлежит ещё дальнейшему изучению.
Второй особенностью использования классификации Н.Д. Стражеско и В.Х. Василенко является трудность (часто невозможность) разграничения при декомпенсированном ХЛС НК IIА и IIБ стадий. НК II стадии, по данной классификации, характеризуется сохранением НК в покое: при IIА стадии – в одном, при IIБ – в обоих кругах кровообращения. При ДЗЛ декомпенсация длительное время проявляется только правожелудочковой недостаточностью, а одышка в покое, которая при сердечных заболеваниях свидетельствует преимущественно о застое в малом круге кровообращения, здесь связана прежде всего с лёгочной недостаточностью.
Таким образом, при декомпенсированном ХЛС рекомендуется выделять только II и III стадии.
При НК II стадии появляются следующие признаки:
1. Постоянная набухлость шейных вен. Этому предшествует в течение длительного времени изменение наполнения шейных вен в зависимости от фаз
654
2.Увеличение печени. Небольшое (на 1-2 см) увеличение печени может быть связано со смещением органа вниз из-за низкого стояния диафрагмы. Убедительным признаком декомпенсации является более значительное увеличение размеров печени, особенно левой доли, наличие хотя бы небольшой болезненности при пальпации, уменьшение размеров печени после лечения кардиотоническими средствами.
3.Периферические отёки. Однако необходимо иметь в виду возможность развития пастозности голеней, иногда значительной, не за счёт сердечной декомпенсации, а в связи с дыхательной недостаточностью и гиперкапнией (повидимому, за счёт влияния на минералокортикоидную функцию надпочечников).
4.«Холодный» цианоз (конечности холодные), что свидетельствует о его застойном происхождении. При лёгочной недостаточности цианоз «тёплый», что указывает на его гипоксемическую природу. Однако застойный цианоз «наслаивается» на гипоксемический, причём последний длительное время преобладает. Поэтому у многих больных с декомпенсацией ХЛС II стадии цианоз сохраняется ещё тёплым. «Холодный» цианоз более характерен для НК III стадии.
При декомпенсации ХЛС имеются некоторые особенности проявлений одышки. К ним относится отсутствие или слабая выраженность ортопноэ, ко-
торое, как правило, наблюдается только при наличии асцита.
Диагностика НК III стадии основана на общеизвестных признаках (развитие застойного цирроза печени, распространённых и рефрактерных к лечению отёков,
втом числе полостных, дистрофических изменений во внутренних органах и т.д.). Как уже отмечалось, симптомы декомпенсации ХЛС наслаиваются на поя-
вившееся раньше проявление лёгочной недостаточности. Поэтому в осложнении основного заболевания, например ХОБЛ, необходимо указать степень ЛН и стадию сердечной недостаточности. Например, после формулировки основного заболевания (ХОБЛ) в качестве осложнения отмечают ЛН III степени, легочная ги-
655
пертензия III степени, декомпенсированное хроническое лёгочное сердце, НК II стадии. Для выражения функциональных нарушений аппарата внешнего дыхания и сердца у больных ДЗЛ можно пользоваться термином «лёгочно-сердечная недостаточность» (ЛСН) и выражать ее в виде дроби: в числителе – степень легочной, в знаменателе – степень сердечной недостаточности. В таком случае осложнение формулируется так: хроническое легочное сердце, легочно-сердечная недостаточность III/II степени. Необходимо подчеркнуть, что степени легочной и сердечной недостаточности обычно не совпадают: чаще степень легочной недостаточности более высокая, чем степень сердечной. Поэтому строго обязательно раздельное указание степени легочной и сердечной недостаточности.
ЛЕЧЕНИЕ ЛЕГОЧНО-СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
ХЛС и ЛСН являются осложнениями различных заболеваний. Поэтому лечение должно быть направлено, прежде всего, на основное заболевание. Наиболее часто к ЛСН приводит ХОБЛ. Не разбирая подробно лечение этого заболевания, остановимся лишь на узловых вопросах.
В зависимости от тяжести состояния больному назначают соответствующий режим. При отсутствии обострения основного заболевания проводятся физические тренировки, характер и объем которых составляются индивидуально для каждого больного. Рекомендуется диета с ограничением соли и повышенным содержанием витаминов. Категорически запрещается курение.
Для лечения ХОБЛ, уменьшения ДН, улучшения вентиляции и снижения альвеолярной гипоксии большое значение имеет применение бронхолитиков: ингаляции атровента, беротека, беродуала, использование эуфиллина, особенно пролонгированных теофиллинов – теопека, теолонга, ретафилла, в тяжёлых случаях – назначение глюкокортикостероидов. Улучшению бронхиального дренажа и бронхиальной проходимости способствуют также применение отхаркивающих и муколитических средств, постуральный дренаж, ингаляции гидрокарбоната натрия и гипотонического раствора хлорида натрия.
Необходимо подчеркнуть, что выраженные признаки ДН и декомпенсации ХЛС обычно впервые появляются при обострении бронхолёгочного процесса. В
656
дальнейшем, когда проявления ЛСН становятся постоянными, развивается их закономерное усиление при обострении воспалительного процесса. В связи с этим обязательным элементом лечебного комплекса является антимикробная терапия. За счёт подавления инфекционного процесса уменьшается воспалительная отёчность слизистой оболочки бронхов, количество секрета в бронхах, что приводит к улучшению вентиляции и снижению альвеолярной гипоксии; последняя, в свою очередь, в силу обратного действия альвеолярно-капиллярного рефлекса снижает ЛГ и облегчает работу правого желудочка. На работу сердца положительно влияет также снижение гипоксемии. В результате уменьшаются проявления дыхательной и сердечной недостаточности. Вот почему академик Б.Е. Вотчал считал, что антимикробная терапия при обострении бронхолёгочной инфекции у больных ХОБЛ имеет решающее значение в лечении ЛСН («лучшее сердечное средство – это антибиотики»). Антибиотиками выбора являются аминопенициллины и макролиды. Для усиления действия антимикробных средств, особенно при хроническом гнойном бронхите, показано назначение иммунокорригирующих препаратов.
Если ХОБЛ сочетается с бронхиальной астмой, то назначается стандартная ступенчатая терапия этого заболевания. Лечение должно быть направлено на все компоненты бронхиальной обструкции: воспалительные изменения слизистой оболочки бронхов, бронхоспазм, скопление в просвете бронхов вязкой мокроты, экспираторный коллапс мелких бронхов.
Несомненно полезными для воздействия на основной процесс и снижения ДН являются лечебная физкультура и особенно дыхательные упражнения с тре-
нировкой выдоха, чрескожная электростимуляция диафрагмы, вибрационный массаж грудной клетки, направленный на улучшение бронхиального дренажа.
В лечении ДН большая роль отводится оксигенотерапии. Показанием для неё является отчётливое гипоксемическое состояние, которое имеется у больных с ЛН II и III степени. В повседневной практике используются ингаляции кислорода через носовой катетер или негерметичную маску. Для кислородной терапии используется увлажнённый кислород, концентрация которого должна составлять 30-
657
40 %. Такая концентрация достигается при подаче кислорода через носовой катетер со скоростью 6-8 л/мин. Продолжительность ингаляции составляет 20-30 мин, при хорошей переносимости увеличивается до 1 часа и более; при необходимости сеансы повторяют до 3-5 раз в сутки.
Однако эпизодическое или курсовое применение кратковременных сеансов оксигенотерапии существенно не влияет на отдаленные результаты лечения и особенно на прогноз больных ДЗЛ, в частности ХОБЛ с наличием выраженной ЛСН. Это связано с тем, что такая оксигенотерапия не приводит к стойкому улучшению газового состава крови и, следовательно, уменьшению ДН, которая является ведущей причиной летальности при ДЗЛ.
Более эффективна при ДН так называемая длительная кислородотерапия (ДКТ), под которой понимается лечение ингаляциями кислорода в течение 15 и более часов в сутки, включая ночные часы. Максимальные перерывы между сеансами не должны превышать двух часов подряд. ДКТ на сегодняшний день является единственным методом лечения, способным снизить летальность при ХОБЛ с ЛСН. Такое лечение у больных с гипоксемией способно продлить жизнь на 6-7
лет [3].
Благоприятное влияние ДКТ на выживаемость больных с хронической ДН объясняется, во-первых, повышением содержания кислорода в артериальной крови, что приводит к увеличению его доставки к сердцу, головному мозгу и другим жизненноважным органам; во-вторых, благоприятным влиянием на гемодинамику малого круга кровообращения, вследствие чего повышается сердечный выброс и минутный объем крови, улучшается почечный кровоток. Отчетливое снижение легочной гипертензии наблюдается лишь в начале лечения, в дальнейшем этот процесс замедляется. При проспективном исследовании в течение 6 лет установлено, что за этот срок систолическое давление в легочной артерии не снизилось, а лишь стабилизировалось, что следует считать положительным результатом, поскольку при отсутствии кислородотерапии наблюдается ежегодный прирост давления на 1,5-2,8 мм рт. ст. [3]. При ДКТ отмечено также замедление скорости ухудшения показателей ФВД. На фоне ДКТ наблюдается уменьшение одышки и
658
повышение физической работоспособности, снижение частоты госпитализации в стационар, снижение гематокрита, улучшение функции дыхательных мышц и нейрофизиологического статуса [4].
Перед началом ДКТ необходимо убедиться, что возможности медикаментозной терапии исчерпаны и ее продолжение не приводит к повышению уровня кислорода в крови.
Показаниями для ДКТ являются РаО2 < 55 мм рт. ст. или SaO2 (насыщение гемоглобина кислородом) < 88 % в покое, а при наличии легочного сердца или полицитемии (гематокрит > 55 %) – РаО2 < 60 мм рт. ст. или SaO2 менее 90 %.
Для оценки эффективности ДКТ крайне желательно периодически определять параметры газообмена.
Не останавливаясь подробно на техническом обеспечении ДКТ, отметим лишь, что в качестве источника кислорода используются концентраторы кислорода (в них используют принцип разделения воздуха на кислород и азот), баллоны со сжатым газом или резервуары с жидким кислородом. Указанные приборы можно использовать как в больничных, так и (при наличии соответствующего технического обеспечения и врачебного контроля) в домашних условиях. В настоящее время в США и странах Западной Европы широко используются портативные системы с жидким кислородом (рис. 1), которые можно применять в любых условиях (на работе, при поездках в транспорте и т.д.).
Для доставки кислорода в дыхательные пути с помощью перечисленных выше аппаратов чаще используются носовые канюли, в которые кислород из аппарата поступает по тонким трубочкам, которые, к тому же, фиксируют канюли в носу (рис. 2). Поскольку канюли не закрывают полностью носовой проход, в дыхательные пути поступает и наружный воздух, к которому примешивается кислород из канюли. Регулируя скорость подачи кислорода, можно менять концентрацию кислорода во вдыхаемой смеси. При среднем потоке кислорода от 2 до 5 л/мин создается кислородно-воздушная смесь с содержанием кислорода от 24 до
40 %.
659

Рис. 1. Заправка портативной системы с жидким кислородом из стационарного резервуара
Рис. 2. Носовые канюли
660
Необходимо иметь в виду, что оксигенотерапия – ответственная лечебная процедура. При проведении оксигенотерапии необходимо следить за общим состоянием больного, глубиной дыхания, пульсом. Особую осторожность необходимо соблюдать у больных с ДН III степени.
Как известно, у здоровых лиц содержание углекислоты в артериальной крови является основным стимулятором дыхательного центра. У больных с тяжелой ДН в связи с гиперкапнией чувствительность дыхательного центра к углекислоте снижена. Единственным возбудителем дыхательного центра у таких больных ос-
тается артериальная гипоксемия. Уменьшение ее при оксигенотерапии приводит к ослаблению вентиляции и дальнейшему накоплению углекислоты в организме с развитием декомпенсированного ацидоза. Клинически это проявляется уменьше-
нием глубины дыхания, головной болью, профузным потоотделением, психическим возбуждением, появлением сонливости, бреда; кожа обычно теплая, гиперемированная, пульс частый и напряжённый, артериальное давление повышено. При дальнейшем нарастании дыхательной недостаточности может наступить смерть от гиперкапнической комы.
При тяжелой легочной и легочно-сердечной недостаточности для предупреждения этого осложнения при проведении оксигенотерапии внутривенно капельно вводят стимуляторы дыхательного центра (кордиамин, этимизол). Для предупреждения угнетения дыхательного центра и гиповентиляции у таких больных для ингаляции используется небольшая (24 %) концентрация кислорода.
Таким образом, наибольшая опасность при проведении оксигенотерапии за-
ключается в снижении вентиляции и угрозе развития гиперкапнии. Гиперкапния является маркером снижения вентиляционного резерва и имеет серьезное прогностическое значение.
Еще 8-10 лет назад при отсутствии эффекта от комплексного лечения с включением ДКТ, при тяжелой некупирующейся ДН больного интубировали и начинали проводить искусственную вентиляцию легких (ИВЛ). Эта респираторная поддержка и сейчас остается важным лечебным мероприятием для борьбы с тяжелой дыхательной недостаточностью. Однако во многих случаях, при которых
661
раньше приходилось назначать эту лечебную процедуру, в настоящее время удается достичь эффекта с помощью более щадящей процедуры – так называемой неинвазивной вентиляции легких (НВЛ). Этот вариант респираторной поддержки получил развитие лишь в 90 гг. ХХ столетия. При этом респираторное пособие проводится без установки искусственных дыхательных путей (интубационной или трахеостомической трубок), что позволяет эффективно и безопасно разгрузить дыхательную мускулатуру, уменьшить одышку и улучшить газовый состав крови. Во время НВЛ кислород из дыхательного аппарата (респиратора) поступает под лицевую маску, под которой поддерживается определенный объем и давление («масочная вентиляция»).
При НВЛ устраняется возможность возникновения многочисленных механических и инфекционных осложнений, связанных с интубацией трахеи; больной находится в сознании и, как правило, не требуется применения седативных и миорелаксирующих препаратов. И, пожалуй, самое главное, при улучшении состояния больного можно сравнительно легко «отлучить» его от респиратора. Это обусловлено тем, что при НВЛ используются преимущественно триггерные режимы, что позволяет сохранить центральную инспираторную активность больного. В то же время общеизвестны трудности при «отлучении» больного от респиратора при традиционной ИВЛ, часто требующие применения специально разработанных программ и перевода больных в специализированные отделения.
Показаниями для НВЛ являются:
1.Выраженная одышка в покое с ЧДД > 25.
2.Участие в дыхании вспомогательной дыхательной мускулатуры.
3.Гипоксемия (РаО2) < 60 мм рт. ст., несмотря на проводимую оксигеноте-
рапию.
4.Спутанное сознание.
5.Гиперкапния > 60 мм рт. ст. и прогрессирующее нарастание РаСО2.
6.рН крови < 7,35 и прогрессивное снижение этого показателя. Наряду с этим НВЛ показана в тех случаях, когда у больного с острой ДН (или резким
662
При улучшении состояния больной снимается с НВЛ и переводится на обычную терапию. При отсутствии эффекта от НВЛ (это наблюдается у 20-30 %
больных) больного интубируют и переводят на традиционную ИВЛ. В этих слу-
чаях НВЛ рассматривается как промежуточный этап для перехода к традиционной ИВЛ. В тех случаях, когда НВЛ недоступна из-за отсутствия соответствующей аппаратуры, традиционная ИВЛ при тяжелой ДН выступает в качестве первого этапа вспомогательной вентиляции легких (респираторной поддержки).
Показаниями к ИВЛ (инвазивной респираторной поддержке) у больных ДЗЛ, в частности ХОБЛ, являются:
1)остановка дыхания;
2)выраженные нарушения сознания (сопор, кома);
3)тяжелая одышка с участием вспомогательных мышц и парадоксальными движениями передней брюшной стенки;
4)утомление дыхательной мускулатуры;
5)тахипноэ >35 в мин;
6)нестабильная гемодинамика (САД < 70 мм рт. ст., частота сердечных сокращений < 50/мин или > 160/мин.);
7)угрожающая жизни гипоксемия (РаО2 < 40 мм рт. ст.);
8)гиперкапния (РаСО2 > 60 мм рт. ст.) и тяжелый ацидоз (рН < 7,25);
9)неэффективность НВЛ.
ИВЛ проводится также при других тяжелых состояниях, связанных с сепсисом, массивной пневмонией, эмболией легочной артерии, баротравмой, массивными плевральными выпотами и другими заболеваниями.
В связи с высоким риском инфекционных осложнений, чаще так называемой вентилятор-ассоциированной пневмонии, и развитием при ИВЛ (в связи с полным отсутствием спонтанного дыхания) атрофии дыхательной мускулатуры необходимо, по возможности, использовать ИВЛ при ХОБЛ и других заболеваниях в течение короткого времени – около 24 часов, после чего переходить на режи-
663
мы вспомогательной вентиляции легких. Этого времени обычно достаточно для снятия утомления дыхательной мускулатуры.
К патогенетическим методам лечения ЛСН относится использование средств, снижающих ЛГ и облегчающих таким образом работу правого желудочка. При транзиторной ЛГ эффективно ограничение физических нагрузок и целенаправленное лечение основного заболевания. Выраженное снижение ЛГ (на 1520 %) достигается при оксигенотерапии. Однако в большинстве случаев к этим методам добавляют лекарственные препараты. Длительное время выбор препаратов для воздействия на ЛГ был невелик и практически ограничивался эуфиллином, который с этой целью назначают в больших дозах (до 15-18 мл 2,4 % раствора) внутривенно капельно. Недостатком эуфиллина является кратковременность гипотензивного действия, поэтому в течение суток введение препарата необходимо повторять несколько раз.
В настоящее время оптимальными препаратами, по-видимому, являются ингибиторы АПФ, которые не только снижают давление в легочной артерии, но и уменьшают влияние нейрогуморальных механизмов патогенеза сердечной недостаточности за счет воздействия на РАСС. Назначают каптоприл (капотен) по 6,25 мг, постепенно увеличивая дозу до 12,5-25 мг 3 раза в сутки, эналаприл по 2,5-5-10 мг 2 раза в сутки и другие препараты. По механизму действия к ингибиторам АПФ близки антагонисты рецепторов ангиотензина II, например козаар (лозартан), который назначают по 12,5-25-50 мг 1 раз в сутки.
Для лечения ЛГ хорошо зарекомендовали себя антагонисты кальция, которые, кроме того, оказывают бронхолитическое действие. Уменьшая общее и лёгочное сосудистое сопротивление, они, как и ингибиторы АПФ и другие вазодилататоры, увеличивают сердечный выброс. Назначают коринфар ретард (нифеди- пин-ретард) по 10-20 мг 2 раза в сутки, дилтиазем по 15-30 мг 3 раза в сутки. Более эффективны пролонгированные дигидропиридины III поколения, например ломир (исрадипин) по 2,5-5 мг 2 раза в сутки, амлодипин в дозе 5-10 мг 1 раз в сутки. По данным некоторых авторов, антагонисты кальция не показаны при деком-
664
пенсированном ХЛС в связи с активацией этими препаратами симпатоадреналовой системы и РААС.
При ЛГ и ХЛС применяют и другие вазодилататоры: молсидомин (корватон) по 2 мг 3 раза в сутки, пролонгированные нитраты (изосорбида динитрат – изокет – по 20-40 мг 1-2 раза в сутки, изосорбида мононитрат по 50-100 мг 1 раз в сутки, нитросорбид по 10-20 мг 3-4 раза в сутки), гидралазин, празозин.
Индивидуальный подбор гипотензивного (на малый круг) препарата рекомендуется проводить под контролем гемодинамического исследования. Важно помнить, что эффективность указанных препаратов повышается при одновременно проводимой оксигенотерапии.
В последние годы предпринимаются попытки снижать ЛГ путем воздейст-
вия на нарушенную функцию эндотелия легочных сосудов. Наибольшие перспек-
тивы имеют ингаляции оксида азота, при которых достигаются эффекты, свойственные эндотелий расслабляющему фактору. С другой стороны, получен препарат бозентан для перорального применения, который блокирует выработку эндотелием пептидных гормонов эндотелинов, обладающих сосудосуживающим действием.
При наличии декомпенсированного легочного сердца ограничивают физическую нагрузку вплоть до назначения постельного режима, уменьшают потреб-
ление жидкости и соли. Из лекарственных средств предпочтение отдается мочегонным препаратам и вазодилататорам.
При умеренных признаках декомпенсации правого желудочка применяют тиазидовые диуретики, например гипотиазид от 25 до 100 мг однократно утром в течение 3-4 дней, затем делают перерыв на 3-4 дня; калийсберегающие диуретики: триамтерен по 50-100 мг 1-2 раза утром и днём после еды, антагонист альдостерона спиронолактон (альдактон, верошпирон) по 0,05 (2 таблетки) 3 раза в сутки. При наличии выраженной дыхательной недостаточности и гиперкапнии рекомендуется ингибитор карбоангидразы диакарб в дозе 0,25 (1 таблетка) один раз в сутки в течение 3 дней с повторением курса лечения через каждые 2-3 дня. Он обладает не только мочегонным эффектом, но и способствует выведению из орга-
665
низма углекислоты. Наибольший эффект оказывают петлевые диуретики: фуросемид (лазикс) по 40-80 мг и урегит по 50-100 мг один раз в день утром.
За последнее время у спиронолактонов, помимо мочегонного, обнаружено прямое сосудистое действие: расширение системных и легочных сосудов, уменьшение легочного сосудистого сопротивления, снижение давления в правом предсердии, правом и левом желудочках. Наряду с этим препарат уменьшает бронхиальную обструкцию. Применение верошпирона приводит к увеличению выработки простагландинов Е2, оказывающих вазодилатирующий и антиагрегантный эффекты, и ингибированию рецепторов ангиотензина II. В связи с этим назначение спиронолактонов является предпочтительным, однако в связи с умеренным мочегонным эффектом их рекомендуется комбинировать с тиазидовыми или петлевыми диуретиками.
Вазодилататоры относятся к средствам, которые уменьшают нагрузку на сердце и таким путем улучшают его работу. При этом венозные вазодилата-
торы (нитраты, молсидомин) уменьшают преднагрузку, артериальные (гидралазин) – постнагрузку, а «смешанные» вазодилататоры (ингибиторы АПФ, антагонисты рецепторов ангиотензина II, антагонисты кальция, празозин) приводят к разгрузке сердца за счёт уменьшения как предтак и постнагрузки. Исходя из отмеченных выше особенностей механизма действия, предпочтение следует отдавать ингибиторам АПФ и антагонистам рецепторов ангиотензина II.
В настоящее время большинство авторов не рекомендуют применять сер-
дечные гликозиды при декомпенсированном легочном сердце в связи с сомнитель-
ным клиническим эффектом и быстро развивающейся интоксикацией. Кроме того, доказано, что в правом желудочке не существует рецепторов для сердечных гликозидов. Последние эффективны лишь при сочетанном поражении правого и левого желудочков [1].
Для усиления сократительной способности декомпенсированного легочного сердца применяют препараты, улучшающие метаболические процессы и защищающие миокард от неблагоприятного воздействия гипоксии. К таким средствам относится предуктал (по 20 мг 3 раза в сутки).
666
Декомпенсированное легочное сердце сопровождается вторичным эритроцитозом, гиперволемией, повышением вязкости крови, нарушением микроциркуляции, повышением свертывающей способности и снижением фибринолитической активности крови. В связи с этим к патогенетическим методам лечения отно-
сятся лечебные мероприятия, направленные на коррекцию гемореологических на-
рушений. К ним относится, прежде всего, применение гепарина (по 5 000 ЕД каждые 6 часов подкожно в течение 10-14 дней) или низкомолекулярных гепаринов (например, фраксипарина), а также антиагрегантов: ацетилсалициловой кислоты по 0,125-0,375 г 1 раз в сутки, курантила и пентоксифиллина соответственно по 0,05 и 0,1 г 3 раза в сутки.
Улучшению гемореологических свойств крови способствуют сеансы гемосорбции (за счет элиминации из кровотока фибриногена, продуктов деградации фибрина, растворимых фибринмономеров, что снижает вязкость крови и улучшает перфузию в лёгочных сосудах) и эритроцитафереза (за счет удаления патологически измененных эритроцитов).
При выраженной декомпенсации хронического легочного сердца (одышка, диффузный цианоз, набухшие шейные вены, увеличение печени, повышение венозного давления и сгущение крови с повышением содержания гемоглобина и увеличением гематокрита), если нет возможности провести гемосорбцию и эритроцитаферез, рекомендуются кровопускания. Проводят 2-3 кровопускания по 400-500 мл с промежутком 5-7 дней. Как показали наши наблюдения, эффективность кровопусканий повышается на фоне курсового лечения гепарином и при последующем (сразу после кровопускания) внутривенном введении 400 мл реополиглюкина, который улучшает микроциркуляцию и гемодинамику малого круга кровообращения.
Литература
1. Трубников Г.А., Уклистая Т.А., Егорова И.О. и соавт. Ремоделирование сердца при хронических обструктивных заболеваниях легких. Методические рекомендации для врачей и студентов медицинских ВУЗов. – Астрахань: государственная медицинская академия, 2003. – 46 с.
667
2.Федорова Т.А. Хроническое легочное сердце. // Хронические обструктивные болезни легких / Под ред. Чучалина А.Г. – М.: ЗАО «Издательство БИНОМ». Санкт–Петербург: «Невский диалект», 1998. – С. 192 – 215.
3.Хроническая обструктивная болезнь легких. Клинические рекомендации. Всероссийское научное общество пульмонологов. – М.: Изд-во Атмосфера, 2003.
–168 с.
4.Чучалин А.Г. Клинические рекомендации по лечению больных хронической обструктивной болезнью легких. – М., 2002. – 68 с.
5.Шмелев Е.И. Хроническая обструктивная болезнь легких. – М., 2003. –
112 с.
668
