
Практикум_KX_2004
.pdfМИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ УКРАИНЫ НАЦИОНАЛЬНЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ "ХАРЬКОВСКИЙ ПОЛИТЕХНИЧЕСКИЙ ИНСТИТУТ"
А.П. НЕКРАСОВ Б.А. ВЕРЕТЕНЧЕНКО
ЛАБОРАТОРНЫЙ ПРАКТИКУМ ПО КОЛЛОИДНОЙ ХИМИИ
Рекомендовано Министерством образования и науки Украины в качестве учебного пособия для высших технических учебных заведений
Харьков НТУ "ХПИ" 2004
ББК 24.6я7 Н 56 УДК 541.182
Рецензенты: В. Д. Орлов, д-р хим. наук, зав. кафедрой органической химии, Харьковский национальный университет им. В. Н. Каразина; Е. Т. Ковалев, д-р технических наук, директор Украинского научноисследовательского углехимического института.
Гриф присвоен Министерством образования и науки Украины,
письмо № 14/18.2−1033 от 17.06.2003 р.
Н 56 Некрасов А.П., Веретенченко Б.А. Лабораторный практикум по коллоидной химии: Учебное пособие для студентов химических специальностей всех форм обучения. − Харьков: НТУ "ХПИ", 2004. − 276 с. − На русск. яз.
ISBN 966-593-348-5
Вучебном пособии соединены элементы лабораторных и практических работ с большим количеством контрольных вопросов по основным разделам курса коллоидной химии. В каждом разделе упражнений приведены краткие теоретические сведения и примеры решения задач по данной теме.
Рекомендуется для студентов химико-технологических специальностей высших учебных заведений, изучающих курс коллоидной химии.
Внавчальному посібнику поєднані елементи лабораторних та практичних робіт з великою кількістю контрольних запитань з базових розділів курсу колоїдної хімії. В кожному розділі вправ наведені стислі теоретичні відомості та приклади рішення задач за даною темою.
Рекомендується для студентів хіміко-технологічних спеціальностей вищих учбових закладів, вивчаючих курс колоїдної хімії.
Ил. 28. Табл. 17. Библиогр.: 14 назв.
ББК 24.6я7
ISBN 966-593-348-5 |
© |
А.П.Некрасов, |
|
|
Б.А.Веретенченко, 2004 г. |
|
© |
НТУ "ХПИ", 2004 г. |
2
СОДЕРЖАНИЕ |
|
Введение......................................................................................................... |
5 |
Работа 1. Седиментационный анализ.......................................................... |
7 |
1.1. Задания к лабораторной работе 1. ...................................................... |
17 |
Работа 2. Определение удельной адсорбции на поверхности |
|
твердое тело – раствор................................................................................ |
24 |
2.1. Задания к лабораторной работе 2 ....................................................... |
29 |
Работа 3. Определение адсорбции поверхностно-активных |
|
веществ на поверхности раствор – газ...................................................... |
31 |
3.1. Задания к лабораторной работе 3 ....................................................... |
40 |
Работа 4. Исследование мицеллообразования в растворах |
|
поверхностно-активных веществ............................................................... |
45 |
4.1. Задания к лабораторной работе 4. ...................................................... |
53 |
Работа 5. Изучение электрокинетических явлений в |
|
коллоидных системах ................................................................................. |
60 |
5.1. Задания к лабораторной работе 5 ....................................................... |
67 |
5.2. Задания к лабораторной работе 5 ....................................................... |
73 |
Работа 6. Определение вискозиметрической константы |
|
Хаггинса полимерных растворов .............................................................. |
79 |
6.1. Задания к лабораторной работе 6 ....................................................... |
88 |
Работа 7. Кинетика набухания высокомолекулярных |
|
веществ (ВМВ) ............................................................................................ |
95 |
7.1. Задания к лабораторной работе 7 ..................................................... |
102 |
Работа 8. Определение порога коагуляции золя |
|
электролитами ........................................................................................... |
108 |
3 |
|
8.1. Задания к лабораторной работе 8 ..................................................... |
114 |
|
Упражнения............................................................................................... |
123 |
|
9.1. |
Поверхностные явления................................................................. |
123 |
9.1.1. |
Примеры решения типовых задач................................................. |
129 |
9.1.2. |
Задачи для самостоятельного решения......................................... |
133 |
9.2. |
Электрокинетические явления....................................................... |
138 |
9.2.1. |
Примеры решения типовых задач................................................. |
143 |
9.2.2. |
Задачи для самостоятельного решения......................................... |
144 |
9.3. |
Оптические свойства дисперсных систем.................................... |
150 |
9.3.1. |
Примеры решения типовых задач................................................. |
155 |
9.3.2. |
Задачи для самостоятельного решения......................................... |
156 |
9.4. |
Устойчивость и коагуляция дисперсных систем......................... |
162 |
9.4.1. |
Примеры решения типовых задач................................................. |
168 |
9.4.2. |
Задачи для самостоятельного решения......................................... |
171 |
9.5. |
Молекулярно-кинетические свойства дисперсных систем........ |
176 |
9.5.1. |
Примеры решения типовых задач................................................. |
182 |
9.5.2. |
Задачи для самостоятельного решения......................................... |
185 |
9.6. |
Структурно-механические свойства дисперсных систем........... |
190 |
9.6.1. Примеры решения типовых задач................................................. |
194 |
|
9.6.2. Задачи для самостоятельного решения......................................... |
195 |
|
Задания − тесты......................................................................................... |
202 |
|
Ответы........................................................................................................ |
274 |
|
Список литературы................................................................................... |
275 |
|
|
4 |
|
ВВЕДЕНИЕ
Предлагаемый "Практикум по коллоидной химии" предназначен для студентов технологических и политехнических вузов.
Цель практикума − закрепить знания теоретических основ коллоидной химии и привить студентам навыки экспериментальной работы. В настоящее время нельзя назвать ни одного раздела коллоидной химии, который не был бы самым тесным образом связан с развитием отраслей химической технологии.
Традиционный способ преподавания курса коллоидной химии всегда разделял практические и лабораторные занятия. Однако модернизация учебных планов, изменение концепции преподавания, требующее увеличения самостоятельной работы студентов, использования методов дистанционного обучения, настоятельно требуют пособий, в которых органично соединены элементы лабораторных и практических работ. Их применение в учебном процессе позволит придать индивидуальную направленность подготовке каждого специалиста, исключить возможные ограничения и недоразумения.
Десять разделов пособия практически полностью охватывают базовый курс коллоидной химии, что позволяет получить необходимые практические навыки, как работая индивидуально, так и в составе группы, как непосредственно в аудитории, так и виртуально, с использованием ЭВМ.
Приведенные в достаточном количестве контрольные вопросы позволяют каждому студенту управлять процессом овладения дисциплиной.
В практикуме преимущественно нашли отражение те экспериментальные методы коллоидной химии, которые в той или иной мере могут быть использованы в научной и инженерной деятельности будущего специалиста в области прикладной химии.
Отличительной чертой предлагаемого практикума является стремление к развитию у студентов навыков самостоятельного научного поиска. В соответствии с этим работы, рекомендуемые в пособии, требуют углубленного изучения теоретического материала, сопоставления полученных результатов с теорией.
По учебному плану прохождение студентами лабораторного практикума часто опережает лекционный курс, поэтому описание каждой работы содержит необходимые для ее понимания теоретические сведения, которые позволяют подготовиться к выполнению любой работы без лекционного материала согласно плана организации учебного процесса. Для этой же цели в конце каждой главы приведен перечень рекомендованной литературы с указанием соответствующих страниц.
5
Отчеты по лабораторным работам должны содержать: краткое изложение теории работы с выводами важнейших закономерностей; описание установки, подготовки реактивов, порядка проведения опытов; результаты измерений, представляемые в виде таблиц и графиков; статистическую обработку результатов измерений; выводы, объясняющие результаты эксперимента; факторы, влияющие на определяемые параметры.
Значения физических констант, терминология и обозначения в пособии соответствуют рекомендациям ИЮПАК и КОДАТА−74.
Графические методы изображения и анализа широко применяются при обработке результатов коллоидно-химических измерений. При построении графиков необходимо выполнять следующие основные правила:
1.Графики необходимо строить на миллиметровой бумаге в карандаше, вклеивать в лабораторный журнал, все надписи делать чернилами. Начало координат и оси должны совпадать с крупной сеткой миллиметровой бумаги.
2.На оси абсцисс (горизонтальная ось) следует откладывать значение независимой переменной, а на оси ординат – зависимой переменной. На каждой координатной оси указывать свойство и единицы, в которых оно измеряется.
3.Масштаб графика следует выбирать так, чтобы координаты любой точки можно было найти без дополнительных расчетов. Если график строится для определения каких-либо величин, то рекомендуемый масштаб приведен в соответствующих методических указаниях.
4.Нанесенные на график координаты экспериментальных точек следует обводить кружочком или помечать крестиком, которые должны быть хорошо видны. По экспериментальным точкам проводится плавная усредняющая линия, при этом часть из точек может выпасть. Не следует проводить ломаную линию с охватом всех экспериментальных точек. Линия должна быть тонкой, но отчетливо видимой и занимать почти все поле чертежа. Шкалы Х и Y должны начинаться ближайшим к наименьшему округленному значению данной величины, а заканчиваться ближайшим к наибольшему округленному значению. В случае величин с порядком следует выбирать масштаб целых чисел, умножая его на масштабный коэффициент. Масштабы по
осям нужно выбирать так, чтобы линия была наклонена к оси абсцисс примерно под углом 45о. Под графиком необходимо написать, какая зависимость на нем изображена.
Графический метод дает наглядное представление о взаимосвязи изучаемых величин и позволяет непосредственно осуществить ряд вычислительных операций.
6
Работа 1. СЕДИМЕНТАЦИОННЫЙ АНАЛИЗ
Цель работы − получение кривой осаждения порошка низкой дисперсности, построение интегральной и дифференциальной кривых распределения частиц, определение основных характеристик порошка.
Теоретические сведения
Седиментационный анализ дисперсных систем в гравитационном поле применяется для определения основных характеристик гранулометрического состава суспензий и эмульсий, размеры частиц которых находятся в интервале 10–4 – 10–7 м. При исследовании таких систем важно знать степень дисперсности и характер распределения частиц по размерам. Это позволяет установить процентное содержание дисперсной фазы в заданных интервалах радиусов или фракционный состав системы.
В основу седиментационного анализа дисперсных систем в гравитационном поле положена зависимость скорости осаждения (всплывания) частиц дисперсной фазы от их размеров, корректная для условий, в которых соблюдается закон Стокса, а именно: частицы имеют сферическую форму, движутся без скольжения независимо друг от друга с постоянной скоростью, трение является внутренним для дисперсионной среды.
Относительная масса крупных частиц может превышать силу внутреннего трения, тогда их движение становится равноускоренным. Мелкие частицы участвуют в молекулярно-кинетическом движении, в результате чего возникает диффузионный поток частиц, направленный противоположно седиментационному потоку. На движении частиц сильно сказываются конвекционные тепловые потоки.
Сила трения f , Н, возникшая при движении шарообразной частицы радиуса r , м, со скоростью v , м/с, в среде с вязкостью η, Па с:
f = 6π r η v . |
(1.1) |
Если частица движется в поле земного притяжения в среде с плотностью ρ0 , кг/м3, то это движение направлено вниз, если плотность вещества дисперсной фазы ρ, кг/м3, больше плотности среды ρ >ρ0 , или вверх, если
7
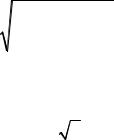
плотность вещества меньше плотности среды ρ<ρ0 . Сила тяжести, действующая на частицу, равна ее кажущемуся весу P, H:
P = |
4π r3 |
(ρ−ρ0 ) g , |
(1.2) |
|
3 |
||||
|
|
|
где r − радиус частицы, м;
g− ускорение свободного падения, м/с2;
ρи ρ0 − плотности дисперсной фазы и дисперсионной среды, кг/м3,
соответственно.
Постоянная скорость оседания v устанавливается при равенстве силы тяжести P и силы трения f :
|
4π r3 |
|
|
|
|
||
|
|
|
(ρ−ρ0 ) g = 6π r η v . |
(1.3) |
|||
3 |
|
||||||
|
|
|
|
|
|
||
Решение уравнения (1.3) относительно r имеет вид: |
|
||||||
|
|
r = |
|
9 η v |
|
||
|
|
|
|
. |
(1.4) |
||
|
|
|
2 (ρ−ρ0 ) g |
||||
Поскольку для данной системы все величины, кроме скорости, посто- |
|||||||
янны, можно записать уравнение (1.4) в следующем виде: |
|
||||||
|
|
|
|
r = K v . |
(1.5) |
||
Величину K , (м с)1 2 обычно называют константой уравнения Стокса. Способность системы к седиментации характеризуют константой седиментации Sсед , которая для сферических частиц имеет вид:
2 обычно называют константой уравнения Стокса. Способность системы к седиментации характеризуют константой седиментации Sсед , которая для сферических частиц имеет вид:
Sсед = |
2r2 |
(ρ−ρ0 ) |
(1.6) |
|
9η |
||
|
|
|
|
Единицей измерения константы |
седиментации Sсед является 1 Свед- |
||
берг, который равен 10–13 с. Уравнение (1.1) справедливо лишь для сферических частиц, движущихся равномерно с небольшой скоростью без скольжения в среде, которую можно считать безграничной по отношению к движущейся частице. Расстояние между такими частицами должно быть настолько велико, чтобы движение одних частиц не влияло на скорость других, поэтому анализ ведут обычно в суспензиях с концентрацией 0,05 – 0,5 % массовых.
8

Реальные суспензии очень часто содержат частицы, сильно отличающиеся от сферической формы. При исследовании таких суспензий с помощью седиментационного анализа радиус частиц, рассчитанный по (1.4), представляет собой радиус воображаемых сферических частиц, оседающих с такой же скоростью, что и частицы изучаемой суспензии, и называется эквивалентным радиусом.
Способы седиментационного анализа
1.Изучение скорости оседания частиц в гравитационном поле.
2.Наблюдение за оседанием высокодисперсных систем в центробежном поле.
Наиболее распространен первый способ, позволяющий определить скорость оседания частиц следующими методами:
а) измерения гидростатического давления в процессе оседания частиц; б) непрерывного взвешивания осадка; в) наблюдения за оседанием частиц с помощью микроскопа;
г) измерения концентрации частиц на определенной высоте.
Порядок выполнения работы методом измерения гидростатического давления
Скорость оседания дисперсной фазы определяют по изменению гидростатического давления столба суспензии при помощи седиментометра Виг- нера-Ребиндера (рис. 1.1).
Рисунок 1.1 − Седиментометр Вигнера-Ребиндера
9
Седиментометр построен по принципу сообщающихся сосудов, в один из которых (стеклянная трубка А) наливается исследуемая суспензия, а в другой (трубка В) помещается дисперсионная среда. Жидкости в обеих трубках находятся в гидростатическом равновесии. По мере оседания суспензии в трубке А уровень жидкости в трубке Вснижается.
Разница в высоте уровней в каждый момент времени пропорциональна весовому количеству вещества дисперсной фазы, находящегося во взвешенном состоянии. Так как гидростатическое давление представляет собой произведение высоты столба жидкости на ее удельный вес, то можно записать:
H ρ g = h ρ0 g , |
|
(1.7) |
||||
или |
|
|
|
|
|
|
|
H = |
ρ0 . |
|
|
|
(1.8) |
|
h |
ρ |
|
|
|
|
В этих формулах: H − уровень суспензии в широкой трубке, м; |
|
|||||
h − уровень жидкости (дисперсионной среды) в узкой трубке, м; |
|
|||||
ρ0 − плотность дисперсионной среды, кг/м3; |
|
|
||||
ρ − плотность дисперсной фазы, кг/м3. |
|
|
|
|||
После преобразования уравнения получим: |
|
|
||||
h − H = h |
(ρ−ρ |
) = H |
(ρ−ρ |
) . |
(1.9) |
|
ρ |
0 |
ρ |
0 |
0 |
|
|
|
|
|
|
|
|
|
Обычно дисперсионной средой служит вода, плотность которой при температуре опыта, близкой к 20 oС, можно без большой погрешности принять равной 103 кг/м3.
Величина H является практически постоянной вследствие того, что диаметр узкой трубки значительно меньше диаметра широкой трубки. Разность плотности суспензии и дисперсионной среды можно считать пропорциональной количеству вещества, находящегося во взвешенном состоянии:
ρ−ρ0 =C P , |
(1.10) |
H − h =C1 P , |
(1.11) |
где C и C1 − постоянные величины;
P − количество осажденного вещества.
10
