
- •Болезни печени
- •Стадии печёночной комы
- •Морфологические изменения в печени
- •Хронический гепатит g
- •Паразитарные поражения
- •Алкогольное поражение печени
- •Цирроз печени
- •Гемохроматоз
- •Циркуляторные расстройства в печени
- •Опухоли печени
- •Пороки развития печени
- •Поражения печени при беременности
- •Поражения печени у детей
- •Посттрансплантационные поражения печени
- •Пороки развития желчевыводящих путей
- •Болезни экзокринной части поджелудочной железы
- •Хроническая почечная недостаточность
- •Гломерулопатии
- •Классификация гломерулопатий
- •Развёрнутая классификация гломерулопатий
- •Воспалительные гломерулопатии
- •Фибромускулярная дисплазия
- •Инфаркты пoчек
- •Острый канальцевый некроз
- •Множественная миелома
- •Уратная нефропатия
- •Нефрокальциноз
- •Хронический пиелонефрит
- •Стадии хронического пиелонефрита
- •Подбор донора
- •Реакция организма реципиента
- •Отторжение трансплантата
- •Исходы и осложнения трансплантации почек
- •Почечно-клеточный рак
- •Нефробластома
- •Мезенхимальные опухоли почки
- •Кистозные болезни почек
- •Поликистозная болезнь почек взрослого типа
- •Поликистозная болезнь почек детского типа
- •Медуллярная губчатая почка
- •Нефронофтиз
- •Воспалительные заболевания
- •Опухоли лоханок и мочеточников
- •Факторы риска
- •Предопухолевые изменения
- •Пролиферативные изменения
- •Метапластические изменения
- •Опухоли мочевого пузыря
- •Доброкачественные эпителиальные опухоли
- •Злокачественные эпителиальные опухоли
- •Эндометриоз
- •Ревматизм
- •Ревматоидный артрит
- •Поражение суставов
- •Внесуставные проявления
- •Системная красная волчанка
- •Системная склеродермия
- •Поражения кожи и внутренних органов
- •Узелковый полиартериит
- •Дерматомиозит
- •Морфогенез
- •Механизмы действия возбудителей
- •Морфология инфекционных заболеваний
- •Инфекции органов дыхания
- •Парагрипп
- •Респираторно-синцитиальная инфекция
- •Аденовирусная инфекция
- •Орнитоз
- •Туберкулёз
- •Сальмонеллёз
- •Иерсиниозный энтерит
- •Кампилобактерный энтерит
- •Эшерихиозы
- •Гнойные и анаэробные инфекции
- •Скарлатина
- •Анаэробные инфекции
- •Гонорея
- •Хламидиозы
- •Паховый лимфогранулематоз
- •Трихомоноз
- •Инфекционный мононуклеоз
- •Полиомиелит
- •Ветряная оспа
- •Опоясывающий герпес
- •Болезнь лайма
- •Оппортунистические инфекции
- •Герпетическая инфекция
- •Цитомегаловирусная инфекция
- •Пневмоцистная инфекция
- •Аспергиллёз
- •Мукоромикоз
- •Кандидоз
- •Псевдомонадные инфекции
- •Амебиаз
- •Криптоспоридиоз
- •Токсоплазмоз
- •Трихинеллёз
- •Эхинококкоз
- •Цистицеркоз
- •Трахома
- •Лейшманиоз
- •Трипаносомозы
- •Шистосомоз
- •Филяриоз
- •Туляремия
- •Эпидемический возвратный тиф
- •Бруцеллёз
- •Карантинные инфекции
- •Натуральная оспа
- •Жёлтая лихорадка
- •Особенности вскрытия умерших от карантинных инфекций
- •Виды гипергликемических ком
- •Опухоли поджелудочной железы
- •Тиреоидиты
- •Опухоли щитовидной железы
- •Патология нейрогипофиза
- •Заболевания мозгового слоя надпочечников
- •Болезни шишковидной железы
- •Заболевания apud-системы
- •Множественная эндокринная неоплазия
- •Патология нейрона
- •Ноцицептивная система
- •Нейрогенные расстройства движений
- •Поражение пирамидного тракта
- •Расстройства трофической функции нервной системы
- •Алкоголизм
- •Наркомания и токсикомания
- •Объёмные внутричерепные заболевания
- •Набухание и отёк мозга
- •Гидроцефалия
- •Черепно-мозговая травма
- •Цереброваскулярные болезни
- •Инфекционные заболевания центральной нервной системы
- •Гнойные инфекции
- •Вирус ветряной оспы и опоясывающего герпеса
- •Бешенство
- •Персистирующие вирусные инфекции
- •Вирус иммунодефицита человека
- •Демиелинизирующие заболевания
- •Рассеянный склероз
- •Острый диссеминированный энцефаломиелит
- •Острый геморрагический лейкоэнцефалит
- •Витаминная недостаточность, нарушения углеводного обмена
- •Влияние злокачественных опухолей
- •Токсические и лучевые поражения
- •Алкогольные поражения
- •Нейродегенеративные процессы
- •Синдром паркинсона
- •Атаксия фридрайха
- •Врождённые аномалии развития центральной нервной системы
- •Повреждения мозга в перинатальном периоде
- •Заболевания спинного мозга
- •Опухоли центральной нервной системы
- •Нейроэпителиальные опухоли
- •Периферические невропатии
- •Опухоли периферических нервов
- •Опухоли из периферических ганглиев и параганглиев
- •Опухоли полового члена
- •Опухоли предстательной железы
- •Воспалительные заболевания
- •Опухоли
- •Заболевания оболочек яичка
- •Опухоли придатков яичек
- •Болезни шейки матки
- •Аденомиоз
- •Болезни маточных труб
- •Опухоли яичника
- •Зрелая тератома
- •Незрелая тератома
- •Дисгерминома
- •Опухоль эндодермального синуса
- •Гранулёзоклеточная опухоль взрослого типа
- •Опухоли молочной железы
- •Нарушения кровообращения
- •Плаценты близнецов
- •Поздний гестоз
- •Трофобластическая болезнь
- •Пузырный занос
- •Инвазивный пузырный занос
- •Хориокарцинома
- •Трофобластическая опухоль плацентарного ложа
- •Дисплазии
- •Хрящеобразующие опухоли
- •Костномозговые опухоли
- •Патогенез
- •Спондилоартропатии
- •Дистрофические заболевания суставов
- •Травмы костей
- •Асептический остеонекроз
- •Опухоли суставов
- •Опухолеподобные поражения суставов
- •Воспалительные и токсические миопатии
- •Псевдопаралитические миастении
- •Опухоли мягких тканей
- •Патология перинатального периода
- •Нарушения внутриутробного развития плода
- •Родовая травма
- •Инфекционные болезни плода и новорождённого
- •Гемолитическая болезнь новорождённых
- •Прочие болезни перинатального периода
- •Опухоли детского возраста
- •Классификация опухолей у детей
- •Синдром внезапной смерти младенцев
- •Нарушения пигментации кожи
- •Пигментный невус
- •Меланома
- •Предраковые заболевания кожи
- •Злокачественные эпителиальные опухоли
- •Заболевания и опухоли из придатков кожи
- •Эритема
- •Дерматиты
- •Изменения кожи при заболеваниях соединительной ткани
- •Красная волчанка
- •Грибковые инфекции
- •Паразитарные заболевания кожи
- •Патология органа зрения
- •Инфекционные заболевания глаза
- •Инфекционные заболевания роговицы и конъюнктивы
- •Инфекционные заболевания увеального тракта глазного яблока
- •Заболевания уха
- •Острая кишечная непроходимость
- •Классификация острой кишечной непроходимости
- •Септицемия
- •Хрониосепсис
- •Патоморфоз сепсиса
- •Генные болезни
- •Аутосомно-сцепленные врождённые пороки развития
- •Фенилкетонурия
- •Галактоземия
- •Хромосомные болезни
- •Синдромы, связанные с аномалиями половых хромосом
- •Мутации митохондриальных генов
- •Импринтинг генома
- •Болезни с наследственной предрасположенностью
- •Влияние генетических факторов на фармакодинамику
Патология перинатального периода
Перинатальный период — период с 22-й полной недели (154-го дня) внутриутробной жизни плода до семи полных суток после рождения ребёнка.
Неонатальный период начинается с момента рождения и заканчивается через 28 дней жизни ребёнка.
Живорождение — полное изгнание или извлечение продукта зачатия из организма матери независимо от продолжительности беременности, если плод имеет при рождении любой из четырёх признаков жизни: самостоятельное дыхание, сердцебиение, пульсацию сосудов пуповины, произвольные движения мускулатуры.
Мертворождение — смерть продукта зачатия, наступившая до его полного изгнания или извлечения из организма матери. Смерть, наступившая до начала родовой деятельности, называют антенатальной, смерть во время родов — интранатальной. Смерть плода, наступившую ранее 28 нед беременности, делят на раннюю (до 20 нед) и позднюю (21–28 нед).
Младенческая смертность — число детей, умерших в возрасте до 1 года на 1000 живорождённых.
Неонатальная смертность — число детей, умерших в возрасте до 28 суток на 1000 живорождённых. Выделяют следующие виды:
ранняя неонатальная смертность — смертность новорождённых в течение первых 7 сут жизни;
поздняя неонатальная смертность — смертность новорождённых с 8-го по 28-й полный день жизни.
Перинатальная смертность — число рождённых мёртвыми и умерших в первые 6 сут после рождения на 1000 рождённых живыми и мёртвыми. Показатели перинатальной смертности значительно неодинаковы в разных странах — от 12 до 50‰. В России этот показатель в 1999 г составил 14,3‰.
Срок беременности (гестационный возраст). Продолжительность беременности измеряют с первого дня последней нормальной менструации. Срок беременности выражают в полных днях или полных неделях. Средняя продолжительность беременности составляет 280 дней (40 нед).
Доношенный ребёнок — рождённый в срок беременности 37–42 нед (259–293 дня).
Нарушения внутриутробного развития плода
Недоношенность
Недоношенный ребёнок — рождённый при сроке беременности менее 37 полных недель. Обычно недоношенные дети имеют массу менее 2500 г и рост менее 45 см. С учётом детей, рождённых с массой более 500 г, частота невынашивания достигает 60% от числа рождённых детей.
Факторы риска рождения недоношенного ребёнка:
хронические соматические и гинекологические заболевания матери;
гестозы;
эндокринопатии;
предшествующие медицинские аборты;
малый интервал между беременностями;
неблагоприятные социально-экономические условия;
врождённые пороки развития плода;
внутриутробные инфекции плода.
Заболеваемость и смертность недоношенных детей очень высока. У преждевременно родившихся новорождённых часто бывают следующие заболевания и состояния:
перинатальная асфиксия;
гипотермия;
гипогликемия;
синдром дыхательных расстройств;
бронхолёгочная дисплазия;
аномалии водно-солевого обмена;
гипербилирубинемия;
внутричерепные кровоизлияния;
некротизирующий энтероколит;
инфекционные заболевания и др.
Морфологические признаки недоношенности:
пушковое оволосение лица, плеч, спины;
мягкие ушные раковины из-за слабого развития хрящей;
недоразвитие ногтевых пластинок;
мягкие кости черепа;
у мальчиков яички не опущены в мошонку, у девочек большие половые губы не прикрывают малые;
отсутствие или недоразвитие ядер окостенения в эпифизах длинных трубчатых костей (у доношенного зрелого плода диаметр ядра окостенения нижнего эпифиза бедра достигает 5–6 мм).
Морфофункциональные особенности внутренних органов недоношенных детей
Лёгкие. Развитие лёгких плода в первой половине внутриутробной жизни происходит путём образования из эпителия передней кишки системы ветвящихся трубочек — предшественников трахеи, бронхов, бронхиол. С 16 нед сегментация бронхов закончена, на их концах образуются ацинусы, выстланные кубическим эпителием. Дифференцировка альвеол начинается на 24 нед беременности. Альвеолы выстланы кубическим эпителием, в эпителиальных клетках возникают первые осмиофильные пластинчатые тельца. Между 26-й и 32-й неделями происходит уплощение кубического эпителия, его дифференцировка в альвеолоциты первого и второго типов. Альвеолоциты второго типа немногочисленны, расположены небольшими группами, в основном, в местах ветвления альвеолярных ходов. Перегородки между альвеолами содержат много соединительной ткани, капилляры не имеют тесного контакта с просветом альвеол (рис. 24-1). Дальнейшая дифференцировка лёгких приводит к уменьшению количества соединительной ткани и увеличению количества капилляров, однако даже у доношенного новорождённого альвеолы маленькие, а перегородки толще, чем у взрослого. Развитие альвеол продолжается и после рождения. Лёгкие ребёнка начинают соответствовать лёгким взрослого лишь к 8 годам жизни.

Рис. 24-1. Лёгкое 24-недельного плода. Альвеолы маленькие, выстланы кубическим эпителием. Дифференцировка альвеолоцитов отсутствует. Межальвеолярные перегородки широкие вследствие избытка соединительной ткани. Капилляры межальвеолярных перегородок немногочисленные, узкие. Окраска гематоксилином и эозином (x250).
Головной мозг. Извилины появляются на поверхности мозга, начиная с 20 нед внутриутробного развития. Вещество мозга мягкое, желатинообразное, граница между серым и белым веществом не выражена, что связано с незаконченной миелинизацией нервных волокон. У недоношенных детей под эпендимой желудочков расположен зародышевый слой из клеток — предшественников нейронов, постепенно мигрирующих в другие области головного мозга (рис. 24-2). Зародышевый слой исчезает к 34–36 нед внутриутробного развития.

Рис. 24-2. Головной мозг недоношенного новорождённого (32 нед). Под эпендимой бокового желудочка камбиальный слой с полнокровными сосудами. Окраска гематоксилином и эозином (x200).
Почки. У недоношенного ребёнка в субкапсулярной зоне расположены примитивные клубочки, в них париетальный и висцеральный листки капсулы Боумена выстланы кубическим эпителием (рис. 24-3). Число слоёв примитивных клубочков уменьшается (три слоя в 22 нед, два — в 26 нед, один слой — в 34 нед). Гломерулогенез заканчивается к 36 нед внутриутробного развития.

Рис. 24-3. Почка 26-недельного плода. Примитивные клубочки под капсулой. Окраска гематоксилином и эозином (x250).
Печень у недоношенных детей относительно большая, однако ферментные системы её незрелы. Физиологическая желтуха, возникающая после рождения в связи с разрушением фетального гемоглобина, у недоношенных детей бывает более выраженной и длительной из-за недостаточной активности глюкуронилтрансферазы. Характерно выраженное экстрамедуллярное кроветворение.
Надпочечники. Корковое вещество бывает сформировано к 21–22 нед беременности. Особенность строения надпочечников плода — наличие фетальной коры, состоящей из крупных полигональных клеток с крупными светлыми ядрами и пенистой цитоплазмой, расположенных в виде радиальных тяжей. После рождения ребёнка происходит редуцирование фетальной коры. Дефинитивная кора состоит из субкапсулярно расположенных клеток клубочковой зоны, лишь у зрелых плодов наблюдают начало формирования пучковой зоны. Мозговое вещество представлено небольшими группами базофильных клеток.
Переношенность
Содержание раздела «Переношенность» смотрите в книге.
Задержка внутриутробного роста и развития
Задержку внутриутробного роста диагностируют у детей, имеющих массу тела ниже 10 перцентилей для данного срока беременности. Адекватный рост зависит от обеспечения плода питательными веществами. Оно может быть нарушено при заболеваниях и нарушении питания матери, плацентарной недостаточности, болезнях самого плода. Рост плода также зависит от особенностей его эндокринной системы.
Гормональная регуляция роста плода
На рост плода не влияют гормоны роста и гормоны щитовидной железы. Функции анаболизма и роста при внутриутробном развитии выполняют другие гормоны, в частности, инсулин. Инсулин не проникает через плаценту и должен быть синтезирован самим плодом. При сахарном диабете беременной в связи с высоким уровнем сахара в крови, поступающей от матери, поджелудочная железа плода вырабатывает избыточное количество инсулина. Это вызывает повышение его массы. Если синтез инсулина плодом отсутствует (например, при агенезии островков Лангерханса), рост плода замедлен.
Причины задержки внутриутробного роста бывают фетальные, материнские, плацентарные.
● Фетальные причины: генетические (расовые, этнические, семейные, хромосомные и генные болезни), женский пол (девочки весят на 150–200 г меньше, чем мальчики), внутриутробные инфекции.
● Материнские причины: артериальная гипертензия, токсикоз, нарушения питания, хроническая гипоксия (болезни лёгких, сердца, крови, курение), приём алкоголя, наркотиков, небольшой рост, масса тела до беременности менее 50 кг, многоплодная беременность.
● Плацентарные причины: гипоплазия, предлежание, инфаркты плаценты, инфекции, аномалии пуповины.
Заболеваемость и смертность детей с задержкой внутриутробного роста выше, чем у детей с нормальной для данного гестационного возраста массой тела. У детей с задержкой внутриутробного роста повышена частота асфиксии, гипотермии, гипогликемии, инфекционных заболеваний. Смертность в группе детей с задержкой внутриутробного роста в 3–5 раз превышает средние показатели. Выделяют гипопластический и гипотрофический варианты задержки внутриутробного роста плода.
● Гипопластический вариант — симметричное отставание в росте, когда вес, длина и окружность головы снижены на равное количество перцентилей. Такой вариант наблюдают, если рост плода нарушен в I и II триместрах беременности. При этом в органах уменьшено количество клеток. Прогноз при гипопластическом варианте задержки внутриутробного роста неблагоприятный.
● Гипотрофический вариант наблюдают, если рост и окружность головы снижены меньше, чем масса ребёнка (асимметричная форма). Гипотрофия развивается в последние 2–3 мес беременности. Прогноз более благоприятный, чем при гипопластическом варианте.
Внутриутробная гипоксия
Внутриутробная гипоксия — состояние гипоксемии, возникающее в результате нарушения маточно-плацентарного или плацентарно-плодного кровообращения. Термин «асфиксия» (удушье) неверен, так как у плода отсутствует лёгочное дыхание. Внутриутробная гипоксия может быть острой и хронической.
● Острая гипоксия плода наступает при остром нарушении маточно-плацентарного или плацентарно-плодного кровообращения: преждевременной отслойке плаценты, выпадении пуповины, истинных узлах или обвитии пуповины вокруг шеи, конечностей плода. Чаще возникает во время родов.
● Хроническая гипоксия — проявление хронической плацентарной недостаточности (гипоплазии или повторных инфарктов плаценты, её незрелости, недостаточной васкуляризации). Причины хронической гипоксии плода — гестозы и соматические заболевания матери (анемия, декомпенсированные пороки сердца, хронические заболевания лёгких, сахарный диабет и др.).
При недостатке кислорода в крови плода развивается метаболический и дыхательный ацидоз, в тканях растёт интенсивность гликолитических процессов и уменьшается количество гликогена. Вначале отмечают резкое повышение АД, затем падение сосудистого тонуса с развитием общего венозного полнокровия. Возникают повышение сосудистой проницаемости, отёк и диапедезные кровоизлияния. В тяжёлых случаях происходит активация фибринолитической активности крови, что усиливает кровоточивость. Гипоксия стимулирует дыхательный центр головного мозга, что активирует дыхательные движения плода и приводит к аспирации околоплодных вод. Раздражение блуждающего нерва вызывает усиление моторики кишечника и выделение мекония в околоплодные воды.
Морфология внутриутробной гипоксии связана с признаками общего венозного полнокровия. Характерны множественные диапедезные кровоизлияния в слизистые и серозные оболочки, паренхиму внутренних органов. В полостях сердца и крупных сосудах — тёмная жидкая кровь. В лёгких могут быть обнаружены элементы околоплодных вод и родовых путей — чешуйки ороговевшего эпителия, пушковые волосы (лануго), глыбки мекония, аморфные белковые массы (рис. 24-4). При аспирации инфицированных околоплодных вод (при хориоамнионите, эндометрите, вагините матери) среди аспирированных частиц находят большое число микроорганизмов и материнских лейкоцитов. Проксимальные отделы толстой кишки спавшиеся, не содержат мекония. В головном мозге — отёк, стаз, диапедезные кровоизлияния. Характерны субарахноидальные кровоизлияния в височной, теменной долях, мозжечке. Возможны кровоизлияния под эпендиму желудочков с их прорывом в полость. При длительной тяжёлой гипоксии, кроме того, возникают тяжёлые дистрофические и некротические изменения в паренхиматозных органах, нейронах головного и спинного мозга.
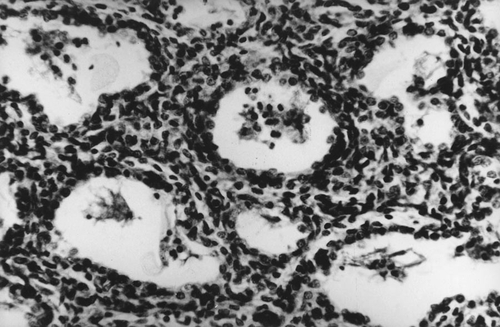
Рис. 24-4. Лёгкие 28-недельного новорождённого с аспирацией околоплодных вод. В просвете альвеол роговые чешуйки, аморфные массы, альвеолярные макрофаги и единичные лейкоциты. Окраска гематоксилином и эозином (x250).
БОЛЕЗНИ ЛЁГКИХ ПЕРИНАТАЛЬНОГО ПЕРИОДА
Синдром дыхательных расстройств новорождённых
Этот синдром объединяет заболевания лёгких неинфекционной природы, возникающие в перинатальном периоде. Клинические проявления: тахипноэ, втяжение «уступчивых» мест грудной клетки, цианоз. Данную группу заболеваний называют также респираторным дистресс-синдромом, или пневмопатией. Различают несколько вариантов синдрома дыхательных расстройств, прежде всего, болезнь гиалиновых мембран. Основное звено в патогенезе синдрома дыхательных расстройств — дефицит сурфактанта.
Сурфактант синтезируют пневмоциты второго типа и бескаёмчатые эпителиоциты респираторных бронхиол. Незрелые предшественники этих клеток появляются в лёгких плода лишь в 20–24 нед, в этот период сурфактант начинают обнаруживать в ткани лёгких и амниотической жидкости в незначительных количествах. Количество пневмоцитов второго типа и бескаёмчатых эпителиоцитов с признаками синтетической активности быстро растёт с 24 нед и достигает максимума к 35 нед беременности. До 32–34 нед внутриутробного развития синтез сурфактанта происходит, в основном, за счёт метилирования этаноламина, позднее — холиновым путём. Первый путь синтеза сурфактанта несовершенен и легко истощается под влиянием гипоксии, ацидоза, гипотермии, часто возникающих у новорождённых, особенно у недоношенных. Важную роль в метаболизме сурфактанта играют гормоны. Глюкокортикоиды, гормоны щитовидной железы, эстрогены ускоряют созревание лёгких и уменьшают риск развития пневмопатий у недоношенных плодов. Очень велика роль инсулина, рецепторы к нему обнаружены на пневмоцитах второго типа. Избыток инсулина приводит к замедлению созревания пневмоцитов второго типа, снижению содержания ненасыщенного фосфатидилхолина, фосфатидилглицерина и сурфактантных апопротеинов.
Если беременная женщина страдает сахарным диабетом, у плода развивается гипергликемия и гиперинсулинизм. У таких детей значительно повышена частота возникновения синдрома дыхательных расстройств, главным образом, болезни гиалиновых мембран.
Недостаток сурфактанта приводит к низкому поверхностному натяжению альвеол и ателектазу, гиповентиляции, гипоксемии, гиперкапнии. Связанные с этим ацидоз и спазм лёгочных сосудов повреждают эндотелий капилляров и покровный эпителий альвеол. Это приводит к истечению плазмы в альвеолы и формированию гомогенных эозинофильных масс из фибрина и некротизированных клеток. Экссудат выстилает внутреннюю поверхность альвеол, по внешнему виду его называют гиалиновыми мембранами. Гиалиновые мембраны, нарушая газообмен, усиливают гипоксемию и способствуют снижению синтеза сурфактанта, таким образом, формируя «порочный круг».
Факторы риска синдрома дыхательных расстройств — заболевания и состояния, приводящие к недостатку сурфактанта в лёгких новорождённого:
недоношенность и незрелость;
внутриутробная гипоксия;
сахарный диабет матери;
родоразрешение путём кесарева сечения (при этом в предродовом и родовом периодах нет выделения катехоламинов и, следовательно, не происходит адаптация лёгких плода к внеутробной жизни).
Морфология при болезни гиалиновых мембран: лёгкие безвоздушные, тёмно-красного цвета, характерной «резиновой» консистенции. Микроскопически внутренняя поверхность альвеол, альвеолярных ходов и терминальных бронхиол выстлана гиалиновыми мембранами — гомогенными эозинофильными массами, лежащими на эпителии или непосредственно на базальной мембране в местах гибели эпителия (рис. 24-5). Основа гиалиновых мембран — фибрин, в них также находят высокие количества тирозин-α1-антитрипсина и компонента С3 комплемента. Нередки кровоизлияния в строму и просвет альвеол. Артерии сужены, вены и лимфатические сосуды расширены. Клеточная воспалительная реакция на гиалиновые мембраны не выражена.

Рис. 24-5. Болезнь гиалиновых мембран. Лёгочная ткань незрелая, с дистелектазом (некоторые альвеолы спавшиеся, другие — резко расширены). Внутренняя поверхность альвеол выстлана гомогенными эозинофильными массами, местами плотно прилежащими к повреждённому эпителию альвеол. Окраска гематоксилином и эозином (x150).
Синдром массивной аспирации
Синдром массивной аспирации околоплодных вод и мекония развивается при внутриутробной гипоксии. При аспирации мекониальных вод лёгкие приобретают зеленоватый оттенок, в просвете трахеи и крупных бронхов — мекониальные пробки. Микроскопически в просвете дыхательных путей обнаруживают содержимое околоплодных вод: слущенные клетки плоского эпителия, роговые чешуйки, пушковые волоски (лануго), частицы мекония. Основной патогенетический механизм синдрома связан с ингибированием меконием сурфактанта, последующим развитием ателектазов и нередко гиалиновых мембран. Нередко сочетание синдрома аспирации околоплодных вод с персистирующей лёгочной гипертензией.
Другие варианты синдрома дыхательных расстройств.
● Первичный (врождённый) ателектаз проявляется у глубоко недоношенных новорождённых сразу после рождения. Макроскопически: лёгкие безвоздушные, синюшные, уменьшены в объёме. Края лёгких уплощены, заострены. Микроскопически значительная часть лёгочной паренхимы безвоздушная, с отдельными расширенными респираторными бронхиолами и альвеолярными ходами.
● Отёк и кровоизлияния в лёгкие чаще наблюдают у новорождённых, проживших более 2 сут. Лёгкие плотные, тяжёлые, с крупными участками кровоизлияний. В трахее и бронхах — окрашенная кровью пенистая жидкость. Микроскопически альвеолы, бронхиолы и ряд бронхов заполнены эритроцитами. Возможно сочетание кровоизлияний с гиалиновыми мембранами, аспирацией околоплодных вод, пневмонией. Существует мнение, что кровоизлияния в лёгкие — проявление острой левожелудочковой недостаточности, а не истинный признак синдрома дыхательных расстройств.
Бронхолёгочная дисплазия
Бронхолёгочная дисплазия — осложнение терапии синдрома дыхательных расстройств у недоношенных (в течение продолжительного времени — кислород в высоких концентрациях и искусственная вентиляция лёгких под высоким давлением). Для бронхолёгочной дисплазии характерно сочетание очагов эмфиземы и ателектаза (дистелектаз). Микроскопически обнаруживают некроз эпителия дистальных бронхов, бронхиол и альвеол, позднее — мононуклеарную воспалительную реакцию, пролиферацию фибробластов и миофибробластов, приводящую к выраженному фиброзу стромы. Регенерация эпителия бронхов и бронхиол, как правило, протекает с гиперплазией и плоскоклеточной метаплазией эпителия. Происходит гиперплазия мышечного слоя бронхов и бронхиол, фиброз межальвеолярных перегородок. В тяжёлых случаях возникают облитерирующий бронхит и бронхиолит. Наблюдают признаки персистирующей эмфиземы и лёгочной гипертензии. Бронхолёгочная дисплазия нарушает постнатальное развитие лёгких (отсутствие мультипликации альвеол), что ведёт в дальнейшем к уменьшению размеров и объёма лёгких. Дети, страдающие бронхолёгочной дисплазией, отстают в физическом и умственном развитии, часто страдают лёгочными инфекциями.
