коллоквиум VI
ФИЗИКОХИМИЯ ПОВЕРХНОСТНЫХ ЯВЛЕНИЙ
Термодинамика поверхностного слоя. Поверхностные явления и их значение в фармации. Поверхностная энергия и поверхностное натяжение. Факторы, влияющие на поверхностное натяжение. Классификация сорбционных процессов. Удельная адсорбция и способы ее выражения.
Адсорбция на границе раздела жидкость-газ, жидкость-жидкость. Движущая сила адсорбции. Уравнение Гиббса и его анализ. Поверхностно-активные (ПАВ), поверхностно-инактивные (ПИАВ) и поверхностно-неактивные (ПНВ) вещества. Поверхностная активность. Правило Дюкло – Траубе. Определение площади, занимаемой молекулой ПАВ в насыщенном адсорбционном слое, и максимальной длины его молекулы. Методы определения поверхностного натяжения. Применение ПАВ в фармации.
Адсорбция на границе раздела твердое тело–газ, твердое тело–жидкость. Теории адсорбции (Ленгмюра, Поляни, БЭТ). Факторы, влияющие на величину адсорбции. Уравнения Фрейндлиха и Ленгмюра, определение их констант по экспериментальным данным. Адсорбция из растворов. Особенности адсорбции электролитов. Явление смачивания. Краевой угол. Пути управления процессами смачивания.
Адсорбция электролитов. Эквивалентная и избирательная адсорбция ионов. Правило Панета – Фаянса. Ионообменная адсорбция. Иониты и их классификация. Применение ионитов в фармации.
Хроматография. Классификация хроматографических методов по технике выполнения и механизму процесса. Применение хроматографии для разделения и анализа лекарственных веществ. Гель-фильтрация.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
6.1 термодинамика поверхностного слоя.адсорбция. значение поверхностных явлений в фармации
6.2. Адсорбция на жидкой поверхности
6.3. Адсорбция на твердой поверхности. Теории Адсорбции
6.4. Молекулярная адсорбция из растворов. особенности Адсорбции электролитов
6.5. смачивание
6.1 термодинамика поверхностного слоя. значение поверхностных явлений в фармации
Поверхностными явлениями называются процессы, происходящие на границе раздела фаз в гетерогенных системах и обусловленные особенностями состава и строения поверхностного слоя. Молекулы конденсированных фаз, находящиеся на поверхности раздела, обладают избыточной энергией по сравнению с молекулами в объеме фазы из-за нескомпенсированности их межмолекулярных взаимодействий. Это порождает возникновение на поверхности раздела поверхностных сил и избытка энергии, которую называют поверхностной энергией или энергией Гиббса поверхности (GS, моль/м2). Последняя в свою очередь и служит причиной интенсификации поверхностных явлений, протекающих самопроизвольно (ΔG < 0).
В изобарно-изотермических условиях энергия Гиббса поверхности пропорциональна площади межфазной поверхности (S, м2) и поверхностному натяжению (σ, Дж/м2):
|
|
(6.1) |
Стремление системы к уменьшению функции Гиббса поверхности может реализоваться как через уменьшение величины площади поверхности, так и величины поверхностного натяжения.
Поверхностное натяжение – это величина работы, которую необходимо совершить в изотермических условиях, чтобы увеличить площадь межфазной поверхности на единицу.
К поверхностным явлениям, связанным с уменьшением поверхности, можно отнести:
1) стремление капель жидкости или пузырьков газа образовывать сферическую форму;
2) слипание твердых частиц дисперсной фазы в процессе коагуляции;
3) слияние капель эмульсии или пузырьков газа в пенах при коалесценции;
4) рост кристаллов.
К поверхностным явлениям, связанным с уменьшением поверхностного натяжения, относят адсорбцию, адгезию, смачивание.
Адсорбция – самопроизвольный процесс накопления (повышения концентрации) вещества одной фазы на поверхности другой. При этом вещество, накапливающееся на поверхности, называется адсорбатом, а вещество, на поверхности которого идет адсорбция – адсорбентом. Адсорбция может происходить из газов или жидкостей (растворов), а агрегатное состояние поверхности, на которой происходит адсорбция, – жидкость или твердое тело. Поэтому различают адсорбцию на твердой и жидкой поверхности. Наиболее часто в качестве адсорбентов используют высокопористые материалы с развитой поверхностью: активированные угли, силикагель, пористые полимерные смолы и др.
Адсорбция представляет собой частный случай процесса сорбции – поглощения каким-либо веществом других веществ. Если поглощение не ограничивается поверхностным слоем, а происходит во всем объеме, то этот процесс называется абсорбцией, а обратный процесс – десорбцией.
В зависимости от характера взаимодействия адсорбента и адсорбата различают адсорбцию физическую и химическую (хемосорбция). Физическая адсорбция обусловлена проявлением сил Ван-дер-Ваальса, хемосорбция осуществляется путем образования химических связей. Характер реализуемого взаимодействия определяет свойства физической адсорбции и хемосорбции. Физическая адсорбция характеризуется обратимостью и установлением адсорбционного равновесия, уменьшением адсорбции при повышении температуры. Хемосорбция необратима, при десорбции происходит выделение не исходного адсорбата, а продукта его взаимодействия с адсорбентом.
По степени заполнения поверхности адсорбция подразделяется на моно- и полимолекулярную, а по природе адсорбируемых частиц – на молекулярную, ионную и ионообменную.
Наибольшую значимость поверхностные явления приобретают в микрогетерогенных и ультрамикрогетерогенных дисперсных системах, поскольку они имеют очень большую площадь поверхности. Особо следует выделить роль этих явлений в живой природе. В каждой живой системе существует огромное количество границ раздела, поскольку организм можно рассматривать как совокупность систем с высокоразвитыми поверхностями. Это кожа, стенки кровеносных сосудов, мембраны клеток, оболочки органов и т.п. Так площадь поверхности альвеол взрослого человека достигает 1000 м2.
С процесса адсорбции начинается взаимодействие любых веществ с клетками и тканями организма, взаимодействие ферментов с субстратами, антител с антигенами и др.
Большинство физиологических процессов, например, дыхание, пищеварение и др. происходят на поверхности биомембран (рис.6.1). Кроме того, действие лекарственных препаратов, токсических веществ на организм также осуществляется с участием границы раздела фаз. Поэтому для их понимания требуется знание основных закономерностей поверхностных явлений.

Рис. 6.1. Модели строения биологической мембраны: а) — по Даниэли и Давсону: 1 — липидный бислой; 2 — мономолекулярный слой белков; б) — мозаичная модель: 1 — липидный бислой; 2 — поверхностный слой белков; 3 — интегральные белки; 4 — ионный канал.
В медицине большое применение имеет абсорбционная терапия, простейшим примером является использование в качестве адсорбентов активированного угля, гидроксида алюминия в составе препарата «альмагель» для связывания токсинов, попадающих в желудочно-кишечный тракт. Кроме того, в последнее время планомерно развивается эфферентная медицина, которая осуществляет интенсивную детоксикацию организма. Причем, в зависимости от конкретных целей сорбционная детоксикация организма осуществляется путем гемосорбции, плазмосорбции, лимфосорбции, энтеросорбции, ликвосорбции и аппликационной сорбции. Адсорбентами являются и многие биологически активные добавки (БАД), ассортимент и производство которых в последнее время возрастает.
В фармацевтической промышленности адсорбенты, в частности, активированные угли, нашли широкое применение для очистки лекарственных препаратов.
Поверхностные явления лежат в основе хроматографического метода анализа и широко применяются в медико-биологических исследованиях и клинической практике.
Хроматография основана на многократно повторяющихся процессах сорбции и десорбции с обязательным участием двух фаз: неподвижной (стационарной) и подвижной.
Неподвижная фаза представляет собой сорбент с развитой поверхностью, а подвижная (элюэнт) – поток газа или жидкости, поэтому различают газовую или жидкостную хроматографию.
При внесении смеси веществ в хроматографическую систему осуществляется сложный характер взаимодействия между веществом – подвижной и неподвижной фазами.
По доминирующему механизму взаимодействия различают адсорбционную, распределительную, ионообменную и другие виды хроматографии.
Адсорбционная хроматография основана на различии в адсорбционных свойствах разделяемых веществ. Компоненты смеси не адсорбируемые на твердой неподвижной фазе, будут находиться во время анализа только в подвижной фазе, поэтому их скорость перемещения вдоль неподвижной фазы будет максимально возможной. А компоненты, обладающие хорошей адсорбционной способностью, будут медленно перемещаться вдоль неподвижной фазы.
С точки зрения техники проведения эксперимента различают колоночную (разновидность – капиллярная), бумажную и тонкослойную хроматографию.
Для проведения точных количественных анализов применяют специальные приборы – хроматографы, которые, например, за считанные минуты могут определить в крови присутствие алкоголя, наркотиков, летучих компонентов, вызывающих токсикоманию.
6.2. Адсорбция на жидкой поверхности
Данный вид адсорбции заключается в том, что растворенное в жидкости вещество концентрируется на поверхности жидкого раствора на границе его с газом. При этом различные растворенные вещества по разному влияют на поверхностное натяжение растворов.
1. Вещества, понижающие поверхностное натяжение, называются поверхностно-активными (ПАВ).
По отношению к воде поверхностно-активными являются спирты, жирные кислоты и их соли, амины и другие вещества, что является следствием их особого строения. Молекулы ПАВ имеют неполярную часть (углеводородный радикал) и полярную – представленную функциональными группами (–COOH; –OH; –NH2; –SO2OH и др.). Таким образом, молекулы ПАВ имеют асимметричное или дифильное строение. Схематически молекулу ПАВ принято изображать так:

2. Вещества, повышающие поверхностное натяжение, называются поверхностно-инактивными (ПИАВ). К ним относятся сильные электролиты: соли, щелочи, кислоты. Ионы, образующиеся в результате диссоциации, взаимодействуют с водой сильнее, чем молекулы воды между собой. Поэтому значительная часть ионов увлекается молекулами воды в объем раствора, а немногие оставшиеся на поверхности ионы создают на поверхности силовое поле, повышая тем самым поверхностное натяжение.
3. Существуют вещества, растворение которых практически не приводит к изменению поверхностного натяжения, поверхностно-неактивные вещества (ПНВ). К ним относятся вещества, которые имеют много полярных групп, например, сахароза и некоторые другие углеводы.
Следует отметить, что понятия ПАВ и ПИАВ не носят абсолютный характер, они определяются выбранным растворителем, его поверхностным натяжением σ0. Зависимость поверхностного натяжения от концентрации растворенного вещества для указанных групп веществ представлена на рис. 6.2.

Рис. 6.2. Зависимости поверхностного натяжения растворов от концентрации: 1 — поверхностно-активных; 2 — поверхностно-инактивных; 3 — не влияющих на величину поверхностного натяжения веществ.
Адсорбция молекул поверхностно-активных веществ на поверхности раствора служит примером адсорбции на границе раздела жидкость-газ.
Количественной характеристикой данного вида адсорбции является величина избыточной (гиббсовской) адсорбции Г, которая определяется как некоторый избыток растворенного вещества в поверхностном слое (на единицу площади поверхности) по сравнению с его количеством в таком же по толщине слое объемной фазы (моль/м2):
|
|
(6.2) |
где СS и СV – концентрации растворенного вещества в поверхностном слое и объеме фазы, соответственно, моль/м3; VS – объем поверхностного слоя, м3; S – площадь поверхности, м2.
Простых и общедоступных методов прямого определения избытка растворенного вещества в поверхностном слое на жидких границах раздела пока не существует. Но так как адсорбция молекул ПАВ в растворах всегда сопровождается уменьшением поверхностного натяжения (рис. 6.2), то в данном случае о величине избыточной адсорбции можно судить по изменению величины поверхностного натяжения раствора.
Наиболее доступными для экспериментального определения поверхностного натяжения являются системы жидкость-газ и жидкость-жидкость.
Существующие методы определения поверхностного натяжения делят на три группы: статические, полустатические и динамические.
Динамические методы дают возможность измерять поверхностное натяжение при движущейся поверхности раздела, например, при механических воздействиях на жидкость, сопровождающихся периодическими растяжениями и сжатиями ее поверхности. Недостатком данного метода является сложность аппаратурного оформления и определение неравновесного значения поверхностного натяжения. К динамическим методам относятся: метод капиллярных волн и метод колеблющейся струи.
На практике наиболее часто используют статические и полустатические методы, позволяющие измерять равновесные значения поверхностного натяжения.
Статическими методами определяют поверхностное натяжение практически неподвижных поверхностей, образованных задолго до начала измерений и поэтому находящихся в равновесии с объемом жидкости. К этим методам относятся: метод капиллярного поднятия и метод лежащей или висящей капли (пузырька).
Полустатическими называют методы определения поверхностного натяжения границы раздела фаз, возникающей и периодически обновляемой поверхности в процессе измерения. К ним относятся: метод максимального давления пузырька и сталагмометрический метод.
Для определения величины поверхностного натяжения наиболее широко используется сталагмометрический метод (метод счета капель). Значение σ находят путем сравнения данных по истечению из сталагмометрической трубки исследуемого раствора ПАВ (например, спирта) и стандартной жидкости с известным значением поверхностного натяжения (например, воды).
Значение σ рассчитывают по формуле
|
|
(6.3) |
где n – число капель жидкости, r – плотность жидкости, кг/м3.
Таблица 6.1
Поверхностное натяжение некоторых веществ на границе с воздухом и температурный коэффициент поверхностного натяжения
Вещество |
Т, К |
σ · 103, Дж/м2 |
dσ/dΤ ·103, Дж/(моль К) |
Гелий (ж) |
3 |
0,22 |
|
Азот (ж) |
80 |
8,27 |
|
Эфир |
293 |
17,0 |
|
Гексан |
298 |
17,9 |
|
Этанол |
298 |
22,1 |
|
Бутанол–1 |
298 |
24,5 |
-0,0822 |
Молоко |
298 |
45–60 |
|
Сыворотка крови человека |
311 |
46,0–47,0 |
|
Вода |
298 |
71,5 |
-0,1541 |
Ртуть |
298 |
473,5 |
-0,2330 |
Кварцевое стекло (т) |
298 |
740 |
|
Серебро (т) |
298 |
1140 |
|
Алмаз (т) |
298 |
11400 |
|
Зная поверхностное натяжение, избыточную адсорбцию Г на поверхности раздела раствор – газ рассчитывают по уравнению Гиббса:
|
|
(6.4) |
где С – концентрация раствора, моль/м3; R – универсальная газовая постоянная, R = 8,314 Дж/(моль ∙ К); Т – абсолютная температура, К; σ – поверхностное натяжение, Дж/м2 или Н/м.
В
такой форме уравнение Гиббса применяют
для разбавленных растворов. Проанализируем
данное уравнение. Значение
![]() соответствует
накоплению вещества в поверхностном
слое (Г > 0 - положительная адсорбция).
Пределом ее служит полное насыщение
поверхностного слоя адсорбируемым
веществом
соответствует
накоплению вещества в поверхностном
слое (Г > 0 - положительная адсорбция).
Пределом ее служит полное насыщение
поверхностного слоя адсорбируемым
веществом
![]() .
.
Значение
![]() соответствует
уменьшению вещества в поверхностном
слое (Г < 0 - отрицательная адсорбция).
соответствует
уменьшению вещества в поверхностном
слое (Г < 0 - отрицательная адсорбция).
Из
уравнения Гиббса (6.4) следует, что величина
![]() является
характеристикой поведения вещества
при адсорбции. Однако, ее значение
зависит от концентрации и, чтобы придать
этой величине вид характеристической
постоянной, берут ее предельное значение
при С
→ 0. Эту величину П. А. Ребиндер (1924) назвал
поверхностной
активностью g.
Количественно ее выражают отношением
является
характеристикой поведения вещества
при адсорбции. Однако, ее значение
зависит от концентрации и, чтобы придать
этой величине вид характеристической
постоянной, берут ее предельное значение
при С
→ 0. Эту величину П. А. Ребиндер (1924) назвал
поверхностной
активностью g.
Количественно ее выражают отношением
|
|
(6.5) |
и измеряют в Дж∙м/моль или Н∙м2/моль. Чем в большей степени уменьшается поверхностное натяжение с увеличением концентрации адсорбируемого вещества, тем больше поверхностная активность этого вещества, и тем больше его гиббсовская адсорбция.
Значение поверхностной активности g можно определить графически по экспериментальной изотерме поверхностного натяжения (рис. 6.3) как отрицательный тангенс угла наклона касательной к изотерме поверхностного натяжения при С → 0.

Рис. 6.3. Графическое определение величины поверхностной активности
Поверхностно-активные свойства ПАВ зависят от числа метиленовых групп в углеводородном радикале, природы и содержания полярных групп, входящих в состав ПАВ. Установлены следующие закономерности:
1. Поверхностная активность возрастает с уменьшением полярности вещества. Поэтому поверхностная активность у органических кислот больше, чем у их солей.
2. Согласно правилу Дюкло – Траубе поверхностная активность спиртов, жирных кислот, аминов и других веществ в гомологических рядах на поверхности раздела раствор – газ возрастает в 3 – 3,5 раза при увеличении углеводородного радикала на каждую –СН2–группу.
|
|
(6.6) |
где n – число метиленовых групп в углеводородном радикале.
Например,
|
|
|
Это правило выполняется лишь для водных растворов ПАВ. Для растворов ПАВ в неполярных растворителях поверхностная активность при увеличении длины углеводородного радикала, наоборот, уменьшается (обращение правила Дюкло – Траубе).
По изотерме поверхностного натяжения можно рассчитать величину избыточной адсорбции Г на границе раздела раствор – воздух (или в общем случае жидкость – газ). Для этого проводят касательные к 4–5 точкам, соответствующим различным концентрациям раствора (рис. 6.4).
Отрезок
z,
отсекаемый на оси ординат касательной
и прямой, параллельной оси абсцисс,
имеет следующее математическое
выражение:![]() .
Величину z
измеряют в единицах поверхностного
натяжения.
.
Величину z
измеряют в единицах поверхностного
натяжения.

Рис. 6.4. Графическое решение уравнения Гиббса
При подстановке z в уравнение Гиббса (6.4) получают
|
|
(6.7) |
Определив значения z для нескольких концентраций, вычисляют соответствующие им величины избыточной адсорбции Г.
Для
вычисления величины предельной
адсорбции на границе раздела жидкость
– газ (![]() ),
соответствующей образованию насыщенного
мономолекулярного слоя из молекул ПАВ,
используют уравнение Ленгмюра в виде:
),
соответствующей образованию насыщенного
мономолекулярного слоя из молекул ПАВ,
используют уравнение Ленгмюра в виде:
|
|
(6.8) |
По
экспериментальным данным вычисляют
значения
![]() и
строят график в координатах
и
строят график в координатах
![]() (рис.
6.5).
(рис.
6.5).
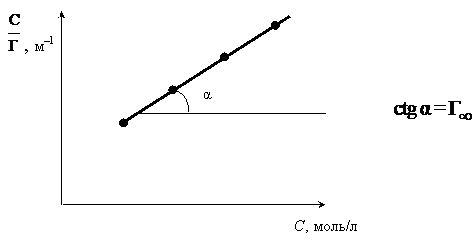
Рис. 6.5. Графическое решение уравнения Ленгмюра
Определив величину предельной адсорбции , можно рассчитать параметры адсорбционного слоя: площадь, занимаемую одной молекулой, S0 и толщину поверхностного слоя δ.
|
|
(6.9) |
|
|
(6.10) |
где М – молярная масса ПАВ, кг/моль; ρ – плотность раствора ПАВ, кг/м3; NA – постоянная Авогадро.
Ленгмюром экспериментально было определено, что площадь поперечного сечения молекул всех жирных кислот равна 20∙10-20 м2, а предельных спиртов – 25∙10-20 м2, площадь поперечного сечения холестерина – 40,8∙10-20 м2, лецитина – 52∙10-20 м2.
Уменьшение поверхностного натяжения в результате адсорбции ПАВ на границе раздела жидкость – газ описывается эмпирическим уравнением Шишковского:
|
|
(6.11) |
Вид данного уравнения подтверждается путем совместного решения уравнений Гиббса и Ленгмюра:
|
|
(6.12) |
При малых концентрациях ПАВ (линейный участок изотермы поверхностного натяжения) оно имеет вид
|
|
(6.13) |
При
этом
![]() и
не изменяется в гомологическом ряду, а
константа К
увеличивается в 3 – 3,5 раза при удлинении
цепи на одну –СН2-группу.
и
не изменяется в гомологическом ряду, а
константа К
увеличивается в 3 – 3,5 раза при удлинении
цепи на одну –СН2-группу.
В 1915 году Ленгмюр установил, что при адсорбции ПАВ полярная группа, обладающая большим сродством к полярной фазе, втягивается в воду, а неполярный радикал ориентируется в неполярную фазу.

Рис. 6.6. Ориентация молекул ПАВ на границе раздела твёрдое тело – раствор а) граница раздела: силикагель – бензол; б) граница раздела: сажа – вода.
Значение для биологических систем. В живых системах ПАВ играют исключительную роль, совмещая в своей структуре две системы – гидрофильную и гидрофобную. Именно такие вещества формируют основу тех клеточных мембран, которые обладают и гидрофильными, и гидрофобными свойствами одновременно.
Применение ПАВ в фармации. Поверхностно-активные вещества используются в производстве многих лекарственных препаратов, так как проявляют малую токсичность, легко получаются и обладают высокой стабилизирующей и смачивающей способностью. Соли высших карбоновых кислот (мыла) используются как эмульгаторы и стабилизаторы мазей и кремов. Соли аммониевых и сульфониевых оснований проявляют бактерицидные, дезинфицирующие свойства. Сложные эфиры сахарозы и одноосновных высших карбоновых кислот используют в производстве кишечнорастворимых покрытий для таблеток, шампуней, моющих средств, зубных паст.