
- •Редокс-равновесия и редокс-процессы
- •Примеры решения типовых задач Пример 1
- •Пример 2 . Определение направления редокс-процесса в стандартном состоянии
- •Пример 3
- •Пример 4
- •Пример 5
- •Пример 6
- •Пример 7
- •Пример 8
- •Пример 9
- •Пример 10
- •Пример 11
- •Пример 12
- •Пример 13
- •Пример 14
- •После введения некоторого количества протолита значение редокс-потенциала системы уменьшается:
- •Пример 15
- •Пример 16
- •Пример 17
- •Пример 18
- •Пример 19
- •Ответ: эдс гальванического элемента равна 0,118 в.
- •Задания для самостоятельной работы из «Сборника задач и упражнений по общей химии».
- •Изучение зависимости редокс-потенциала от соотношения концентраций окисленной и восстановленной форм
- •Изучение влияния лигандного окружения на редокс-потенциал
- •Задания для самостоятельной работы из «Сборника задач и упражнений по общей химии».
- •Изучение влияния рН на редокс-потенциал.
- •Измерение рН растворов с помощью стеклянного электрода
Пример 13
Расчет изменения редокс-потенциала при
введении в редокс-систему окислителя или восстановителя
Редокс-потенциал системы метгемоглобин/гемоглобин равен при 298 К 0,055 В. Как изменится редокс-потенциал системы, если 5 % гемоглобина будет окислено нитритом натрия?
Решение. Рассчитаем по модифицированному уравнению Нернста (8.2) соотношение концентраций окисленной (метгемоглобин) и восстановленной (гемоглобин) форм:
с(Hb-Fe3+) 0,055 – 0,17
lg = ——
с(Hb-Fe2+) 0,0591
с(Hb-Fe3+) с(Hb-Fe3+)
=10–1,95 = 0,0111 или ————— = 1:89
с(Hb-Fe2+) с(Hb-Fe2+)
Примем за х количество вещества метгемоглобина, тогда 89х – количество вещества гемоглобина. Окисляется 0,0589х = 4,45х гемоглобина. Поскольку стехиометрические
коэффициенты равны единице количество вещества образующегося метгемоглобина равно также 4,45х.
Для расчета редокс-потенциала при новом соотношении концентраций окисленной и восстановленной форм воспользуемся также модифицированным уравнением Нернста (8.2):
2,303 RT c(Fe3+) х+4,45х
φr = φr0 + lg ; φr = 0,17 +0,0591 lg ;
nF c(Fe2+) 89х+4,45х
φr = 0,17 + 0,0591 lg0,065 = 0,17 + 0,0591 (-1,19) = 0,1 В.
Ответ: редокс-потенциал в системе возрастает на 0,045 В.
Пример 14
Расчет рН раствора при введении в редокс-систему сильного протолита
В систему, содержащую хинон и гидрохинон в эквимолярном соотношении, ввели некоторое количество кислоты, при этом редокс-потенциал уменьшился на 77 мВ. На сколько единиц изменился при этом рН раствора? Т=298 К.
Решение. Воспользуемся модифицированным уравнением Нернста (8.6) для редокс-систем второго типа:
2,303 RT а(ox)аm(H+)
φr = φr0 + lg
nF а(red)
При температуре 298К значение множителя 2,303RT/ F равно 0,0591 В(табл. ).
Определим число электронов, принимающих участие в полуреакции:
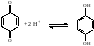 оx
red n
= 2; m=
2
оx
red n
= 2; m=
2
Преобразуем выражение аналогично примеру 8-11:
2,303 RT a(ox)
φr = φr0 + [lg - (-m lg a(Н+)) ] =
nF а(red)
0,0591рН
= φr0 - 2рН = φr0 - 0,0591рН
2
После введения некоторого количества протолита значение редокс-потенциала системы уменьшается:
φr ΄= φr0 - 0,0591рН΄.
Вычислим, на сколько единиц изменился рН раствора после введения некоторого количества протолита:
φr0 - φr ΄= 0,0591(рН΄- рН) = 0,0591ΔрН
Отсюда
φr0 - φr ΄ Δφr
ΔрН = =
0,0591 0,0591
0,077
ΔрН = = 1,3
0,0591
Ответ: рН увеличился на 1,3 единицы.
Пример 15
Расчет потенциала водородного электрода при заданном значении рН
Вычислите потенциал водородного электрода, насыщенного водородом при давлении 101 кПа, погруженного в дистиллированную воду при 298 К.
Решение. В соответствии с уравнением Нернста:
2,303RT
φr (Н2) = φr0 + lg (Н3О+)
zF
Стандартный потенциал водородного электрода принимается за 0; z = 1.
При температуре 298К значение множителя 2,303RT/ F равно 0,0591 В(табл. ).
Тогда
φr (Н2) = -0,0591рН,
рН дистиллированной воды при 298 К равен 7.
Вычислим значение редокс-потенциала водородного электрода:
φr (Н2) = 7 (-0,0591) = -0,413 В.
Ответ: -0,413 В.
__________________________________________________________________________________
