
- •Скорость химических реакций в гетерогенных системах
- •Химическое равновесие.
- •Экспериментальная часть.
- •Зависимость скорости реакции от концентрации реагирующих веществ.
- •Зависимость скорости реакции от температуры.
- •Влияние величены поверхности реагирующих веществ на скорость гетерогенных химических реакций.
- •Влияние концентрации реагирующих веществ на химическое равновесие.
- •Влияние температуры веществ на химическое равновесие.
- •Влияние величены поверхности реагирующих веществ на скорость гетерогенных химических реакций.
- •Влияние концентрации реагирующих веществ на химическое равновесие.
- •Влияние температуры веществ на химическое равновесие.
- •Влияние величены поверхности реагирующих веществ на скорость гетерогенных химических реакций.
- •Влияние концентрации реагирующих веществ на химическое равновесие.
- •Влияние температуры веществ на химическое равновесие.
Зависимость скорости реакции от концентрации реагирующих веществ.
Ход опыта:
Для проведения опыта было приготовлено 5 химических стаканов емкостью 50 мл, 7 пробирок и 2 капельные пипетки. В 5 стаканов налили по 10 мл раствора Б и дистилированной воды в количествах, указанных во 2-ой и 3-ей графах таблицы 1. Затем в одну из пробирок внесли 20 капель раствора А, а в другую 20 капель раствора Б. Быстро их слили и включили секундомер. Как только полученный раствор начал синеть, выключили секундомер и занесли данные в 5-ую графу таблицы 1. Тем же способом провели эксперименты с остальными стаканами.
Таблица 1
-
№ стакана
Обьем,
мл
Относительная конц. Na2SO4 a/(a+b) (нормальность)
Время, сек (t)
Относительная скорость реакции,
V= 1/ t, сек -1
Раств. В(а)
Дист. вода (б)
1.
10
0
0,02
23
0,043
2.
10
5
0,0133
31
0,032
3.
10
10
0,01
42
0,024
4.
10
15
0,008
69
0,014
5.
10
20
0,0066
105
0,009
Формула этой реакции выглядит следующим образом:
2KIO3 + 5Na2SO3 + H2SO4 = I2 + 5Na2SO4 + K2SO4 + H2O
или в ионном виде:
2IO3-+ 5SO32-+ 2H+ = I2 + 5SO42-+ H2O
Вычисление относительной скорости реакции:
V= 1/t:
V1=1/23=0,043
V2=1/31=0,032
V3=1/42=0,024
V4=1/69=0,014
V5=1/105=0,009
Начертим
график зависимости скорости реакции
от концентрации:
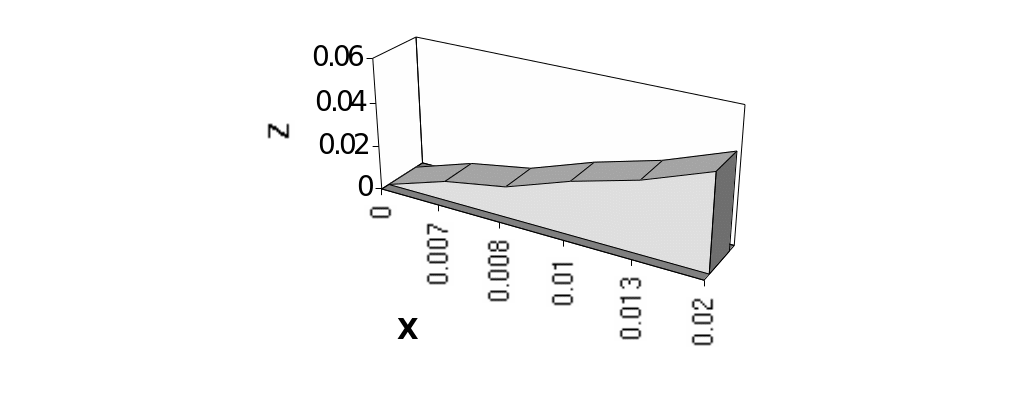
На оси Z показано изменение относительной скорости реакции в зависимости от значения относительной концентрации, отображенного на ось X.
Вывод:
В гомогенной системе относительная скорость протекания химических реакций прямо пропорционально зависит от значения относительной концентрации реагирующих веществ.
Опыт 2.
Зависимость скорости реакции от температуры.
Ход опыта:
Для проведения опыта подготовили 2 пробирки: в одну налили 20 капель 0,1н раствора щавелевой кислоты, а в другую столько же перманганата калия и 20 капель серной кислоты. Обе пробирки закрепили в крышке калориметра, наполовину заполненного водой, так, чтобы они не касались стенок и дна калориметра. Установили в калориметр термометр. Поставили калориметр на электрическую плитку и нагрели до 30оC. Затем содержимое 1-ой пробирки вылили во 2-ую, не вынимая ее из калориметра и включили секундомер. Отметили время с момента смешения до полного обесцвечивания смеси растворов, данные занесли в таблицу 2. Затем в той же последовательности выполнили 2-4 варианты опыта, повышая температуру каждый раз на десять градусов, пока она не достигла 60оС.
Для проведения этого опыта используем следующую реакцию:
5H2(CO2)2 + 2KMnO4 + 3H2SO4 = 10CO2 + 2MnSO4 + K2SO4 + 8H2O
или в ионном виде
5H2(CO2)2 + 2MnO4- + 6H+ = 10CO2 + 2Mn2+ + 8H2O
Таблица 2
-
№ опыта
Температура t, °С
Время от начала реакции до обесцвечивания , сек
Относительная скорость реакции
V=1 / , сек -1
1.
30
37.3
0.026
2.
40
18.7
0.053
3.
50
9.9
0.10
4.
60
5.4
0.20
Расчет температурного коофициента:
Vt2=Vt1*t/10
t=10, =Vt2/Vt1
g1= 0.053/0.026 = 2.03
g2= 0.1/0.053 = 1.88
3= 0.2/0.1 = 2
<>=1.97
Исходя из полученных данных, построим график зависимости скорости реакции от температуры:
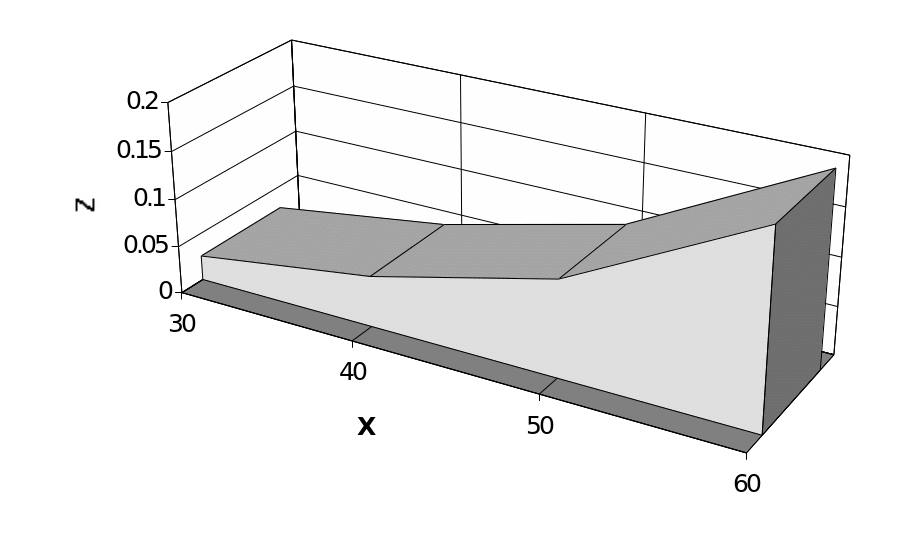 На
оси Z
отображены значения относительной
скорости реакции в зависимости от
температуры, отображенной на ось X.
На
оси Z
отображены значения относительной
скорости реакции в зависимости от
температуры, отображенной на ось X.
Вывод:
Согласно правилу Вант-Гофа, скорость реакции зависит от температуры следующим образом: при повышении температуры на каждые 10оС скорость химической реакции увеличивается в 2-4 раза.
Опыт 3.
