
- •Предисловие
- •Введение
- •1Атмосфера
- •3. Организация санитарной защиты воздушного бассейна
- •3.1. Предельно допустимые концентрации вредных веществ в воздухе
- •3.2. Предельно допустимые выбросы вредных веществ в атмосферный воздух
- •3.3. Требования при проектировании предприятий
- •3.4. Санитарная защита воздушного бассейна на предприятиях
- •3.5. Обоснование допустимых выбросов вредных веществ в атмосферу
- •3.5.1. Факторы, влияющие на рассеивание вредных веществ в атмосферном воздухе и загрязнение приземного слоя воздуха
- •3.5.2. Обоснование допустимых выбросов при рассеивании вредных веществ через высокие источники
- •4. Процессы пылегазоочистных установок и аппараты для пылегазоулавливания
- •4.1. Общие положения
- •Общие принципы анализа и расчета процессов и аппаратов
- •Интенсивность процессов и аппаратов
- •Моделирование и оптимизация процессов и аппаратов
- •4.2. Пылеулавливание
- •4.2.1. Параметры процесса пылеулавливания
- •4.2.2 Сухие пылеуловители
- •Принцип работы циклона
- •Основные характеристики цилиндрических циклонов
- •Расчёт циклонов
- •4.2.3. Мокрые пылеуловители
- •Принцип работы скруббера Вентури
- •Принцип работы форсуночного скруббера
- •Скрубберы центробежного типа
- •Принцип работы
- •Принцип действия барботажно-пенных пылеуловителей
- •4.2.4 Электрофильтры
- •Принцип работы двухзонного электрофильтра
- •4.2.5 Фильтры
- •Принцип работы рукавных фильтров
- •Туманоуловители
- •5. Очистка от промышленных газовых выбросов
- •5.1 Общие сведения о массопередаче
- •Равновесие в системе газ - жидкость
- •Фазовое равновесие. Линия равновесия
- •Материальный баланс. Рабочая линия
- •Направление массопередачи
- •Кинетика процесса абсорбции
- •Конвективный перенос
- •Дифференциальное уравнение массообмена в движущейся среде
- •Уравнение массоотдачи
- •Подобие процессов массоотдачи
- •Уравнение массопередачи
- •Зависимость между коэффициентом массопередачи и массоотдачи
- •5.2 Устройство абсорбционных аппаратов
- •5.3 Адсорбционная очистка газов
- •5.3.1Общие сведения
- •Равновесие и скорость адсорбции
- •5.3.2 Промышленные адсорбенты
- •Адсорбционная емкость адсорбентов
- •Пористая структура адсорбентов
- •Конструкция и расчёт адсорбционных установок
- •Расчет адсорбционных установок
- •5.4 Каталитическая очистка
- •5.4.1Общие сведения
- •Конструкции контактных аппаратов
- •Аппараты с взвешенным (кипящим) слоем катализатора
- •6. Тепловые процессы Общие положения
- •6.1 Температурное поле. Температурный градиент. Теплопроводность
- •Закон Фурье
- •Дифференциальное уравнение теплопроводности
- •Теплопроводность плоской стенки
- •Теплопроводность цилиндрической стенки
- •6.2 Тепловое излучение
- •Баланс теплового излучения
- •Закон Стефана – Больцмана
- •Закон Кирхгофа
- •Взаимное излучение двух твердых тел
- •Лучеиспускание газов
- •6.3 Передача тепла конвекцией
- •Тепловое подобие
- •Численные значения коэффициента теплоотдачи
- •Сложная теплоотдача
- •6.4 Теплопередача Теплопередача при постоянных температурах теплоносителя
- •Теплопередача при переменных температурах теплоносителя
- •Уравнение теплопередачи при прямотоке и противотоке Теплоносителей
- •4.5. Нагревание, охлаждение и конденсация Общие сведения
- •6.4.1 Нагревающие агенты и способы нагревания Нагревание водяным паром
- •Нагревание горячей водой
- •Нагревание топочными газами
- •Нагревание перегретой водой
- •Нагревание электрической дугой
- •6.4.2 Охлаждающие агенты, способы охлаждения и конденсации Охлаждение до обыкновенных температур
- •Охлаждение до низких температур
- •Конденсация паров
- •6.4.3 Конструкции теплообменных аппаратов
- •Расчет концентрации двуокиси серы
- •Пример расчета насадочного абсорбера
- •Пример расчёта теплообменника
- •Пример расчета электрофильтра
- •Методика расчета адсорбера
- •В ориентировочном расчете используется формула
- •4.2.8 Находим время защитного действия адсорбера
- •Библиографический список
- •Содержание
- •Макаров Володимир Володимирович
1Атмосфера
1.1 Структура и состав атмосферы. Атмосфера - газовая оболочка Земли. Её масса около 5,91015 т. Она имеет слоистое строение и состоит из нескольких сфер, между которыми располагаются переходные слои - паузы. В сферах изменяется количество воздуха, давление, температура, скорость, влажность и концентрация примесей. Состав атмосферы представлен в табл.1.1.
Наиболее плотный слой воздуха, прилегающий к земной поверхности, носит название тропосферы. Толщина её в средних широтах составляет 10 - 12 км над уровнем моря, на полюсах - 7 - 10, над экватором - 16 - 18 км. В тропосфере сосредоточенно более 45 массы земной атмосферы. Из-за неравномерности нагрева земной поверхности в ней образуются мощные вертикальные токи воздуха, отмечаются неустойчивость температуры, относительной влажности, давления и т.д. Температура воздуха в тропосфере по высоте уменьшается на 0,6 на каждые 100 м и колеблется от 40 до -50 С.
Выше тропосферы находится стратосфера. Между ними расположена тропопауза. В разных широтных зонах имеются два и иногда три уровня тропопаузы с разрывом по высоте между ними. Различают тропическую с высотой от 15 до 18 км и полярную тропопаузу с высотой примерно 10 км. Граница разрыва тропической и полярной тропопаузой меняется ото дня ко дню, от месяца к месяцу, но чаще всего она лежит между 35 и 50 широты в северном и южном полушариях. Третья тропопауза иногда появляется на промежуточных широтах и называется межширотной тропопаузой. Место разрыва её с тропической тропопаузой приходится примерно на 30 широты, а с полярной - на 45.
Стратосфера имеет протяжённость по высоте около 40 км. Воздух в ней разряжён, влажность невысокая. Температура воздуха от границы тропосферы до высоты 30 км постоянная (около -50 С), а затем начинает повышаться и на высоте 50 км достигает +10 С. В стратосфере под воздействием космического излучения и коротковолновой части ультрафиолетового излучения Солнца молекулы воздуха ионизируются, в результате чего образуется озон. Озоновый слой находится на высоте 25 - 40 км.
Стратопауза отделяет стратосферу от лежащей выше мезосферы. Высокая температура стратосферы, вероятно, является результатом полного поглощения солнечной ультрафиолетовой и инфракрасной радиации озоновым слоем. В мезосфере количество озона уменьшается, поэтому средняя температура там значительно ниже. На высоте примерно 80 км она равна -70 С. В слое мезосферы наблюдаются серебристые облака.
Выше мезосферы расположена термосфера (или ионосфера), между которыми имеется мезопауза. Для термосферы характерно непрерывное повышение температуры с увеличением высоты. На высоте 150 км температура достигает +200 - +240 С, на уровне 200 км - +500 С. В термосфере газы очень разрежены. Молекулы их движутся с большой скоростью, но редко сталкиваются между собой и поэтому не могут вызвать даже небольшого нагревания находящегося здесь тела.
Под действием солнечной радиации
протекает множество реакций, в которых
участвуют кислород, озон, азот, оксид
азота, пары воды, диоксид углерода.
Ионизация в основном происходит на
высоте 70 - 80 км. При этом отмечаются
отрицательные (![]() )
и положительные (
)
и положительные (![]() и др.) ионы. Эти ионы образуют различные
комплексы:
и др.) ионы. Эти ионы образуют различные
комплексы:
![]()
![]() .
.
Наиболее удалена от Земли экзосфера (от 800 и до 1600 км). В ней ещё обнаруживаются газы атмосферы и происходит утечка атомов, в основном водорода и гелия, в мирровое пространство.
Таблица 1.1 Состав атмосферы
|
Содержание |
|
Содержание |
||
Компоненты |
% по массе |
% по объёму |
Компоненты |
% по массе |
% по объёму |
Азот Кислород Аргон Диоксид углерода Неон Гелий Криптон Ксенон |
75,52 23,15 1,28 0,046
1,2*10-3 7,2*10-5 3,3*10-4 3,9*10-5 |
78,09 20,94 0,93 0,0330
1,8*10-3 5,2*10-4 1*10-4 8*10-6 |
Оксид азота Водород Метан Диоксид азота Озон Диоксид серы Оксид углерода Аммиак |
2,5*10-3 3,5*10-6 0,8*10-4 8*10-5
10-6 10-5
|
2,5*10-4 5*10-5 1,5*10-4 1,5*10-4
2*10-6 2*10-8
1*10-5
1*10-6 |
До высоты 100 км химический состав воздуха существенно меняется. Выше атмосфера состоит в основном из кислорода и азота. На высоте 110 - 120 км кислород почти весь становится атомарным. Предполагается, что выше 400 - 500 км и другие газы, составляющие атмосферу, находятся в атомарном состоянии. Кислородно-азотный состав сохраняется примерно до высоты 400 - 600 км. Выше 600 км в атмосфере начинает преобладать гелий. "Гелиевая корона" Земли простирается примерно до высоты 1600 км, а выше 2000 - 3000 км преобладает водород.
1.2 Классификация загрязняющих атмосферу веществ. По агрегатному состоянию все загрязняющие атмосферу вещества делят на четыре группы: твёрдые, жидкие, газообразные и смешанные. Кроме того, промышленные выбросы в атмосферу могут классифицироваться: 1) по организации отвода и контроля (организованные и неорганизованные); 2) по режиму отвода (непрерывные и периодические); 3) по температуре (нагретые, у которых температура газопылевой смеси выше температуры воздуха, и холодные); 4) по локализации (в основном, вспомогательном и подсобном производствах); 5) по признакам очистки (рис.1.1): на выбрасываемые без очистки (организованные и неорганизованные) и после очистки (организованные). При этом под очисткой газа понимается отделение от газа или превращение в безвредное состояние загрязняющего вещества, поступающего от промышленного источника.
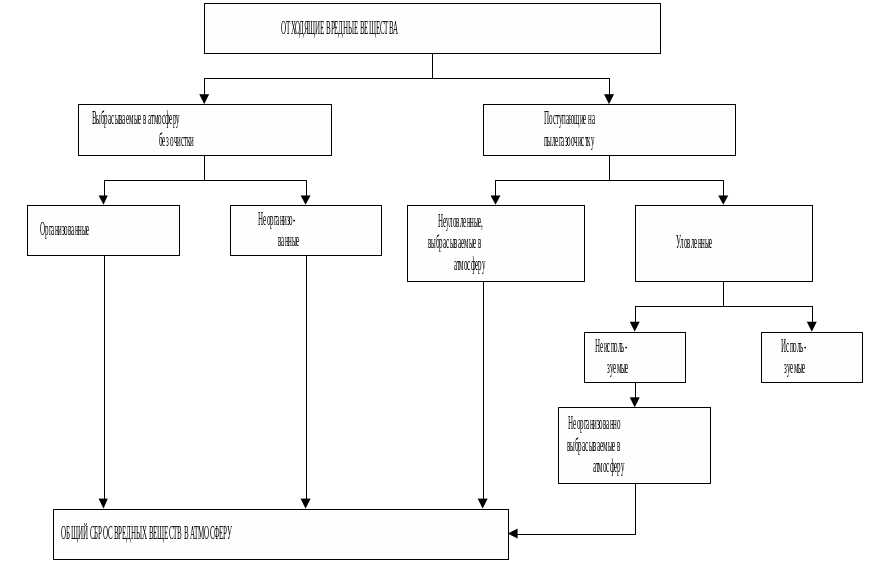
Рисунок 1.1 - Классификация отходящих вредных веществ по признакам очистки и использования.
Организованный промышленный выброс - это выброс, поступающий в атмосферу через специально сооружённые газоходы, воздуховоды, трубы, а неорганизованным выбросом называется промышленный выброс, поступающий в атмосферу в виде ненаправленных потоков газа в результате нарушения герметичности оборудования, отсутствия или неудовлетворительной работы оборудования по отсосу газа в местах загрузки, выгрузки и хранения продукта.
Промышленные выбросы в атмосферу подразделяют также на первичные и вторичные. Первичные - это выбросы, непосредственно поступающие в атмосферу от тех или иных источников, а вторичные, будучи продуктами образования первичных, могут более токсичными и опасными, чем первичные. Типичное превращение некоторых веществ - их фотохимическое окисление.
1.3 Источники загрязнения. Существуют два главных источника загрязнения атмосферы: естественный и искусственный (антропогенный). Они представлены на схеме.

Космическая пыль образуется из остатков сгоревших метеоритов при их прохождении в атмосфере. Ежегодно её выпадает на Землю 2 - 5 млн. т. Природная пыль является постоянной составной частью земной атмосферы. Она представляет собой мельчайшие твёрдые взвешенные в воздухе частицы радиусом 10-4 - 10-3 см и ядра конденсации со средним радиусом 5 10-6 см. Частицы природной пыли имеют органическое и неорганическое происхождение и образуются в результате разрушения и выветривания горных пород и почвы, вулканических извержений, лесных, степных и торфяных пожаров, испарения с поверхности морей. Одним из источников пыли в нижних слоях атмосферы являются безводные пустыни и степи. Кроме того, она образуется аэропланктоном-бактериями, спорами растений, плесневыми и другими грибами, продуктами гниения, брожения и разложения растений и животных.
Атмосферный воздух над океаном включает мельчайшие кристаллы солей магния, натрия, калия, кальция, образующиеся в результате высыхания в воздухе брызг воды. Как правило, естественное загрязнение не угрожает отрицательными последствиями для биогеоценозов и обитающих в них живых организмов, хотя кратковременные последствия возможны.
Атмосферная пыль имеет большое значение для процессов, происходящих на Земле. Она способствует конденсации водяных паров, а следовательно, и образованию осадков. Кроме того, поглощает прямую солнечную радиацию и защищает организмы от солнечного излучения. Акад. В. И. Вернадский отмечал, что атмосферная пыль играет огромную роль в химии планеты.
Биологическое разложение веществ на
Земле, в том числе жизнедеятельность
почвенных бактерий, ведёт к образованию
больших количеств сероводорода, аммиака,
углеводородов, оксидов азота (![]() ),
оксида и диоксида углерода. Все они
попадают в атмосферу.
),
оксида и диоксида углерода. Все они
попадают в атмосферу.
Источниками антропогенного загрязнения атмосферы примесями служит теплоэнергетика, промышленность, нефте- и газопереработка, транспорт, испытания термоядерного оружия. Каждый из этих источников (и каждая отрасль производства) связан с выделением специфических примесей, состав которых насчитывает десятки тысяч веществ, иногда сразу не поддающихся идентификации.
1.4 Перенос загрязнений в атмосфере. Количество солнечной энергии, поступающей на Землю и отражаемой от неё в атмосферу, в различных широтах неодинаково. В результате этого атмосфера в разных районах земного шара нагревается не равномерно. Особенно большие различия температуры у поверхности наблюдаются между полярными и экваториальными областями. Эта неравномерность нагревания служит главной причиной общей циркуляции атмосферы, представляющей собой сложную систему воздушных течений над Землёй. Благодаря такой циркуляции усредняется состав основных компонентов воздуха, а воздушные течения переносят водяной пар с океанов в континентальные районы, а так же загрязнения.
Кроме крупномасштабных воздушных течений в нижних слоях атмосферы возникают многочисленные местные циркуляции, связанные с особенностями нагревания атмосферы в отдельных районах. Вследствие образования различных течений в атмосфере перемешиваются большие массы воздуха и на значительные расстояния перемешиваются соединения, выделяемые теми или иными источниками на поверхности земли.
Движение воздушных масс в атмосфере имеет турбулентный характер. Наряду со скоростью ветра, которую можно принять в первом приближении горизонтальной, возникают турбулентные пульсации в направлении осей X, Y, Z соответственноU,V,W. Эти пульсации вместе с молекулярной диффузией перемешивают токсичные примеси с атмосферным воздухом. Принимается, что ось Х совпадает с направлением ветра. Ось Y - перпендикулярна к направлению ветра и параллельна плоскости Земли, а ось Z - перпендикулярна поверхности Земли. Изменение концентраций загрязнений в разных направлениях определяется уравнением турбулентной диффузии:
![]()
где с - концентрация загрязнений; - время; c - коэффициент изменения концентрации за счет превращений; Кх, Ку, Кz - коэффициенты турбулентной диффузии в направлении соответствующих осей.
При равенстве коэффициентов Кx = Кy = Кz наблюдается изотропная турбулентная диффузия.
Для решения уравнения турбулентной диффузии и расчета концентрации загрязнений на разном расстоянии от источников выбросов определяют коэффициенты К и вводят ряд ограничений. Например, загрязнители выбрасываются из непрерывного точечного источника; процесс квазистационарен, т. е. dc/d=0; направление основного переноса, обусловленного ветром, совпадает с осью Х; скорость ветра U предполагается постоянной в любой точке в системе координат X, Y, Z; перенос загрязнителей по ветру в направлении оси Х преобладает над диффузией вдоль направления ветра.
1.5. Характеристики основных газов атмосферы. Кислород. Содержание по объему 20,95%. Деятельность организма во всех ее проявлениях требует затраты энергии. Энергия же образуется в процессе окислительно-восстановительных реакций, непременным участником которых является кислород. Не будет кислорода – остановятся процессы биологического окисления, оборвется цель реакций, обеспечивающих организм энергией, и жизнь каждой клетки живого организма будет парализована. Кислород недаром называют эликсиром жизни.
При t = -185 oC кислород превращается в жидкость
При t = -219 oC затвердевает
ρ=1,43 г/л.
Азот. По своей массе азот составляет основную часть атмосферы. Жизнь многих обязана азоту, но и азот, по крайней мере азот земной атмосферы, своим происхождением обязан жизни, жизненным процессам. В литосфере содержание азота – 0,01%, в атмосфере 75,69% по массе. Практически человек обитает в азотной атмосфере, умеренно разбавленный кислородом. Азот атмосферного воздуха – источник так называемого диоксидированного азота, который усваивается растениями.
Углекислый газ. В атмосфере содержится 0,03% СО2 (IV) или 2,3 * 1012 т. Источником поступления углекислот газа в атмосферу является вулканические газы, горячие клетки, дыхание человека, животных, растений и, наконец, сжигание человеком ископаемого топлива. Сжигание топлива вносит ежегодно в атмосферу не менее 1 * 1011 углекислоты, находится непрерывно в обменном состоянии между атмосферой и океаном. Обмен углекислоты в поверхностных слоях океана происходят в течение 5 – 25 лет, в глубоких 200 – 1000 лет. Полный обмен диоксида углерода в атмосфере происходит за 300 – 500 лет. Растворимость СО2 зависит от t, поэтому в холодных областях океана происходит преимущественно его поглощение, а в тропиках – выделение. Наличие СО2 в атмосфере обеспечивает накопление солнечной энергии в атмосфере. Эта динамическая система поддерживается деятельностью наземных растений и водорослей, улавливающих энергию солнечного света и использующих для превращения диоксида углерода и воды в разнообразные органические соединения с выделением кислорода. В процессе фотосинтеза растения ежегодно поглощают из атмосферы 70 млр. т СО2. Преобразование его в организме вещество происходит в живых клетках с помощью хлорофилла и света. Главнейшим составляющим этого процесса является фотолиз воды. В ходе фотолиза из молекулы воды под действием энергии солнечных лучей высвобождается кислород. А водород идет на восстановление углекислоты. На фотосинтез одной тонны органики необходимо 1,5 – 1,8 т СО2, при этом высвобождается 1,1 – 1,3 т кислорода. Считают, что растения ежегодно создают до 100 млр. тонн органических веществ. При этом они расходуют 130 млрд. т воды и выделяют 155 млрд. т кислорода. Систематически наблюдения за содержанием СО2 в атмосфере показывают, что оно растёт. Известно, что СО2 в атмосфере подобно стеклу в оранжерее пропускает лучистую энергию Солнца к поверхности Земли, но задерживает инфракрасное (тепловое) излучение Земли и тем самым создаёт так называемый тепличный (парниковый) эффект. Рост концентрации СО2 в атмосфере в основном происходит за счёт сжигания ископаемых. Согласно реектам, в 2000 году концентрация СО2 достигнет примерно 0,04%, а в 2030 году – 0.05%-0.07%. А так как t воздуха зависит от концентрации СО2, то вероятно повышение средней глобальной t.
Водород, инертные газы, радон. В атмосфере содержится свободного водорода 0,0001%, а так же инертные газы. Присутствие в атмосфере группы инертных газов (гелия, неона, аргона, крептона, ксенона) связана с непрерывными процессами естественного радиоактивного распада. Атмосферный воздух также содержит следы продуктов распада урана, тория, радона, постоянно диффундирующего из почвы.
Озон. Он образуется в стратосфере из молекулярного кислорода путём присоединения к нему атомарного кислорода. Последнее образуется под воздействием ультра фиолетового излучения Солнца. Слой атмосферы, близко совпадающий со стратосферой, лежит между 7-8 км. на полюсах, 17-18км на экваторе и 50 км над поверхностью планеты и отличающийся повышенной концентрацией молекул озона, называется озоносферой (озоновый экран). Толщина приведённого (к нормальному давлению) слоя всего около 3 мм. Слой озона защищает всё живое на земле от ультрафиолетового излучения Солнца. Естественный процесс образования и разрушения стратосферного озона нарушается при наличии в стратосфере: оксидов азота, водорода, хлора, брома, N2O (работа холодильников(газ фрион-это хлорофторметан), испарение растворителей красок в аэрозольных упаковках, выбросы различных веществ в стратосферу при полётах сверхвысотных самолётов) прогнозы: на высоте 40 км озон уменьшается на 40%, но Н=10км увеличится до 20км.
Атмосферная влага. Основные источники атмосферной влаги – океаны, моря, водоёмы, увлажнённая почва. Влага так же поступает в атмосферу в результате испарения воды растениями, а так же в результате дыхания живых существ. Вода в атмосфере находится во всех 3 агрегатных состояниях – газообразном (водяной пар), жидком (капли дождя), и в твёрдом (кристаллики снега). Конденсация водяных паров приводит к образованию облаков; атмосферная влага теряемая в результате выпадения осадков пополняется за счёт новых поступлений порций испарившейся воды. Полное обновление состава водяных паров в атмосфере происходит за 9-10 дней. Таким образом, атмосферная влага является самым активным звеном круговорота воды в природе. Регулярное наблюдение за атмосферой характеристикам – давлением, t, ветром – производится уже более 200 лет. Крайние значения давления: 11×104 и 8,5 ×104. Среднее 10×104 Па. Крайние значения t: +58о с 1992г. в Триполи; - 88,3оС август 1960г. в Антарктиде станция «Восток». Средняя t на земном шаре +15оС. Наибольшая скорость ветра – 85 м/с (306 км/ч), 110 м/с (400 км/ч). Значительно изменяется количество осадков по годам. В Индии, штат Асеем в 1947 году выпало 24325,9 мл (слой воды более 24 м) при годовой норме 11000 мл. Температура, влажность, давление, движение воздуха оказывает воздействие на организм человека. Оптимальная влажность 40-60%.
Аэрозоли. Система из газа и взвешенных в нём свободных пылинок, частичек твёрдого тела и капелек жидкости называется аэрозоли. Аэрозоли в окружающей природе довольно частое явление. Облака, целительные, морской воздух, насыщенными солями – полезные аэрозоли. Но есть и вредные: выхлопы ДВС, дымы другие, так и другие. Аэрозоли наблюдаются как в тропосфере, так и в верхних слоях тропосферы. Возникают они в результате «засорения» атмосферы от зелённой поверхности, индустриальных загрязнений, вулканических извержений и космической пылью. Один кубический сантиметр воздуха, которым мы дышим в городе, содержит от 104 до 105 мельчайших частиц, в горах и сельской местности – около 5×103, а над океаном ещё меньше.
Ионы.Под действием Земного радиоактивного излучения и космических излучений в атмосфере образуются ионы. В одном куб. см. воздуха их может содержаться от нескольких сотен до нескольких десятков тысяч. Лёгкие ионы с отрицательным зарядом оказывают положительное влияние на живой организм. В городах, где воздух загрязнён, ионов в атмосфере значительно меньше.
1.6 Химические превращения веществ в атмосфере. Химические вещества, попавшие в атмосферу, подвергаются различным превращениям. Эти превращения зависят от пребывания веществ в атмосфере. Под временем пребывания понимают промежуток между поступлением компонента в атмосферу и удалением (стоком) из нее. Превращения происходят под действием солнечной радиации. Фотоны, излучаемые Солнцем, имеют энергию hv (где v - частота, связанная с определенным фотоном, и h - постоянная Планка, равная 6,6210-34 Джс). В общем случае при поглощении кванта света с частотой v могут происходить следующие процессы:
образование электронно-возбужденных молекул: АhvА*;дезактивация за счет флуоресценции: А*Аhv';дезактивация (тушение) за счет соударения с другими молекулами А*QАQ';диссоциация: А*ВС.
Для атмосферной фотохимии наибольший интерес представляют явления фотохимической диссоциации электронно-возбужденных молекул А*. Возбужденное состоя6ие весьма нестабильно, так что вслед за появлением А* быстро следует реакция образования продуктов В и С. Один или оба из них могут быть очень активны и приводят к началу цепи реакций, в результате которых возникают нежелательные соединения, в том числе фотохимический смог.
Химические превращения и тропосфере и стратосфере инициируются главным образом продуктами фотолиза таких молекул, как О3, О2, Н2О и NO2. Важнейшим компонентом, определяющим химию стратосферы, является озон. Образование атомарного кислорода в атмосфере (выше 80 км) происходит по следующей реакции: Оhv2O. Атомарный кислород участвует в реакциях возникновения О2 и О3. Озон получается по уравнению: ОО2МО3М, где М - третье вещество, принимающее избыток энергии. Озон подвергается фотохимической диссоциации: О3hvО2О.В атмосфере присутствуют пять основных азотсодержащих газов: N2, NH3, NO, NO2, N2O. В конденсированной фазе азот присутствует в форме иона аммония (NH4) и нитратного иона (NO3). В атмосфере городов наблюдается значительное количество органических нитратов.
Оксиды азота антропогенного происхождения в большинстве случаев попадают в атмосферу в виде NO. Затем происходят следующие реакции:
2NOO22NO2 OO2MO3+M
NO2 hv NOO O3+NONO2O2
Возможны и другие многочисленные реакции с участием веществ, содержащих азот и кислород:
O+NO2NO+O2 NO3+NO2NO3
O+NO2+MNO3+M NO2+O3NO3+O2
O+NO+MNO2+M NO3+NO2+MN2O5+M
Цикл соединения азота в тропосфере дополняется образованием азотной кислоты: 4NO2+2H2O+O24HNO3.
Диоксид азота может гидролизоваться также в газовой фазе: 2NO2+H2O2HNO3+NO.
Выделяющаяся по этим реакциям азотная кислота далее может реагировать с ионами металлов, образуя нитраты.
Атомарный кислород и озон способны вступать в соединения с различными органическими веществами, в результате чего получаются органические и неорганические свободные радикалы. Для олефиновых углеводородов возможна следующая подобная реакция: O3 + RCH = CHR RCHO + RO* + HCO*, где RO* и HCO* - свободные радикалы.
Полученный альдегид RCHO может подвергаться фотодиссоциации по реакции: RCHO+hvR*+HCO*. Кроме альдегидов фотохимически активны также кетоны, пероксиды и ацилнитраты, которые при поглощении солнечной радиации также образуют свободные радикалы.
Свободные радикалы с молекулярным кислородом образуют пероксидные радикалы (RОО*), т.е. R*+O2 ROO*
Пероксидные радикалы способны окислять NO в NO2 по реакции
ROO*+NO NO2+RO*
Возможно также возникновение озона по реакции пероксидных радикалов с кислородом.
Присутствие свободных радикалов приводит к смогу. Основные продукты этих фотохимических реакций - альдегиды, кетоны, СО, СО2, органические нитраты и оксиданты. Оксиданты включают озон, диоксид азота, соединения типа пероксиацетилнитратов и др.
Пероксиацетилнитрат (ПАН) сильно раздражает слизистую оболочку глаз и повреждает растительность. Его формула имеет вид
O
CH3COONO2
Это соединение не очень устойчиво: вступает в дальнейшие реакции с оксидом азота
RC(O) OONO2+NO2NO2+RCO2
и распадается в конденсированной фазе
OH+RC(O) OONO2RCOOH+O2+NO2
Другим раздражающим глаза веществом, присутствующим в смоге, является пероксибензоилнитрат (ПБН), имеющий структуру
O
C6H5COONO2
Фотодиссоциация диоксида серы невозможна, так как она отмечается лишь при длинах волн короче тех, которые достигают нижних слоев атмосферы. Однако в присутствии NO2 и SO2 происходит фотодиссоциация NO2 с образованием атомарного кислорода и озона. Таким образом, диоксид серы может реагировать с атомами кислорода по реакции SO2+O+MSO3+M.
Эффективность этой реакции возрастает по мере роста отношения концентраций SO2/NO2. Кинетические расчеты показывают, что при концентрациях (NO NO2) и SO2, равных 0,2 млн-1 (типичных для фотохимического смога), скорость реакции между SO2 и O будет приблизительно в 10 раз ниже скорости реакции между атомарным кислородом и оксидами азота.
В любой загрязненной атмосфере одновременно присутствуют SO2, NO2, NO и углеводороды. В этом случае облучение олефинов и ароматических соединений приводит к образованию значительного количества аэрозолей, а скорость исчезновения SO2 увеличивается. Количество аэрозолей уменьшается с увеличением относительной влажности воздуха. К загрязнением воздуха относятся вещества, присутствующие в атмосфере в концентрациях, которые могут оказывать неблагоприятное воздействие на человека и окружающую среду. Большинство таких веществ, как диоксид серы (SO2), оксид азота NO и другие, обычно присутствуют в атмосфере в низких (фоновых) не представляющих опасности концентрациях. Они образуются, как в результате природных процессов, так и из антропогенных источников. В некоторых исключительных случаях наблюдаются необычно высокие концентрации этих веществ в природной среде, как например, метан (болотный газ) или диоксид серы, выделяемый геотермальными источниками. Таким образом, к загрязнениям воздуха следует относить вещества в высоких концентрациях (по сравнению с фоновыми значениями), которые возникают в результате химических или биологических процессах используемых человеком. Наиболее значительную роль среди них играют процессы сгорания топлива.
1.7. Образование загрязнений при сгорании топлива. В качестве топлива широкое применение находят уголь, нефть, природный газ. Основными компонентами угля, нефти, и древесины являются углерод, водород и кислород, в меньших количествах присутствуют сера и азот, а также следа других веществ, например соединений металлов (сульфиты и оксиды). Природный газ перед использованием обычно очищают от содержания в нем серы, чтобы предотвратить коррозию трубопроводов. Содержание серы в нефти и угле может изменяться от долей до 5 %. В нефти она практически полностью входит в состав органических соединений ( так называемая органическая сера), в угле половина серы органическая, остальное – неорганическая сера, распределенная в виде мелких кристалликов Пирита (FeS2), сульфатов железа Fe2(SO4)3, магния (MgSO4), кальция (CaSO4) и других соединений. При сгорании топлива происходит окисление соединений водорода и углерода, сопровождающая выделением энергией:
С + О2 →СО2 + 94,0 ккал/моль (395 МДж/моль)
Н2 + ½ О2 → Н2О + 68,3 ккал/моль (287 МДж/моль).
Если количество кислорода недостаточно для полного окисления углерода, протекает реакция
С + ½ О2 →СО + 26,4 ккал/моль(111 МДж/моль),
либо часть образующегося СО2 вступают в реакцию с углеродом, образуя оксид:
С + О2 →2 СО -41,0 ккал/моль (172 МДж/моль)
С + СО2 → 2 СО – 172 МДж/моль.
Таким образом, при сгорании в условиях недостатки кислорода может выделяться большое количество оксида углерода, при этом по сравнению с полным сгоранием уменьшается количество выделяющегося тепла. При неполном сгорании нефти или угля летучие органические соединения удаляются, образуя один из компонентов дыма, что особенно характерно для небольших домашних печей. В больших печах летучие соединения, обладающие высокой горючестью, воспламеняются от излучения горячих стенок печи и сгорают полностью до СО2 и Н2О. Сера и азот, входящие в состав угля и нефти, также сгорают с образованием оксидов: S + O2 → S O2 в меньшей степени в пламени протекает дальнейшее окисление S O2 + О → SO3 либо SO2 +1/2 O2 → SO3 +85 МДж/моль. В процессах горения выделяется также оксид азота NO. Источником ее образования является частично азот, содержащийся в топливе ( по данным различий исследователей окисляется от 18 до 80% этого азота), остальная часть образуется в результате с атмосферным азотом в пламени и в прилегающих к нему слоях. Наиболее характерными являются реакции, известные как реакции Зельдовича:
N2 + O → NO + N - 25 ккал/моль (0,305 МДж/моль).
N* + O2 → NO + 0 + 31,8 ккал/моль (0,133МДж/моль).
Попадая в атмосферу, оксид азота медленно превращается в диоксид путем сложных фотохимических реакций. В упрощенном виде они сводятся к реакции:
NO + ½ О2 → NO2
При горении газа или нефти, не содержащей серы и азота, оксиды азота образуются в результате реакций с участием атмосферного азота.
1.8. Самоочищение атмосферы. Атмосфера обладает способностью к самоочищению от загрязняющих веществ. Аэрозоли вымываются из атмосферы осадками, ионы оседают под влиянием электрического поля атмосферы, а так же в следствии гравитации. Частицы размером 10 мкм проходят путь от устья трубы Н=45 м до поверхности Земли до 1,4 часа. За это время при скорости ветра 2 м/с выброс из трубы будет отнесён на 10 км. Частицы меньшего размера осядут ещё на большее расстояние. В отсутствие атмосферных осадков выпадение аэрозолей происходит в результате соприкосновения нижнего слоя воздуха с земной поверхностью и предметами расположенными на ней. В следствии турбулётного перемешивания приземного слоя воздуха всё время обновляется, поэтому на поверхность оседает значительное количество аэрозолей. За сутки очищается слой высотой 250 м. Это величина называется скоростью или высотой очистки. Всякое загрязнение вызывает у природы значительную реакцию, направленную на его нейтрализацию. Однако, при прогрессирующем росте загрязнителей становится очевидным, что природные системы самоочищения рано или поздно не смогут выдержат такой нагрузки.
2. Параметры воздушного бассейна
К ним относятся: температура воздуха, скорость воздуха, давление, концентрация климата, плотность, влажность, силы внутреннего трения.
2.1 Давление
Условия равновесия для элементарного параллепипеда выделенного в неподвижной атмосфере можно описать диффиренциальным уравнением равновесия Эйлера
![]() (2.1)
(2.1)
Учитывая, что в этой системе уравнений
частные производные
![]() и
и
![]() равны нулю, частная производная
равны нулю, частная производная
![]() может быть заменена на
может быть заменена на
![]() ,
и следовательно,
,
и следовательно,
![]() ,
,
то ![]() (2.2)
(2.2)
Для нижних слоев тропосферы.
![]() =
const.
=
const.
dP= - gdz (3)
Интегрируя (3) от Р0 до Р и Z0 до Z получим
![]()
P – P0 = - gz
P = P0 – gz (4)
P0 = 1,013*105 Па при t = 150С
= 1,23 кг/м3, тогда
Р = 1,013*105 – 12Z (5)
Но
с высотой не константа, т. е.
≠ const, учитывая, что для
газов ,
![]()
тогда ![]() (6)
(6)
принимая, что T = const до высоты 2 км тропосферы, Т0 = 288 К R = 287,1 кдж/кг.:
тогда
![]()
![]()
или
![]() , т. е.
, т. е.
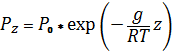
При принятиях выше исходных условиях
Pz = 1,013*1015exp(-1,19*10-4z) (Па).
2.2 Температура
Принято, что температура в атмосфере изменяется по закону адиабатного расширения.
формула не отображена, (1)
где к = ср / сv – показатель адиабаты.
С – постоянная величина для данного процесса.
Беря производную по Т получим:
Подставляя значения С из выражения (1)
(3)
Величину сухоадиабатического градиента можно найти, поделив выражение.
на 3,
(4)
В последнем преобразовании использовано уравнение молярной теплоемкости Ср – Сv = R , удельных теплоемкостей Ср – Сv = .
Для сухого воздуха Ср = 1000Дж/кг*К;Тогда dT/dZ = 0,98*10-2≈ -102 К/м.
Температурным градиентом называют величину
= - dT/dZ = 0,65*10-2 К/м
2.3 Скорость ветра
Существенные значения силы внутреннего трения достигают в нижней части пограничном слое – в приземном слое толщиной 40 – 70 м.Наблюдения показали, что изменение скорости с высотой при турбулентном течении у поверхности наиболее точно соответствует логарифмическому закону
где - скорость ветра на высоте z1 = 1 м над землей, м/с;
- скорость ветра на высоте z1, м/с;
Z0 – шероховатость земной поверхности, м.
Распределение скорости над сушей, для некоторых усредненных условий, в зависимости от высоты над Землей.
Z |
10 |
20 |
40 |
60 |
80 |
100 |
150 |
200 |
250 |
u/u1 |
1 |
1.18 |
1.35 |
1.46 |
1.53 |
1.59 |
1.69 |
1.76 |
1.81 |
За счет турбулентного движения в атмосфере создаются пульсационные скорости во всех трех направлениях ūх, ūу, ūz, которые и обеспечивают перемешивание дымовых газов с атмосферным воздухом.
Особые значения имеют пульсационные скорости горизонтальные Х и вертикальные Z, т.к. именно за счет них происходит .раскрытие дымового облака.
2.4 Концентрация примеси
Концентрация примеси связана отношением:
где М – кг/с; V – объем атмосферного воздуха, в котором происходит распыление вредных выбросов из источника
,
где СД – концентрация действительная.
Последнее выражение можно привести к виду:
,
В точке выброса вредности СД = СГ поскольку V=0
dM = - К grad C dω
где К – коэффициент молекулярной диффузии.
* В сферических координатах выражение примет вид:
Связь с декартовыми координатами находите по выражению:
; ; ;
2.4.1 Распределение примесей в неподвижной атмосферы.
Дифференциальное уравнение для изменения концентрации в неподвижной сфере имеет вид: (1)
(2)
где - оператор . . . . в декартовых координатах.
В ряде случаев для роста диффузии более удобным является использование цилиндрических или сферических координат.
В цилиндрических координатах выражение (2) записывается:
(3)
При переходе к прямоугольным декартовым координатам
; z =z.
Для стационарного процесса: (5)
Рассмотрим некоторые простейшие задачи построение примесей в неподвижной атмосфере. Точечный источник в бесконечном неподвижном пстранстве.Пользуясь уравнением Фика: ПринимаяS=4πr2 получим:
r
0
Z
R
A
H
-H
R
r
r
Рис. 1 Точечный источник в неподвижной атмосфере над земной поверхностью.
В результате интегрирования получим концентрацию на некотором расстоянии R от точечного источника.
(8)
Точечный источник в неподвижной атмосфере над земной поверхностью.
выразим концентрацию по формуле (8) в цилиндрических кордитах, начало координат расположим в точке находящейся ниже выброса на величину Н, а ось Z цилиндрических координат совместим с точкой выброса (рис. 1)
(9)
и (10)
Концентрация на плоскости Z=0; (11)
Эта концентрация установилась бы на земной поверхности, если бы она была абсолютно защищена.
Поместим источник (реактивной) примеси такой же мощности в точке Z = - H и
(1
2)
Действительная концентрация в любой точке пространства в случае наличия земной поверхности можно найти, просуммировав (10 и 12).
H
r
C/См
0,8
0,6
0,4
0,2
1
2
3
4
5
gz
Y
X
gY+dy


2


1
r/Н

(13)
Распределение концентраций по поверхности земли определяется из (13) при Z = 0
(14)
Наибольшая концентрация на земной поверхности наблюдается в точке r = 0
(15)
Относительное изменение концентрации по мере удаления от точки определяется отношением:
(16)
При r/Н >5 можно принимать, что .
2.5 Параметры влажного воздуха.
Смесь сухого воздуха с водяным паром называется влажным воздухом. Водяной пар во влажном воздуха может быть в насыщенном или перегретом состоянии. Смесь сухого воздуха и насыщенного водяного пара называется насыщенным влажным воздухом. Смесь сухого воздуха и перегретого пара называется насыщенным влажным воздухом. Температура, до которого необходимо охлаждать ненасыщенный влажный воздух, чтобы содержащийся в нем перегретый пар стал насыщенным называется температурой точки росы. При дальнейшем охлаждении влажного воздуха (ниже точки росы), происходит конденсация водяного пара. Переменной величиной является количество содержащегося в смеси пара. Все удельные величины, характеризующий влажный воздух, относятся к 1 кг сухого воздуха.Абсолютной влажностью воздуха называется количество водяного пара (кг), содержащегося в 1 м3 влажного воздуха.
Так как влажный воздух представляет собой газовую смесь, то объем пара смеси равен объему всей смеси. Следовательно, абсолютная влажность может быть выражена в виде плотности пара ρn смеси при парцианальном давлении Рn и температуре смеси.
Ρn = Мn / Vn = Mn /Vn (1)
Относительная влажность воздуха – отношение абсолютной влажности воздуха к максимально возможной при данном давлении и температуре.
![]() =ρ п / ρmax = ρ п
/ ρн (2)
=ρ п / ρmax = ρ п
/ ρн (2)
ρн – плотность сухого насыщенного пара.
Так как для идеальных газов отношение плотности компонентов смеси можно заменить отношением парциальных давлений, то отношение (2) можно записать:
= Рп / Рmax (3)
Рп – парциональное давление водяного пара во влажном воздухе;
Рmax – максимальное возможное давление водяного пара (при данной температуре).
Рmax = Рн.
Можно отметить три характерные состояния влажного воздуха:
ρ п ≤ ρн, Рп ≤ Рн – воздух не насыщен влагой.
ρ п = ρн, Рп = Рн – воздух насыщен влагой, водяной пар сухой.
ρ п > ρн, Рп = Рн – воздух пересыщен влагой, водяной пар влажный так как ρ п > ρн.
Влагосодержание (d) – это отношение массы водяного пара Мп во влажном воздухе к массе сухого воздуха.
d = Мп / Мв = ρ п / ρ в (4)
Молярным влагосодержанием (Х) называется числа молей водяного пара, содержащегося во влажном воздухе к числу молей сухого воздуха:
Х = (Мп / mп) / (Мв / mв) (5)
Мп – масса пара.
Мв – масса сухого воздуха.
mп – молекулярная масса пара.
mв – молекулярная масса сухого воздуха.
mп = 18.016, mв = 28.95.
Х = 1.61 d (6),
d = 0.622 Х (7).
Плотность, газовая постоянная:
ρ = ρ в+ρ п (8).
Значение ρ в и ρ п должны выбираться при их парцианальных давлений.
Для 1 кг газа, находящегося в газовой смеси, уравнение состояния:
Р![]() = RT (9).
= RT (9).
Р – абсолютное давление газа, Н/м2;
- удельный объем газа, м3/кг;
R – газовая постоянная, Дж/кг град К;
Т – температура газа, К.
Так как = 1/ ρ, и подставляя (9) в (8) получим (10)
Если учесть,
что газовая постоянная 1 кг воздуха
![]() =
287 Дж/кг град,
=
287 Дж/кг град, ![]() =
462 Дж/кг град, то путем соответствующего
преобразования уравнение (10) можно
получить:
=
462 Дж/кг град, то путем соответствующего
преобразования уравнение (10) можно
получить:
Формула не была отображена (11)
Формула не была отображена (12)
Можно оценить зависимость плотности влажного воздуха от влагосодержания:
![]() (13)
(13)
Значение газовой постоянной R 1 кг влажного воздуха определяется:
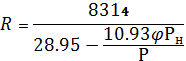 Дж/кг град (14)
Дж/кг град (14)
Мы видим при
![]() и
R = 287
(15)
и
R = 287
(15)
Малекулярная масса влажного воздуха:
![]() (16)
(16)
Теплоемкость и энтальпия влажного воздуха.
Избранная теплоемкость:,
Формула не была отображена
– изобарная теплоемкость сухого воздуха,
Формула не была отображена
– изобарная теплоемкость водяного пара.
В приближенных расчетах можно принимать
Формула не была отображена
≈ 1.00 (кДж/кг град) = const,
Формула не была отображена
≈ 1.96 (кДж/кг град)= const,
Ср = 1 + 1.9 d.
Таким образом, Ср = 1 + 1.96 d
Энтальпия влажного воздуха:
![]() ,
,
.Энтальпия водяного пара содержащегося во влажном воздухе в перегретом состоянии:
Формула не была отображена
r – скрытая теплота парообразования;
t – температура перегретого пара;
tн – температура насыщения.
Для значения tн от 0 до 1000С r = 2500 – 2.3 tн(кДж/кг град).
Температура мокрого термометра.
В общем случае, когда температура воды на равна температуре воздуха в зависимости от влагосодержания воздуха, можно наблюдать либо испарение воды с ее поверхности, либо конденсацию водяного пара из воздуха на поверхности воды. У поверхности воды воздух всегда насыщен, поэтому его влагосодержание определяется парциальным давлением пара, взятого при температуре воды. Установившую температуру между слоем воздуха прилегающим к воде и температурой воды называют температурой мокрого термометра. Установившуюся температуру мокрого термометра, которую воздух имеет в состоянии насыщения, называют температурой адиабатного насыщения воздуха.
Существует связь между температурой влажного воздуха t, температурой мокрого термометра tм и влагосодержанием воздуха d. Эта связь устанавливается количеством теплоты, необходимой для испарения влаги и подогрева воды до температуры воздуха.
Формула не была отображена (1)
– теплота парообразования при температуре мокрого термометра;
Формула не была отображена
– удельная изобарная теплоемкость водяного пара.
Количество теплоты из окружающего воздуха:
(2)
Приравняв уравнение (1) и (2) получим дифференциальное уравнение процесса адиабатного насыщения:
Формула не была отображена (3)
Интегрирование уравнения (3) в пределах от t до tм и от d до dм дает нам температуру мокрого термометра:
Формула не была отображена (4)
– влагосодержание насыщенного воздуха при tм.
Выражение (4) показывает, что температура мокрого термометра является функцией температуры воздуха и его влагосодержания. При d = dм (полное насыщение)t = tм.
