
- •Предисловие
- •Введение
- •1Атмосфера
- •3. Организация санитарной защиты воздушного бассейна
- •3.1. Предельно допустимые концентрации вредных веществ в воздухе
- •3.2. Предельно допустимые выбросы вредных веществ в атмосферный воздух
- •3.3. Требования при проектировании предприятий
- •3.4. Санитарная защита воздушного бассейна на предприятиях
- •3.5. Обоснование допустимых выбросов вредных веществ в атмосферу
- •3.5.1. Факторы, влияющие на рассеивание вредных веществ в атмосферном воздухе и загрязнение приземного слоя воздуха
- •3.5.2. Обоснование допустимых выбросов при рассеивании вредных веществ через высокие источники
- •4. Процессы пылегазоочистных установок и аппараты для пылегазоулавливания
- •4.1. Общие положения
- •Общие принципы анализа и расчета процессов и аппаратов
- •Интенсивность процессов и аппаратов
- •Моделирование и оптимизация процессов и аппаратов
- •4.2. Пылеулавливание
- •4.2.1. Параметры процесса пылеулавливания
- •4.2.2 Сухие пылеуловители
- •Принцип работы циклона
- •Основные характеристики цилиндрических циклонов
- •Расчёт циклонов
- •4.2.3. Мокрые пылеуловители
- •Принцип работы скруббера Вентури
- •Принцип работы форсуночного скруббера
- •Скрубберы центробежного типа
- •Принцип работы
- •Принцип действия барботажно-пенных пылеуловителей
- •4.2.4 Электрофильтры
- •Принцип работы двухзонного электрофильтра
- •4.2.5 Фильтры
- •Принцип работы рукавных фильтров
- •Туманоуловители
- •5. Очистка от промышленных газовых выбросов
- •5.1 Общие сведения о массопередаче
- •Равновесие в системе газ - жидкость
- •Фазовое равновесие. Линия равновесия
- •Материальный баланс. Рабочая линия
- •Направление массопередачи
- •Кинетика процесса абсорбции
- •Конвективный перенос
- •Дифференциальное уравнение массообмена в движущейся среде
- •Уравнение массоотдачи
- •Подобие процессов массоотдачи
- •Уравнение массопередачи
- •Зависимость между коэффициентом массопередачи и массоотдачи
- •5.2 Устройство абсорбционных аппаратов
- •5.3 Адсорбционная очистка газов
- •5.3.1Общие сведения
- •Равновесие и скорость адсорбции
- •5.3.2 Промышленные адсорбенты
- •Адсорбционная емкость адсорбентов
- •Пористая структура адсорбентов
- •Конструкция и расчёт адсорбционных установок
- •Расчет адсорбционных установок
- •5.4 Каталитическая очистка
- •5.4.1Общие сведения
- •Конструкции контактных аппаратов
- •Аппараты с взвешенным (кипящим) слоем катализатора
- •6. Тепловые процессы Общие положения
- •6.1 Температурное поле. Температурный градиент. Теплопроводность
- •Закон Фурье
- •Дифференциальное уравнение теплопроводности
- •Теплопроводность плоской стенки
- •Теплопроводность цилиндрической стенки
- •6.2 Тепловое излучение
- •Баланс теплового излучения
- •Закон Стефана – Больцмана
- •Закон Кирхгофа
- •Взаимное излучение двух твердых тел
- •Лучеиспускание газов
- •6.3 Передача тепла конвекцией
- •Тепловое подобие
- •Численные значения коэффициента теплоотдачи
- •Сложная теплоотдача
- •6.4 Теплопередача Теплопередача при постоянных температурах теплоносителя
- •Теплопередача при переменных температурах теплоносителя
- •Уравнение теплопередачи при прямотоке и противотоке Теплоносителей
- •4.5. Нагревание, охлаждение и конденсация Общие сведения
- •6.4.1 Нагревающие агенты и способы нагревания Нагревание водяным паром
- •Нагревание горячей водой
- •Нагревание топочными газами
- •Нагревание перегретой водой
- •Нагревание электрической дугой
- •6.4.2 Охлаждающие агенты, способы охлаждения и конденсации Охлаждение до обыкновенных температур
- •Охлаждение до низких температур
- •Конденсация паров
- •6.4.3 Конструкции теплообменных аппаратов
- •Расчет концентрации двуокиси серы
- •Пример расчета насадочного абсорбера
- •Пример расчёта теплообменника
- •Пример расчета электрофильтра
- •Методика расчета адсорбера
- •В ориентировочном расчете используется формула
- •4.2.8 Находим время защитного действия адсорбера
- •Библиографический список
- •Содержание
- •Макаров Володимир Володимирович
5. Очистка от промышленных газовых выбросов
5.1 Общие сведения о массопередаче
В процессе очистки газов широко используют процессы массопередачи, характеризуемые переходом одного или нескольких веществ из одной фазы в другую. При очистке газов в основном используют процессы массопередачи между газовой и жидкой фазами.
Поглощение газа жидкостью, т.е. процесс разделения, характеризующийся переходом вещества из газовой фазы в жидкую , называется абсорбцией . Обратный процесс, выделение газа из жидкости - десорбция. Жидкий поглотитель - абсорбент, поглощаемый газ - абсорбтив. Поглощение газа твердым пористым поглотителем, т.е. процесс разделения, характеризуемый переходом вещества из газовой фазы в твердую называется адсорбцией. Обратный процесс - десорбция, часто проводится после адсорбции с целью регенерации поглощенного вещества из поглотителя. Разновидностью адсорбции является ионный обмен - процесс разделения, основанный на способности ионитов обменивать свои подвижные ионы на ионы растворов. Если же газ (абсорбтив) образует с абсорбентом химическое соединение, то процесс называется хемосорбцией.
Массопередача происходит обычно через границу раздела соприкасающихся фаз. Перенос вещества из фазы к границе раздела фаз или в обратном направлении, т.е. в пределах одной из фаз, называется массоотдачей.
Абсорбция относится к массопередаче, в которой участвуют минимально три вещества: одно образует первую фазу, другое - вторую фазу, а третье представляет собой распределяемое между фазами вещество. Вещества, составляющие каждую из фаз, являются лишь носителями распределяемого вещества, а сами не переходят из фазы в фазу. Так, например, при поглощении аммиака водой из его смеси с воздухом вода и воздух служат носителями распределяемого вещества (аммиака). Распределяемое вещество внутри каждой фазы переносится путем диффузии, поэтому процессы массопередачи называются также диффузионными процессами. Для диффузионных процессов принимают, что количество вещества приблизительно равно поверхности раздела фаз и движущей силе. Движущую силу в процессе массопередачи выражают через разность концентраций.
Расчетные выражения движущей силы для процессов массоотдачи и массопередачи неодинаковы. Процессы массотдачи в большей части обратимы, т.е. могут протекать в противоположных направлениях в зависимости от температуры, давления и др.
Равновесие в системе газ - жидкость
Равновесие между жидкой и газовой фазами устанавливается при весьма продолжительном соприкосновении фаз, оно определяется термодинамическими свойствами извлекаемого компонента и поглотительного раствора и зависит от концентрации, температуры и давления фаз. Состав газовой и жидкой фаз может быть представлен следующими величинами (см. таблицу 3.1).
Таблица 3.1 - Способ выражения состава фаз
Способы выражения концентрации |
Условные обозначения |
|
Объемная концентрация (число кмоль или кг компонента в единице объема фазы ) |
С,кмоль/м3,
кмоль/л |
С, кг/м3,
кг/л |
Мольная или массовая доля компонента по отношению к общему количеству вещества в данной фазе: для газовой фазы
для жидкой фазы
|
y, мольные доли
x, мольные доли |
y, массовые доли x, массовые доли |
Относительные концентрации ( отношение кмоль или кг компонента к числу кмоль или кг носителя ): для газовой фазы
для жидкой фазы |
Y, кмоль/кмоль
X, кмоль/кмоль
|
X, кг/кг
|
Парциальное давление компонента для газовой фазы |
Рк, Па |
- |
Связь между указанными величинами описывается следующими выражениями.
1. Парциальное давление компонентов
![]() ,
(3.1)
,
(3.1)
где Р - общее давление газовой среды;
y - концентрация компонента в газовой среде (в долях).
или
![]() .
(3.2)
.
(3.2)
2. Парциальное давление инертного газа (газовой фазы)
![]() .
(3.3)
.
(3.3)
3. Объемная концентрация
![]() , (3.4)
, (3.4)
где Мк - мольная масса компонента.
4. Мольная доля компонента
![]() , (3.5)
, (3.5)
или
![]() . (3.6)
. (3.6)
5. Относительная концентрация компонента
![]() .
(3.7)
.
(3.7)
6. Средняя мольная масса определяется соотношениями
для газовой фазы
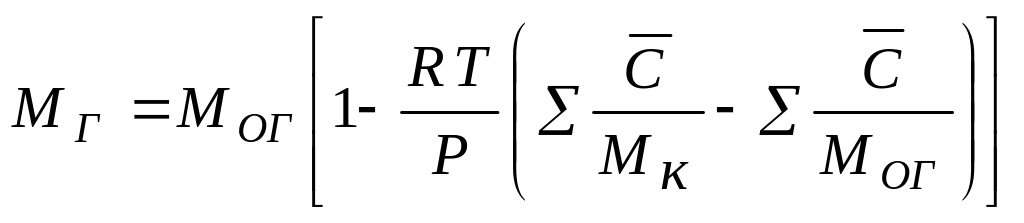 ,
(3.8)
,
(3.8)
для жидкой фазы
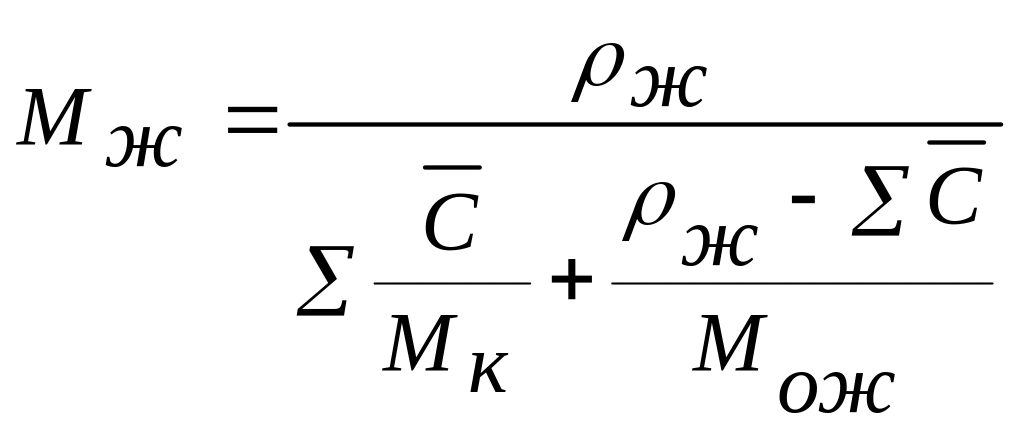 , (3.9)
, (3.9)
где Р - общее давление;
Мк - мольная масса компонента;
МОГ и Мож - мольные массы носителя в газовой и жидкой фазах;
T - температура, К;
R - универсальная газовая постоянная;
ж - плотность жидкости, кг / м3.
При абсорбции переход компонента из газовой фазы в жидкую продолжается до тех пор, пока парциальное давление компонента в газовой фазе не станет равным равновесному давлению этого компонента над раствором.
Состояние равновесия между концентрацией газа в газовой и жидкой фазах характеризуется константой фазового равновесия (коэффициент распределения), которая равна отношению концентрации компонента в газовой фазе к его концентрации в жидкой фазе
![]() .
.
В зависимости от способа выражения концентрации в газовой и жидкой фазах константа фазового равновесия имеет следующий вид:
![]() . (3.10)
. (3.10)
Символы, обозначенные ( * ), относятся к равновесным концентрациям
компонентов, а индексы при константе фазового равновесия (m) относятся:
1-й - к единицам концентрации газовой фазы, 2-й - к единицам концентрации жидкой фазы.
Если единицы измерения концентрации газовой и жидкой фаз одинаковы, то ставится один индекс, а константа фазового равновесия безразмерна. Во всех остальных случаях (m) имеет размерность.
Примеры выражения константы фазового равновесия (m) в зависимости от единиц измерения концентрации компонентов в газовой и жидкой фазах представлены в таблице 3.2.
Таблица 3.2 - Примеры выражения константы фазового равновесия
Выражение константы фазового равновесия |
Выражение концентрации компонента
|
||
в газовой фазе |
в жидкой фазе |
||
m с ( безразмерная) |
С,
|
С, |
|
mс ( безразмерная) |
С,
|
С, |
|
m
cс
,
|
С, |
С, |
|
m
рс
,
|
Р, Па |
С, |
|
m
рс ,
|
Р, Па |
С, |
|
m рх , Па
|
Р, Па |
Х, мольная доля |
|
m р ( безразмерная) |
Р, Па
|
Р, Па |
|
m ух (безразмерная)
|
У, мольная доля |
Х, мольная доля |
|
Соотношение между константами фазового равновесия при различных способах выражения состава фаз приведены в таблице 3.3.
Таблица 3.3 - Соотношение между константами фазового равновесия при различных способах выражения состава фаз
Вели чины |
m с |
m ух |
m рх |
m рс |
m рс |
m с |
- |
|
|
|
|
m ух |
|
- |
|
|
|
m рх |
|
|
- |
|
|
m рс |
|
|
|
- |
|
m рс |
|
|
|
|
- |
Здесь Мк - мольная масса компонента,
ж - плотность жидкости,
Мж - мольная масса компонента,
Пример: определить константы фазового равновесия mрх, mух, mс и mрс для системы диоксид серы - вода - воздух при следующих условиях:
температура 200 С, давление 102 кПа, концентрация раствора х =3,55.10-3 - мольная составляющая, равновесное парциальное давление диоксида серы над раствором р* =0,813 кПа.
Из уравнения (3.10)
![]() = 0,813/ 3,55*10-3
= 229 кПа.
= 0,813/ 3,55*10-3
= 229 кПа.
По
таблице 3.3 находим myx![]() =
=
![]() =
2,29 (безразмерная),
=
2,29 (безразмерная),
mс
=
![]() =
=
![]() =1,69*10-3
( безразмерная).
=1,69*10-3
( безразмерная).
mрс
=![]() =
=
![]() =
4,12 (м3. Па/кмоль).
=
4,12 (м3. Па/кмоль).
Значение Мж определено из уравнению (3.9).
