
7. Скорость химической реакции. Механизм реакции
Возможность протекания реакции определяется энергетическим и энтропийным факторами. Если реакция возможна, она может протекать быстро (иногда даже слишком быстро - со взрывом) или медленно (иногда даже так медленно, что мы ее не замечаем). Но в любом случае мы можем говорить о скорости химической реакции. Как скорость тела характеризует быстроту перемещения этого тела, так и скорость реакции характеризует интенсивность реакции, показывая, сколько частиц прореагировало в единицу времени в единице объема реактора. Для удобства вместо числа частиц берут количество вещества, а отношение количества вещества к объему системы - это концентрация данного вещества.
Скорость химической реакции - физическая величина, характеризующая интенсивность протекания реакции и равная отношению изменения концентрации вещества, участвующего в реакции, к промежутку времени, за который это изменение произошло. |
Скорость химической реакции рассчитывается с учетом коэффициента перед формулой данного вещества в уравнении реакции (bБ). Данное определение применимо только для реакций, протекающих в жидкой или газовой фазе.
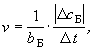
где v - скорость химической реакции,
сБ = с2(Б) - с1(Б) - изменение концентрации вещества Б (c1 - начальное значение, c2 - конечное значение концентрации),
t = t2 - t1 - промежуток времени(t1 - начальное значение, t2 - конечное значение времени).
[v] = моль/(л.с).
Задача
В реакции Н2 + I2 = 2HI концентрация водорода изменилась с 0,1 моль/л до 0,05 моль/л за 2 секунды. Определите скорость реакции.
Решение
v = ? |
Н2 + I2 = 2HI |
c1(H2) = 0,1 моль/л c2(H2) = O,05 моль/л D t = 2 c b(H2) = 1 |
|
Ответ: v = 0,025 моль/(л.с).
Задача
В реакции 2СО + О2 = 2СО2 при определенных условиях скорость равна 0,5 моль/(лЧ с). В некоторый момент времени с1(СО2) = 2 моль/л. Какова будет концентрация диоксида углерода через три секунды?
Решение
с2(СО2) = ? |
2СО + О2 = 2СО2 |
с1(СО2) = 2 моль/л D t = 2 с v = 0,5 моль/(лЧ с) b(СО2) = 2 |
c2(CO2) > c1(CO2) c2(CO2) = (2 + 3) моль/л = 5 моль/л |
Ответ: с2(СО2) = 5 моль/л.
Если реагирующие вещества газообразны, то продукты реакции могут получиться только при столкновении молекул исходных веществ. Чем больше таких соударений, тем быстрее идет реакция. Число столкновений пропорционально концентрациям исходных веществ. Следовательно, скорость реакции А + Б = Д (все вещества газообразны) будет выражаться уравнением (закон действующих масс для скорости реакции):
v = kcAcБ
где k
- константа скорости реакции, а сА
и сБ
- концентрации веществ А и Б.
Увеличение
давления в реакторе приводит к
пропорциональному возрастанию всех
концентраций, поэтому при увеличении
давления скорость реакции возрастает.
Далеко
не каждое столкновение молекул приводит
к их взаимодействию. Эффективны лишь
достаточно сильные соударения. Сила
соударений пропорциональна кинетической
энергии молекул, которая возрастает с
повышением температуры. Следовательно,
и скорость реакции с увеличением
температуры тоже возрастает.
Для
многих реакций можно оценить изменение
скорости в зависимости от температуры,
используя приближенное уравнение,
предложенное голландским х имиком
Якобом Вант-Гоффом (1852 - 1911):
имиком
Якобом Вант-Гоффом (1852 - 1911):
![]() ,
или ,
,
или ,
![]()
где v1 - скорость реакции при температуре T1, v2 - скорость реакции при температуре T2, а g - так называемый температурный коэффициент реакции, который для разных реакций разный, но обычно принимает значения от 2 до 4.
И в газах, и в жидкостях одновременно могут сталкиваться только две частицы (рис. 9.4 а). Тройное соударение крайне маловероятно (рис 9.4 б).
Поэтому большинство реакций, выражающихся иногда очень сложными уравнениями, протекает в несколько стадий, для осуществления каждой из которых необходимы только двойные соударения. Если экспериментально удается выяснить, из каких стадий складывается та или иная реакция, то говорят, что для этой реакции известен ее механизм.
Механизм реакции - совокупность всех стадий данной реакции. |
Например, механизм реакции 4HBr + O2 = 2H2O + 2Br2, протекающей в газовой фазе при температуре около 500 ° С, включает три стадии: HBr + O2 = HOOBr; HOOBr + HBr = 2HOBr; HOBr + HBr = H2O + Br2. Скорость этих реакций различна, а общая скорость суммарной реакции определяется скоростью самой медленной из этих стадий (в данном случае первой). Практически важно то, что по суммарному уравнению реакции невозможно определить механизм этой реакции. Например, реакция H2(г) + I2(г) = 2HI(г) простая, то есть проходит в одну стадию, а, казалось бы, совершенно аналогичная реакция
H2(г) + Cl2(г) = 2HCl(г)
сложная, протекающая в несколько стадий по цепному механизму: Cl2 = Cl· + · Cl (при нагревании или освещении) Cl· + H2 = HCl + H· H· + Cl2 = HCl + Cl· и так далее. Существуют и другие механизмы реакций, с некоторыми из них вы познакомитесь позже. Скорости реакций и их механизмы изучает раздел физической химии, который называется " химическая кинетика" . Итак, скорость химической реакции, в которой участвуют только газообразные вещества (то есть " газовый раствор" ), зависит 1) от температуры, 2) от концентрации веществ, участвующих в реакции, и, как следствие этого, 3) от давления.
Скорости реакций, протекающих в жидких растворах, от давления практически не зависят. Если реагирующие вещества не образуют между собой раствора (жидкого или газового), то реакция протекает только на поверхности соприкосновения этих веществ. Скорость такой реакции зависит от площади этой поверхности. Действительно, щепки горят быстрее полена, а древесная пыль в смеси с воздухом иногда даже взрывается. Таким образом, скорость этих реакций зависит 1) от температуры; 2) от концентрации реагентов в том, или ином растворе; 3) от давления (если в реакции участвуют газы) и 4) от площади поверхности соприкосновения реагентов.


