
Лекция – Химическая термодинамика
Экзотермические реакции. Энтальпия
Почему происходят химические реакции? Для ответа на этот вопрос вспомним, почему отдельные атомы объединяются в молекулы, почему из изолированных ионов образуется ионный кристалл, почему при образовании электронной оболочки атома действует принцип наименьшей энергии. Ответ на все эти вопросы один и тот же: потому, что это энергетически выгодно. Это значит, что при протекании таких процессов выделяется энергия. Казалось бы, что и химические реакции должны протекать по этой же причине. Действительно, можно провести множество реакций, при протекании которых выделяется энергия. Энергия выделяется, как правило, в виде теплоты.
Экзотермическая реакция – химическая реакция, при которой происходит выделение теплоты. |
Если при экзотермической реакции теплота не успевает отводиться, то реакционная система нагревается. Например, в реакции горения метана
СН4(г) + 2О2(г) = СО2(г) + 2Н2О(г)
выделяется столько теплоты, что метан используется как топливо. Тот факт, что в этой реакции выделяется теплота, можно отразить в уравнении реакции:
СН4(г) + 2О2(г) = СО2(г) + 2Н2О(г) + Q.
Это так называемое термохимическое уравнение. Здесь символ "+Q" означает, что при сжигании метана выделяется теплота. Эта теплота называется тепловым эффектом реакции. Откуда же берется выделяющаяся теплота? Вы знаете, что при химических реакциях рвутся и образуются химические связи. В данном случае рвутся связи между атомами углерода и водорода в молекулах СН4, а также между атомами кислорода в молекулах О2. При этом образуются новые связи: между атомами углерода и кислорода в молекулах СО2 и между атомами кислорода и водорода в молекулах Н2О. Для разрыва связей нужно затратить энергию, а при образовании связей энергия выделяется. Очевидно, что, если "новые" связи более прочные, чем "старые" , то энергии выделится больше, чем поглотится. Разность между выделившейся и поглощенной энергией и составляет тепловой эффект реакции. Тепловой эффект (количество теплоты) измеряется в килоджоулях, например:
2Н2(г) + О2(г) = 2Н2О(г) + 484 кДж.
Такая запись означает, что 484 килоджоуля теплоты выделится, если два моля водорода прореагируют с одним молем кислорода и при этом образуется два моля газообразной воды (водяного пара).
Таким образом, в термохимических уравнениях коэффициенты численно равны количествам вещества реагентов и продуктов реакции.
Термохимическое уравнение реакции – уравнение реакции, включающее тепловой эффект реакции, рассчитанный на количества вещества, задаваемые коэффициентами этого уравнения. |
От чего зависит тепловой эффект каждой конкретной реакции? Тепловой эффект реакции зависит а) от агрегатных состояний исходных веществ и продуктов реакции, б) от температуры и в) от того, происходит ли химическое превращение при постоянном объеме или при постоянном давлении. Зависимость теплового эффекта реакции от агрегатного состояния веществ связана с тем, что процессы перехода из одного агрегатного состояния в другое (как и некоторые другие физические процессы) сопровождаются выделением или поглощением теплоты. Это также может быть выражено термохимическим уравнением. Пример – термохимическое уравнение конденсации водяного пара:
Н2О(г) = Н2О(ж) + Q.
В термохимических уравнениях, а при необходимости и в обычных химических уравнениях, агрегатные состояния веществ указываются с помощью буквенных индексов: (г) – газ, (ж) – жидкость, (т) или (кр) – твердое или кристаллическое вещество. Зависимость теплового эффекта от температуры связана с различиями в теплоемкостях исходных веществ и продуктов реакции. Так как в результате экзотермической реакции при постоянном давлении всегда увеличивается объем системы, то часть энергии уходит на совершение работы по увеличению объема, и выделяющаяся теплота будет меньше, чем в случае протекания той же реакции при постоянном объеме. Тепловые эффекты реакций обычно рассчитывают для реакций, протекающих при постоянном объеме при 25 ° С и обозначают символом Qo. Если энергия выделяется только в виде теплоты, а химическая реакция протекает при постоянном объеме, то тепловой эффект реакции (QV) равен изменению внутренней энергии (Δ U) веществ-участников реакции, но с противоположным знаком:
QV
= –
![]() U.
U.
Под внутренней энергией тела понимают суммарную энергию межмолекулярных взаимодействий, химических связей, энергию ионизации всех электронов, энергию связей нуклонов в ядрах и все прочие известные и неизвестные виды энергии, " запасенные" этим телом. Знак " – " обусловлен тем, что при выделении теплоты внутренняя энергия уменьшается. То есть
U = – QV .
Если же реакция протекает при постоянном давлении, то объем системы может изменяться. На совершение работы по увеличению объема также уходит часть внутренней энергии. В этом случае
U = – (QP + A) = –(QP + P V),
где Qp – тепловой эффект реакции, протекающей при постоянном давлении. Отсюда
QP = – U – P V .
Величина, равная U + P V получила название изменение энтальпии и обозначается ΔH.
H = U + P V.
Следовательно
QP = – H.
Таким образом, при выделении теплоты энтальпия системы уменьшается. Отсюда старое название этой величины: " теплосодержание" . В отличие от теплового эффекта, изменение энтальпии характеризует реакцию независимо от того, протекает она при постоянном объеме или постоянном давлении. Термохимические уравнения, записанные с использованием изменения энтальпии, называются термохимическими уравнениями в термодинамической форме. При этом приводится значение изменения энтальпии в стандартных условиях (25 °С, 101,3 кПа), обозначаемое Hо. Например: 2Н2(г) + О2(г) = 2Н2О(г) Hо = – 484 кДж; CaO(кр) + H2O(ж) = Сa(OH)2(кр) Hо = – 65 кДж.
Зависимость количества теплоты, выделяющейся в реакции (Q) от теплового эффекта реакции (Qo) и количества вещества (nБ) одного из участников реакции (вещества Б – исходного вещества или продукта реакции) выражается уравнением:

Здесь Б – количество вещества Б, задаваемое коэффициентом перед формулой вещества Б в термохимическом уравнении.
Задача
Определите количество вещества водорода, сгоревшего в кислороде, если при этом выделилось 1694 кДж теплоты.
Решение
-
n(Н2) –?
2Н2(г) + О2(г) = 2Н2О(г) + 484 кДж.
Q = 1694 кДж,
(Н2) = 2 моль,
Qo = 484 кДж.
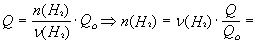
= 2 мольЧ (1694 кДж/484 кДж) = 7 моль.
Ответ: n(H2O) = 7 моль.
4. Эндотермические реакции. Энтропия
Кроме экзотермических реакций возможны реакции, при протекании которых теплота поглощается, и, если ее не подводить, то реакционная система охлаждается. Такие реакции называют эндотермическими.
Эндотермическая реакция – химическая реакция, при которой происходит поглощение теплоты. |
Тепловой эффект таких реакций отрицательный. Например: CaCO3(кр) = CaO(кр) +CO2(г) – Q, 2HgO(кр) = 2Hg(ж) + O2(г) – Q, 2AgBr(кр) = 2Ag(кр) + Br2(г) – Q.
Таким образом, энергия, выделяющаяся при образовании связей в продуктах этих и им подобных реакций, меньше, чем энергия, необходимая для разрыва связей в исходных веществах. Что же является причиной протекания таких реакций, ведь энергетически они невыгодны? Раз такие реакции возможны, значит существует какой-то неизвестный нам фактор, являющийся причиной их протекания. Попробуем его обнаружить.

Возьмем две колбы и заполним одну из них азотом (бесцветный газ), а другую – диоксидом азота (бурый газ) так, чтобы и давление, и температура в колбах были одинаковыми. Известно, что эти вещества между собой не вступают в химическую реакцию. Герметично соединим колбы горлышками и установим их вертикально, так, чтобы колба с более тяжелым диоксидом азота была внизу (рис. 9.1). Через некоторое время мы увидим, что бурый диоксид азота постепенно распространяется в верхнюю колбу, а бесцветный азот проникает в нижнюю. В результате газы смешиваются, и окраска содержимого колб становится одинаковой. Что же заставляет газы смешиваться? Хаотическое тепловое движение молекул. Приведенный опыт показывает, что самопроизвольно, без какого бы то ни было нашего (внешнего) воздействия может протекать процесс, тепловой эффект которого равен нулю. А он действительно равен нулю, потому что химического взаимодействия в данном случае нет (химические связи не рвутся и не образуются), а межмолекулярное взаимодействие в газах ничтожно и практически одинаково. Наблюдаемое явление представляет собой частный случай проявления всеобщего закона Природы, в соответствии с которым системы, состоящие из большого числа частиц, всегда стремятся к наибольшей неупорядоченности. Мерой такой неупорядоченности служит физическая величина, называемая энтропией.
Энтропия – физическая величина, характеризующая степень неупорядоченности систем, состоящих из большого числа частиц, находящихся в тепловом движении. |
Таким образом,
чем БОЛЬШЕ ПОРЯДКА – тем МЕНЬШЕ ЭНТРОПИЯ, чем МЕНЬШЕ ПОРЯДКА – тем БОЛЬШЕ ЭНТРОПИЯ. |
Уравнения связи между энтропией (S) и другими величинами изучаются в курсах физики и физической химии. Единица измерений энтропии [S] = 1 Дж/К. Энтропия возрастает при нагревании вещества и уменьшается при его охлаждении. Особенно сильно она возрастает при переходе вещества из твердого в жидкое и из жидкого в газообразное состояние. Что же произошло в нашем опыте? При смешении двух разных газов степень неупорядоченности возросла. Следовательно, возросла энтропия системы. При нулевом тепловом эффекте это и послужило причиной самопроизвольного протекания процесса. Если теперь мы захотим разделить смешавшиеся газы, то нам придется совершить работу, то есть затратить для этого энергию. Самопроизвольно (за счет теплового движения) смешавшиеся газы никогда не разделятся! Итак, мы с вами обнаружили два фактора, определяющих возможность протекания многих процессов, в том числе и химических реакций: 1) стремление системы к минимуму энергии (энергетический фактор) и 2) стремление системы к максимуму энтропии (энтропийный фактор). Посмотрим теперь, как влияют на возможность протекания химических реакций различные комбинации этих двух факторов. 1. Если в результате предполагаемой реакции энергия продуктов реакции оказывается меньше, чем энергия исходных веществ, а энтропия больше (" под гору к большему беспорядку" ), то такая реакция может протекать и будет экзотермической. 2. Если в результате предполагаемой реакции энергия продуктов реакции оказывается больше, чем энергия исходных веществ, а энтропия меньше (" в гору к большему порядку" ), то такая реакция не идет. 3. Если в предполагаемой реакции энергетический и энтропийный факторы действуют в разные стороны (" под гору, но к большему порядку" или " в гору, но к большему беспорядку" ), то без специальных расчетов сказать что-либо о возможности протекания такой реакции нельзя (" кто перетянет" ). Подумайте, к какому из этих случаев относятся эндотермические реакции. Возможность протекания химической реакции можно оценить, рассчитав изменение в ходе реакции физической величины, зависящей как от изменения энтальпии, так и от изменения энтропии в этой реакции. Такая физическая величина называется энергией Гиббса (в честь американского физикохимика XIX в. Джозайя Уилларда Гиббса).
G = H – T S
Условие самопроизвольного протекания реакции:
G < 0.
При низких температурах фактором, определяющим возможность протекания реакции в большей степени является энергетический фактор, а при высокой – энтропийный. Из приведенного уравнения, в частности, видно, почему не протекающие при комнатной температуре реакции разложения (энтропия увеличивается) начинают идти при повышенной температуре.
Обратимость химических реакций. Химическое равновесие
Рассмотрим эндотермическую реакцию
H2(г) + I2(г) = 2HI(г) - Q . (1)
Смешаем в реакторе (в данном случае, в каком-либо закрытом сосуде) нагретые, например, до 450 ° С водород и пары йода. Для простоты расчетов допустим, что концентрации исходных веществ были одинаковыми и равными одному молю на литр, то есть с(Н2) = 1 моль/л и с(I2) = 1 моль/л. Несмотря на отрицательный тепловой эффект водород и йод начнут реагировать друг с другом, образуя йодоводород. Следовательно, в данной реакции "перетягивает" энтропийный фактор. Действительно, в смеси трех газов (Н2, I2 и HI) порядка меньше, чем в смеси двух газов (Н2 и I2). Экспериментально протекание этой реакции можно обнаружить, измеряя концентрации участвующих в ней веществ. Сразу после смешивания концентрации йода и водорода начнут уменьшаться, в реакторе появится йодоводород, концентрация которого будет постепенно увеличиваться.
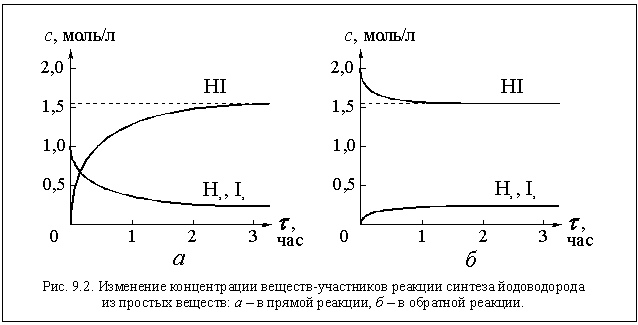
Может ли эта реакция пройти до конца? То есть могут ли все молекулы йода и водорода прореагировать друг с другом с образованием молекул йодоводорода? Наверное, нет. Ведь по мере протекания реакции в реакторе будут накапливаться молекулы йодоводорода и исчезать молекулы йода и водорода. В конце реакции газ должен был бы представлять собой чистый йодоводород. Но в системе, состоящей только из молекул одного газа, порядка много больше (а энтропия меньше), чем в смеси газов. Энтропийный фактор " потянет" в обратную сторону. И энергетический фактор здесь не поможет - тепловой эффект исходной реакции отрицательный. Действительно, примерно через 1,5 часа мы обнаружим, что концентрации всех трех газов в реакторе перестали изменяться и приняли следующие значения: с(Н2) = 0,22 моль/л; с(I2) = 0,22 моль/л и с(HI) = 1,56 моль/л (см. рис. 9.2 а). Если теперь мы поместим в тот же реактор при той же температуре столько чистого йодоводорода, чтобы его концентрация была равной 2 моль/л, начавшаяся реакция
2HI(г) = H2(г) + I2(г) + Q (2)
также не дойдет до конца (почему?). Дождавшись прекращения изменения концентраций, мы увидим, что концентрации газов в реакторе оказались такими же, как и в предыдущем случае (см. рис. 9.2 б). Две рассмотренные нами реакции (1 и 2) можно представить как один процесс, в котором реакции протекают в разных направлениях. Условно одно из них называют прямым направлением (слева направо по уравнению реакции), а другое - обратным направлением (справа налево по уравнению реакции). Соответствующие реакции называются прямой и обратной реакциями, а весь процесс обратимым процессом или обратимой реакцией.
Обратимая реакция - реакция, которая в данных условиях может протекать как в прямом, так и в обратном направлениях. |
Таким образом реакция водорода с йодом обратима. В уравнениях обратимых реакций вместо знака равенства ставится знак обратимости - " Б " , например:
H2
+ I2
![]() 2HI.
2HI.
Состояние, в котором в обратимой реакции концентрации участвующих в этой реакции веществ остаются постоянными, называется состоянием химического равновесия. В состоянии равновесия молекулы не перестают испытывать соударения, и между ними не прекращается взаимодействие, но концентрации веществ остаются постоянными. Эти концентрации называются равновесными.
Равновесная концентрация - концентрация вещества, участвующего в обратимой химической реакции, достигшей состояния равновесия. |
Равновесная концентрация обозначается формулой вещества, взятой в квадратные скобки, например:
сравновесная(Н2) = [H2] или сравновесная(HI) = [HI].
Как и любая другая концентрация, равновесная концентрация измеряется в молях на литр. Если бы в рассмотренных нами примерах мы взяли другие концентрации исходных веществ, то после достижения равновесия получили бы другие значения равновесных концентраций. Эти новые значения (обозначим их звездочками) будут связаны со старыми следующим образом:
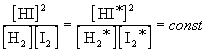 .
.
В общем случае для обратимой реакции
aA + bB dD + fF
в состоянии равновесия при постоянной температуре соблюдается соотношение
![]()
Это соотношение носит название закон действующих масс, который формулируется следующим образом:
при постоянной температуре отношение произведения равновесных концентраций продуктов реакции, взятых в степенях, равных их коэффициентам, к произведению равновесных концентраций исходных веществ, взятых в степенях, равных их коэффициентам, есть величина постоянная.
Постоянная величина (КС) называется константой равновесия данной реакции. Индекс " с" в обозначении этой величины показывает, что для расчета константы использовались концентрации. Если константа равновесия велика, то равновесие сдвинуто в сторону продуктов прямой реакции, если мала, то - в сторону исходных веществ. Если константа равновесия очень велика, то говорят, что реакция " практически необратима" , если константа равновесия очень мала, то реакция " практически не идет" . Константа равновесия - для каждой обратимой реакции величина постоянная только при постоянной температуре. Для одной и той же реакции при разных температурах константа равновесия принимает разные значения. Приведенное выражение для закона действующих масс справедливо только для реакций, все участники которых представляют собой либо газы, либо растворенные вещества. В других случаях уравнение для константы равновесия несколько меняется. Например, в протекающей при высокой температуре обратимой реакции
С(гр) + СО2 2СО(г)
участвует твердый графит С(гр). Формально, пользуясь законом действующих масс, запишем выражение для константы равновесия этой реакции, обозначив ее К':

Твердый графит, лежащий на дне реактора, реагирует только с поверхности, и его " концентрация" не зависит от массы графита и постоянна при любом соотношении веществ в газовой смеси. Умножим правую и левую части уравнения на эту постоянную величину:
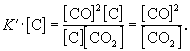
Получившаяся величина и есть константа равновесия этой реакции:
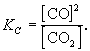
Аналогичным образом, для равновесия другой обратимой реакции, протекающей также при высокой температуре,
CaCO3(кр) СаО(кр) + СО2(г),
получим константу равновесия
КС = [CO2].
В этом случае она просто равна равновесной концентрации углекислого газа. С метрологической точки зрения константа равновесия не является одной физической величиной. Это группа величин с различными единицами измерений, зависящими от конкретного выражения константы через равновесные концентрации. Например, для обратимой реакции графита с углекислым газом [Kc] = 1 моль/л, такая же единица измерений и у константы равновесия реакции термического разложения карбоната кальция, а константа равновесия реакции синтеза йодоводорода - величина безразмерная. В общем случае [Kc] = 1 (моль/л)n.
