- •Інструкція з безпеки для кабінету (лабораторії) хімії
- •Загальні положення
- •3 Вимоги безпеки під час виконання роботи
- •4. Вимоги безпеки після закінчення роботи
- •5. Вимоги безпеки в екстремальних ситуаціях
- •Лабораторна робота №1
- •Хід роботи
- •Контрольні запитання.
- •Лабораторна робота № 2
- •Хід роботи.
- •Контрольні запитання.
- •Лабораторна робота №3
- •Хід роботи
- •Контрольні запитання.
- •Лабораторна робота № 4
- •Хід роботи
- •Контрольні запитання
- •Лабораторна робота № 5
- •Хід роботи
- •2.1. Окислення мурашиного альдегіду купрум гідроксидом
- •2.2. Окислення мурашиного альдегіду аргентум нітратом
- •Контрольні запитання.
- •Лабораторна робота № 6
- •Хід роботи
- •Лабораторна робота №7
- •Хід роботи
- •1. Вивчення властивостей глюкози.
- •1.1.Реакції глюкози, як багатоатомного спирту
- •1.2. Реакції глюкози, як альдегіду
- •3.1. Доведення мономерного складу цукрози
- •Контрольні запитання.
- •Лабораторна робота №8
- •Хід роботи
- •Контрольні запитання.
- •Лабораторна робота №9
- •Хід роботи
- •Контрольні запитання.
- •Лабораторна робота №10
- •Хід роботи
- •Література
Хід роботи
Дослід 1.Дисоціація карбонових кислот
В пробірку налийте 1 мл розчину оцтової кислоти та додайте 1-2 краплі метилоранжу. Як змінилося забарвлення? Запишіть спостереження, рівняння реакції та висновки.
Дослід 2. Pеакції солеутворення
2.1. Взаємодія карбонових кислот з гідроксидами металів.
В пробірку з досл. 1 доливайте розчину натрій гідроксиду до зміни забарвлення. Запишіть рівняння відповідної реакції, спостереження та висновки.
2.2 Взаємодія карбонових кислот з активними металами.
В пробірку налийте 1-1,5мл оцтової кислоти, додайте невелику кількість порошку магнію. Запишіть спостереження, рівняння реакції та висновки.
2.3. Взаємодія карбонових, кислот з основними оксидами
До Імл оцтової кислоти додайте 1г купрум (П) оксиду. Обережно нагрійте. Виникнення синього забарвлення розчину свідчить про присутність гідратованих йонів міді. Запишіть відповідне рівняння реакції, спостереження та висновки.
2.4. Взаємодія карбонових кислот з солями
До 1-1,5мл оцтової кислоти долийте розчину натрій карбонату. Запишіть спостереження, рівняння відповідної реакції та висновки.
Дослід 3 . Вивчення властивостей ненасичених карбонових кислот.
В пробірку налийте 1 мл олеїнової кислоти та долийте 1 мл бромної води. Енергійно збовтайте. Як змінилося забарвлення? Запишіть спостереження, рівняння реакції та висновки.
Контрольні запитання.
Що таке карбонові кислоти? Як вони класифікуються?
Як утворюються назви карбонових кислот за номенклатурою ЮПАК та раціональною ?
Які хімічні властивості карбонових кислот ви знаєте?
Які специфічні властивості мають: а) мурашина кислота,б) стеаринова кислота, в) олеїнова кислота ?
Як залежить розчинність карбонових кислот від молекулярної маси та кількості карбоксильних груп ?
Як виявити карбонову кислоту серед інших органічних речовин?
Виконати перетворення: етан→ етилен →етанол→ →етаналь→етилацетат
Лабораторна робота №7
Тема. Вивчення властивостей моно – та дисахаридів.
Мета: закріпити навики проведення хімічних реакцій між органічними речовинами, довести хімічну природу глюкози , провести реакцію окислення глюкози, гідролізу цукрози та виявити її мономерний склад
Прилади та реактиви: розчини глюкози(C6H12O6) ,фруктози (C6H12O6), цукрози(C12H22O11), мальтози(C12H22O11), розчин купрум(ІІ) сульфату(CuSO4) , розчин натрій гідроксиду(NaOH), реактив Фелінга, реактив Селіванова, розчин соляної кислоти
( HCl) , штатив з пробірками, тримачі
Вуглеводи – це полі гідроксильні альдо -, або кето спирти.
Із моносахаридів найбільше значення має глюкоза, яку ще називають виноградним цукром. Глюкоза міститься у великих кількостях у виноградному соку, меді, а також у спілих фруктах і ягодах. Це біла кристалічна речовина, добре розчинна у воді, солодка на смак. Назва «глюкоза» утворена від грецького слова глюкос, що означає «солодкий».
Молекулярна формула глюкози С6Н12О6. її будову визначено на основі вивчення властивостей. Так, глюкоза виявляє властивості багатоатомних спиртів і альдегідів. Якщо до розчину глюкози влити гідроксид міді (II), то він набуває яскраво-синього забарвлення, подібно до того, як це відбувається з гліцерином. Якщо підігріти яскраво-синій розчин, який добули, з'являється червоний осад, який свідчить про наявність альдегідної групи.
Д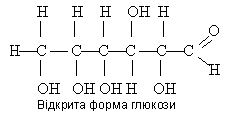 оведено,
що в молекулі глюкози є
альдегідна група і п'ять гідроксильних
груп. Отже, глюкоза — це альдегідоспирт,
її молекула має
таку будову:
оведено,
що в молекулі глюкози є
альдегідна група і п'ять гідроксильних
груп. Отже, глюкоза — це альдегідоспирт,
її молекула має
таку будову:
Однак її не всі властивості глюкози узгоджуються з її будовою як альдегідоспирту. Деяких реакцій, характерних для альдегідів, глюкоза не дає. Справа в тому, що глюкоза є сполукою з мішаною функцією, її природа ускладнюється можливістю внутрішїіьомолекулярних взаємодій гідроксильної групи з карбонільною групою, завдяки чому глюкоза існує не тільки у відкритій ланцюговій формі, айв циклічних α- та β-формах, які відрізняються розміщенням гідроксильних груп відносно площина кільця. Циклічну будову молекула глюкози має у кристалічному стані, у водних же розчинах вона існує у двох різних формах, які взаємно переходять одна в одну:
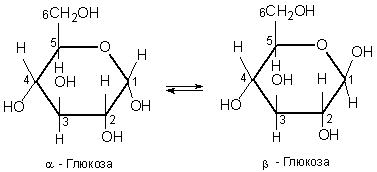
Хімічні властивості глюкози обумовлені наявністю гідроксильних і альдегідної груп. Тому глюкоза вступає в реакції, характерні для спиртів і альдегідів.
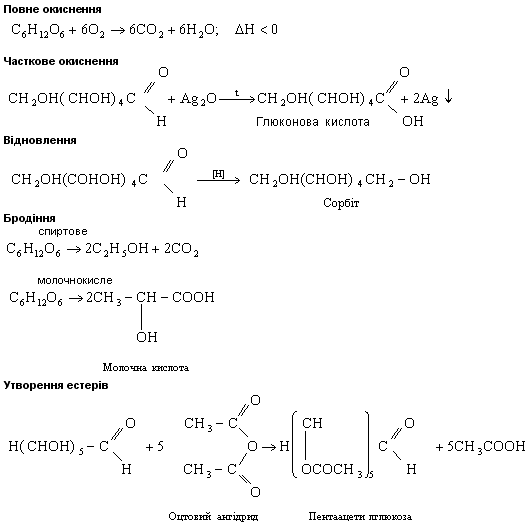
Глюкоза подібно до альдегідів може відновлюватись, перетворюючись на шестиатомний спирт — сорбіт.
Сорбіт вперше був виділений з плодів горобини. Він приблизно вдвічі менш солодкий, ніж звичайний цукор. Сорбіт не підвищує вмісту глюкози в крові, тому його використовують замість Цукру в харчуванні людей, хворих на цукровий діабет.
Як альдегід глюкоза легко окиснюється. Вона вступає в реакцію «срібного дзеркала», окиснюючись до глюконової кислоти.
Глюкоза окиснюється гідроксидом міді (II) під час кипіння також до глюконової кислоти.
Як багатоатомний спирт глюкоза вступає в реакції естерифікації з органічними кислотами і утворює естери.
Одна молекула глюкози взаємодіє з п'ятьма молекулами оцтової кислоти, що підтверджує наявність у молекулі глюкози п'яти спиртових гідроксигруп.
За участю гідроксильних груп відбувається взаємодія глюкози з гідроксидами металів з утворенням сахаратів.
При взаємодії глюкози з гідроксидом міді (II) утворюється сахарат міді — сполука синього кольору. Цю реакцію використовують для виявлення цукру в сечі.
Велике значення мають процеси бродіння глюкози, які відбуваються під дією органічних каталізаторів — ферментів (вони виробляються мікроорганізмами). Відомо кілька видів бродіння.
Спиртове бродіння відбувається під дією ферментів дріжджів.
Молочнокисле бродіння глюкози відбувається під молочнокислих бактерій:
Молочна кислота утворюється при скисанні молока, квашенні капусти, огірків, силосуванні зелених кормів.
Глюкоза — цінна поживна речовина. При окисненні її у тканинах вивільнюється енергія, необхідна для нормальної життєдіяльності організму.
В обміні речовин глюкоза займає центральне місце, оскільки є енергетичним «паливом» для численних процесів, що відбуваються в клітинах організму. Глюкоза — необхідний компонент крові, її вміст у крові людини становить 80—120 мг в 100 мл. Коли вміст глюкози у крові становить більше ніж 180 мг, порушується вуглеводневий обмін, виникає хвороба діабет.
У зв'язку з тим, що глюкоза легко і швидко засвоюється, її застосовують як засіб посиленого харчування, а також для виготовлення лікувальних препаратів, при консервуванні крові. Вона широко використовується в кондитерському виробництві, у виробництві дзеркал та іграшок (сріблення). Нею користуються при обробці й фарбуванні тканин і шкір.
У промисловості глюкозу добувають із більш складного вуглеводню — крохмалю.
До моносахаридів належить і фруктоза С6Н12О6 , або, як її називають, плодовий цукор. Це ізомер і супутник глюкози у багатьох плодових і ягідних соках.
На відміну від глюкози фруктоза е кетоноспиртом, до її складу входить функціональна кетонна група:
СН2ОН-СНОН-СНОН-СНОН-С-СН2ОН
║
О
Фруктоза значно солодша за глюкозу, у суміші з нею входить до складу меду. Фруктоза — найкращий вид цукру для хворих атеросклерозом, при порушенні в організмі обміну жирів.
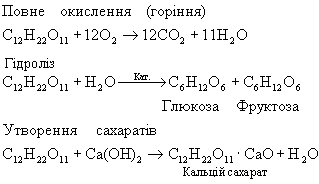
Сахароза (звичайний цукор) — біла кристалічна речовина, солодша за глюкозу, добре розчинна у воді. Важлива хімічна властивість сахарози — здатність до гідролізу (при нагріванні і наявності іонів водню як каталізатора). При цьому з однієї молекули сахарози утворюється молекула глюкози й молекула фруктози:
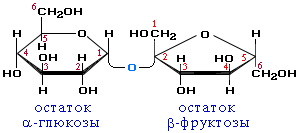
Це підтверджує, що молекули сахарози складаються із сполучених один з одним залишків молекул глюкози і фруктози. Сахарозу порівняно з глюкозою можна розглядати ніби подвійним цукром, через що вона й належить до дисахаридів (грецьке слово ди означає «двічі»),
Утворення дисахаридів можна уявити собі як процес, зворотний їх гідролізу:
С12Н22О11 + Н2О→ С6Н12О6 ( глюкооза) + С6Н12О6 (фруктоза)
Сахароза не дає реакції «срібного дзеркала» і не має відновних властивостей. У цьому її відмінність від глюкози. В той же час вона, як і глюкоза, легко взаємодіє з гідроксидами металів. Так, суспензія гідроксиду кальцію розчиняється у розчині сахарози з утворенням сахарату кальцію, подібного за будовою до сполуки глюкози з кальцієм.
Мальтоза – ізомер сахарози , що складається з двох залишків α глюкози
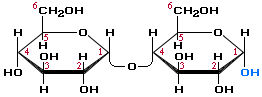
Рівняння , що характеризують хімічні властивості сахарази