
Свойства элементарных частиц, образующих атом
Частицы |
Заряд |
Масса |
||
Кл |
Условные единицы |
г |
а.е.м. |
|
Протон |
1,6∙10-19 |
+1 |
1,67∙10-24 |
1,00728 |
Нейрон |
0 |
0 |
1,67∙10-24 |
1,00866 |
Электрон |
– 1,6∙10-19 |
– 1 |
9,1∙10-28 |
0,00055 |
Принадлежность атома к какому-либо элементу определяется зарядом его ядра Z, т.е. числом протонов. При этом число нейтронов и, соответственно, массовое число у атомов одного и того же элемента может различаться. Такие атомы называются изотопами.
Как
известно из СТО, энергия покоя частицы
связана с ее массой соотношением: Е
= тс2.
Это
означает, что энергия покоящегося ядра
меньше суммарной энергии невзаимодействующих
нуклонов. Эта разница составляет
величину:![]() Она
называется энергией связи в ядре и равна
работе, которую нужно совершить для
того, чтобы разделить нуклоны в ядре и
разнести их на расстояния, где они бы
не взаимодействовали. Энергия связи,
приходящаяся на один нуклон,
Она
называется энергией связи в ядре и равна
работе, которую нужно совершить для
того, чтобы разделить нуклоны в ядре и
разнести их на расстояния, где они бы
не взаимодействовали. Энергия связи,
приходящаяся на один нуклон,![]() называется
удельной
энергией связи в
ядре,
величина
называется
удельной
энергией связи в
ядре,
величина![]() –дефектом
массы ядра.
–дефектом
массы ядра.
В
свободном состоянии нейтрон оказался
нестабильным
– он самопроизвольно распадается (с
периодом полураспада 12 мин), превращаясь
в протон и электрон, испуская еще одну
частицу – антинейтрино:![]()
Задача:
Условие:Если известно, что энергия связи ядра дейтерия 12Н равна 2,224 МэВ, то чему равна удельная энергия связи этого ядра?
Решение:У ядра дейтерия 2 нуклона. Удельная энергия связи ядра составит 2,224 МэВ / 2 = 1,112 МэВ/нуклон.
4.1. Поясните процесс образования молекул, понятие валентности. Как отражена валентность химического элемента в Периодической таблице? Какими фундаментальными взаимодействиями обусловлена химическая связь? Чем определяется устойчивость химической связи? Для каких соединений характерна ионная химическая связь?
Опыт У.Никольсона и А.Карлейна (1800) по разложению воды с помощью электрического тока впервые показал связь химических и электрических взаимодействий, но только через столетие появилась теория, описывающая природу химической связи. Теория Й. Берцелиуса (1819), основанная на электростатическом взаимодействии зарядов, не могла объяснить образование молекул из двух одинаковых атомов и фактически касалась лишь ионной связи, поскольку электрическая природа других видов химической связи не столь очевидна. Сокрушительный удар по теории Берцелиуса нанесла неведомая ему тогда наука – органическая химия.
Химические связи можно рассматривать с точки зрения превращения энергии: если при создании молекулы ее энергия меньше, чем сумма энергий составляющих ее изолированных атомов, то она может существовать, т. е. ее связь устойчива. Для измерения энергии связи одной молекулы используют энергию, отнесенную к одному молю (числу граммов, равному относительной молекулярной массе) и деленную на число Авогадро N. Эта величина для O2 равна 487,2 кДж/моль, а для Н2– 432,6 кДж/моль, т. е. меняется незначительно.
Устойчивым считается состояние, в котором потенциальная энергия минимальна, поэтому при образовании молекулы атомы находятся в потенциальной яме, совершая небольшие тепловые колебания около положения равновесия. Расстояние от вертикальной оси до дна ямы соответствует равновесию – на этом расстоянии находились бы атомы, если бы прекратилось тепловое движение. Точки левее дна соответствуют отталкиванию, правее – притяжению. Крутизна кривой тоже информативна: чем круче кривая, тем больше сила взаимодействия между атомами. Для разных пар атомов различны не только расстояния от вертикальной оси до дна ямы, но и глубина ям. Это просто объяснить: ведь для того чтобы выбраться из ямы, нужна энергия, равная ее глубине. Поэтому глубину ямы можно назвать энергией связи частиц.
Валентность – это способность атомов образовывать химические связи. Валентность можно рассматривать, как способность атома отдавать или присоединять определённое количество электронов. Валентность положительна, если атом при образовании химической связи отдаёт электроны, и отрицательна, если он их присоединяет.
Значения энергии, которые может принимать движущаяся частица, определяются главным квантовым числом (и): п = 1, 2, 3,... Электронные слои обозначают большими буквами латинского алфавита К, L, М, N, О и т.д. Наибольшее количество электронов в слое равно 2n2, поэтому в самом близком к ядру слое К (п = 1) может находиться не более двух электронов, в слое L (п = 2) – не более восьми и т.д. Чем больше заряд ядра или порядковый номер в таблице, тем сильнее притягиваются электроны, особенно внутренних слоев, поэтому диаметры слоев с ростом номера элемента уменьшаются, и все атомы имеют почти одинаковые размеры порядка 10-10 м. Атомы, относящиеся к одной группе элементов таблицы Менделеева, имеют одинаковую валентность, обусловливающую их сходные химические свойства. На внешних оболочках они имеют одинаковое число электронов, которые называются валентными.
Ионная связь, основанная на переносе валентных электронов от одного атома к другому и электростатическом притяжении этих образовавшихся ионов, – самый распространенный вид связи. Молекула представляется электрическим диполем, а центры ионов в нем расположены на определенном расстоянии друг от друга, называемом длиной связи.
5.1.Опишите модель идеального газа, приведите его уравнение состояния. Каково давление смеси из 6г водорода и 12г гелия в закрытом сосуде вместимостью 20 литров, если смесь находится в нем при температуре 300К?
Классический режим для газа определяется теми значениями температуры и плотности, при которых среднее число атомов в любом квантовом состоянии (орбитали) значительно меньше единицы. Газ при комнатной температуре и атмосферном давлении находится во вполне классическом режиме.
Квантовый режим противоположен классическому: в квантовом режиме заселенность квантового состояния может быть сравнима с единицей или даже превышать ее.
Идеальный газ определяется как система свободных невзаимодействующих атомов, находящихся в классическом режиме. Под свободными мы понимаем частицы, заключенные в ящик, которые могут свободно, без каких-либо ограничений двигаться внутри него. Во многих традиционных приложениях статистической термодинамики предполагается, что рабочим веществом служит идеальный газ.
Уравнение состояния идеального газа, или уравнение Менделеева-Клайперона, имеет вид
 ,
,
где
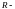 универсальная газовая постоянная,
универсальная газовая постоянная,
 масса
газа,
масса
газа,
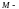 его
молярная масса,
его
молярная масса,
 его
температура,
его
температура,
 его
давление,
его
давление,
 его
объём.
его
объём.
Температурой
 называется физическая величина,
характеризующая степень нагретости
тела. С другой стороны, в молекулярно-кинетической
теории температура вводится как мера
средней кинетической энергии
называется физическая величина,
характеризующая степень нагретости
тела. С другой стороны, в молекулярно-кинетической
теории температура вводится как мера
средней кинетической энергии
 молекул вещества. Так
молекул вещества. Так
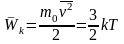 ,
,
где
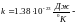 постоянная
Больцмана,
постоянная
Больцмана,
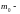 масса
молекулы вещества. Таким образом,
абсолютная температура с точностью
до постоянного множителя совпадает
со средней энергией теплового движения
молекул.
масса
молекулы вещества. Таким образом,
абсолютная температура с точностью
до постоянного множителя совпадает
со средней энергией теплового движения
молекул.
Задача:Каково давление смеси из 6г водорода и 12г гелия в закрытом сосуде вместимостью 20 литров, если смесь находится в нем при температуре 300К
Решение:Найдем давление на стенки сосуда водорода:
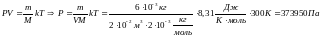
Найдем давление на стенки сосуда гелия:
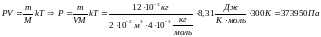
Далее, воспользуемся законом Дальтона: давление в смеси химически невзаимодействующих газов равно сумме их парциальных давлений.
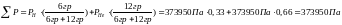
6.1.Поясните суть корпускулярно-волнового дуализма. Какими свойствами обладает электрон в разных экспериментах? Оцените длину волны электрона с энергией 20 эВ и пули массой 2г, летящей со скоростью 500 м/с. Каковы возможности обнаружения у этих объектов волновых свойств?
Луи де Бройль, потомок старинной французской аристократической фамилии, герцог. Под влиянием старшего брата, известного физика, члена Парижской академии наук Мориса де Бройля, окончив Парижский университет (1913), после возвращения из армии, он обратился к теоретической физике.
К 1924 опубликовал три кратких заметки, а затем и защитил докторскую диссертацию, выдвинув идею об универсальном корпускулярно-волновом дуализме. В классической физике материя имела двойственную природу: дискретные материальные точки – «механическая материя» – и непрерывное, занимающее большие области в пространстве, не имеющее никаких черт дискретности электромагнитное поле, в том числе электромагнитные волны – «лучистая материя». Вслед за тем как после работ М. Планка, Эйнштейна, Комптона и других выдающихся физиков выяснилось, что излучению также присущи черты дискретности, после того, как было обнаружено наличие у него квантовых свойств, могло показаться, что непрерывность вообще устранена из физических представлений о материи, и двойственная физическая картина мира уступила место единой дискретной картине. Это единство опять было утрачено после появление теории атома Бора: хотя в ней электроны по-прежнему выглядели как материальные точки, движущиеся по орбитам, но самому этому движению приписывались (при помощи условий квантования) черты дискретности.
Опять двойственная картина: квантованное движение электронов и классическая электродинамика при описании излучения. По-видимому тогда, в начале двадцатых годов, после впечатляющих успехов теории Бора, эта двойственность мало кого волновала. Ярчайшим исключением на этом фоне стал тридцатилетний французский теоретик Луи де Бройль.
Занимаясь исследованием рентгеновских лучей, он все больше стал склоняться к мысли, чтонужно найти общее синтезирующее понятие, которое позволило бы объединить точку зрения волновой теории с точкой зрения корпускулярной». В трех докладах, представленных Парижской академии наук, де Бройль изложил то, что теперь называют идеей корпускулярно-волнового дуализма. Согласно этой идее, и корпускулярные, и волновые черты присущи всем видам материи без исключения.
О том, как физики восприняли гипотезу де Бройля, достаточно красноречиво свидетельствует, например, письмо Эйнштейна к Максу Борну, в котором, в частности, говорится о диссертации де Бройля: «Прочтите ее! Хотя и кажется, что ее писал сумасшедший, написана она солидно». Однако, верховный арбитр в науке – эксперимент – уже в 1927 подтвердил обоснованность идеи о корпускулярно-волновой природе электронов. Американские физики К. Дэвиссон и Джермер и, независимо от них, английский физик Дж. П. Томсон открыли дифракцию электронов на монокристаллах. Что же касается макроскопических, т.е. имеющих большие массы тел, то их волновые свойства не обнаруживаются по простой причине: в природе не существует подходящих «решеток», т. е. объектов с пространственными неоднородностями достаточно малых размеров. Благодаря де Бройлю, в физику вошло принципиально новое представление о двуединой корпускулярно-волновой природе материи. Появился даже новый термин «волночастица», призванный подчеркнуть эту двуединость.
Обнаружение волновых свойств у электронов (а затем и других видов материи) породило мнение, что вся материя имеет чисто-волновую природу. Наиболее полно эта идея проявилась в работах австрийского физика-теоретика Эрвина Шредингера, именем которого названо основное уравнение квантовой (волновой!) механики. Он полагал, что любая материя существует в виде волн, подобных классическим электромагнитным, хотя и несколько отличающихся от них.
То, что волны де Бройля неправильно толковать как классические, было выяснено в напряженных дискуссиях с физиками «копенгагенской школы» во главе с Бором, и было выдвинуто принципально новое, вероятностное (иначе – статистическое) толкование. Волновое уравнение Шредингера, согласно этому толкованию, относится к комплексной (ненаблюдаемой) величине – амплитуде вероятностей. Квадрат модуля этой величины дает картину распределения вероятностей обнаружить частицу в различных точках пространства. Так, если частица – свободная, то эта вероятность (в отличие от амплитуды!) вообще не зависит от координат и от времени, т. е. одинаково вероятно обнаружить частицу в любой точке. Но это вовсе не означает, что частица «равномерно размазана» по всему пространству: можно говорить лишь о вероятности ее обнаружения. Таким образом, описание материи приобретает принципиально новые черты, оно становится статистическим, т.е. вероятностным.
Вероятностное описание не было новостью для физиков. В классической (доквантовой) теории оно привлекалось (например, в молекулярной теории) когда объект исследования был настолько сложным, что полное однозначное (детерминистическое) предсказание его эволюции становилось невозможным из-за действия неконтролируемых случайных факторов. В квантовой теории, т.е. в физике микромира, положение было иным: утверждалось, что даже например, в каждом единичном акте рассеяния электрона на кристалле, принципиально невозможно предсказать, на каком месте экрана он обнаружится, а можно лишь предсказать вероятности этого.
Надо сказать, что такая вероятностная интерпретация квантовой теории принималась не всеми. Имея в виду вывод о принципиальной непредсказуемости результатов измерений, Эйнштейн писал: «Господь Бог не играет в кости!», да и сам де Бройль до конца дней пытался найти пути к спасению детерминистической физики. И то, что эти попытки не могли увенчаться успехом, не умаляет заслуги перед наукой этого великого ученого.
Электронный микроскоп: электронно-оптический прибор, в котором увеличенное изображение микроскопического объекта получают на флуоресцентном экране (таком же, как и экран телевизора) или на фотографической пластинке. В отличие от оптического микроскопа, в нем используют потоки электронов и магнитные или электростатические линзы. В основе проектирования электронных микроскопов лежит электронная оптика.
С помощью современного электронного микроскопа можно рассмотреть (обычно в виде неясных пятен) частицы размером около 5 А. Это примерно в тысячу раз меньше того, что можно увидеть в лучшем оптическом микроскопе. Но и в этом случае разрешение сильно зависит от условий эксперимента.
Здесь полезно напомнить, что наименьшая частица, которую можно видеть невооруженным глазом, содержит примерно 500000 атомов в поперечнике, а с помощью оптического микроскопа нам удается рассмотреть частичку с 2000 атомов в поперечнике. Электронный микроскоп позволяет увидеть расположение атомов в кристалле, которое напоминает построение солдат на параде; с помощью устройства, называемого ионным проектором, можно рассмотреть даже отдельные атомы - по крайней мере некие их туманные очертания. Однако даже при значительно лучшей разрешающей способности микроскопа (а со временем таковая, возможно, и будет достигнута) вряд ли нам удастся увидеть что-нибудь очень конкретное.
E = h * ν = h * c/λ, следовательно:
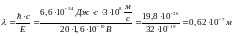
Формула де Бройля устанавливает зависимость длины волны λ, связанной с движущейся частицей вещества, от импульса p частицы:
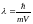
где m – масса частицы, v – ее скорость, h – постоянная Планка. Волны, о которых идет речь, называются волнами де Бройля.
Для пули:
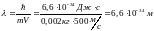 .
Данная длина волны фактически не
обнаружима современными средствами
измерения.
.
Данная длина волны фактически не
обнаружима современными средствами
измерения.
7.1.Как происходит процесс фотосинтеза? Сравните клеточное дыхание и фотосинтез. Расположите процессы, связанные с преобразованием энергии живыми организмами (дыхание, брожение, фотосинтез), в порядке эволюционного возникновения и обоснуйте ответ.
Фотосинтез– образование органических веществ зелеными растениями и некоторыми бактериями с использованием энергии солнечного света.
В ходе фотосинтеза происходит поглощение из атмосферы диоксида углерода и выделение кислорода.
Первым обнаружил, что растения выделяют кислород, английский химик и философ Джозеф Пристли около 1770. Вскоре было установлено, что для этого необходим свет и что кислород выделяют только зеленые части растений. Затем исследователи нашли, что для питания растений требуется диоксид углерода и вода, из которых создается большая часть массы растений. В 1817 французские химики Пьер Жозеф Пелатье (1788–1842) и Жозеф Бьенеме Каванту (1795–1877) выделили зеленый пигмент хлорофилл (по-гречески ó – chloros, зеленый; – phyllon, лист). Позднее российский ученый Климент Аркадьевич Тимирязев (1843–1920) показал, что фотосинтез проходит с наибольшей интенсивностью в тех областях солнечного спектра, где находятся максимумы поглощения хлорофилла.
К середине 19 в. было установлено, что фотосинтез является процессом, как бы обратным дыхательному. Французский ученый Жан Батист Буссенго (1802–1887) в своих работах, опубликованных в это время, утверждал, что в процессе фотосинтеза происходит выделение кислорода из углекислого газа. Это мнение в научной литературе господствовало длительное время.
В 1860-х было высказано предположение, что диоксид углерода в растениях восстанавливается до органических кислот, в частности, муравьиной и щавелевой. Затем эти кислоты при дальнейшем восстановлении переходят в углеводы.
В 1861 русский химик Александр Михайлович Бутлеров получил при действии известковой воды на формальдегид сиропообразное вещество, содержащее углеводы. Основываясь на этом открытии, немецкий химик Адольф Байер в 1870 высказал предположение, что первичным продуктом восстановления диоксида углерода в зеленых растениях является формальдегид, который затем превращается в углеводы. Эта гипотеза привлекла всеобщее внимание – она казалась наиболее правдоподобной. Однако она ничего не говорила о механизме выделения кислорода.
Этим вопросом занялся в конце 19 в. биохимик Алексей Николаевич Бах (1857–1946). На основе экспериментальных исследований он пришел к выводу, что при ассимиляции диоксида углерода источником выделяющегося молекулярного кислорода являются пероксиды, образующиеся из воды. Он же высказал предположение о биокаталитической роли белков-ферментов в фотосинтезе.
В 20 в. было установлено, что процесс фотосинтеза начинается на свету в фоторецепторах хлорофиллов, однако многие из последующих стадий могут протекать в темноте. Общий процесс является эндотермическим (H° ~ 469 кДж/моль СО2). В нем участвует несколько типов хлорофилла, а также другие комплексы магния, железа и меди.
В 1941 американский биохимик Мелвин Калвин (1911–1997) показал, что первичный процесс фотосинтеза заключается в фотолизе молекул воды, в результате чего образуются кислород, выделяющийся в атмосферу, и водород, идущий на восстановление диоксида углерода до органических веществ. Используя радиоактивный изотоп углерода 14С, бумажную хроматографию и классические методы органической химии, Калвин и его группа смогли проследить биосинтетические пути фотохимических процессов. К 1956 стал ясным полный путь превращения углерода при фотосинтезе. За исследования в области ассимиляции диоксида углерода в растениях Калвин был удостоен в 1961 Нобелевской премии по химии.
Полная последовательность всех стадий фотосинтеза пока еще выяснена не до конца, однако интенсивная научная работа в этом направлении продолжается. Исследуется механизм электронного транспорта, продолжается выяснение природы комплекса, катализирующего образование кислорода, изучается структура реакционных центров и светособирающих комплексов.
В целом, химический баланс фотосинтеза может быть представлен в виде простого уравнения:
6CO2 + 6H2O = C6H12O6 + 6O2
Водород, необходимый для восстановления диоксида углерода до глюкозы, берется из воды, а выделяющийся в ходе фотосинтеза кислород является побочным продуктом. Процесс нуждается в энергии света, так как вода сама по себе не способна восстанавливать диоксид углерода.
В светозависимой части фотосинтеза (световой реакции) происходит расщепление молекул воды с образованием протонов, электронов и атома кислорода. Электроны, возбужденные энергией света, восстанавливают никотинадениндинуклеотидфосфат (НАДФ). Образующийся НАДФ-Н является подходящим восстановителем для перевода диоксида углерода в органические соединения. Кроме того, в световой реакции образуется аденозинтрифосфат (АТФ), который также необходим для фиксации диоксида углерода.
В световых реакциях электроны переносятся по электрон-транспортной цепи от одной окислительно-восстановительной системы к другой.
Возбуждение электронов для восстановления никотинадениндинуклеотидфосфата – сложный фотохимический процесс. Он происходит в реакционных центрах (фотосистемах), которые представляют собой белковые комплексы, содержащие множество молекул хлорофилла и других пигментов.
Только около 1% молекул хлорофилла участвуют непосредственно в фотохимическом переносе электронов. Основная часть связана с другими пигментами в так называемом комплексе светособирающей антенны. Энергия кванта света, накопленного в комплексе, передается на реакционный центр, где и используется.
Последующие процессы могут протекать в темноте (темновая реакция). Полная последовательность превращения диоксида углерода в органические соединения называется циклом Калвина.
В зеленых водорослях и высших растениях фотосинтез происходит в хлоропластах, которые окружены двумя мембранами и содержат собственную ДНК. Световые реакции катализируются ферментами, находящиеся в сложенных стопками утолщенных мембранных мешках, а темновые реакции происходят во внутреннем пространстве хлоропластов.
Таким образом, в основе фотосинтеза лежит превращение электромагнитной энергии света в химическую энергию. Эта энергия, в конце концов, дает возможность превращать диоксид углерода в углеводы и другие органические соединения с выделением кислорода.
Фотосинтез, являющийся одним из самых распространенных процессов на Земле, обуславливает природные круговороты углерода, кислорода и других элементов и обеспечивает материальную и энергетическую основу жизни на нашей планете. Фотосинтез является единственным источником атмосферного кислорода.
Процесс фотосинтеза является основой питания всех живых существ, а также снабжает человечество топливом (древесина, уголь, нефть), волокнами (целлюлоза) и бесчисленными полезными химическими соединениями. Из диоксида углерода и воды, связанных из воздуха в ходе фотосинтеза, образуется около 90–95% сухого веса урожая. Остальные 5–10% приходятся на минеральные соли и азот, полученные из почвы.
Человек использует около 7% продуктов фотосинтеза в пищу, в качестве корма для животных и в виде топлива и строительных материалов.
Атмосфера начала образовываться вместе с формированием Земли. В процессе эволюции планеты и по мере приближения ее параметров к современным значениям произошли принципиально качественные изменения ее химического состава и физических свойств. Согласно эволюционной модели, на раннем этапе Земля находилась в расплавленном состоянии и около 4,5 млрд. лет назад сформировалась как твердое тело. Этот рубеж принимается за начало геологического летоисчисления. С этого времени началась медленная эволюция атмосферы. Некоторые геологические процессы, (например, излияния лавы при извержениях вулканов) сопровождались выбросом газов из недр Земли. В их состав входили азот, аммиак, метан, водяной пар, оксид СО и диоксид СО2 углерода. Под воздействием солнечной ультрафиолетовой радиации водяной пар разлагался на водород и кислород, но освободившийся кислород вступал в реакцию с оксидом углерода, образуя углекислый газ. Аммиак разлагался на азот и водород. Водород в процессе диффузии поднимался вверх и покидал атмосферу, а более тяжелый азот не мог улетучиться и постепенно накапливался, становясь основным компонентом, хотя некоторая его часть связывалась в молекулы в результате химических реакций. Под воздействием ультрафиолетовых лучей и электрических разрядов смесь газов, присутствовавших в первоначальной атмосфере Земли, вступала в химические реакции, в результате которых происходило образование органических веществ, в частности аминокислот. С появлением примитивных растений начался процесс фотосинтеза, сопровождавшийся выделением кислорода. Этот газ, особенно после диффузии в верхние слои атмосферы, стал защищать ее нижние слои и поверхность Земли от опасных для жизни ультрафиолетового и рентгеновского излучений. Согласно теоретическим оценкам, содержание кислорода, в 25 000 раз меньшее, чем сейчас, уже могло привести к формированию слоя озона со всего лишь вдвое меньшей, чем сейчас, концентрацией. Однако этого уже достаточно, чтобы обеспечить весьма существенную защиту организмов от разрушительного действия ультрафиолетовых лучей.
Вероятно, что в первичной атмосфере содержалось много углекислого газа. Он расходовался в ходе фотосинтеза, и его концентрация должна была уменьшаться по мере эволюции мира растений, а также из-за поглощения в ходе некоторых геологических процессов. Поскольку парниковый эффект связан с присутствием углекислого газа в атмосфере, колебания его концентрации являются одной из важных причин таких крупномасштабных климатических изменений в истории Земли, как ледниковые периоды.
Присутствующий в современной атмосфере гелий большей частью является продуктом радиоактивного распада урана, тория и радия. Эти радиоактивные элементы испускают -частицы, которые представляют собой ядра атомов гелия. Поскольку в ходе радиоактивного распада электрический заряд не образуется и не исчезает, с образованием каждой -частицы появляются по два электрона, которые, рекомбинируя с -частицами, образуют нейтральные атомы гелия. Радиоактивные элементы содержатся в минералах, рассеянных в толще горных пород, поэтому значительная часть гелия, образовавшегося в результате радиоактивного распада, сохраняется в них, очень медленно улетучиваясь в атмосферу. Некоторое количество гелия за счет диффузии поднимается вверх в экзосферу, но благодаря постоянному притоку от земной поверхности, объем этого газа в атмосфере почти не меняется. На основании спектрального анализа света звезд и изучения метеоритов можно оценить относительное содержание различных химических элементов во Вселенной. Концентрация неона в космосе примерно в десять миллиардов раз выше, чем на Земле, криптона – в десять миллионов раз, а ксенона – в миллион раз. Отсюда следует, что концентрация этих инертных газов, по-видимому, изначально присутствовавших в земной атмосфере и не пополнявшихся в процессе химических реакций, сильно снизилась, вероятно, еще на этапе утраты Землей своей первичной атмосферы. Исключение составляет инертный газ аргон, поскольку в форме изотопа 40Ar он и сейчас образуется в процессе радиоактивного распада изотопа калия.
8.1.Раскройте понятие «биосфера», укажите ее функции и характеризуйте ее оболочки. Каковы основные факторы устойчивости биосферы и существования ее как единой целостной системы? Как В.И. Вернадский изменил представление о биосфере?
Биосфера (от био и сфера), область активной жизни, охватывающая нижнюю часть атмосферы, гидросферу и верхнюю часть литосферы. В биосфере живые организмы (живое вещество) и среда их обитания органически связаны и взаимодействуют друг с другом, образуя целостную динамическую систему. Термин «биосфера» введен в 1875 Э. Зюссом. Учение о биосфере как об активной оболочке Земли, в которой совокупная деятельность живых организмов (в т. ч. человека) проявляется как геохимический фактор планетарного масштаба и значения, создано В. И. Вернадским (1926).
Вернадский Владимир Иванович (1863-1945), российский естествоиспытатель, мыслитель и общественный деятель. Основоположник комплекса современных наук о Земле – геохимии, биогеохимии, радиогеологии, гидрогеологии и др. Создатель многих научных школ. Академик АН СССР (1925; академик Петербургской АН с 1912; академик Российской АН с 1917), первый президент АН Украины (1919). Профессор Московского университета (в 1898-1911), ушел в отставку в знак протеста против притеснений студенчества. Идеи Вернадского сыграли выдающуюся роль в становлении современной научной картины мира. В центре его естественнонаучных и философских интересов – разработка целостного учения о биосфере, живом веществе (организующем земную оболочку) и эволюции биосферы в ноосферу, в которой человеческий разум и деятельность, научная мысль становятся определяющим фактором развития, мощной силой, сравнимой по своему воздействию на природу с геологическими процессами. Учение Вернадского о взаимоотношении природы и общества оказало сильное влияние на формирование современного экологического сознания. Развивал традиции русского космизма, опирающегося на идею внутреннего единства человечества и космоса. Вернадский – один из лидеров земского либерального движения и партии кадетов (конституционалистов-демократов). Организатор и директор Радиевого института (1922-39), Биогеохимическая лаборатория (с 1928; ныне Институт геохимии и аналитической химии РАН им. Вернадского). Государственная премия СССР (1943).
Человек является качественно новой ступенью биосферы, так как замыкает почти все пищевые цепочки.
9.1.Поясните, в чем состоят отличия динамических законов от статистических. Приведите примеры. В чем заключаются различия понимания вероятности в классической науке и современной? Каким образом при изучении типичного поведения систем можно избавляться от случайных явлений, всегда ли это возможно?
Исторически первой формой детерминизма был механистический детерминизм – это философское учение, абсолютизирующее динамические законы. Закон – это существенная, необходимая, устойчивая связь. Динамические законы – это физические законы, отображающие объективные закономерности в форме однозначной связи физических величин. Динамические законы описывают функциональную связь, при которой аргументы функции и её значение являются точно определёнными величинами. Например, классическая механика, зная первоначальные координаты и импульсы материальных точек, может точно описать движение, т.е. определить координаты и импульсы точек в последующие моменты времени.
Другой пример физической теории динамического типа – электродинамика Максвелла, которая точными величинами описывает изменения электромагнитного поля. Динамическими теориями являются также механика сплошных сред, термодинамика, теория гравитации (ОТО).
Сторонники механистического детерминизма не признавали никаких других видов закономерностей, кроме динамических.
А невозможность описать некоторые явления с помощью динамических законов они объясняли ограниченностью знаний. Ещё древнегреческий философ Демокрит утверждал, что всё в мире происходит с необходимостью, а случайностью люди называют то, причину чего не могут объяснить. В начале XIX века механистический детерминизм достиг апогея во взглядах П. Лапласа. В науку вошло понятие «демон Лапласа» - это фантастический сверхразум, который, имея полное описание современного состояния мира и зная законы его движения, смог бы точно предсказать будущее и воссоздать прошлое. Механистический детерминизм не признаёт объективное существование случайности, отождествляет причинность и необходимость, т.е. является примером метафизического, упрощённого представления о мире.
Вероятностный детерминизм. Соотношение динамических и вероятностных законов.
Во второй половине XIX века выявляется ограниченность механистического детерминизма. Максвелл, пытаясь описать движение молекул газа, т.е. систему из огромного числа элементов, пришёл к выводу об ограниченности динамических законов классической механики и ввёл понятие вероятностного (статистического) закона (1859). Вероятностный закон, как и динамический, с помощью уравнений устанавливает жёсткую, однозначную связь состояний системы. Т.е. зная первоначальное состояние системы, вероятностный закон может точно предсказать её состояние в последующие моменты времени. Отличие вероятностных и динамических законов состоит в способе описания состояния системы. Если динамический закон описывает состояние точными значениями величин, то вероятностный оперирует средними величинами, распределением вероятностей (вероятность значений в заданных интервалах).
В ХХ веке было открыто множество вероятностных законов, и возникла дискуссия об их соотношении с динамическими законами. Эта дискуссия обострилась после создания квантовой механики, описывающей неопределённый и вероятностный характер физических характеристик микрообъектов.
Вероятностный закон не может точно предсказать значение той или иной физической величины, а предсказывает её среднее значение; не может точно предсказать событие, а предсказывает его вероятность. Поэтому возникает ощущение неполноты такого знания, его приближённого характера. В частности, возникают вопросы о полноте квантовой механики: является ли статистическое описание микрообъектов единственно возможным?
Существуют ли более глубокие динамические законы, описывающие движение микрообъектов, но скрытые за статистическими законами квантовой механики? Такие учёные как Н. Бор, В. Гейзенберг, М. Борн считали вероятностные законы основными законами природы, а квантовое описание микрообъектов полным и единственно возможным (соотношение неопределённостей Гейзенберга, принцип дополнительности Бора). При этом, не имея чёткой философской позиции, они делали вывод об индетерминизме микромира. Индетерминизм – это философское учение, отрицающее всеобщие закономерные взаимосвязи объективных явлений. Ошибка этих учёных в том, что они сводили детерминизм к его первой и ограниченной форме – к механистическому детерминизму и заявляли об отсутствии такой детерминации в микромире.
Учёные, несогласные с такой позицией, объявляли квантовую механику неполной, а её знания промежуточными (А. Эйнштейн, М. Планк, Шредингер) (ЭПР-парадокс). Обобщая этот вывод, они переносили его и на все остальные вероятностные законы, считая их результатом неполноты наших знаний. Этот вывод в настоящее время также признаётся ошибочным.
На самом деле, наличие вероятностных законов противоречит только механистическому детерминизму. Современный, вероятностный детерминизм не только признаёт их наличие, но и считает их основным типом законов. Вероятностный закон соответствует всем признакам объективного закона, как существенной, необходимой, устойчивой связи. А значит, распространённость таких законов доказывает всеобщую и закономерную взаимосвязь явлений, т.е. подтверждает детерминизм.
Динамические законы – это идеализация реальных отношений, выделение из бесконечного множества условий отдельных существенных связей. Поэтому в чистом виде динамические законы нигде не реализуются. Даже для отдельных макротел невозможно точно описать начальное состояние системы.
Поэтому с течением времени точность предсказаний уменьшается. Любой закон ограничен определёнными условиями. Но в реальности условия могут измениться, и закон не реализуется.
В тоже время динамические законы не являются ошибочными. Ошибочной является их абсолютизация. Динамические законы применимы для описания реальных объектов, которые настолько близки к идеализированным объектам, что случайные отклонения величин ничтожно малы, и ими можно пренебречь.
Такими объектами являются устойчивые системы из небольшого числа элементов и с ограниченным набором условий, существенно влияющих на систему (например, Солнечная система). Но большинство реальных объектов не отвечают этим признакам (например, погода на Земле).
Поэтому применение динамических законов ограниченно.
Вероятностные законы – это более глубокая, более общая и совершенная форма описания объективных связей. Все современные вероятностно-статистические теории содержат в качестве своего приближения соответствующие динамические теории. Например: квантовая механика и классическая механика, статистическая термодинамика и классическая термодинамика, микроскопическая электродинамика (электронная теория) и классическая электродинамика Максвелла и т.д.
Открытия физики в ХХ веке заставили многих учёных сомневаться в верности принципа детерминизма. Но если бы мир подчинялся принципу индетерминизма, он был бы хаосом, в котором не было бы никаких законов и возможным было бы любое событие, любое чудо. Такой мир не поддавался бы научному познанию, т.к. наука познаёт законы. Новейшие открытия не опровергают принцип детерминизма, а расширяют его понимание. Дальнейшее развитие получили представления об объективности и всеобщности причинных связей, о наличии непричинных видов связи, об объективном содержании категорий «случайность» и «вероятность», о диалектике случайности и необходимости. Т.о. детерминизм остаётся одним их важнейших принципов философской и физической картины мира.
10.1.Как формировалось представление о критериях истинности знания? Чем отличается естественнонаучный подход от натурфилософского? Как наука связана с проблемой наглядности? Можно ли назвать Аристотеля ученым? Чем отличается метод Галилея от метода Аристотеля?
Задача воспитания «нового человека» осознается как главная задача эпохи. Греческое слово («воспитание») является самым четким аналогом латинского humanitas (откуда берет свое происхождение «гуманизм»). Humanitas в ренессансном представлении подразумевает не только овладение античной премудростью, чему придавалось огромное значение, но также самопознание и самосовершенствование.
Гуманитарно-научное и человеческое, ученость и житейский опыт должны быть объединены в состоянии идеальной virtu (по-итальянски одновременно и «добродетель», и «доблесть» – благодаря чему слово несет в себе средневеково-рыцарский оттенок).
Натуроподобно отражая эти идеалы, искусство Возрождения придает воспитательным чаяниям эпохи убедительно-чувственную наглядность. Древность (то есть античное наследие), Средние века (с их религиозностью, равно как и светским кодексом чести) и Новое время (поставившее человеческий ум, его творческую энергию в центре своих интересов) находятся здесь в состоянии чуткого и непрерывного диалога.
Галилей принадлежал к знатной, но обедневшей флорентийской семье. Отец его, Винченцо, известный музыкант, оказал большое влияние на развитие и формирование способностей Г. До 11 лет Г. жил в Пизе, посещал там школу, затем семья переселилась во Флоренцию. Дальнейшее воспитание Г. получил в монастыре Валломброса, где был принят послушником в монашеский орден. Здесь познакомился с работами латинских и греческих писателей. Под предлогом тяжёлой глазной болезни отец взял сына из монастыря.
По настоянию отца в 1581 Г. поступил в Пизанский университет, в котором изучал медицину. Здесь он впервые познакомился с физикой Аристотеля, с самого начала показавшейся ему неубедительной. Г. обратился к чтению древних математиков – Евклида и Архимеда. Архимед стал его настоящим учителем. Увлечённый геометрией и механикой, Г. бросил медицину и вернулся во Флоренцию, где провёл 4 года, изучая математику. Результатом этого периода жизни Г. были небольшое сочинение «Маленькие весы» (1586, изд. 1655), в котором описаны построенные Г. гидростатические весы для быстрого определения состава металлических сплавов, и геометрическое исследование о центрах тяжести телесных фигур. Эти работы принесли Г. первую известность среди итальянских математиков. В 1589 он получил кафедру математики в Пизе, продолжая научную работу. В рукописях сохранился его «Диалог о движении», написанный в Пизе и направленный против Аристотеля. Часть выводов и аргументация в этой работе ошибочны, и Г. впоследствии от них отказался. Но уже здесь, не называя имени Коперника, Г. приводит доводы, опровергающие возражения Аристотеля против суточного вращения Земли.
В учении о познании и о его видах Аристотель различал «диалектическое» и «аподиктическое» познание. Область первого – «мнение», получаемое из опыта, второго – достоверное знание.
Хотя мнение и может получить весьма высокую степень вероятности по своему содержанию, опыт не является, по А., последней инстанцией достоверности знания, ибо высшие принципы знания созерцаются умом непосредственно. Цель науки А. видел в полном определении предмета, достигаемом только путём соединения дедукции и индукции:
1) знание о каждом отдельном свойстве должно быть приобретено из опыта;
2) убеждение в том, что это свойство – существенное, должно быть доказано умозаключением особой логической формы – категория, силлогизмом.
Исследование категорического силлогизма, осуществленное А. в «Аналитике», стало наряду с учением о доказательстве центральной частью его логического учения. Связь трёх терминов силлогизма А. понимал как отражение связи следствия, причины и носителя причины. Основной принцип силлогизма выражает связь между родом, видом и единичной вещью. Совокупность научного знания не может быть сведена к единой системе понятий, ибо не существует такого понятия, которое могло бы быть предикатом всех других понятий: поэтому для А. оказалось необходимым указать все высшие роды –категории,к которым сводятся остальные роды сущего.
