
- •Автор-составитель: Пузин ю.И. Проф., д-р хим. Наук
- •Кудашева ф.Х., проф., д-р хим. Наук
- •Оглавление
- •1. Газ, нефть и нефтепродукты
- •Пример решения задач
- •1.1.4. Температуры вспышки и застывания
- •1.2. Классификация нефтей
- •1.3. Практикум
- •Ареометр
- •Затем вычисляют динамическую вязкость исследуемого нефтепродукта (η, мПас) по формуле
- •Лабораторная работа № 2. Первичная перегонка нефти
- •Свойства продуктов фракционирования
- •Нефть как многокомпонентная система
- •2.1. Основные примеси, содержащиеся в нефтях и газах
- •2.2. Нефтяные эмульсии и способы их разрушения
- •2.3. Вода в нефти и нефтепродуктах
- •2.4. Сернистые соединения в нефти и нефтепродуктах
- •2.5. Присутствие минеральных кислот, щелочей и солей в нефтепродуктах
- •2.6. Механические примеси в нефти
- •2.7. Степень ненасыщенности нефтей и нефтепродуктов
- •2.8. Практикум
- •3. Компоненты нефтей, газов, нефтепродуктов. Состав, строение, свойства
- •3.1. Ациклические углеводороды
- •3.1.5. Практикум
- •3.2.1. Алициклические углеводороды (нафтены)
- •Контрольные вопросы
- •3.2.2. Ароматические углеводороды (арены)
- •3.2.3. Практикум
- •Контрольные вопросы
- •3.3.1. Спирты
- •Методы получения спиртов
- •3.3.2. Фенолы
- •3.3.3. Карбоновые кислоты
- •3.3.4. Практикум
- •Опыт 2.Свойства фенола
- •Контрольные вопросы
- •3.4.1. Азотсодержащие соединения
- •3.4.2. Соединения, содержащие серу
- •3.4.3. Практикум
3.3.2. Фенолы
Фенолы - органические соединения, в которых гидроксильная группа связана непосредственно с углеродным атомом ароматического кольца. Простейшие представители:

Фенол получают сплавлением солей сульфокислот со щелочами:

Этот метод применяется в промышленности.
Фенол можно получить окислением изопропилбензола (кумола) кислородом воздуха в присутствии катализатора с последующим разложением образующегося гидропероксида кумола. В результате получаются фенол и ацетон:

Этот метод, применяемый в промышленности для получения фенола и ацетона, называется кумольный метод.
С хорошим выходом можно получить фенол пиролизом хлорбензола.

Химические свойства
Фенолы проявляют большую кислотность, чем спирты, однако они слабее, чем карбоновые кислоты. Фенолы реагируют со щелочами, с образованием фенолятов:

2. Феноляты реагируют с галогенпроизводными с получением эфиров фенолов:

3. С галогенангидридами кислот феноляты образуют сложные эфиры:

4. С хлоридом железа () FeCl3 фенол дает комплексные соединения с фиолетовым окрашиванием. Реакция используется как качественная при определении фенолов:

Кроме того, для фенолов характерны реакции замещения (сульфирования, нитрования, галогенирования) в ароматическом кольце, при этом группа ОН проявляет себя как очень активный заместитель первого рода, и эти реакции замещения для фенола проходят намного легче, чем для бензола.
1. Так, при действии на фенол бромной воды идет замещение сразу трех атомов водорода при углеродных атомах ароматического кольца на бром, и образуется 2,4,6-трибромфенол:
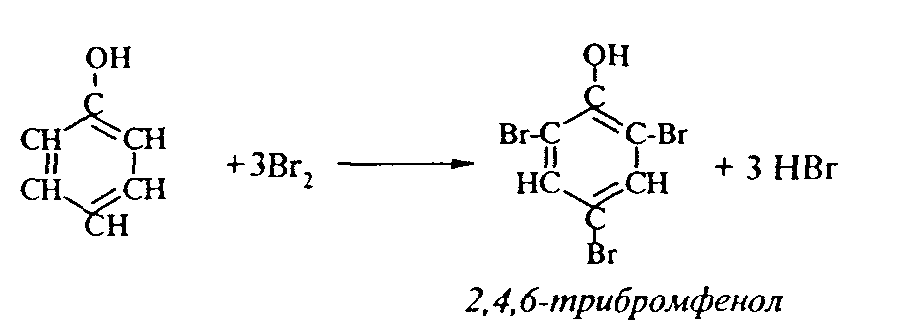
2. При сульфировании фенола получают орто- и пара-фенолсульфокислоты:

3. Нитрование фенола идет уже при действии разбавленной азотной кислоты. Получается смесь орто- и пара-нитрофенолов:

4. В присутствии кислых катализаторов фенол вступает в реакцию поликонденсации с формальдегидом:

По такой схеме в промышленности получают фенол-формальдегидные смолы.
3.3.3. Карбоновые кислоты
Карбоновые кислоты - это производные углеводородов, в молекулах которых содержится карбоксильная группа

Общая формула одноосновных кислот CnH2n+1COOH. Простейшие представители предельных одноосновных кислот:


Карбоновые кислоты содержатся в нефтях в количестве от десятых долей процента до 3%. В нефтях найдены карбоновые кислоты с алифатическими радикалами (CH3-, СН3-СН2- и т.д. до 24 атомов углерода в молекуле) с нафтеновыми и ароматическими радикалами.
Нефтяные кислоты выделяют из нефтей и далее используют для получения мыла, антисептиков, наполнителей для взрывчатки. В промышленности кислоты получают также окислением высокомолекулярных парафиновых углеводородов, выделенных из нефтей.
Окисление проводят кислородом воздуха при температуре 100-150°С в присутствии катализаторов:
![]()
Кроме того, карбоновые кислоты получают окислением:
а) первичных спиртов при температуре 300-500°С в присутствии катализаторов:

б) альдегидов:

В карбоновых кислотах, в отличие от альдегидов и кетонов, не проявляются специфические свойства карбонильной группы. Основными же реакциями карбоновых кислот являются реакции замещения -Н или -ОН, приводящие к образованию различных функциональных производных.
Все органические кислоты являются более слабыми кислотами, чем любая минеральная кислота.
Некоторые важнейшие свойства карбоновых кислот:
1. Органические кислоты с металлами или гидроксидами металлов способны образовывать соли:
СН3-СООН + NaOH СН3-COONa + Н2О
уксусная кислота ацетат натрия
2СН3-СООН + 2 К 2СН3-COOК + Н2
2. При действии аммиака на кислоты образуются аммонийные соли, которые при нагревании теряют воду и образуют амиды кислот:
СН3-СООН + NН3 —— СН3-СООNН4 —— CH3-CONH2 + H2O;
уксусная кислота аммонийная соль ацетамид
3. При взаимодействии с РСl5 карбоновые кислоты дают хлорангидриды кислот:

4. Со спиртами карбоновые кислоты образуют сложные эфиры. Реакция эта происходит в присутствии минеральных кислот:

этилацетат
5. При действии Р2O5 происходит отщепление молекулы воды от двух молекул кислоты, и образуется ангидрид кислоты:

Хлорангидриды и ангидриды кислот во многих химических реакциях более активны, чем сами кислоты.
