
9501
.pdf80
парообразования (r) и площадь парообразования B1C1DF – теплоте перегрева.
Вся площадь ОО1А1B1C1D соответствует энтальпии перегретого пара i.
Для решения ряда задач удобно в диаграмме T-s иметь также изохоры
(v = const) и кривые одинаковых внутренних энергий (и = const).
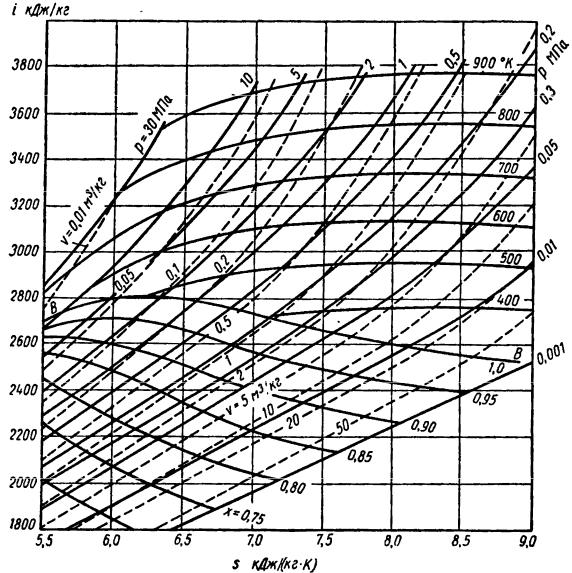
9.6.2 Диаграмма i-s
На рис. 42 изображена диаграмма i-s для водяного пара. На ней нанесены изохоры (пунктирные кривые), изобары, изотермы и линии равной сухости па-
ра. Линия ВВ – верхняя пограничная кривая. Ниже ее расположена область влажного насыщенного пара, выше ее – область перегретого пара. Изобары в области насыщенного пара – прямые линии, являющиеся одновременно изо-
термами. При переходе в область перегретого пара изобары и изотермы разде-
ляются, и каждая из них представляет собой отдельную кривую.
Обычно часть диаграммы i-s для области влажного пара со степенью су-
хости пара ниже 0,5 отбрасывается.
Диаграмма i-s имеет много ценных свойств: она позволяет быстро опреде-
лять параметры пара с достаточной для технических расчетов точностью, дает возможность определять энтальпию водяного пара и разности энтальпий в виде отрезков, чрезвычайно наглядно изображает адиабатный процесс, имеющий большое значение при изучении паровых двигателей, и, наконец, позволяет бы-
стро, наглядно и достаточно точно решать различные практические задачи.
9.7 Процессы изменения состояния водяного пара
При решении задач, связанных с изменением состояния водяного пара,
применение графического или аналитического метода в большой мере опреде-
ляется характером процесса. Однако в редких случаях удается определить все необходимые величины одним из этих способов; поэтому чаще всего приходит-
ся одновременно пользоваться как графическим, так и аналитическим способа-
ми. При этом часть параметров пара и величин, подлежащих определению, на-
81
ходят из диаграммы, а остальные определяют аналитическим путем с примене-
нием таблиц водяного пара.
Рис. 42
Во всех случаях весьма важно определить, к какому пару (насыщенному или перегретому) относится начальное или конечное состояние. Этот вопрос легко решается с помощью таблиц и диаграмм.
Для аналитического определения необходимых параметров и величин на-
до пользоваться следующими соотношениями:
1. Изохорный процесс (рис. 43). Если в начальном состоянии пар пере-
гретый, а в конечном – влажный (случай а), то
|
|
, |
м |
3 |
/ кг. |
(197) |
v1 v2 v2x2 |
(1 x2)v2 |
|

82
Так как последний член весьма мал, и им часто можно пренебречь, то
x |
2 |
|
v1 |
. |
(198) |
|
|||||
|
|
|
|
||
|
|
|
v2 |
|
|
Рис. 43 |
Рис. 44 |
Если в начальном и конечном состояниях пар влажный насыщенный
(случай б), то
|
|
|
|
(199) |
v1x1 |
(1 x1)v1 |
v2x2 |
(1 x2)v2. |
Если в обеих частях уравнения пренебречь вторыми членами, то получим
x2 |
|
v1 |
. |
(200) |
x1 |
|
|||
|
v2 |
|
||
Так как при v = const работа пара равна нулю, то вся сообщаемая пару те-
плота (или отнимаемая у него) расходуется на увеличение (уменьшение) его внутренней энергии и, следовательно,
qv u2 u1. |
(201) |
83
2. Изобарный процесс (рис. 44). Если пар в начальном состоянии влаж-
ный насыщенный, а в конечном состоянии перегретый (случай а), то
|
(1 x1), |
м |
3 |
/ кг. |
(202) |
||||
v1 v x1 |
|
||||||||
Если пар в начальном и конечном состояниях влажный (случай б), то, |
|||||||||
пренебрегая слагаемым v' (1 – x1), получаем. |
|
|
|
|
|||||
|
|
x1 |
|
v1 |
. |
|
|
|
(203) |
|
|
x2 |
|
|
|
|
|||
|
|
|
v2 |
|
|
|
|
||
Количество теплоты, участвующей в изобарном процессе, определяется из уравнения
qp i2 |
i1. |
(204) |
Работа в этом процессе |
|
|
l p(v2 |
v1). |
(205) |
3. Изотермический процесс. В области влажного пара изотермический
процесс одновременно является изобарным, поэтому для него справедливо уравнение (203).
Количество теплоты в изотермическом процессе легко определяется из
диаграммы T-s: |
|
q T(s2 s1). |
(206) |
Работа пара в изотермическом процессе находится из уравнения первого |
|
закона |
|
q u l, |
|
откуда |
|
l q u T(s2 s1) (u2 u1). |
(207) |
4. Адиабатный процесс. С достаточной точностью можно принять для водяного пара зависимость
pvk const.
Однако величина k в этом уравнении не является отношением теплоемко-
стей, а лишь опытно подобранным коэффициентом. Для сухого насыщенного
пара
84 |
|
k = 1,135. |
(208) |
Для влажного пара |
|
k = 1,035 + 0,1x, |
(209) |
где х – степень сухости. |
|
Для перегретого пара |
|
k = 1,3. |
(210) |
Для аналитического вычисления степени сухости пара в конечном со- |
|
стоянии пользуются уравнением |
|
|
s1 s2 s2 |
|
r2x2 |
, |
|
(211) |
|||
|
|
T |
|
|
|||||
|
|
|
|
|
н2 |
|
|
|
|
отсюда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
s1 |
|
|
|
|
x |
|
(s1 s2) |
|
s2 |
. |
(212) |
|||
|
|
|
|||||||
2 |
|
r2 |
|
|
s2 s2 |
|
|||
|
|
|
|
|
|||||
Работа пара при адиабатном расширении |
|
||||||||
|
|
l u1 |
u2. |
|
|
|
(213) |
||
Степень сухости пара в конце адиабатного расширения определяется при
помощи диаграммы i-s. Если в начальном состоянии пар сухой насыщенный, то точка, характеризующая его состояние, легко находится в пересечении соответ-
ствующей изобары р1 и верхней пограничной кривой (рис. 45). Если в началь-
ном состоянии пар влажный, то его состояние изобразится точкой, находящей-
ся в пересечении соответствующей изобары р1 и кривой заданной сухости пара.
Если пар перегретый, то точка 1, характеризующая его состояние, находится в пересечении изобары p1 и изотермы t1. Так как для обратимого процесса адиа-
бата на диаграмме i-s изображается прямой, параллельной оси ординат, то ко-
нечное состояние пара легко находится графически по точке пересечения адиа-
баты с заданной конечной изобарой (точка 2). Степень сухости пара определя-
ется по значению кривой равной сухости, проходящей через точку 2. Энтальпия и энтропия пара как в начальном, так и в конечном состоянии находятся очень легко по соответствующим значениям оси ординат и оси абсцисс.
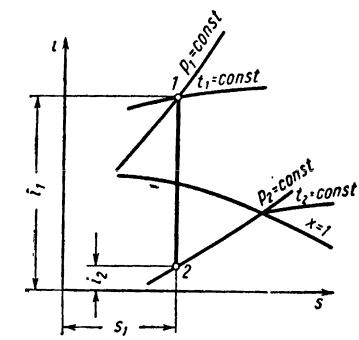
85
Рис. 45
Температура пара в конечном состоянии также определяется весьма про-
сто. Если это состояние изображается точкой, находящейся в области перегре-
того пара, то температура его отсчитывается по значению изотермы, про-
ходящей через эту точку. Если же в конечном состоянии пар влажный, то нуж-
но от точки, характеризующей его состояние, подняться по соответствующей изобаре до верхней пограничной кривой. Температура этой точки, отсчи-
тываемая по соответствующей изотерме, является температурой насыщенного пара конечного давления.
Задача
В закрытом сосуде содержится 1 м3 сухого насыщенного водяного пара при давлении 1 МПа.
Определить давление, степень сухости пара и количество отданной им теплоты, если он охладился до 60° С.

86
Решение
Пользуясь справочными данными, получаем при t2 = 60° С давление пара
р = 0,019917 МПа.
Так как процесс происходит при постоянном объеме, то
v1 v2 v1 0,1946 м3/ кг.
По уравнению (198)
x2 v1 . v2
Пользуясь справочными материалами, находим
v2 7,678 м3/ кг
и таким образом
0,1946
x2 7,678 0,0253.
Количество теплоты в изохорном процессе по формуле (201)
qv u2 u1.
Определяем значения внутренней энергии пара в начале и в конце про-
цесса:
u1 i1 p1v1 2778 1 106 0,1946 2583,4 кДж/ кг, 1000
Значение i2 находим по формуле (187):
i2 i2 rx2 251,1 2358,8 0,0258 311,96 кДж/кг,
следовательно,
u2 i2 p2v2 311,96 0,019917 106 0,1946 308,1 кДж/ кг. 1000
Таким образом,
qv u2 u1 308,1 2583,4 2275,3 кДж/ кг.
Так как в рассматриваемом процессе участвует 1 м3 пара и плотность его
при р = 1 МПа ρ = 5,139 кг/м3, то
qv ρqv 5,139 ( 2275,3) 11692,8 кДж/ м3.

87
10. ИСТЕЧЕНИЕ ГАЗОВ И ПАРОВ
При решении задач, связанных с истечением газа через сопла (насадки) (рис. 46), чаще всего приходится определять скорость истечения и расход, т.е.
количество газа, вытекающего в единицу времени. В этих случаях необходимо прежде всего найти отношение р2/р1 где р2 – давление среды на выходе из со-
пла; p1 – давление среды на входе в сопло.
Рис. 46
Полученное числовое значение р2/р1 сравнивают с так называемым кри-
тическим отношением давлений для данного газа, определяемым из равенства
p |
|
|
|
2 |
|
|
k |
|
||
2 |
|
k 1 |
|
(214) |
||||||
βкр |
|
|
|
|
|
|
||||
p1 |
|
|
||||||||
|
кр |
k 1 |
|
|
||||||
и равным:
для одноатомных газов при k = 1,67
|
р2 |
|
0,487; |
|
|
|
|||
р1 |
||||
|
кр |
|

88
для двухатомных газов при k = 1,4
|
р2 |
|
0,528; |
|
|
|
|||
р1 |
||||
|
кр |
|
для трех- и многоатомных газов при k = 1,29
|
р2 |
|
0,546. |
|
|
|
|||
р1 |
||||
|
кр |
|
Если адиабатное истечение газа происходит при (р2/р1) > (р2/р1)кр, теоре-
тическая скорость газа у устья суживающегося сопла определяется по формуле:
|
k |
|
|
p2 |
|
k 1 |
|
|
|
||
w 2 |
pv |
|
k |
|
(215) |
||||||
|
|
1 |
|
|
|
|
|
, |
|||
k 1 |
p |
|
|||||||||
|
1 1 |
|
|
|
|
||||||
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где k – показатель адиабаты; v1 – удельный объем газа на входе в сопло.
Заменяя для идеального газа в формуле (215) p1v1 на RT, получаем
|
|
k |
|
p2 |
|
k 1 |
|
|
|
|
|
|
|
k |
|
(216) |
|||||
w |
2 |
|
RT1 1 |
|
|
|
|
, |
||
k 1 |
p |
|||||||||
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В формулах (215) и (216) значения р, v и R даны соответственно в сле-
дующих единицах: Па, кг/м3 и Дж/(кг∙К).
Теоретическая скорость газа может быть также найдена по формуле
w |
2(i1 i2), |
(217) |
где i1 и i2 – соответственно энтальпии газа в начальном и конечном состояниях в Дж/кг.
Если значения i выражены в кДж/кг, то формула (217) принимает вид
w 
 2(i1 i2)1000 44,76
2(i1 i2)1000 44,76
 i1 i2.
i1 i2.
Во всех приведенных случаях скорость w получается в м/с.
Расход газа определяется по формуле:
M f 2 |
k |
|
|
p1 |
|
k 1 |
p2 |
||||
|
|
||||
|
|
|
|
2 |
p2 |
|
k 1 |
|
|
|
|
|
p2 |
k |
k |
|
|
(218) |
|||||
|
|
|
|
|
|
|
|
, |
|||
p |
p |
||||||||||
|
|
1 |
|
|
1 |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|

89
где f – выходное сечение сопла в м2.
Если же адиабатное истечение газа происходит при (р2/р1) ≤ (р2/р1)кр, то теоретическая скорость газа в устье суживающегося сопла будет равна крити-
ческой скорости и определится по уравнению
w |
2 |
k |
|
pv . |
(219) |
|
k 1 |
||||||
кр |
|
1 1 |
|
|||
Критическая скорость по формуле (219) зависит только от начального со-
стояния газа и показателя адиабаты k. Поэтому, подставляя значение k для раз-
личных рабочих тел, получим более удобные формулы для определения крити-
ческой скорости. В частности, для двухатомных газов
w |
|
1,08 |
pv |
|
(220) |
||||||
кр |
|
|
|
1 1 |
|
|
|||||
или |
|
|
|
|
|
|
|
|
|
|
|
wкр 1,08 |
|
|
. |
|
(221) |
||||||
RT1 |
|
||||||||||
Критическая скорость может быть также определена до одной из сле- |
|||||||||||
дующих формул: |
|
|
|
|
|
|
|
|
|
|
|
w |
|
|
|
|
|
|
|
|
|||
|
2(i i |
|
); |
|
|||||||
кр |
|
1 |
кр |
|
|
|
|
(222) |
|||
|
|
|
|
|
|
|
|
|
|
||
w |
44,76 |
i |
i |
||||||||
; |
|
||||||||||
кр |
|
|
|
1 |
|
|
|
кр |
|
|
|
где i – энтальпия газа при критическом давлении ркр,
В первой формуле энтальпия выражена в Дж/кг, второй – в кДж/кг.
Расход газа в этом случае будет максимальным и может быть вычислен по уравнению
|
|
k |
|
2 |
|
2 |
|
|
p |
|
|||
|
|
|
|
|
k 1 |
|
|
|
|||||
Mmax f |
2 |
|
|
|
|
|
|
|
1 |
. |
(223) |
||
k 1 |
|
|
|
||||||||||
|
|
k 1 |
|
|
v1 |
|
|||||||
Подставляя в эту формулу значение k, получаем:
для двухатомных газов
Mmax |
0,686 f |
p1 |
; |
(224) |
|
||||
|
|
v1 |
|
|
